Formiate de sodium
Le formiate de sodium est le sel de sodium de l'acide formique de formule Na(HCOO)[7].
| Formiate de sodium | ||
| ||
 | ||
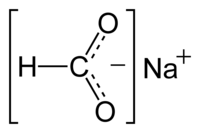
| formule du formiate de sodium. | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| No ECHA | 100.004.990 | |
| No CE | 205-488-0 | |
| No RTECS | LR0350000 | |
| PubChem | 2723810 | |
| SMILES | ||
| InChI | ||
| Apparence | prismes rhombiques ou plaques, incolore, déliquescent, de goût amer-salé[1], hygroscopique[2] | |
| Propriétés chimiques | ||
| Formule | HCO2Na | |
| Masse molaire[3] | 68,007 2 ± 0,001 5 g/mol C 17,66 %, H 1,48 %, Na 33,8 %, O 47,05 %, |
|
| Propriétés physiques | ||
| T° fusion | 261 °C (décomp.)[4] 253 °C[5] 257,3 °C[2] 259-262 °C[6] |
|
| Solubilité | eau : 550 g·L-1 à 20 °C[4] ; peu soluble dans l'éthanol[2] |
|
| Masse volumique | 1,92 g·cm-3 à 20 °C[4] | |
| Écotoxicologie | ||
| DL50 | 11 200 mg·kg-1 (souris, oral)[5] 807 mg/kg (souris, i.v.)[5] |
|
| CL50 | 954 mg/l (Pimephales promelas, 96h)[6] | |
| LogP | (octanol/eau) -4,270[5] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Préparation
Commercialement, le formiate de sodium est formé par l'absorption sous pression de monoxyde de carbone, CO sur de l'hydroxyde de sodium, NaOH à 130 °C et 6-8 bar[8] :
- CO + NaOH → HCO2Na
Du fait de la large disponibilité et du prix modique de l'acide formique (acide méthanoïque) issu de l'hydrolyse de formiate de méthyle lui-même issu de la carbonylation du méthanol, le formiate de sodium est usuellement préparé par neutralisation de cet acide avec de l'hydroxyde de sodium.
Le formiate de sodium est aussi inévitablement formé comme sous-produit dans l'étape finale de la synthèse du pentaérythritol et dans la réaction de Cannizzaro croisée de méthanal (formaldéhyde) avec le produit de réaction aldol triéthylol acétaldéhyde (3-hydroxy-2,2-bis (hydroxyméthyl) propanal)[9]
Au laboratoire, le formiate de sodium peut être obtenu par neutralisation d'acide formique avec du carbonate de sodium. Il peut être aussi synthétisé par réaction entre le chloroforme et une solution alcoolique d'hydroxyde de sodium :
- CHCl3 + 4 NaOH → HCOONa + 3 NaCl + 2 H2O
ou par réaction de l'hydroxyde de sodium avec l'hydrate de chloral :
- C2HCl3(OH)2 + NaOH → CHCl3 + HCOONa + H2O
Cette seconde méthode est en général préférée à la première car la très faible solubilité de CHCl3 dans l'eau le rend plus facile à séparer de la solution de formiate de sodium que ne peut l'être le chlorure de sodium, très soluble.
Finalement le formiate de sodium peut aussi être préparé via la réaction haloforme entre l'éthanol et l'hypochlorite de sodium, NaClO en présence d'une base. Cette procédure est bien documentée pour la préparation du chloroforme.
Propriétés
Physiques
Le formiate de sodium cristallise dans le système cristallin monoclinique , dans le groupe d'espace C2/n, no 15 avec comme paramètres , a = 619 ± 1 pm, b = 672 ± 1 pm, c = 649 ± 1 pm, β = 121° 42′ ± 10′ et Z, nombre d'unité par maille = 4[10]. Les ions formiates qui montrent une résonance complète entre les deux liaisons C-O, ont un angle O-C-O de 124° et la distance C-O vaut 127 pm. Chaque ion sodium est entouré de six atomes d'oxygène provenant de cinq ions formiates différents et les distances Na-O valent 235, 245 et 250 pm, en moyenne 244 pm ce qui est exactement égal à la distance prévue sur la base des rayons ioniques.
Chimiques
Le formiate de sodium se décompose par chauffage en oxalate de sodium (en) et dihydrogène[11]. L'oxalate de sodium peut ensuite être converti par un chauffage plus poussé en carbonate de sodium et monoxyde de carbone[12] - [11].
Comme sel d'un acide faible (acide méthanoïque) et d'une base forte, le formiate de sodium forme des solutions aqueuses basiques :
Ainsi, une solution d'acide formique et de formiate de sodium peut être utilisée comme solution tampon.
Le formiate de sodium est légèrement nocif dans l'eau et inhibe certaines espèces de bactéries, mais est dégradé par d'autres.
Utilisation
Le formiate de sodium est utilisé dans plusieurs procédés de teinture et d'impression de tissus. Il est également utilisé comme agent tampon pour les acides minéraux forts pour augmenter leur pH, comme additif alimentaire (E237), cependant non autorisé en Europe, et comme agent de dégivrage.
- En biologie structurale, le formiate de sodium peut être utilisé comme cryoprotecteur pour des expériences de diffraction des rayons X sur des cristaux de protéine[13], qui sont typiquement conduites à une température de 100 K (−173,15 °C) pour réduire les effets de dommages par rayonnement.
- Le formiate de sodium joue un rôle dans la synthèse d'acide méthanoïque, il est converti par l'acide sulfurique suivant :
- Le formiate de sodium est converti par l'acide sulfurique en acide méthanoïque et en sulfate de sodium.
- Les épines urticantes des orties contiennent en plus de l'acide formique également du formiate de sodium.
- Le formiate de sodium est utilisé comme agent non corrosif dans les aéroports pour le dégivrage des pistes en mélange avec des inhibiteurs de corrosion et d'autres additifs qui pénètrent rapidement les couches de neige consolidées et de glace, les détachent de l'asphalte ou du béton et les fondent rapidement.
- La dépression à haut point de congélation, par ex. par rapport à l'urée encore fréquemment utilisée (qui est efficace mais problématique en raison d'eutrophisation) empêche efficacement la recongélation, même à des températures inférieures à -15 °C. L'effet de décongélation du formiate de sodium solide peut même être augmenté par humidification avec des solutions aqueuses de formiate de potassium ou d'acétate de potassium. La dégradabilité du formiate de sodium est particulièrement avantageuse avec une demande chimique en oxygène (DCO) de 211 mg O2/g comparativement à d'autres agents de dégivrage comme l'acétate de sodium (740 mg O2/g) ou l'urée (> 2,000 mg O2/g)[14].
- Des solutions de formiate de sodium saturées (ainsi que des mélanges d'autres formiates de métaux alcalins tels que le formiate de potassium et de césium) sont utilisées comme aides importants de forage et de stabilisation dans l'exploration de gaz et de pétrole en raison de leur densité relativement élevée. En mélangeant les solutions de formiate de métal alcalin saturées correspondantes, on peut obtenir toute densité entre 1,0 et 2,3 g/cm3. Les solutions saturées sont biocides et à long terme stables contre la dégradation microbienne. Dilués, d'autre part, elles sont rapidement et complètement biodégradables. Comme les formiates de métaux alcalins auxiliaires de forage rendent inutile d'ajouter des charges solides pour augmenter la densité (comme les barytes) et que les solutions de formiate peuvent être récupérées et recyclées sur le site de forage, les formiates représentent un progrès important dans la technologie d'exploration pétrolière[15].
Thermodynamique
- ΔHf0 = −666,5 kJ/mol[16].
Toxicité
- LDLo = 1 250 mg/kg (lapin, i.v.)[5] ;
- LDLo = 4 g/kg (chien, oral)[5] ;
- LDLo = 3 g/kg (chien, i.v.)[5] ;
- LDLo = 1 140 mg/kg (chat, s.c.)[5] ;
- EC0 = > 1 000 mg/l (Daphnia magna, 24 h)[6] ;
- EC50 = 1 070 mg/l (Daphnia magna, 48 h)[6] ;
- EC50 = 790 mg/l (Pseudokirchneriella subcapitata (algue verte), 96 h)[6].
Notes et références
(en)/(de) Cet article est partiellement ou en totalité issu de la page de Wikipédia en anglais intitulée « Sodium formate » (voir la liste des auteurs) et de la page de Wikipédia en allemand intitulée « Natriumformiat » (voir la liste des auteurs).
- (de) « Natriumformiat », sur Römpp Online, Georg Thieme Verlag (consulté le )
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, vol. 97, CRC Press/Taylor and Francis, , 2652 p. (ISBN 1498754287), « Physical Constants of Inorganic Compounds », p. 805 (4-86).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Sodium formate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 02/06/2008 (JavaScript nécessaire)
- (en) « Formiate de sodium », sur ChemIDplus.
- Fiche Sigma-Aldrich du composé Sodium formate 99.998% trace metals basis, consultée le 28/02/2017. + [PDF] Fiche MSDS
- PubChem CID2723810.
- Arnold Willmes, Taschenbuch Chemische Substanzen, Harri Deutsch, Frankfurt (M.), 2007.
- H.-J. Arpe, Industrielle Organische Chemie, 6., vollst. überarb. Aufl., Wiley-VCH Verlag, 2007. (ISBN 978-3-527-31540-6).
- W. H. Zachariasen, The Crystal Structure of Sodium Formate, NaHCO2, J. Am. Chem. Soc., 1940, vol. 62(5), pp. 1011–1013. DOI 10.1021/ja01862a007
- (en) T. Meisel, Z. Halmos, K. Seybold, E. Pungor, The thermal decomposition of alkali metal formates, Journal of Thermal Analysis and Calorimetry, 1975, vol.7(1), pp. 73-80. DOI 10.1007/BF01911627.
- (en) T. Yoshimori, Y. Asano, Y. Toriumi, T. Shiota, Investigation on the drying and decomposition of sodium oxalate,Talanta, 1978, vol. 25(10), pp.603-605. DOI 10.1016/0039-9140(78)80158-1.
- G. Bujacz, B. Wrzesniewska, A. Bujacz, Cryoprotection properties of salts of organic acids: a case study for a tetragonal crystal of HEW lysozyme, Acta Crystallographica Section D: Biological Crystallography, 2010, vol.66(7), pp. 789–796. DOI 10.1107/S0907444910015416.
- (en) Deicer Anti-icing Snow melting Thawing Chemicals Manufacturers
- (en) William Benton et Jim Turner, Cabot Specialty Fluids: Cesium formate fluid succeeds in North Sea HPHT field trials (PDF; 88 ko), Drilling Contractor, mai/juin 2000.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 90e Ed., (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, p. 5-19.



