Acide méthanoïque
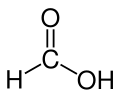
L'acide méthanoïque (appelé aussi acide formique) est le plus simple des acides carboxyliques. Sa formule chimique est CH2O2 ou HCOOH. Sa base conjuguée est l'ion méthanoate (formiate) de formule HCOO−. Il s'agit d'un acide faible qui se présente sous forme de liquide incolore à odeur pénétrante.
| acide méthanoïque | |||
| |||
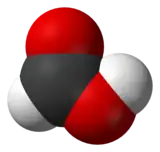 | |||
| Formules de Lewis et 3D de l'acide méthanoïque | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Acide méthanoïque | ||
| Synonymes |
acide formique |
||
| No CAS | |||
| No ECHA | 100.000.527 | ||
| No CE | 200-579-1 | ||
| PubChem | |||
| No E | E236 | ||
| FEMA | 2487 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, fumant, d'odeur âcre[1] | ||
| Propriétés chimiques | |||
| Formule | CH2O2 [Isomères] |
||
| Masse molaire[2] | 46,025 4 ± 0,001 5 g/mol C 26,1 %, H 4,38 %, O 69,52 %, |
||
| pKa | 3,751 (25 °C) [3] | ||
| Moment dipolaire | 1,425 ± 0,002 D [4] | ||
| Diamètre moléculaire | 0,381 nm [5] | ||
| Propriétés physiques | |||
| T° fusion | 8,3 °C [3] | ||
| T° ébullition | 101 °C [3] | ||
| Solubilité | 1 000 g·l-1 (eau, 25 °C)[3], |
||
| Paramètre de solubilité δ | 24,8 MPa1/2 (25 °C)[6]; 21,4 J1/2·cm-3/2 (25 °C)[5] |
||
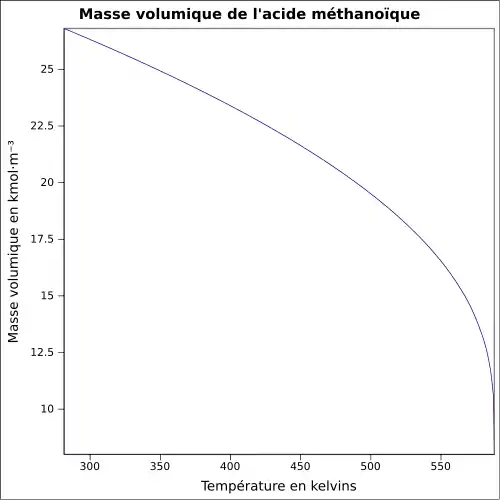
| Masse volumique | 1,22 à 25 °C
|
||
| T° d'auto-inflammation | 520 °C[1] | ||
| Point d’éclair | 69 °C[1] | ||
| Limites d’explosivité dans l’air | 14–34 %vol[1] | ||
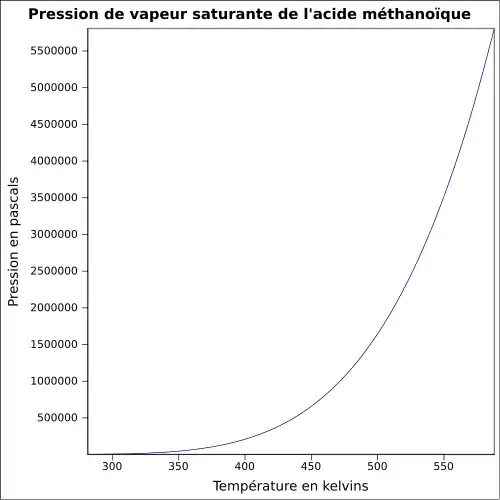
| Pression de vapeur saturante | 42,6 mmHg (25 °C) [3]
|
||
| Viscosité dynamique | 1,57 × 10−3 Pa s à 26 °C | ||
| Point critique | 306,85 °C [8] | ||
| Point triple | 281,45 K (8,3 °C) 23,6 mbar |
||
| Thermochimie | |||
| S0gaz, 1 bar | 248,7 J mol−1 K−1 | ||
| S0liquide, 1 bar | 131,8 J mol−1 K−1 | ||
| ΔfH0gaz | −378,6 kJ mol−1 | ||
| ΔfH0liquide | −425,1 kJ mol−1 | ||
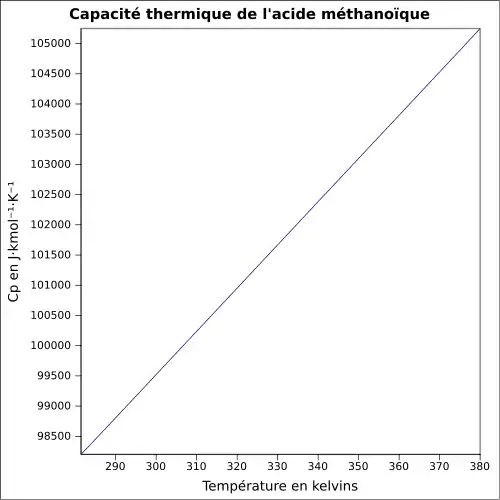
| Cp | 45,7 J·mol-1·K-1 (vapeur) 99,0 J·mol-1·K-1 (liquide) |
||
| PCS | 254,6 kJ·mol-1 (25 °C, liquide)[10] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 11,33 ± 0,01 eV (gaz)[11] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,3694 [5] | ||
| Précautions | |||
| SGH[12] | |||
 Danger |
|||
| SIMDUT[13] | |||
  B3, E, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Inhalation | Les vapeurs concentrées sont corrosives | ||
| Ingestion | Toxique, peut provoquer des réactions allergiques. Agent mutagène suspecté | ||
| Écotoxicologie | |||
| DL50 | 700 mg·kg-1 (souris, oral) 145 mg·kg-1 (souris, i.v.) 940 mg·kg-1 (souris, i.p.) [3] |
||
| LogP | -0,54[1] | ||
| Seuil de l’odorat | bas : 1,6 ppm haut : 340 ppm[14] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Dans la nature, on le trouve dans les glandes de plusieurs insectes de l'ordre des hyménoptères, comme les abeilles et les fourmis, mais aussi sur les poils qui composent les feuilles de certaines plantes de la famille des urticacées (orties). Son nom trivial formique vient du mot latin formica qui signifie fourmi, car il fut isolé pour la première fois par distillation de fourmis.
Histoire
Dès le XVe siècle, quelques alchimistes et naturalistes avaient connaissance que certaines fourmis, en particulier du genre Formica[15], produisaient une vapeur acide. La première personne à avoir décrit l'isolement de cette substance (par distillation d'un grand nombre de cadavres de fourmis) est le naturaliste anglais John Ray en 1671. Sa première synthèse fut faite par le chimiste français Gay-Lussac à partir de l'acide hydrocyanique. En 1855, un autre chimiste français, Marcellin Berthelot, développa une méthode de synthèse à partir du monoxyde de carbone, similaire à celle utilisée de nos jours. L'acide formique est présent dans la composition de la majorité des venins de fourmis, qui le projettent ou l'appliquent directement pour percer la cuticule d'autres arthropodes ou repousser d'éventuels prédateurs[16].
Chimie
Propriétés réductrices
Chauffé avec de l'acide sulfurique, l'acide formique se décompose en eau et en monoxyde de carbone, si bien qu'il possède des propriétés réductrices très marquées (réduction des sels d'or, d'argent, de cuivre, etc.). Sous l'action de la seule chaleur, il se décompose vers 160 °C en dihydrogène et en dioxyde de carbone, d'où de nouveau, des propriétés réductrices.
Acide faible
Bien qu'il soit plus ionisé que ses homologues supérieurs d'acides carboxyliques, c'est un acide faible, mais malgré cela il est capable de déplacer l'acide nitrique de ses sels. Si l'on ajoute de l'acide formique à un mélange de nitrate de potassium et de brucine, le mélange est instantanément porté au rouge. Il ne donne pas d'anhydride d'acide et donne comme équivalent d'halogénure d'acyle le phosgène COCl2.
Fabrication
En chauffant en tube scellé de la potasse et du monoxyde de carbone, Berthelot a fait la synthèse de l'acide formique : CO + KOH → H-CO2K, puis, sous pression de 7 atm. et à 170 °C, hydrolyse du formiate de potassium H-CO2K par l'acide sulfurique ; le produit obtenu par distillation sous pression réduite contient 80 à 85 % d'acide formique.
Utilisations
L'acide méthanoïque est utilisé dans les industries suivantes : textile (teintures, traitement du cuir), insecticides, laques, solvants, tannage, électroplaquage, fumigènes, alimentation humaine (additif alimentaire E236)[17]. Il sert également à argenter les miroirs, et soigner les verrues.
Il est aussi utilisé en apiculture comme moyen complémentaire de lutte contre le varroa[18]. Il est également utilisé dans les détartrants (gel wc)[19].
Traceur biologique
Lors d'un empoisonnement au méthanol, ce dernier est métabolisé d'abord en méthanal par l'action de l'alcool déshydrogénase, enzyme non spécifique et ayant une meilleure affinité avec l'éthanol, puis en acide formique via l'action de la formaldéhyde déshydrogénase. La dernière étape consiste en la transformation en dioxyde de carbone, étape limitante de l'élimination. Le méthanal étant rapidement transformé, une accumulation de formiate se crée et est à l'origine de la toxicité (acidose métabolique). La mesure des formiates dans les urines permet de détecter un empoisonnement au méthanol.
Stockage de l'hydrogène
Une recherche de l’Institut Leibniz de catalyse de Rostock a montré qu'il peut être utilisé pour le stockage de dihydrogène pour alimenter une pile à combustible[20].
En présence de platine, il est possible de décomposer l'acide formique en dihydrogène et dioxyde de carbone.
- CH2O2 → H2 + CO2
En 2006, une équipe de recherche de l’EPFL (Suisse) a présenté l'utilisation de l'acide formique comme solution de stockage de l'hydrogène[21]. Un système catalytique homogène, basé sur une solution aqueuse de catalyseurs au ruthénium décompose l'acide formique HCOOH en dihydrogène H2 et dioxyde de carbone CO2 [22]. Le dihydrogène peut être ainsi produit dans une large plage de pression (1 – 600 bars) et la réaction ne génère pas de monoxyde de carbone. Ce système catalytique résout les problèmes des catalyseurs existants pour la décomposition de l'acide formique (faible stabilité, durée de vie des catalyseurs limitée, formation de monoxyde de carbone) et viabilise cette méthode de stockage d'hydrogène[23]. Le coproduit de cette décomposition, le dioxyde de carbone, peut être utilisé dans un deuxième temps pour générer à nouveau de l’acide formique par hydrogénation. L'hydrogénation catalytique du CO2 a été longuement étudiée et des méthodes efficaces ont été développées[24] - [25].
L'acide formique contient 53 g·l-1 d'hydrogène à température et pression ambiante, ce qui est deux fois la capacité de l’hydrogène comprimé à 350 bars. Pur, l'acide formique est un liquide inflammable dont le point d'éclair vaut +69 °C, ce qui est supérieur à l’essence (−40 °C) ou à l'éthanol (+13 °C). Dilué dès 85 %, il n'est plus inflammable. L'acide formique dilué est même inscrit sur la liste des additifs alimentaires de l'administration américaine des denrées alimentaires et des médicaments (FDA)[26].
Commerce
La France est importatrice nette d'acide formique, d'après les douanes françaises. Le prix moyen de la tonne importée était de 600 €[27].
Détection en dehors du système solaire
En 2018, de l'acide méthanoïque a été détecté par le radiotélescope ALMA dans le disque protoplanétaire de l'étoile TW Hydrae[28].
Notes et références
- ACIDE FORMIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Acide méthanoïque », sur ChemIDplus, consulté le 8 février 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 978-0-88415-858-5 et 978-0-88415-859-2)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Fiche toxicologique n° 149, Acide Formique, INRS, consultée le 5 mai 2021
- « Acide formique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Formic acid », sur hazmap.nlm.nih.gov (consulté le )
- « Jets d'acide formique par des fourmis », sur myrmecofourmis.fr (consulté le ).
- « Regardez le venin de ces fourmis faire des bulles ! » [vidéo], sur YouTube (consulté le ).
- Codex alimentarius, « Noms de catégorie et système international de numérotation des additifs alimentaires », sur http://www.codexalimentarius.net, (consulté le )
- Apicultrice68, « Traitement du Varroa à l’acide formique », sur http://same-apiculture.colinweb.fr/, (consulté le )
- Techni-Contact.com, « Acide Formique 80% - CAS N° 64-18-6 : Devis sur Techni-Contact - Acide Formique 80% », sur www.techni-contact.com (consulté le )
- http://www.bulletins-electroniques.com/actualites/54627.htm
- Gábor Laurenczy, Céline Fellay, Paul J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- Céline Fellay, Paul J. Dyson, Gábor Laurenczy, A Viable Hydrogen-Storage System Based On Selective Formic Acid Decomposition with a Ruthenium Catalyst, Angew. Chem. Int. Ed., 2008, 47, 3966–3970.
- Ferenc Joó, Breakthroughs in Hydrogen Storage – Formic Acid as a Sustainable Storage Material for Hydrogen, ChemSusChem 2008, 1, 805–808.
- P. G. Jessop, in Handbook of Homogeneous Hydrogenation (Eds.: J. G. de Vries, C. J. Elsevier), Wiley-VCH, Weinheim, Germany, 2007, p. 489–511.
- P. G. Jessop, F. Joó, C.-C. Tai, Recent advances in the homogeneous hydrogenation of carbon dioxide, Coord. Chem. Rev., 2004, 248, 2425–2442.
- US Code of Federal Regulations: 21 CFR 186.1316, 21 CFR 172.515
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=29151100 (consulté le )
- (en) Cécile Favre, Davide Fedele, Dmitry Semenov, Sergey Parfenov et al., « First Detection of the Simplest Organic Acid in a Protoplanetary Disk », The Astrophysical Journal Letters, (lire en ligne).