Fourmi
Formicidae, Formicoidea • Formicidés

Les fourmis sont des insectes sociaux qui constituent la famille des Formicidae (ou formicidés en français) et, avec les guêpes et les abeilles, sont classées dans l’ordre des Hymenoptera, sous-ordre des Apocrita. Ces insectes eusociaux forment des colonies, appelées fourmilières, parfois extrêmement complexes, contenant de quelques dizaines à plusieurs millions d’individus. Certaines espèces forment des supercolonies à plusieurs centaines de millions d’individus. Les termites, parfois appelés fourmis blanches pour leur ressemblance formelle et comportementale, sont de l’ordre des Dictyoptera (sous-ordre des isoptères) mais ne sont pas de proches parents.
Les sociétés des fourmis ont une division du travail (polyéthisme d'âge et de caste), une communication entre individus et une capacité à résoudre des problèmes complexes. Ces analogies avec les sociétés humaines ont depuis longtemps été une source d'inspiration et le sujet d'études scientifiques.
En 2013, plus de 12 000 espèces[2] ont été répertoriées[3] - [4] mais il en reste probablement des milliers encore à découvrir. Le recensement participatif, tel qu'il a été fait en 2019-2020 dans le canton de Vaud, en Suisse, pourrait être un moyen d’acquérir de nouvelles connaissances[5]. Famille cosmopolite (la fourmi a colonisé toutes les régions terrestres à l'exception du Groenland et de l'Antarctique), elle atteint une grande densité dans les milieux tropicaux et néotropicaux[6]. Bien que les fourmis représentent moins d'un pour cent des espèces d'insectes, leur population estimée à un milliard de milliards d'individus est telle que la masse de la myrmécofaune[7] excède le poids de l'humanité et représente 10 à 15 % de la biomasse animale dans beaucoup d'habitats[8], cette masse conjuguée à celle des termites représentant le tiers de la biomasse animale de la forêt amazonienne[9].
Leur succès évolutif est en grande partie dû à leur organisation sociale, leur plasticité génétique associée à la présence de nombreux éléments mobiles dans le génome, et leur opportunisme alimentaire[10].
Étymologie
Le substantif féminin « fourmi » est issu, par l'intermédiaire du latin vulgaire formicus, du latin classique formica, de même sens[11] - [12], mot résultant probablement d'une dissimilation de °mormi-, attesté par le grec murmêx (d'où les vocables myrmécologie, myrmécophilie), lui-même apparenté à plusieurs formes indoeuropéennes basées sur la racine °morwi-[13].
Anatomie
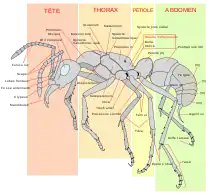
Les fourmis se distinguent morphologiquement des autres hyménoptères aculéates principalement par des antennes avec un coude marqué (l'article basal, très long et flexible, favorise les attouchements antennaires très fréquents), par deux mandibules dirigées vers l'avant (et non sous la tête), deux glandes métapleurales sur la partie postérieure du tronc, et par un étranglement du deuxième segment abdominal (le pétiole), et parfois du troisième aussi (le postpétiole), ce qui forme le pédicelle[14]. Cet étranglement donne à l’abdomen une plus grande mobilité par rapport au reste du corps. À l’exception des individus reproducteurs dotés de quatre ailes, la plupart des fourmis sont aptères. Beaucoup de fourmis possèdent un aiguillon, souvent réduit, et qui peut être absent chez les mâles[15].
Ces insectes ont des organes spécifiques en relation étroite avec leur comportement élaboré : jabot social dans lequel les ouvrières récolteuses stockent des liquides, le plus souvent sucrés, et les régurgitent à des ouvrières nourrices qui à leur tour les transfèrent bouche-à-bouche aux larves et à la reine (mode de transfert appelé trophallaxie)[16] ; filtre à particule (soies) au niveau du pharynx qui permet de n'absorber que la nourriture liquide, les particules solides étant stockées dans une poche infrabuccale et régulièrement vidangées[17].
Types de morphologie
Les plus de 12 000[18] espèces actuelles connues de fourmis (on en estime le nombre total à plus de 20 000, voire 30 000 à 40 000 selon le myrmécologue Laurent Keller[19], plusieurs centaines de nouvelles espèces étant décrites chaque année[20]) varient en taille de 0,75 à 52 mm[21]. La plus grande espèce connue est le fossile Titanomyrma gigantea, la reine atteignant 6 cm de long et 15 cm d'envergure[22]. La plus grande ouvrière est Dinoponera quadriceps (3 cm de long). Cushman et al. notent une variation de la diversité spécifique et de la taille des fourmis européennes selon un gradient latitudinal[23].
Polymorphisme
Une division du travail sur le plan de la reproduction, appelée polyéthisme de caste, se manifeste par une caste de reproducteurs (reines et mâles) et une caste « stérile » travailleuse (ouvrières). Le polyéthisme de caste se retrouve au sein même des ouvrières dont des sous-castes morphologiques se spécialisent dans la réalisation de fonctions différentes. Leur polymorphisme se manifeste surtout au niveau des formes de la tête et des mandibules. Le polyéthisme d'âge se traduit par le fait qu'un même individu passe par différentes formes de spécialisation au cours de son existence dans la société (soins au couvain, puis activités domestiques à l'intérieur du nid, puis garde à l'entrée du nid, et enfin fourrageage (recherche de nourriture)[24].
La différence dans un seul gène de Solenopsis invicta décide si la colonie a une reine simple ou des reines multiples[25]. La taille du génome de 40 espèces montre que ce génome est relativement petit par rapport aux autres insectes mais qu'il n'y a aucun lien entre la taille de ce génome et la taille de l'espèce correspondante[26]. Le séquençage complet du génome des deux premières espèces de fourmis Pegnathos saltator et Camponotus floridanus a été réalisé en 2010 : il montre que 20 % des gènes de ces deux espèces sont uniques et 33 % sont identiques à ceux de l'Homme. Leurs génomes ont respectivement 17 064 et 18 564 gènes (le génome humain en a 23 000)[27].

Écologie et comportement
Longévité
Le record de longévité pour une fourmi est détenu par une reine de la fourmi noire des jardins, Lasius niger, qui vécut 28 ans et 8 mois dans un laboratoire[28].
Les mâles (caractérisés par leur petite tête et de gros ocelles) ont une vie très brève et, ne sachant pas s'alimenter seuls, meurent dès qu'ils se sont reproduits. La fourmi ouvrière vit entre trois semaines et un an. La reine, elle, peut vivre beaucoup plus longtemps, plusieurs années (jusqu'à 15 ans pour la reine des fourmis rousses Formica rufa)[29].
La fourmilière, le nid des fourmis
Les œufs sont pondus par une ou parfois plusieurs reines (les espèces de fourmis possédant une seule reine sont appelées « monogynes » et celles possédant plusieurs reines sont dites polygynes). Certaines espèces peuvent tolérer, lorsque la colonie est importante, plusieurs reines tellement éloignées qu’elles ne se rencontrent jamais (on parle alors d’espèce oligogynes). La plupart des individus grandissent pour devenir des femelles aptères et stériles appelées « ouvrières ». Périodiquement, des essaims de nouvelles princesses et de mâles, généralement pourvus d’ailes, quittent la colonie pour se reproduire. C'est le vol nuptial qui a lieu, grâce à des facteurs climatiques, de façon synchrone avec l'envol des mâles, pour tous les nids d'une même espèce et d'une même région, durant quelques heures. Après l'accouplement, les mâles meurent ensuite rapidement (mais leur éjaculat survit plusieurs années dans la spermathèque des princesses), tandis que les reines survivantes, fécondées, perdent leurs ailes (souvent elles se les arrachent elles-mêmes), s'enfoncent généralement dans le sol et commencent à pondre, pour établir de nouvelles colonies ou, parfois, retournent dans leur fourmilière natale[30].
La densité de nids varie fortement selon l’espèce et l’environnement, étant notamment liée à la disponibilité en nourriture. La taille des colonies varie d'un extrême à l'autre. La plus petite colonie compte quatre individus avec une reine dans le nid[20].
Formica yessensis, une espèce de fourmi des bois, a construit une supercolonie de 45 000 nids sur 1 250 ha à Hokkaidō (Japon), abritant plus d’un million de reines et 306 millions d’ouvrières[31].
Développement


Les fourmis se développent par métamorphose complète, en passant par trois stades successifs: œuf, larve, nymphe puis le stade adulte final dit parfait ou imago, un type de développement nommé holométabole. L'œuf est minuscule et généralement blanc écru. La larve qui en sort est privée de pattes et est particulièrement dépendante des adultes. Elle fait l'objet de soins particuliers en termes de nourrissement à intervalles réguliers avec de la bouillie protéinée et de nettoyages par léchage. Elle est de plus régulièrement retournée et déplacée afin de respecter ses besoins en hygrométrie et température. Trois à cinq stades larvaires se succèdent et sont les seuls stades où l'animal grandit. S'ensuit la formation de la nymphe qui se passe soit dans un cocon tissé de soie par la larve chez les Formicinae soit nue comme chez les Myrmicinae. Durant cette métamorphose, la nymphe immobile prend l'aspect d'un adulte recroquevillé sur lui-même. Au début blanche, elle se pigmente petit à petit jusqu'à sa dernière mue nommée mue imaginale[32]. Durant ce stade, elle produit un méconium des nymphes qui si il n'est pas éliminé, développe des infections fongiques et cause sa mort[33].
Les différences morphologiques majeures entre les reines et les ouvrières, et entre les différentes castes d’ouvrières quand celles-ci existent, sont principalement induites par le régime alimentaire au stade larvaire. Quant au sexe des individus, il est génétiquement déterminé : si l’œuf est fécondé, l’individu est alors diploïde et l’œuf donnera une femelle (ouvrière ou reine) ; s’il ne l’est pas, l’individu est haploïde et forme un mâle[34].
Une nouvelle ouvrière passe les premiers jours de sa vie adulte à s’occuper de la reine et des jeunes. Ensuite, elle participe à la construction et au maintien du nid, puis à son approvisionnement et à sa défense. Ces changements sont assez brusques et définissent des castes temporelles[20]. C’est-à-dire que les ouvrières se regroupent selon l’activité commune qu’elles auront à un stade de leur vie.
Chez certaines fourmis, il existe également des castes physiques. Selon leur taille, les ouvrières sont dites mineures, moyennes ou majeures, ces dernières participant plutôt à l’approvisionnement. Souvent les fourmis les plus grandes paraissent disproportionnées : tête plus grande et mandibules plus fortes. Chez quelques espèces, les ouvrières moyennes ont disparu, et il existe une grande différence physique entre les plus petites et les plus grandes. Ce polymorphisme est progressif mais rien ne distingue morphologiquement les petites des grandes. D'autres appelées parfois soldats, bien que leur rôle défensif ne soit pas nécessairement prépondérant possèdent une morphologie adaptée à leur fonction.
Fourmi sans reine
Environ un pour cent des espèces de fourmis recensées dans le monde sont des fourmis sans reine[35]. Elles vivent au sein de colonies très réduites dans lesquelles certaines ouvrières se reproduisent. Chez certaines espèces, le privilège de la reproduction est le fruit d’une organisation hiérarchique, où la gamergate, individu aux organes reproducteur développés, occupe une place centrale. Son privilège reproductif pourra être remis en cause par des rivales au cours de joutes phéromonales et d’agressions ritualisées[36].
Chez d'autres espèces, tous ou une partie des individus peuvent se reproduire par parthénogenèse thélytoque[37].
On peut citer par exemple :
- Dinoponera quadriceps ;
- Diacamma ceylonense ;
- Gnamptogenys striatula ;
- Streblognathus peetersi ;
- Streblognathus aethiopicus ;
- Ooceraea biroi.
Comportements
Les fourmis possèdent un comportement que l’on retrouve chez les termites, les abeilles et chez d'autres insectes sociaux consistant à rassembler un grand nombre d’individus afin de créer une colonie fonctionnelle et rapide.
Spécialisations

Toutes sortes de comportements sont observés chez les fourmis, le nomadisme en est l’un des plus remarquables. Les fourmis légionnaires d’Amérique du Sud et d’Afrique, par exemple, ne forment pas de nid permanent. Elles alternent plutôt entre des étapes de vie nomade et des étapes où les ouvrières forment un nid provisoire, le bivouac (en), à partir de leurs propres corps. Certaines espèces de fourmis légionnaires et de fourmis de feu forment même des ponts et des radeaux vivants pour franchir des cours d'eau ou s'autoassemblent en structures émergentes étanches (sphère, dôme ou radeau, les fourmis alternant leurs positions respectives dans ces structures) pour survivre à des inondations[38].
La plupart des fourmis forment des colonies stationnaires, creusant généralement dans le sol. Les colonies se reproduisent par des vols nuptiaux comme décrit plus haut, ou par fission (un groupe d’ouvrières creuse simplement un nouveau trou et élève de nouvelles reines). Les membres de différentes colonies se reconnaissent entre eux grâce à leur odeur.
Quelques cas de développement de nouvelles colonies par des mécanismes particuliers :

- quelques fourmis sont esclavagistes, comme Polyergus rufescens, et pillent le couvain des autres espèces en faisant de véritables raids[39] dans les colonies d’autres fourmis. Elles s’emparent des larves, cocons et nymphes qui sont ensuite ramenées au nid[40]. Une fois nées, les ouvrières « esclaves » se comportent comme si elles étaient dans leur colonie mère et s'occupent des différentes tâches. Il a été montré que différents mécanismes étaient impliqués dans ce phénomène, principalement au niveau de l'odeur des esclaves et des esclavagistes[41].
- Quelques espèces, comme les fourmis amazones (Polyergus rufescens), sont devenues complètement dépendantes de telles esclaves, au point qu'elles sont incapables d'élever leur propre couvain ou d'aménager leur nid sans leur aide[42] ;
- certaines fourmis, comme Myrmica karavajevi ou les espèces du genre Teleutomyrmex, sont appelées inquilines. Elles vivent à l'intérieur de colonies d'autres espèces en profitant de leurs ressources et de leurs soins[43]. La plupart du temps les reines de ces espèces ne produisent pas ou peu d'ouvrières, au profit de la production d'individus sexués. Comme les fourmis esclavagistes, elles sont considérées comme des parasites sociaux[44] ;
- les fourmis pot-de-miel possèdent des ouvrières spécialisées qui stockent l’alimentation pour le reste de la colonie ; elles sont généralement immobilisées par leurs gastres considérablement gonflés et forment de véritables réservoirs vivants. En Afrique, Amérique (Myrmecocystus) et Australie où elles vivent, on les considère comme un mets délicieux ;

- les fourmis tisserandes (comme celles du genre Oecophylla) construisent leur nid dans des arbres en assemblant des feuilles. Elles les joignent d'abord par un pont d’ouvrières, puis elles utilisent la soie produite par leurs propres larves, qu'elles tiennent entre leurs mandibules, pour les coller les unes aux autres. La reine est transportée un peu plus loin par les ouvrières lorsque les feuilles se dessèchent et un nouveau nid provisoire est à nouveau construit. Ces fourmis sont depuis longtemps utilisées dans les cultures en Chine dans le but de protéger les fruits contre les insectes ravageurs ;
- les fourmis coupeuses de feuilles, aussi appelées fourmis champignonnistes, comme les espèces des genres Atta et Acromyrmex, se nourrissent principalement d’un champignon symbiotique qui se développe uniquement dans leurs colonies. Elles récoltent continuellement des feuilles qu'elles découpent en petits morceaux et utilisent comme substrat afin de cultiver leur champignon. Les castes de ces fourmis sont organisées autour de la découpe des feuilles et en fonction de la taille des morceaux dont elles sont chargées ;
- les fourmis charpentières (certaines espèces du genre Camponotus) font leurs nids en creusant le bois. Les ouvrières varient en taille (polymorphisme) et certaines d'entre elles comptent parmi les plus grandes espèces d’Europe, même si certaines espèces peuvent être de petite taille ;
- les fourmis moissonneuses (Messor spp.) du Bassin méditerranéen amassent des graines (sauvages ou cultivées) dans des « greniers » souterrains. Les ouvrières décortiquent et mâchent chaque grain pendant plusieurs heures de façon à en obtenir une pâte comestible appelée « pain de fourmi » ;
- certaines espèces de fourmis peuvent être invasives lorsqu'elles arrivent à s’implanter hors de leur région d'origine. Les plus connues en France sont les fourmis d’Argentine. Cette espèce particulièrement remarquable par sa petite taille (1-3 mm) a formé une super-colonie de Barcelone à Milan. Cette espèce introduite accidentellement en France via des pots de lauriers-roses venus d’Argentine a déjà chassé plusieurs espèces d’autres insectes du sud du pays ;
- les espèces de Formica du sous-genre Formica (Formica sensu stricto) sont protégées dans certains pays d'Europe (notamment en Belgique et en Suisse). Leur présence au sein d’une forêt protège les arbres du développement d’insectes ravageurs. Elles forment des nids constitués d'un dôme de brindilles pouvant atteindre plus d’un mètre de haut, souvent en lisière de forêt ou de clairière. Le dôme permet une régulation de la température interne et une exposition optimisée aux rayonnements solaires, favorisant ainsi une croissance rapide du couvain. Ces fourmis utilisent une grande quantité de résine de conifères pour la construction de leur nid et qui joue un rôle antibiotique. Fait notable, certaines espèces de Formica peuvent s’associer en supercolonies.
Communication

La communication entre les fourmis se fait surtout au moyen de produits chimiques volatils appelés phéromones. 39 glandes les émettant ont été répertoriées[45]. Les phéromones sont parfois excrétées dans une substance lipophile qui recouvre naturellement tout le corps de la fourmi. Comme d’autres insectes, les fourmis captent ces composés odorants avec leurs antennes. Celles-ci sont assez mobiles, ayant — comme mentionné plus haut — une articulation coudée après un premier segment allongé (le scape), leur permettant d’identifier aussi bien la direction que l’intensité des odeurs.
L’utilisation principale des phéromones réside dans la définition et le repérage de « pistes » olfactives destinées à guider les fourmis vers des sources de nourriture (voir ci-dessous). Les phéromones sont aussi mélangées avec la nourriture échangée par trophallaxie, informant chacune sur la santé et la nutrition de ses congénères. Les fourmis peuvent aussi détecter à quel groupe de travail (par exemple la recherche de nourriture ou la maintenance de nid) l’une ou l’autre appartient. De manière analogue, une fourmi écrasée ou attaquée produira une phéromone d’alerte dont la concentration élevée provoque une frénésie agressive chez les congénères à proximité ou dont une concentration plus faible suffit à les attirer. Dans certains cas, les phéromones peuvent être utilisées pour tromper les ennemis, ou même pour influencer le développement des individus.
Certaines fourmis émettent des sons, on parle alors de stridulation. Ces sons permettent par exemple d’attirer d’autres ouvrières pour porter une proie trop lourde pour un individu isolé.
Certaines espèces utilisent aussi la communication visuelle. Chez Tetraponera par exemple, lorsque les larves ont un besoin en nourriture, elles remuent simplement la tête afin qu'une ouvrière intervienne pour lui fournir de la nourriture liquide de bouche à bouche. Chez les fourmis tisserandes, lorsqu’une ouvrière se lance dans la construction d’un nouveau nid, elle commence par agripper une feuille pour la courber. Elle sera immédiatement rejointe par son entourage qui aura aperçu la scène et qui l’aidera dans sa tâche. C’est ainsi qu’elles pourront rejoindre les bords de deux feuilles pour les tisser entre elles.
La trophallaxie

La majorité des fourmis pratiquent la trophallaxie, un processus alimentaire au cours duquel une fourmi régurgite une partie de la nourriture qu’elle a ingérée dans son jabot social pour la restituer à une autre fourmi.
Comportement collectif
L'entomologiste américain W. M. Wheeler propose en 1911 d'assimiler la colonie de fourmis à un superorganisme où 95 % d'individus stériles permettent aux 5 % de reproducteurs d'assurer une reproduction inégalée[46]. Le biologiste britannique de l’évolution W. D. Hamilton[47] et le sociobiologiste français Pierre Jaisson[48] introduisent l'hypothèse de super-société, Jaisson donnant l'exemple d'une Fourmi rousse des bois capable de constituer au Japon une fédération de 45 000 colonies interconnectées par 100 kilomètres de pistes et occupant 270 hectares[49]. Ces termes qui idéalisent les colonies et en font des modèles miniatures des sociétés humaines sont entachés d'une doctrine téléologique du « spectacle de la nature » rempli d'harmonie, et sont, comme les termes désignant des « castes » composées par des « reines », des « ouvrières » et des « soldats », empreints d'un anthropomorphisme[50].
Les fourmis attaquent et se défendent de plusieurs manières : morsure grâce aux mandibules (chez les femelles de certaines espèces, ces appendices buccaux sont reliés à des glandes produisant des phéromones d'alarme et des composés toxiques proches de ceux du venin, infligeant des morsures parfois plus douloureuses que celles faites avec un aiguillon)[51] ; envenimation grâce à un appareil à venin (glande à poison produisant un venin habituellement formé d'un mélange très concentré d'enzymes protéolytiques en phase aqueuse ; glande de Dufour (en) qui produit une substance lipophile facilitant la pénétration du venin ; aiguillon, appelé aussi dard). L'aiguillon peut être vulnérant et provoquer une piqûre plus ou moins douloureuse selon les espèces. Il peut avoir une extrémité aplatie en spatule qui étale le poison au niveau des membranes intersegmentaires de la cuticule d'arthropodes[52]. Chez les Formicinés qui n'ont plus d'aiguillon venimeux, la glande à poison contient essentiellement de l'acide formique qui joue alors à la fois le rôle de phéromone d'alarme, de phéromone de piste et de composé toxique. Cet acide concentré est répandu sur les morsures qu'elles infligent à leur ennemi avec leurs mandibules, faisant fondre la chitine grâce à sa causticité (la concentration de cet acide peut atteindre 60 %)[53]. Les fourmis des bois adoptent une autre stratégie en projetant l'acide à plusieurs centimètres par compression de l'abdomen, ce qui a pour but d'alerter la colonie et de dissuader tout prédateur[52].
Les fourmis Camponotus cylindricus peuvent s'agripper à un ennemi puis faire exploser leur abdomen qui contient une substance collante[54] - [55].
Chez la plupart des espèces, la colonie a une organisation sociale complexe et est capable d’accomplir des tâches difficiles (exploiter au mieux une source de nourriture, par exemple). Cette organisation apparaît grâce aux nombreuses interactions entre fourmis, et n’est pas dirigée — contrairement à une idée répandue — par la reine. On parle alors d’intelligence collective pour décrire la manière dont un comportement collectif complexe apparaît en faisant appel à des règles individuelles relativement simples.
Dans les colonies de fourmis, le « comportement global » n’est donc pas programmé chez les individus, et émerge de l’enchaînement d’un grand nombre d’interactions locales entre les individus et leur environnement.

Un exemple classique de comportement collectif auto-organisé est l’exploitation des pistes de phéromones. Une fourmi seule n’a pas l’intelligence nécessaire pour choisir le plus court chemin dans un environnement complexe. De fait, c’est la colonie dans son ensemble (ou du moins les individus impliqués dans la recherche de nourriture) qui va choisir ce chemin.
En 1980, Jean-Louis Deneubourg a pu vérifier expérimentalement qu’une colonie de fourmis (de l’espèce Lasius niger) disposant de deux chemins de longueurs différentes pour rallier une source de nourriture, choisissait plus souvent le chemin le plus court. Il décrit ainsi ce phénomène[56] :
« […] un « éclaireur », qui découvre par hasard une source de nourriture, rentre au nid en traçant une piste chimique. Cette piste stimule les ouvrières à sortir du nid et les guide jusqu’à la source de nourriture. Après s’y être alimentées, les fourmis ainsi recrutées rentrent au nid en renforçant à leur tour la piste chimique. Cette communication attire vers la source de nourriture une population de plus en plus nombreuse. Un individu qui découvre une source de nourriture y « attire » en quelques minutes n congénères (par exemple 5) ; chacun de ceux-ci y attirent à leur tour n congénères (25), et ainsi de suite. »
Si l’on considère plusieurs chemins pour se rendre sur le lieu d’approvisionnement, on comprend que les individus empruntant le plus court reviendront plus vite à la fourmilière que ceux qui auront pris le plus long. C’est ainsi que ce chemin comportera une trace olfactive de plus en plus forte par rapport aux autres et sera donc préféré par les fourmis
Orientation
Certaines fourmis peuvent parcourir des distances éloignées de jusqu'à 200 mètres de leur nid[57], en laissant des pistes odorantes qui leur permettent de retrouver leur chemin même dans l'obscurité. Dans les régions chaudes et arides, ces mêmes fourmis qui affrontent la dessiccation doivent trouver le chemin de retour au nid le plus court possible[58]. Les fourmis diurnes du désert du genre Cataglyphis naviguent en gardant la trace de la direction ainsi que la distance parcourue mesurée par un podomètre interne qui tient compte du nombre de pas effectués[59] et en évaluant le mouvement des objets dans leur champ visuel (flux optique). Les directions sont mesurées en utilisant la position du soleil (leur œil composé possède des cellules spécialisées capables de détecter la lumière polarisée du soleil[60]), de la lune, des étoiles[61] ou le champ magnétique terrestre[60].
En 2011, Antoine Wystrach soutient une thèse qui montre que les fourmis n'utilisent pas des repères visuels individuels, mais l'ensemble du panorama de leur champ visuel. Ceci leur permet d'avoir une orientation précise et exacte dans des environnements naturels[62] - [63].
Répartition
| Écozone | Nombre d’espèces[14] |
|---|---|
| Néotropique | 2162 |
| Néarctique | 580 |
| Europe | 400 |
| Afrique | 2500 |
| Asie | 2080 |
| Mélanésie | 275 |
| Australie | 985 |
| Polynésie | 42 |
Les fourmis se sont adaptées à presque tous les milieux terrestres et souterrains (on en a trouvé jusqu’au fond d’une grotte de 22 km de long en Asie du Sud-est), à l’exception des milieux aquatiques et des zones polaires et glaciaires permanentes.
Le nombre total de fourmis vivant à un instant donné est estimé à 1015-1016 (un à dix millions de milliards)[64] - [65]. Les fourmis représenteraient 1 à 2 % du nombre d’espèces d’insectes, et chaque individu ne pèse que de 1 à 10 milligrammes, mais leur masse cumulée était estimée en 1990 à environ quatre fois supérieure à celle de l’ensemble des vertébrés terrestres[66]. Une nouvelle estimation en 2000 a établi que leur biomasse est comparable à celle de l'humanité, ce qui représente 15 % à 20 % de la biomasse animale terrestre[67]. Environ 12 000 espèces de fourmis[68] étaient répertoriées en 2005 (dont 285 en France[69]), mais de nouvelles espèces sont régulièrement décrites, essentiellement en zone tropicale et dans la canopée. Seules 400 espèces sont connues en Europe[68], alors qu’on peut compter jusqu’à 40 espèces différentes sur un seul mètre carré de forêt tropicale en Malaisie (668 espèces comptées sur 4 hectares à Bornéo)[68] et 43 espèces sur un seul arbre de la forêt péruvienne amazonienne[68], soit presque autant que pour toute la Finlande ou pour les îles Britanniques[68]. Environ huit millions d’individus ont été comptés sur un hectare d’Amazonie brésilienne[68], soit trois à quatre fois la masse cumulée des mammifères, oiseaux, reptiles, et amphibiens vivant sur cette surface. Elles jouent un rôle majeur dans le recyclage des déchets et dans la formation et la structuration des sols. Plusieurs espèces vivent en symbiose avec des bactéries, des champignons, d'autres animaux (papillons ou pucerons par exemple) ou avec des plantes.
Relations de coopération et de prédation

- Les pucerons sécrètent un liquide sucré appelé le miellat dont certaines fourmis se nourrissent. Les fourmis tiennent à distance les prédateurs des pucerons et les transportent aux meilleurs emplacements pour se nourrir. Certaines espèces de pucerons se nourrissant sur les racines des plantes sont même accueillies au sein de la fourmilière.
- Un comportement singulier a été observé chez une centaine de passereaux : le bain de fourmis. La méthode active consiste à prendre des fourmis dans leur bec, soulever une aile qu'ils font reposer sur la queue tournée sur le côté et frotter rapidement les fourmis contre la face interne des extrémités des rémiges primaires, qu'ils imprègnent ainsi d'acide formique, mêlé à leur propre salive, ce qui permettrait d'éliminer les nombreux parasites colonisant le plumage[70]. La méthode passive ou indirecte consiste à laisser les fourmis grimper sur tout leur corps, notamment en se roulant dans une fourmilière, puis à les inciter intentionnellement à lancer un jet d'acide formique[71].
- Les relations avec les chenilles et les Lycaenidae, des papillons, sont plus complexes, allant de la coopération au parasitisme. Ainsi, à l'instar des pucerons, les chenilles du thécla de l'Yeuse et de l'azuré des cytises produisent un miellat qui incitent les fourmis à la protéger. Les larves de l'azuré de la croisette et de l'azuré des mouillères sont pour leur part transportées dans les fourmilières où les chenilles poursuivent leur développement protégées par leurs hôtesses. En revanche, plusieurs espèces du genre Phengaris sont myrmécophages. Elles sécrètent une substance qui attire les fourmis du genre Myrmica et incitent ces dernières à les considérer comme des larves. Elles sont alors emmenées dans la fourmilière où elles dévorent alors les larves et les nymphes[72].
- Beaucoup de plantes myrmécophiles utilisent une structure symbiotique, la domatie, qui constitue un site de nidification pour des colonies de fourmis.

Résistance
Lors des séances d'auto-toilettage, les fourmis sécrétent, au niveau des glandes métapleurales de nombreux composés aux propriétés insecticides, fongicides, bactéricides, virucides servant de défenses chimiques contre les agents pathogènes (notamment chez les fourmis champignonnistes pour protéger leurs œufs et leurs cultures des champignons). Elles produisent également une batterie de molécules qui ont d'autres fonctions documentées chez certaines espèces[73]. Elles font partie des espèces pionnières et montrent des capacités étonnantes de terrassement, de colonisation et de résilience écologique, et même de résistance à la radioactivité.
Certaines fourmis semblent ne pas ressentir la chaleur. Ainsi dans la Pampa d'Argentine les gauchos mettent régulièrement le feu aux herbes sèches. Les fourmis Atta qui vivent au sol continuent à couper des feuilles jusqu'à brûler vives.
Les Solenopsis invicta, aussi appelées fourmis de feu, forment un radeau en s'accrochant les unes aux autres lorsqu'elles sont confrontées à un risque de noyade. Cette technique leur permet de survivre dans la forêt amazonienne, lors des moussons, où les risques d’inondations et de noyade sont élevés[38] .
Terrassement

Les ouvrières de l’espèce Atta d’un seul nid peuvent mobiliser et répartir sur 100 mètres carrés jusqu’à 40 tonnes de terre. Certaines espèces jouent un rôle au moins aussi important que celui des lombrics en ce qui concerne les couches superficielles du sol ; ce sont de 400 à 800 kg de sol qui sont creusés, mobilisés, transportés, maçonnés pour construire un nid climatisé dans le désert, et 2,1 tonnes en Argentine par Camponotus punctulatus. De nombreuses espèces décolmatent et acidifient le sol, rendant ainsi mobilisables des nutriments bien moins disponibles. Elles enfouissent de la matière organique et remontent en surface un sol fragmenté en petites particules propices à la croissance des graines. Les fourmis contribuent à la fois à homogénéiser et aérer le sol, à l’enrichir en surface et en profondeur, tout en diversifiant les habitats en fonction de la proximité de la fourmilière.
Fonctions écologiques
Les fourmis jouent un rôle pédologique majeur en protégeant certains arbres de parasites. Ainsi, le merisier attire les fourmis grâce à ses nectaires - des glandes produisant du nectar - situées sur le pétiole de ses feuilles. La fourmi rousse des bois Formica polyctena consommerait 14 500 tonnes d’insectes par an, rien que dans les forêts alpines d’Italie, conservant des « îlots verts » autour de leurs nids lors des épisodes de défoliation. Elle est protégée par la loi dans plusieurs pays comme la Suisse et la Belgique, au même titre que les autres espèces de Formica sensu stricto.
Certaines fourmis contribuent à disperser et à faire germer de nombreuses graines, près de 100 % des graines d’une euphorbe méditerranéenne sont transportées par 3 ou 4 espèces de fourmis qui consomment l’élaïosome charnu et gras de la graine en rejetant le reste, sans affecter sa capacité germinative.
De nombreuses épiphytes dépendent des fourmis ou sont favorisées par leur présence[74]. Ces plantes produisent du nectar qui les attire et/ou un abri. En contrepartie, les fourmis fournissent une protection contre divers prédateurs et parfois jouent un rôle dans la dispersion des graines. Certaines espèces de Crematogaster[75] - [76] ou de Camponotus végétalisent leurs nids et fabriquent des jardins suspendus en incorporant des graines d’épiphytes dans les parois de leurs nids faits de fibres ou pulpe de bois mâchées. Elles défendent activement leurs jardins dont elles tirent un nectar extrafloral, un abri supplémentaire et peut-être une protection microclimatique.
Seize espèces de fourmis pratiquent un mutualisme de pollinisation[77]. La plupart des autres, si elles fréquentent les fleurs pour y récolter du nectar[78], produisent via leur glande métapleurale des substances antibiotiques inhibant la croissance du tube pollinique[79] ou pratiquent une castration mécanique de la fleur (destruction des pousses florales, ablation d'une partie de la fleur qui sert de gîte aux colonies de fourmis)[80]. La myrmécochorie concerne quant à elle 3 000 espèces de plantes[81]. Certaines plantes tropicales pratiquent aussi le mutualisme de nutrition, appelé myrmécotrophie, ce qui désigne leur aptitude à absorber les nutriments prélevés dans les déchets stockés par les fourmis. Enfin, l'interaction la plus courante est le mutualisme de protection : en échange de nourriture par la plante, la fourmi la débarrasse de ses parasites et phytophages[82].
Certaines espèces causent cependant des dégâts à certaines plantes cultivées via l’élevage qu'elles font des pucerons et cochenilles.
Fonctions agronomiques ou pour l’agrosylviculture
Certaines espèces de fourmis tisserandes sont depuis longtemps introduites dans les cultures fruitières pour défendre les fruits d’attaques d’insectes. Des fourmis du genre Ectatomma à petits effectifs mais à nids nombreux (11 000 nids/ha comptabilisés dans les plantations de café ou cacao au Chiapas au Mexique mangeraient annuellement 16 millions de proies pour Ectatomma tuberculatum et 15 fois plus (260 millions) pour Ectatomma ruidum.. Solenopsis invicta défend la canne à sucre de certains parasites majeurs et Wasmannia auropunctata protège les cocotiers des punaises. En Europe, ces espèces sont toutefois considérées comme invasives.
Fonction sanitaire

Les fourmis jouent un rôle majeur en tant que nécrophages en se nourrissant de petits animaux morts. En nettoyant rapidement les cadavres, elles participent à empêcher la libération de nombreuses propagules de microbes pathogènes dans l’environnement.
On estime que 90 % au moins des cadavres d’insectes dans la nature finissent dans des fourmilières, avant d’être recyclés dans le sol.
Les fourmis se nettoient sans cesse et s’enduisent de molécules bactéricides, virucides et antifongiques. Les « nettoyeuses », fourmis chargées d’éliminer les cadavres du nid (reconnus par l’acide oléique gazeux qu'ils dégagent), les excréments et autres déchets, sont souvent des ouvrières en fin de vie ou des individus qui restent dans les endroits consacrés aux déchets (dépotoirs) et n’ont plus de contacts directs avec les autres fourmis, ce qui limite la propagation d'épidémies. Ces fossoyeuses sont en effet imprégnées d'acide oléique et se voient refuser l'accès au nid par les fourmis-soldats[83]. Certaines espèces s’enduisent de bactéries filamenteuses « amies » qui repoussent d’autres bactéries, pathogènes. Cependant, leurs élevages de pucerons peuvent induire l’infestation des plantes par des champignons, via le miellat ou les piqûres faites dans les feuilles.
Autres fonctions
L’industrie, en particulier l'industrie pharmaceutique, s’intéresse aux nombreuses substances synthétisées par les fourmis. Des fourmilières reconstituées et circulant dans des salles et couloirs de plastique sont quant à elles utilisées comme moyen pédagogique. La fourmi en tant qu’individu ou société intéresse également les cybernéticiens et les scientifiques qui travaillent sur l’auto-organisation.
Menaces
La pollution, notamment celle provoquée par les pesticides, affecte de nombreuses espèces. Toutefois, c’est surtout l’introduction d’espèces de fourmis invasives et la destruction de leurs habitats (forêts, prairies, savanes et terres arbustives tempérées, savanes, bocage) qui sont les menaces principales pesant sur la diversité des fourmis. Leurs prédateurs naturels sont nombreux (notamment amphibiens, reptiles, oiseaux, mammifères ou encore arthropodes). Certains animaux en sont des consommateurs spécialisés, comme le pangolin ou le tamanoir, et d'autres les consomment épisodiquement (par exemple le faisan ou l’ours brun en Europe, ou encore les chimpanzés, qui savent utiliser des brindilles pour aller les chercher dans leur nid, sans jamais mettre en péril les espèces).
Certaines mouches parasites pondent leurs œufs à l'intérieur de fourmis. Les larves se nourrissent et se développent à l'intérieur de leur hôte avant d'en émerger. Certaines espèces de mouches parasites de la famille des Phoridae ont notamment été introduites aux États-Unis dans une démarche de lutte biologique afin de lutter contre la prolifération de la fourmi de feu.
Les fourmis arboricoles se déplaçant le long des branches ou sur les feuilles dans la canopée de la forêt sont sujettes à être balayées par le vent, la pluie, ou encore le passage d'un animal. On a observé en 2005 que les fourmis arboricoles survivent en se comportant en « parachutistes ». Lorsqu'elles tombent, elles se mettent en position pattes écartées, comme les parachutistes qui contrôlent leur chute en inclinant leurs membres et leur corps. Ces fourmis glissent avec les pattes antérieures et l’abdomen orientés vers le tronc d’arbre, effectuant souvent des virages à 180° en direction de la cible dans les airs.
Un petit coléoptère, la loméchuse, présente des poils spéciaux à l'extrémité de son abdomen. Les fourmis lèchent ces poils avec avidité ; et, à partir de ce moment, la colonie est condamnée : au lieu de soigner leurs petits, elles perdront leur temps à lécher les loméchuses, ce qui les intoxique jusqu'à leur faire perdre l'équilibre. La loméchuse, quant à elle, pond ses œufs dans le couvain des fourmis : les jeunes larves à peine écloses dévorent toutes les larves de fourmis qui sont à leur portée, mais seront elles-mêmes bien soignées par les nourrices encore attachées à leur devoir. Au bout de peu de temps, la colonie n'a plus de jeunes et les rares qui naissent, mal nourris, sont anormaux. Alors la troupe de loméchuses sort de la fourmilière qu'elle a conduite à sa ruine et va en exploiter une autre. C'est le seul exemple connu de consommation d'une substance toxique conduisant à la mort de la colonie[84].
Taxonomie
Sous-familles
- Formicomorphes :
- Myrmeciomorphes :
- Dorylomorphes :
- Cerapachyinae
- Ecitoninae
- Leptanilloidinae
- Aenictinae
- Dorylinae
- Aenictogitoninae
- Leptanillomorphes :
- Apomyrminae
- Leptanillinae
- Poneromorphes :
- Amblyoponinae
- Ponerinae
- Ectatomminae
- Heteroponerinae
- Paraponerinae
- Proceratiinae
- Myrmicomorphes :
- Agroecomyrmecinae
- Myrmicinae
- Sous-familles éteintes :
- Armaniinae †
- Sphecomyrminae †
- Brownimeciinae †
- Formiciinae †
- Incertae sedis :
- Paleosminthurinae
Sous-famille Ponerinae
Chez les ponérines, les reines ne se distinguent généralement que difficilement des ouvrières ; le passage d’une caste à l’autre se fait plutôt par des formes de transition. Elles diffèrent des autres fourmis par la base de l’abdomen : le pétiole se compose d’un segment avec un nœud, et l’anneau abdominal qui suit est séparé du gastre par une encoche très nette. Reines et ouvrières possèdent un aiguillon. Les nymphes sont toujours enveloppées par un cocon. Cette sous-famille habite surtout les pays chauds. En France, elle est représentée par 7 espèces.
Après de longues années de controverses et de recherche, il est aujourd'hui accepté que la plupart des espèces considérées comme faisant partie des Ponerinae au sens large ne représentent pas une famille monophylétique mais plutôt un ensemble de familles basales, certaines étant les ancêtres des autres familles[85]. On utilise généralement le terme Poneromorphe (ou Ponerinae lato sensu) pour désigner ce groupe paraphylétique, qui reste utile dans certains cas.
Exemple d'espèce en France : Ponera coarctata (elle fait partie des « Fourmis sans reine » citées plus haut).
Sous-famille Myrmicinae
Les Myrmicinae se distinguent facilement des autres fourmis par leur pétiole abdominal. Il se compose toujours de deux segments en forme de nœuds qui correspondent aux 1er et 2e segments abdominaux. Reines et ouvrières possèdent un aiguillon, et certaines espèces peuvent infliger des piqûres très douloureuses. Les nymphes ne sont pas enveloppées d’un cocon comme chez la plupart des fourmis à écaille (Myrmicinae, Dolichoderinae, Formicinae). En France, on trouve 106 espèces de Myrmicinae.
Quelques exemples d'espèces en France : Myrmica rubra, Temnothorax affinis, Tetramorium caespitum.
Sous-famille Dolichoderinae
Les représentantes de cette sous-famille peu nombreuse (9 espèces en France) possèdent un pétiole à écaille, mais celui-ci est bas et incliné vers l’avant, contrairement à celui des Formicinae, que nous verrons par la suite. Le gastre n’est composé que de 4 segments chez les reines et ouvrières. L'aiguillon est atrophié et les nymphes sont nues.
Exemple d'espèce en France : Dolichoderus quadripunctatus, Tapinoma erraticum.
Sous-famille Formicinae
Chez les Formicinae, le pétiole forme une écaille plate et dressée. Le gastre, se compose de 5 segments chez les ouvrières et les reines. Chez presque toutes les espèces, les nymphes sont enveloppées d’un cocon. 55 espèces de Formicinae sont présentes en France.
Quelques exemples d'espèces en France : Camponotus ligniperdus, Lasius niger, Formica rufa, Formica sanguinea, Polyergus rufescens.
Évolution de la famille

Les fourmis fossiles les plus anciennes sont datées de l'Albien, un étage géologique vieux d'environ 100 millions d’années[86] mais les myrmécologues estiment que les premières espèces pourraient être apparues au Crétacé inférieur, entre 120 et 143 millions d'années[87]. Le plus ancien fossile connu apparenté aux fourmis est celui de Gerontoformica cretacica, découvert en 2004 par le paléoentomologiste du MNHN André Nel dans l’ambre de l’Albien supérieur, en Charente-Maritime (France)[88]. Son anatomie laisse penser qu'elle était carnivore (longues jambes, fortes mandibules)[89].
Les fourmis semblent avoir divergé d’insectes apparentés à des guêpes solitaires (certaines espèces de fourmi ont d'ailleurs conservé un dard et seules les ouvrières ont perdu leurs ailes)[90]. La sous-famille Martialinae, dont la seule espèce connue est Martialis heureka, pourrait être à l’origine de toutes les autres sous-familles. Une radiation explosive se produit dans la litière des forêts tropicales au milieu du crétacé et est contemporaine de l'apparition des plantes à fleurs (coévolution naturelle pour s'adapter aux insectes phytophages et pollinisateurs)[91]. L'extinction Crétacé-Tertiaire il y a 66 millions d'années touche peu les insectes (essentiellement les insectes qui ont les associations les plus spécialisées avec les fleurs, tandis que beaucoup de familles d'insectes ont probablement été protégées par leur mode de vie souterrain)[92] et les fourmis poursuivent leur diversification et leur expansion comme les mammifères[90].
Position phylogénétique de la famille Formicidae[93]
| Vespoidea |
| ||||||||||||||||||||||||
Origine de l'eusocialité
Comme chez d'autres hyménoptères, l'eusocialité a évolué au début de la lignée des fourmis et n'a presque jamais été perdue par la suite. L'apparition de l'eusocialité aurait été favorisée par le système de détermination sexuelle haplodiploïde des hyménoptères et les soins parentaux déjà présents chez les ancêtres des fourmis actuelles[94]. Les soins parentaux témoignent d'un investissement important dans la reproduction, et favorisent le contact entre différentes générations, tandis que le système de détermination haplodiploïde rend les sœurs génétiquement plus proches entre elles qu'elles ne le seraient de leurs propres descendants. La théorie de la sélection de parentèle explique que dans une telle situation des individus peuvent avoir intérêt à privilégier la reproduction de leurs parents plutôt que la leur.
De plus, il semble que chez les fourmis le métabolisme de l'insuline soit impliqué dans l'apparition d'une caste stérile d'ouvrières[95], comme le suggèrent les études de Daniel Kronauer sur le gène ilp2 (insulin-like peptide 2). Ce gène agirait sur le cycle de ponte, permettant à certains individus seulement de se reproduire, en inhibant la reproduction des autres[96].
Relations avec les humains

Les rapports entre humains et fourmis sont très variables. D’un côté, les fourmis ont souvent été utilisées dans des fables et des histoires enfantines pour représenter l’acharnement au travail et l’effort coopératif. Elles peuvent aussi être perçues comme utiles pour éliminer certains insectes nuisibles et aérer le sol. Diverses expéditions ont montré que la tribu Rahamefy se servait des fourmis pour rendre les sols meubles.
Toutefois, elles peuvent devenir sources de nuisances lorsqu'elles envahissent les maisons, les cours, les jardins et les champs.
Les fourmis sont un plat particulièrement apprécié pour ses qualités nutritives par certaines tribus aborigènes d'Australie.
Certaines espèces ont la réputation d'être potentiellement dangereuses pour l'homme, comme les fourmis légionnaires du genre Dorylus ou encore la fourmi « bull dog » (Myrmecia pyriformis). Dans leur quête de nourriture ou pour la défense de leurs nids, elles sont capables d'attaquer des animaux beaucoup plus grands qu’elles. Dans le cas de la fourmi bulldog, même si les attaques sur l’être humain sont plutôt rares, les piqûres et les morsures peuvent être mortelles si elles sont répétées, en raison d'un possible choc anaphylactique[97].
Les fourmis peuvent aussi être source de problèmes lorsqu’elles sont introduites dans des zones géographiques où elles ne sont pas indigènes. C'est le cas de Linepithema humile, la fourmi d’Argentine, qui forme une supercolonie qui va des côtes italiennes aux côtes espagnoles en passant par la France, soit plus de 6 000 km[98], et extermine les espèces indigènes. Ce phénomène a pu être renforcé par le renforcement des échanges commerciaux et des transports.
L'adaptation à un environnement modifié par l'être humain tel que la ville peut faire évoluer des colonies forestières comptant quelques milliers d'individus et une seule reine à plusieurs millions de membres et plusieurs dizaines de milliers de reines. C'est le cas de la fourmi odorante (Tapinoma sessile) en Amérique. Cette adaptation reste exceptionnelle et d'autres espèces, bien qu'étant soumises aux mêmes contraintes et bénéfices, ne réagissent pas de la même manière. Une des explications possibles serait que la fourmi odorante s'adapte plus vite que les autres espèces et monopolise alors cette nouvelle niche écologique au détriment des autres espèces qui en dépendent[99].
Pilosité humaine
Les œufs de fourmis relèveraient d'un rituel de beauté séculaire en Turquie et au Moyen-Orient où les femmes badigeonnaient leurs bébés d'œufs de fourmis pour qu'ils grandissent imberbes[100] - [101].
Alimentation
Les œufs de certaines fourmis (en)sont utilisés pour l'alimentation humaine.
Méthodes répulsives
Certaines odeurs fortes ont une action répulsive sur les fourmis. C'est notamment le cas du jus de citron[29] et du vinaigre, ce qui permet de les éloigner en en dispersant sur leur passage[102].
En science et technologie
Les myrmécologues étudient les fourmis en laboratoire et dans leurs conditions naturelles. Leurs structures sociales complexes et variées ont fait des fourmis un organisme modèle très utilisé. Leur capacité à voir dans l'ultraviolet a été découverte par Sir John Lubbock en 1881[103]. Des études sur les fourmis ont principalement été menées dans les domaines de l'écologie et de la sociobiologie. Un intérêt important leur a été porté dans le cadre de l'élaboration de théories concernant la sélection de parentèle (leur système de détermination sexuelle haplodiploïde avec des mâles haploïdes et des femelles diploïdes crée des asymétries de parenté entre les représentants des différentes castes de la fourmilière[104]) et les stratégies évolutivement stables[105]. Les colonies de fourmis peuvent être étudiées en élevage ou en les maintenant temporairement dans un vivarium spécialement conçu dans lequel les individus peuvent par exemple être suivis en les marquant avec des couleurs[106].
Les techniques utilisées avec succès par les colonies de fourmis ont été étudiées en informatique et en robotique afin de produire des systèmes distribués et tolérants aux pannes pour servir à résoudre des problèmes complexes, comme avec les algorithmes de colonies de fourmis et la robotique des fourmis (en). Ce domaine de la biomimétique a conduit à des études sur la locomotion des fourmis, sur les moteurs de recherche qui font usage du « chemin le plus court entre la fourmilière et une source de nourriture », d'algorithmes tolérant aux pannes de stockage en réseau.
Invasion de la fourmi d'Argentine

La fourmi d’Argentine, Linepithema humile, décrite pour la première fois en 1868, par Gustav Mayr a profité des échanges commerciaux pour s’expatrier et coloniser le Sud des États-Unis dès 1891, l'Europe en 1904, l'Afrique du Sud en 1908 et l'Australie en 1939. Il est probable qu’elle ait atteint les côtes méditerranéennes en 1920 par le biais de l'importation de plantes à fleur.
En 2002, des entomologistes européens ont constaté que la fourmi d’Argentine avait envahi l'Europe du Sud sur 6 000 km, du nord de l’Italie jusqu’à la Galice et le Portugal, en passant par le sud de la France. Cette supercolonie est la plus grande jamais observée dans le monde. La deuxième se situe en Catalogne.
Le changement d’environnement de ces fourmis serait à l’origine de l'échelle de leurs colonies. En effet, dans leur pays natal, les colonies de Linepithema Humile forment des groupes beaucoup plus petits. C’est l’absence de prédateur en Europe qui aurait permis à ces fourmis d’augmenter la densité de leurs nids[107], augmentant ainsi les échanges entre les ouvrières des différents nids, et entraînant un appauvrissement de la diversité des gènes de reconnaissance des individus au sein de leur nid d'origine, ce qui aurait résulté en l'émergence d'une unique supercolonie composée de l'alliance d'une multitude de colonies. En 2004, des scientifiques américains ont remis en cause l’idée d’appauvrissement génétique. L’étude de Deborah Gordon sur une supercolonie présente en Californie, publiée dans la revue Ecology, a révélé que la coopération des fourmis aurait plutôt pour origine un régime alimentaire commun.
Les fourmis d’Argentine ne sont pas dangereuses pour l’homme mais elles nuisent à l’écosystème de l’Europe du Sud. Un des moyens envisagés pour empêcher l’expansion de cette supercolonie serait de lutter contre l’unicolonialité qui unit les nids de fourmis.
Galerie
 Tête de fourmi grossie au microscope électronique.
Tête de fourmi grossie au microscope électronique. Reine Formica sanguinea et ouvrière « esclave » Formica fusca).
Reine Formica sanguinea et ouvrière « esclave » Formica fusca). Myrmica rubra « à la traite » de pucerons.
Myrmica rubra « à la traite » de pucerons. Fourmis et pucerons.
Fourmis et pucerons. Atta colombica au Panama : ouvrières découpant des feuilles.
Atta colombica au Panama : ouvrières découpant des feuilles. Atta colombica, au Panama. Ouvrières au transport.
Atta colombica, au Panama. Ouvrières au transport. Œil de Formica sanguinea.
Œil de Formica sanguinea. Individus sexués ailés, se préparant pour un vol nuptial.
Individus sexués ailés, se préparant pour un vol nuptial.

 Fourmilière de fourmis rousses des bois, en forêt de Saint-Amand (nord de la France).
Fourmilière de fourmis rousses des bois, en forêt de Saint-Amand (nord de la France). Détail du dôme d’une fourmilière de fourmis rousses des bois, Saint-Amand (nord de la France).
Détail du dôme d’une fourmilière de fourmis rousses des bois, Saint-Amand (nord de la France). Harpegnathos saltator, combat entre deux ouvrières de colonies différentes.
Harpegnathos saltator, combat entre deux ouvrières de colonies différentes.
 Fourmis tisserandes avec couvain sur une feuille.
Fourmis tisserandes avec couvain sur une feuille. Portrait d'une fourmi.
Portrait d'une fourmi.
Aspects culturels
La fourmi symbolise souvent l'ardeur au travail (cf. par exemple les fables de La Fontaine). Les fourmis sont parfois utilisées comme un remède contre la paresse (comme au Maroc). Dans certaines régions africaines, les fourmis sont les messagers des dieux. On dit souvent que les morsures de fourmis ont des propriétés curatives. Quelques religions amérindiennes, comme la mythologie Hopi, reconnaissent les fourmis comme des ancêtres. Les morsures de fourmis sont utilisées comme test d’endurance et de courage dans les cérémonies d’initiation de certaines cultures africaines et amérindiennes[108].
Alors que la culture met d'ordinaire en avant la fourmi comme travailleuse, une étude visant à déterminer la charge de travail chez les fourmis Temnothorax rugatulus (en) a révélé qu'en réalité 45 % des fourmis d'une fourmilière sont inactives[109] - [110].
La fourmi est aussi un élément de certaines expressions imagées :
- « Avoir des fourmis dans les jambes » : cette expression fait référence à la sensation de picotement ressentie habituellement dans les jambes du fait d'une baisse de l'afflux sanguin, à cause d'une mauvaise position du corps.
- « Nous ne sommes que des fourmis. » / « Tu n'es qu'une fourmi. » : du fait de sa très petite taille et de son influence quasi nulle (la mort de quelques fourmis est une perte minime pour une fourmilière), la fourmi est considérée comme un animal insignifiant. Cette comparaison est donc utilisée pour insister sur l'insignifiance d'une personne (son influence serait nulle et son éventuelle disparition serait sans conséquence) ; ou sur l'insignifiance d'un groupe ou de l'espèce humaine en général (« nous ne sommes que des fourmis par rapport à la taille de l'univers »).
Arts
Le thème de la fourmi est traité en littérature, dans les arts visuels ou plastiques, et dans les jeux vidéo :
Littérature
- Une fourmi de dix-huit mètres, poésie de Robert Desnos ;
- Boris Vian a écrit un recueil de onze nouvelles intitulé Les Fourmis (1949) ;
- Bernard Werber, romancier français a écrit une trilogie: Les Fourmis (1991); Le Jour des fourmis (1992); La Révolution des fourmis (1996);
- Jean de La Fontaine, la fable La Cigale et la Fourmi ;
- Raymond de Rienzi auteur du roman Les Formiciens (1932) ;
- Dans l’Iliade d'Homère, Achille commande la tribu mythique des Myrmidons, le « peuple-fourmi », du nom de leur roi légendaire Myrmidon, fils de Zeus s’étant métamorphosé en fourmi pour séduire sa mère.
Arts visuels
- Films de science-fiction : Les fourmis géantes, Quand la marabunta gronde (1954), Des monstres attaquent la ville (1954), Phase IV de Saul Bass (1974) ;
- Films de fiction : La Citadelle assiégée, raconte l’assaut de fourmis magnans sur la citadelle des termites ; Le Pays où rêvent les fourmis vertes (en allemand Wo die grünen Ameisen träumen), de Werner Herzog (1984), évoque un conflit entre des tribus aborigènes et une compagnie minière en Australie ;
- Films d’animation : 1001 pattes du studio Pixar, Fourmiz du studio DreamWorks et Lucas, fourmi malgré lui des studios Warner Bros ;
- Téléfilm : Marabunta : l’invasion souterraine.
Jeux vidéo
- Jeux vidéo : Les Fourmis et son extension les Guerres de l’Ouest (Microïds inspiré des livres de Bernard Werber) ainsi que le jeu de gestion SimAnt de Maxis,
Sculpture
- Germaine Richier : La Fourmi, sculpture en bronze patiné foncé, 1953, 96 × 88 × 66 cm, collection particulière[111].
Religions
Il en est fait mention dans la Bible[112], dans le livre des Proverbes où est évoqué la notion de courage :
« Va vers la fourmi, paresseux ;
Considère ses voies, et deviens sage.
Elle n'a ni chef, ni inspecteur, ni maitre ;
Elle prépare en été sa nourriture, elle amasse pendant la moisson de quoi manger. »
— (Proverbes 6:6-8)[113].
« Les fourmis, peuple sans force, préparent en été leur nourriture. »
— (Proverbes 30:25)[114].
Une sourate du Coran, la XXVIIe, est intitulée Les fourmis (ou La fourmi, selon les traductions). Il s'agit d'une parabole qui évoque l'insecte[115] :
« 27.18. Et lorsqu'elles arrivèrent à la vallée des fourmis, l'une de celles-ci s'écria : « Ô fourmis ! Regagnez vos demeures de peur que Salomon et ses armées ne vous écrasent sans s'en apercevoir. »
27.19. Ces paroles firent sourire Salomon qui dit : « Seigneur ! Permets-moi de rendre grâce des bienfaits dont Tu nous as comblés, mon père, ma mère et moi-même. Fais que toutes mes actions Te soient agréables et admets-moi, par un effet de Ta grâce, parmi Tes saints serviteurs. »
Divers
- La fourmi est le symbole du Mouvement de Libération du Congo.
Notes et références
- Zoologica Scripta, 12/08/2008
- À comparer avec les 3 000 espèces de termites et les 1 000 espèces d'abeilles sociales.
- (en) How many ants (Formicidae) are there ?, sur antbase.org
- (en) carte situant les différentes espèces répertoriées, sur antmaps.org
- Anne Freitag, Tanja Schwander, Olivier Broennimann et Aline Dépraz, « Opération fourmis, les résultats du premier recensement participatif des espèces de fourmis vaudoises », Bulletin de la Société vaudoise des Sciences Naturelles, vol. 99, , p. 13-27 (ISSN 0037-9603)
- (en) N. Kusnezov, « Number of species of ants in fauna of different latitudes », Evolution, vol. 11, , p. 298–299
- La myrmécofaune désigne l'ensemble des espèces de fourmis d'un milieu, d'un pays, d'un continent, voire d'un éleveur amateur de fourmis. Source : http://www.futura-sciences.com/planete/definitions/zoologie-myrmecofaune-11479/
- (en) Carlos M. Herrera et Olle Pellmyr, Plant animal interactions. An evolutionary approach, John Wiley & Sons, (lire en ligne), p. 211.
- (en) Edward O. Wilson, « The Arboreal Ant Fauna of Peruvian Amazon Forests : A First Assessment », Biotropica, vol. 19, no 3, , p. 245-251 (DOI 10.2307/2388342)
- Luc Passera, L'organisation sociale des fourmis, Privat, , p. 313
- « Fourmi », dans le Dictionnaire de l'Académie française, sur Centre national de ressources textuelles et lexicales (consulté le 10 mai 2016).
- Informations lexicographiques et étymologiques de « fourmi » (sens A) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales (consulté le 10 mai 2016).
- X. Delamare, Le Vocabulaire indo-européen : lexique étymologique thématique, Libr. d'Amérique et d'Orient, , p. 143.
- (en) B. Hölldobler et E. O. Wilson, The Ants, Harvard University Press.
- Roger Dajoz, Dictionnaire d'entomologie, Lavoisier, , p. 127.
- Luc Passera et Serge Aron, Les fourmis : comportement, organisation sociale et évolution, NRC Research Press, (lire en ligne), p. 7-12.
- Luc Passera, Serge Aron, op. cit., p. 13
- http://osuc.biosci.ohio-state.edu/hymenoptera/tsa.sppcount?the_taxon=Formicidae
- Laurent Keller & Elisabeth Gordon, Le Monde des Fourmis, Odile Jacob, 2006, 303 p.
- Alain Lenoir, professeur à l’Institut de recherche sur la biologie de l'insecte, « L’incroyable instinct des fourmis », émission C'est pas du vent sur RFI, 11 février 2012
- (en) Shattuck SO, Australian ants : their biology and identification, CSIRO, (ISBN 0-643-06659-4), p. 149
- (de) Herbert Lutz, « Systematische und palökologische Untersuchungen an Insekten aus dem Mittel-Eozän der Grube Messel bei Darmstadt », Cour. Forschungsinst. Senckenb, vol. 124, nos 1-165,
- Cushman JH, Lawton JH & Manly B (1993) Latitudinal patterns in European ant assemblages : variation in species richness and body size. Oecologia 95:30-37
- Document pour l’élevage et l’observation des fourmis
- (en) KG Rossa et coll., « Alternative genetic foundations for a key social polymorphism in fire ants », Genetics, vol. 165 (4), , p. 1853–1867 (lire en ligne)
- (en) ND Tsutsui et coll, « The evolution of genome size in ants », BMC Evolutionary Biology, vol. 8, no 64, (lire en ligne)
- (en) Danny Reinberg et coll, « Scientists Are First to Sequence the Genome of Two Ant Species », NYU Langone Medical Center, (lire en ligne)
- Les fourmis: comportement, organisation sociale et évolution. Par Luc Passera, Serge Aron. NRC Research Press, 2005. (ISBN 0-660-97021-X et 978-0-660-97021-9), 480 pages. en ligne
- Luc Passera, interrogé par Noëlle Bréham, « L'émission Les P'tits Bateaux du 13 juin 2010 », sur France Inter (consulté le ) (cinquième et dernière question, de 19 min 08 s à 23 min 29 s)
- Eric Darrouzet et Bruno Corbara, Les insectes sociaux, Quae, (ISBN 978-2-7592-2429-6), p. 30.
- (en) Higashi, S. et K. Yamauchi, « Influence of a Supercolonial Ant Formica (Formica) yessensis Forel on the Distribution of Other Ants in Ishikari Coast », Japanese Journal of Ecology, vol. 29, , p. 257-264.
- Claude Lebas, Rumsaïs. Blatrix et Philippe Wegnez, Fourmis d'Europe occidentale, Delachaux & Niestlé, (ISBN 2-603-02430-2)
- (en) Snir, O., Alwaseem, H., Heissel, S. et al., « The pupal moulting fluid has evolved social functions in ants », Nature, (DOI 10.1038/s41586-022-05480-9, lire en ligne)

- Neil Campbell et Jane Reece (trad. René lachaîne et Michel Bosset), Biologie, Pearson education, (ISBN 978-2-7440-7223-9)
- Interview de Christian Peeters.
- (en) J. Heinze, B. Hölldobler et C. Peeters, « Conflict and cooperation in ant societies », Naturwissenschaften, vol. 81, no 11, , p. 489–497 (ISSN 0028-1042 et 1432-1904, DOI 10.1007/BF01132680, lire en ligne, consulté le )
- F. Ravary et P. Jaisson, « The reproductive cycle of thelytokous colonies of Cerapachys biroi Forel (Formicidae, Cerapachyinae) », Insectes Sociaux, vol. 49, no 2, , p. 114–119 (ISSN 0020-1812 et 1420-9098, DOI 10.1007/s00040-002-8288-9, lire en ligne, consulté le )
- (en) Nathan J. Mlot, Craig A. Tovey et David L. Hu, « Fire ants self-assemble into waterproof rafts to survive floods », Proceedings of the National Academy of Sciences, vol. 108, , p. 7669-7673 (ISSN 0027-8424 et 1091-6490, PMID 21518911, PMCID 3093451, DOI 10.1073/pnas.1016658108, lire en ligne, consulté le )
- Myrmecofourmis.fr, « Raid de Polyergus rufescens, fourmis amazone esclavagistes », sur www.myrmecofourmis.fr (consulté le )
- P. D'Ettorre et J. Heinze, « Sociobiology of slave-making ants », Acta ethologica, vol. 3, no 2, , p. 67–82 (ISSN 0873-9749 et 1437-9546, DOI 10.1007/s102110100038, lire en ligne, consulté le )
- (en) Tomasz Włodarczyk et Lech Szczepaniak, « Facultative slave-making ants Formica sanguinea label their slaves with own recognition cues instead of employing the strategy of chemical mimicry », Journal of Insect Physiology, vol. 96, , p. 98–107 (DOI 10.1016/j.jinsphys.2016.10.016, lire en ligne, consulté le )
- La véritable histoire des fourmis, Pr Luc Passera
- (en) Alfred BUSCHINGER, « Social parasitism among ants: a review (Hymenoptera: Formicidae) », Myrmecological News, vol. 12, , p. 219-235 (lire en ligne)
- (en) Alfred Buschinger, « Evolution of social parasitism in ants », Trends in Ecology & Evolution, vol. 1, no 6, , p. 155–160 (DOI 10.1016/0169-5347(86)90044-3, lire en ligne, consulté le )
- Serge Aron, « Les fourmis : un modèle extraordinaire », conférence à la Cité des sciences et de l'industrie, 1er décembre 2011
- (en) W. M. Wheeler, « The ant-colony as an organism », Journal of Morphology, , p. 307-326 (DOI 10.1002/jmor.1050220206).
- (en) W. D. Hamilton, « The genetical evolution of social behaviour », Journal of Theorical Biology, no 7, , p. 1-52 (lire en ligne).
- (en) P. Jaisson, « Social behaviour », in G.A. Kerkut & L.l. Gilbert (Eds.), Comprehensive insect physiology, biochemistry and pharmacology, 1985, p. 673-694.
- Michel Lamy, Les insectes et les hommes, Albin Michel, (lire en ligne), p. 193.
- (en) R. E. Page & S. D. Mitchell, « The superorganism : new perspective or tired metaphor ? », Trends in Ecology and Evolution, vol. 8, no 7, , p. 265-266.
- Luc Passera et Serge Aron, Les fourmis : comportement, organisation sociale et évolution, NRC Research Press, , p. 181.
- Luc Passera, L'organisation sociale des fourmis, Privat, , p. 184.
- (de) M.F.H. Osman, J. Brander, « Weitere Beiträge zur Kenntnis der chemischen Zusammensetzung des Giftes von Ameisen aus der Gattung Formica », Zeitschrift für Naturforschung, vol. 16b, , p. 749–753 (lire en ligne).
- T. H. Jones, D. A. Clark, A. A. Edwards, D. W. Davidson, T. F. Spande, R. R. Snelling, The chemistry of exploding ants, Camponotus SPP. (cylindricus complex), Journal of chemical ecology, 2004, vol. 30(8), p. 1479-1492. DOI 10.1023/B:JOEC.0000042063.01424.28.
- La fourmi kamikaze sur Agence Science-Presse.
- Sur archipress.org.
- (en) C R Carroll et D H Janzen, « Ecology of Foraging by Ants », Annual Review of Ecology and Systematics, vol. 4, no 1, , p. 231-257 (DOI 10.1146/annurev.es.04.110173.001311)
- S. Sommer et R. Wehner, « The ant?s estimation of distance travelled: experiments with desert ants, Cataglyphis fortis », Journal of Comparative Physiology A: Sensory, Neural, and Behavioral Physiology, vol. 190, no 1, , p. 1-6 (DOI 10.1007/s00359-003-0465-4)
- (en) M. Wittlinger, « The Ant Odometer: Stepping on Stilts and Stumps », Science, vol. 312, no 5782, , p. 1965-1967 (DOI 10.1126/science.1126912)
- (en) Alexander N. Banks et Robert B. Srygley, « Orientation by magnetic field in leaf-cutter ants, Atta colombica (Hymenoptera: Formicidae) », Ethology, vol. 109, no 10, , p. 835-846 (DOI 10.1046/j.0179-1613.2003.00927.x)
- (en) Åkesson S, Wehner R, « Visual navigation in desert ants Cataglyphis fortis : are snapshots coupled to a celestial system of reference? », Journal of Experimental Biology, vol. 205, no 14, , p. 1971–1978 (lire en ligne)
- Antoine Wystrach, « Résumé en français : Wystrach, Antoine. Visual navigation in ants », (consulté le ). Thèse : (en) Antoine Wystrach, « Visual navigation in ants » [PDF], sur Université Paul-Sabatier, (consulté le ))
- Entretien de David Christoffel avec Antoine Wystrach sur Radio Thésards : http://plus.franceculture.fr/factory/radio-thesards/les-fourmis
- Atlas du nouveau monde, de Alastair Bonnett, p. 102.
- Voyage chez les fourmis, de Bert Hölldobler et Edward O. Wilson, p. 12.
- E.O Wilson, Success and Dominance in Ecosystems : The Case of the Social Insects (1990), Ecology Institute, Oldendorf.
- T. R. Schultz, « In search of ant ancestors », Proceedings of the National Academy of Sciences, vol. 97, no 26, , p. 14028-14029 (DOI 10.1073/pnas.011513798)
- (en) « Antbase », sur Antbase (consulté le ).
- Laurent Keller & Elisabeth Gordon, Le Monde des Fourmis, Odile Jacob, 2006, p. 19
- (en) Horace Groskin, « Additional Observations and Comments on "Anting" by Birds », The Auk, vol. 67, no 2, , p. 201–209 (DOI 10.2307/4081213, lire en ligne).
- (en) The World of Birds, Globe Pequot Press, , p. 27
- Guides complet des papillons de jour de Lorraine et d'Alsace. Éditions Serpenoise, 2012
- Yek, Sze Huei, & Ulrich G. Mueller. 2011. The metapleural gland of ants. Biological Reviews 86:774-791.
- Jacquet P., « Fourmis & orchidées », L'Orchidophile , revue de la Fédération France orchidées, no 53, , p. 145
- (en) Truman P. Young, Maureen L. Stanton, Caroline E. Christian (2003) Effects of natural and simulated herbivory on spine lengths of Acacia drepanolobium in Kenya. Oikos April 2003, 101 (1), 171–179. DOI 10.1034/j.1600-0706.2003.12067.x
- (en) Stapley L (1999) Physical worker castes in colonies of an acacia-ant (Crematogaster nigriceps) correlated with an intra-colonial division of defensive behaviour. Insectes sociaux 1999, vol. 46, no 2, p. 146-149.
- V. Rico-Gray et P. Oliveira, The ecology and evolution of ant-plant interactions, The University of Chicago Press, Chicago and London, 2007
- WA Haber et coll, Ants like flower nectar, Biotropica no 13, 1981, p. 211-214
- AJ Beattie et coll, The vulnerability of pollen and fungal spores to ant secretions: evidence and some evolutionary implications, American Journal of Botany no 72, 1985, p. 606-614
- DW Yu et NE Pierce, A castration parasite of ant-plant mutualism. Proceedings of the Royal Society Biological Research Journal, no 265, 1998, p. 375-382.
- AJ Beattie et L. Hughes, Ant-plant interactions, Plantanimal interactions, 2002, p. 211-235
- M. Heil et D. McKey D, Protective ant-plant interactions as model systems in ecological and evolutionary research, Annual Review of Ecology, Evolution, and Systematics, no 34, 2003, p. 425-453
- Laurent Keller et Élisabeth Gordon, La vie des fourmis, Odile Jacob, , p. 263
- Rémy Chauvin, « Les sociétés les plus complexes chez les insectes », Communications, vol. 22, no 1, , p. 63–71 (DOI 10.3406/comm.1974.1338, lire en ligne, consulté le )
- (en) Roberto A. Keller, « A Phylogenetic Analysis of Ant Morphology (Hymenoptera: Formicidae) with Special Reference to the Poneromorph Subfamilies », Bulletin of the American Museum of Natural History, vol. 355, , p. 1–90 (ISSN 0003-0090, DOI 10.1206/355.1, lire en ligne, consulté le )
- (en) Ted R. Schultz, « In search of ant ancestors », Proc. Natl. Acad. Sci. USA, vol. 97, no 26, , p. 14928–14029 (résumé).
- (en) Sean G. Brady, Ted R. Schultz, Brian L. Fisher & Philip S. Ward, « Evaluating alternative hypotheses for the early evolution and diversification of ants », Proc. Natl. Acad. Sci. USA, vol. 103, no 48, , p. 18172-18177 (DOI 10.1073/pnas.0605858103).
- (en) Nel A, Perrault G, Perrichot V & Neraudeau D. 2004. The oldest ant in the Lower Cretaceous amber of Charente-Maritime (SW France) (Insecta : Hymenoptera : Formicidae). Geologica Acta, 2(1) : 23-29.
- Laurent Keller et Élisabeth Gordon, La vie des fourmis, Odile Jacob, (lire en ligne), p. 40.
- (en) David Grimaldi, Donat Agosti, « A formicine in New Jersey cretaceous amber (Hymenoptera: formicidae) and early evolution of the ants », Proc. Natl. Acad. Sci. USA, vol. 97, no 25, , p. 13678–13683 (DOI 10.1073/pnas.240452097).
- Luc Passera et Serge Aron, Les Fourmis : comportement, organisation sociale et évolution, Presses Scientifiques du CNRC, , p. 7.
- (en) Conrad C. Labandeira, Kirk R. Johnson & Peter Wilf, « Impact of the terminal Cretaceous event on plant–insect associations », PNAS, vol. 99, no 4, , p. 2061-2066 (doi=10.1073/pnas.042492999).
- (en) Brothers, D. J. 1999. Phylogeny and evolution of wasps, ants and bees (Hymenoptera, Chrysisoidea, Vespoidea, and Apoidea). Zoologica Scripta 28: 233–249.
- (en) Michael G. Branstetter, Bryan N. Danforth, James P. Pitts et Brant C. Faircloth, « Phylogenomic Insights into the Evolution of Stinging Wasps and the Origins of Ants and Bees », Current Biology, vol. 27, no 7, , p. 1019–1025 (DOI 10.1016/j.cub.2017.03.027, lire en ligne, consulté le )
- « How Insulin Helped Create Ant Societies | Quanta Magazine », Quanta Magazine, (lire en ligne, consulté le ).
- (en) Vikram Chandra, Ingrid Fetter-Pruneda, Peter R. Oxley et Amelia L. Ritger, « Social regulation of insulin signaling and the evolution of eusociality in ants », Science, vol. 361, no 6400, , p. 398–402 (ISSN 0036-8075 et 1095-9203, PMID 30049879, DOI 10.1126/science.aar5723, lire en ligne, consulté le ).
- (en) « Des Fourmis Tueuses », sur Dailymotion.com — reportage de Planète
- (en) Giraud, Tatiana, Jes S. Pedersen, et Laurent Kelle, « Evolution of supercolonies: The Argentine ants of southern Europe », National Academy of Sciences, vol. 99, no 9, (résumé).
- Grégoire Macqueron, « Les supercolonies de fourmis s'installent en ville », FuturaSciences, (consulté le )
- Topsante.com, « Insolite : les œufs de fourmis, nouvelle astuce contre les poils ? », Topsante.com, (lire en ligne, consulté le )
- « L'épilation définitive à la crème aux oeufs de fourmi : une arnaque ? », consoGlobe, (lire en ligne, consulté le )
- Myrmecofourmis.fr, « Comment chasser les fourmis de la maison », sur www.myrmecofourmis.fr (consulté le )
- (en) John Lubbock, « Observations on Ants, Bees, and Wasps.-Part IX. », Journal of the Linnean Society of London, Zoology, vol. 16, no 90, , p. 110-121 (DOI 10.1111/j.1096-3642.1882.tb02275.x)
- Luc Passera et Serge Aron, « Asymétries de parenté et conflits d’intérêt génétique chez les fourmis », M/S : médecine sciences, vol. 19, no 4, , p. 453-458
- (en) Bernhard Stadler et Tony Dixon, Mutualism : Ants and their insect partners, Cambridge University Press, , 248 p. (ISBN 978-0-521-86035-2)
- Daniel P. Wojcik, Richard J. Burges, Chantal M. Blanton et Dana A. Focks, « An Improved and Quantified Technique for Marking Individual Fire Ants (Hymenoptera: Formicidae) », The Florida Entomologist, vol. 83, no 1, , p. 74 (DOI 10.2307/3496231)
- (en) Valérie Vogel, Jes S. Pedersen, Patrizia D'Ettorre, Laurent Lehmann et Laurent Keller, « DYNAMICS AND GENETIC STRUCTURE OF ARGENTINE ANT SUPERCOLONIES IN THEIR NATIVE RANGE », Evolution, vol. 63, no 6, , p. 1627–1639 (DOI 10.1111/j.1558-5646.2009.00628.x, lire en ligne, consulté le )
- Voir en particulier le roman L’enfant noir de Camara Laye.
- « Les fourmis seraient en fait très flemmardes », sur www.europe1.fr (consulté le )
- « Les fourmis, ces grosses fainéantes ? », sur Le Point, https://plus.google.com/+LePointfr (consulté le )
- Jean-Louis Prat, Germaine Richier, rétrospective, Saint-Paul-de-Vence, Fondation Maeght, , 240 p. (ISBN 978-2-900923-13-9), p. 108
- Traduction Louis Segond (1910).
- Proverbes. 6:6-8, lire sur Wikisource: . Consulté le .
- Proverbes. 30:25, lire sur Wikisource: . Consulté le .
- Sourate XXVII du Coran, versets 18 et 19 , lire sur Wikisource, traduction de A. Kazimirski de Biberstein (1869): . Consulté le .
Voir aussi
Fourmis notables
- Atta est un genre de fourmis coupeuses de feuilles.
- Linepithema humile, la fourmi d'Argentine, est invasive en Europe, où elle a formé une supercolonie allant du Portugal à l’Italie.
- Wasmannia auropunctata, la petite fourmi de feu, et Solenopsis invicta, la fourmi de feu, sont deux espèces originaires d'Amérique du Sud, considérées comme invasives sur d'autres continents qu'elles ont su coloniser.
- Les fourmis pots-de-miel ont la particularité de présenter une caste d'ouvrières spécialisée qui stockent des réserves de nourriture dans leur abdomen et servent de citernes, auprès desquelles les autres fourmis de la colonie peuvent venir se sustenter.
- Paraponera est appelée fourmi balle-de-fusil en raison de sa piqure extrêmement douloureuse.
- Eciton est un genre de fourmis légionnaires. Elles forment d’immenses colonies nomades de 150 000 à 700 000 individus.
- Les fourmis Magnan, fourmis légionnaires du genre Dorylus, sont originaires d’Afrique centrale et orientale.
- Formica rufa, l’une des espèces de fourmis rousses présentes en Europe, forme des dômes typiques formés d'aiguilles de conifères.
- Lasius niger, la fourmi noire des jardins, est une espèce cosmopolite présente en Europe et en Inde.
- Cephalotes texanus occupe des galeries d’insectes xylophages. Certaines ouvrières spécialisées bloquent les entrées des galeries grâce à leur tête aplatie en forme de bouclier.
Autres
- Edward Osborne Wilson, entomologiste et sociobiologiste, célèbre pour son travail sur les fourmis
- L'Eusocialité est le mode d'organisation sociale de certains animaux vivant en groupe et présentant des castes d'individus reproducteurs et non reproducteurs. C'est notamment le cas des fourmis, des abeilles ou encore des termites.
- La myrmécologie est l’étude des fourmis.
- La myrmécophilie est l'aptitude de certaines espèces à vivre en association symbiotique avec les fourmis (autres animaux, plantes, champignons).
- Les animaux myrmécophages se nourrissent essentiellement de fourmis.
- La trophallaxie est un mode de transfert de nourriture utilisé par certains insectes hyménoptères.
- Le myrmécomorphisme désigne le phénomène par lequel un animal présente des caractères imitant les fourmis.
- Élevage des fourmis
- Les algorithmes de colonies de fourmis sont des métaheuristiques inspirées par le comportement des fourmis réelles.
- Algorithmes à estimation de distribution
- Insectes sociaux
- Intelligence collective
- Fourmi de Langton, automate cellulaire au comportement imprévisible.
- Les supercolonies sont des colonies de fourmis formées de multiples reines et de nids couvrant un immense territoire.
Références externes
- (en) Référence Fauna Europaea : Formicidae (consulté le )
- (en) Référence Animal Diversity Web : Formicidae
- (fr+en) Référence ITIS : Formicidae
- (en) Référence NCBI : Formicidae (taxons inclus)
Liens externes
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (en) Animal Diversity Web
- (en) Australian Faunal Directory
- (en) BugGuide
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) NBN Atlas
- (nl) Nederlands Soortenregister
- (en + en) New Zealand Organisms Register
- (en) Plazi
- (en) Système d'information taxonomique intégré
- (en) World Register of Marine Species
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- "Fourmis : une pour toutes et toutes pour unes", La Méthode scientifique, France Inter, 16 septembre 2019
- (en) AntBase.org, base de données (environ 12 000 espèces)
- myrmecos.net, base de données photographiques sur les espèces de formicidae.
- AntArea, étude des fourmis françaises métropolitaines (identification, systématique, clef de détermination, répartition et localisation des espèces).
- (en) projects.biodiversity.be/ants/, the objective of this website is to provide rapidly information about the numerous morphospecies (unnamed species diagnosed by standard taxonomic procedures) collected and to provide detailed data about the ant distribution and morphology.
- Camponotus ligniperdus, décrit l’espèce de fourmi Camponotus ligniperdus.
- Réactualisation de la liste des fourmis de France, réactualisation de la liste des fourmis de France avec une bibliographie très complète par Janine Casevitz-Weulersse et Christophe Galkowski.
- Liste actualisée des espèces de fourmis du Québec par André Francœur de l'Université du Québec à Chicoutimi
- Les fourmis nuisibles du Québec
- la Section myrmécofaune du site Entomofaune du Québec
- (en) Antmaps.org, cartographie d'espèces par région
Bibliographie
- Heikko Bellmann, Guide des abeilles, bourdons, guêpes et fourmis d’Europe, Lausanne, Delachaux et Niestlé, 1999, coll. "Les compagnons du naturaliste" : 336 p.
- Daniel Cherix, Les Fourmis des bois, Lausanne, Payot, 1986, coll. "Atlas visuels", série "Comment vivent-ils ?" : n.f.
- Franck Courchamp, La guerre des fourmis, Des Équateurs Ed., 2019 : 104 p.
- Maurice Maeterlinck, La Vie des fourmis, 1932.
- Bert Hölldobler et Edward O. Wilson, Voyage chez les fourmis, Paris, Le Seuil, 1994, coll. "Science ouverte" : 247 p.
- Julian Huxley, Les Voies de l’instinct : fourmis et termites, Neuchâtel, La Baconnière, 1955, coll. "Observation et synthèse" : 104 p.
- Pierre Jaisson, La Fourmi et le Sociobiologiste, Paris, Odile Jacob, 1993, (ISBN 978-2-7381-0207-2).
- Pierre Jolivet, Les Fourmis et les plantes. Un exemple de coévolution, 1986, Paris, Boudée : 254 p.
- Pierre-André Latreille, Histoire des fourmis de la France, Paris, Cité des Sciences et de l’Industrie, 1989 : 64 p.
- Maurice Maeterlinck, La Vie des fourmis, 1932.
- Thibaud Monnin, Xavier Espalader, Alain Lenoir et Christian Peeters, Guide des Fourmis de France, Humensis, , 192 p. (lire en ligne)
- Luc Passera, L’Organisation sociale des fourmis, Toulouse, Privat, 1987, coll. "Bios" : 280 p.
- Luc Passera, Formidables fourmis !, Editions Quae, , 160 p. (lire en ligne)
- Luc Passera et Serge Aron, Les Fourmis : comportement, organisation sociale et évolution. Ottawa, Presses Scientifiques du CNRC, 2005 : 480 p. (ISBN 978-0-660-97021-9).
- Luc Passera, La Véritable histoire des fourmis, Paris, Fayard, 2006, coll."Le temps des sciences", (ISBN 2-213-62886-6) 33-60-3086-2/01.
- Luc Passera, Formidables fourmis !, Quae, , 160 p. (lire en ligne)
- Albert Raigner, Vie et Mœurs des fourmis. Lausanne, Payot, 1952, coll. "Bibliothèque scientifique", 11 : 223 p.
- Laurent Keller et Elisabeth Gordon, La Vie des fourmis, Paris, Odile Jacob, 2006, 303 p.
- (en) William Morton Wheeler, Ants : Their Structure, Development and Behavior, Columbia University Press, , 663 p. (lire en ligne).
- Cleo Bertelsmeier, Les guerres secrètes des fourmis - Sexe, meurtres et invasions territoriales, Editions Favre, , 216 p.
- Anne Freitag, Tanja Schwander, Olivier Broennimann et Aline Dépraz, « Opération fourmis, les résultats du premier recensement participatif des espèces de fourmis vaudoises », Bulletin de la Société vaudoise des Sciences Naturelles, vol. 99, , p. 13-27 (ISSN 0037-9603).