Angiosperme
Magnoliidae, Magnoliopsida, Magnoliophyta • Plantes à fleurs

Classes de rang inférieur
- Liliopsida - monocotylédones
- Magnoliopsida - dicotylédones
Classification selon l'ITIS
| Règne | Plantae |
|---|---|
| Sous-règne | Viridiplantae |
| Infra-règne | Streptophyta |
| Super-division | Embryophyta |
| Division | Tracheophyta |
| Sous-division | Spermatophytina |
Classification selon Tropicos
| Classe | Equisetopsida |
|---|
Ordres de rang inférieur
Les Angiospermes sont des plantes vasculaires du groupe des Spermatophytes (les plantes à graines). Ces végétaux, qui portent des fleurs puis des fruits, sont couramment appelés « plantes à fleurs ». « Angiosperme » vient des mots grecs ἀγγεῖον, aggeîon (« vase », « réceptacle »), et σπέρμα, spérma (« graine »), et signifie « graine dans un récipient » — par opposition aux gymnospermes (« graine nue »). Elles représentent la plus grande partie des espèces végétales terrestres (90 % à 96 % de la biodiversité végétale en dehors des océans), avec près de 319 000 espèces répertoriées en 2015[1], sachant que près de 2 000 nouvelles espèces sont découvertes chaque année[2]. Les Angiospermes comprennent les Dicotylédones et les Monocotylédones.
D'un point de vue systématique, les Angiospermes forment un taxon considéré comme monophylétique qui a reçu plusieurs noms scientifiques et rangs taxinomiques : selon les classifications, les plantes à fleurs sont la division des Magnoliophyta (Magnoliophytes), la classe des Magnoliopsida (en français Magnoliopsides, mais nom se rapportant plus souvent aux Dicotylédones), ou la sous-classe des Magnoliidae (Magnoliidées), le nom Angiospermae (Angiospermes) pouvant prendre de nombreux rangs différents. Les plus proches parents des Angiospermes sont les Gnétophytes, les Cycadophytes, les Ginkgophytes et les Coniférophytes, c'est-à-dire principalement les conifères.
Les principales familles sont, en nombre décroissant d'espèces, les Asteracées (ou Composées) qui représentent un peu plus de 10 % des plantes à fleurs, les Orchidacées (ou Orchidées) près de 9 %, les Fabacées (ou Légumineuses) un peu plus de 6 %, les Rubiacées un peu plus de 4 %, les Poacées (ou Graminées) 3,5 %, les Lamiacées (ou Labiées) près de 2,5 % et les Euphorbiacées 2 %[3].
Les Angiospermes diffèrent des autres plantes à graines par la présence des caractères suivants :
- la condensation des organes reproducteurs en une fleur ;
- la présence d'un ovaire enveloppant les ovules, et qui se développera pour donner un fruit ;
- la double fécondation de l'ovule, qui donnera l'embryon et son tissu nourricier, l'albumen.
La fleur et le fruit, qui sont propres à ce groupe, entraînent, pour de nombreuses espèces, une interaction avec les animaux dans la reproduction (pollinisation par les insectes, zoochorie…).
Les Angiospermes dominent les paysages naturels terrestres tropicaux et tempérés, comme la savane ou la forêt. Elles laissent la place aux résineux (Pinophytes) et aux lichens dans les biotopes les plus froids. Elles sont aussi présentes dans les milieux aquatiques (Zostère…).
Étymologie
Le terme angiosperme est composé du grec ancien ἀγγεῖον / angeîon, « récipient », et σπέρμα / spérma, « graine », soit littéralement « graine dans un récipient ».
Apparition et histoire évolutive

L'avènement des Angiospermes est un saut évolutif en ce sens qu'elles enferment leurs ovules (puis leurs graines) dans un ovaire, ce qui les protège, à l'inverse de leur groupe frère, les Gymnospermes (du grec sperma « graines » et gymno « nu ») qui ont des cônes femelles sur lesquels se développent les ovules nus à l'aisselle d'écailles ovulifères. C'est sans doute Théophraste qui, le premier, distingue les Angiospermes des Gymnospermes dans son atlas de botanique Historia plantarum. À la fin du XVIIe siècle, John Ray utilise cette différence dans sa classification, qui est la première tentative de classification naturelle de l'époque moderne, basée chez les Angiospermes sur le nombre des cotylédons de la graine. C'est de lui que date la distinction entre Monocotylédones et Dicotylédones[4].
L'origine des Angiospermes était pour Darwin un « abominable mystère »[5]. Certains servent cette formule « un peu à toutes les sauces, dénaturant quelque peu la pensée de Darwin ; d'autres prétendent même l'avoir résolu, alors qu'il reste encore tant à comprendre »[6]. Bien que les plantes aient colonisé la terre ferme il y a plus de 400 Ma (millions d'années), l'âge d'apparition des plantes à fleurs n'était pas connu.
Jusqu'au début des années 2000, les plus anciens fossiles connus dataient d'un peu plus de 100 Ma. En 2012, un fossile de Montsechia vidalii trouvé dans le sud de l'Italie 58 ans après la découverte en Espagne de cette espèce — qui n'est sans doute pas la toute première plante à fleurs —, a été daté à 130 Ma environ[7] ; il montre qu'une plante à fleurs aquatique lacustre[8] vivait en eau douce, d'une forme proche de l'actuel Ceratophyllum, mais avec des tiges principales nettement plus épaisses[9] - [10] - [11]. Selon Gomez & al en 2015, cette espèce était caractéristique de milieux lacustres peu profonds, alcalins, oligotrophes et temporaires.
Le fossile le plus ancien de plante à fleurs éclose est Archaefructus liaoningensis, découvert en Chine et daté de -125 Ma (Crétacé). Une étude de 2013 a par ailleurs daté six différents grains de pollen de 240 Ma[12] - [13]. Une étude moléculaire publiée en 2007 montre par ailleurs que 5 grands groupes des Angiospermes seraient déjà apparus il y a 140 Ma[14]. Un fossile découvert en Chine, Nanjinganthus dendrostyla, pourrait reculer l'âge des angiospermes à 174 Ma (Jurassique inférieur), s'il appartient bien à ce groupe[15] - [16].
La plante à fleurs actuelle située le plus à la base de l'arbre phylogénétique des plantes à fleurs est Amborella trichopoda. Elle forme le clade frère de toutes les autres angiospermes dont l'apparition daterait d'environ 135 Ma[17].
En 2019, un petit insecte coléoptère, Angimordella burmitina a été décrit dans de l'ambre birman. Il est daté du tout début du Crétacé supérieur (Cénomanien), il y a environ 99 millions d'années[18] - [19]. Il porte sur ses poils une soixantaine de grains de pollens tricolpés caractéristiques des dicotylédones vraies. Il s'agit de la première preuve directe d'une pollinisation de plante à fleurs par un insecte[19].
Un modèle numérique de climat suggère que les changements climatiques induits par la dislocation du supercontinent Pangée il y a 175 Ma auraient joué un rôle important dans l'émergence et la diversification des plantes à fleurs. La fragmentation de la Pangée en continents et sous-continents ouvre en effet des océans et des mers favorisant des courants océaniques qui auraient induit une augmentation graduelle des précipitations et l'expansion progressive des zones climatiques tempérés humides, tandis que les grandes ceintures désertiques des moyennes latitudes du Jurassique se seraient fractionnées au Crétacé. Ces changements climatiques auraient ainsi favorisé la radiation des Angiospermes des basses vers les hautes latitudes[20].
Une étude de 2017 a permis de modéliser le génome du dernier ancêtre commun des plantes à fleurs et de la dater de 214 Ma[21]. Cet ancêtre aurait 15 chromosomes porteurs de plus de 22 000 gènes.
Une étude en 2018 suggère que le succès évolutif des Angiospermes s'explique en grande partie, non par leur fleurs, mais par leurs feuilles. Il existe un large consensus scientifique sur le fait que la grande diversification des fleurs s'explique en grande partie par les innovations qui portent sur différents points de leur reproduction sexuée (fleur, modalités de pollinisation, graine et fruit) et par les coévolutions plantes-insectes et plantes-herbivores. L'origine de leur grand succès par rapport aux Ptéridophytes et aux Gymnospermes, qui dominaient la biosphère végétale au Crétacé, reste l'objet de nombreuses hypothèses. Au début du Crétacé moyen, alors que le climat se réchauffe et que le niveau marin s'élève, les Angiospermes occupent pour la première fois les sous-bois des plaines d'inondation, en compétition avec les fougères et les conifères. Elles conquièrent de nouveaux habitats en bénéficiant d'innovations : des feuilles plus petites, une grande densité de stomates et de nervures favorisant un taux de transpiration et de photosynthèse plus importants, et donc une croissance initiale accrue des plantules. Elles auraient acquis ces avantages grâce à leur génome plus petit que celui des Gymnospermes, associé à un noyau et à une cellule végétale également plus petites, assurant un « pavage » plus dense de leurs feuilles[22].
Les angiospermes forment donc un groupe « jeune » et qui s'est rapidement diversifié dans un environnement déjà riche, en subissant une pression de sélection de la part de nombreux autres groupes (en particulier des animaux, comme les insectes). Ceci permet de comprendre l'étonnante adéquation ou symbiose qui existe aujourd'hui entre de nombreux Angiospermes et certains animaux (voir le concept de coévolution).
Tendances évolutives
Les grandes tendances évolutives chez les Angiospermes concernent son appareil végétatif et reproducteur. L'appareil végétatif est caractérisé par la lignification à la sortie des eaux, donnant les premières angiospermes (petits arbres peu ramifiés, à feuilles persistantes) qui deviennent des plantes herbacées par la suite. La contraction des axes floraux donnent des inflorescences plus compactes. L'appareil reproducteur se caractérise par la cyclisation des pièces florales et la diminution de leur nombre, la diminution du nombre de pièces par verticille, la protection accrue des sporophylles[23] et l'adaptation à une pollinisation par divers animaux[24].
La reproduction des Angiospermes
Les Angiospermes présentent le système reproductif le plus évolué des végétaux. Ce sont d'ailleurs les organes reproducteurs (fleurs et fruits) qui sont les caractéristiques les plus visibles du groupe.
L'organisation des pièces florales
Les termes fleur et plante sont souvent confondus par les non-botanistes. Or, il doit être noté que les fleurs ne constituent que la partie reproductive de certaines plantes — les plantes à fleur. La fleur est constituée de plusieurs pièces, dont les étamines (constituant la partie mâle), et le pistil (constituant la partie femelle). Une fleur hermaphrodite est une fleur possédant à la fois étamines et pistil.
La répartition des sexes chez les plantes à fleurs
Les Angiospermes sont à reproduction majoritairement sexuée, avec quelques cas de parthénogenèse (pissenlits).
La majorité (70 %) sont hermaphrodites (les individus ont les deux sexes), avec en général des fleurs mixtes (voir Herkogamie). Cependant, chez d'autres espèces, les fleurs mâles et femelles sont séparées sur le même individu (espèces monoïques, telles que le noisetier et le maïs). D'autres combinaisons sont possibles (fleurs hermaphrodites et fleurs mâles sur le même pied par exemple).
Quelques espèces (environ 7 %) sont à sexes séparés sur plantes séparées (les individus sont mâles ou femelles, par exemple le houx, le kiwi, on parle d'espèce dioïque), voire fleur hermaphrodite et fleur femelle sur pieds différents (espèce gynodioïque). Enfin, on note des cycles reproductifs plus curieux, comme le cas du figuier.
Les individus ne sont pas nécessairement autofécondables, c'est-à-dire que la fécondation n'est pas toujours possible sur la même plante (nombreux cultivars de pommiers).
Cycle de vie des Angiospermes
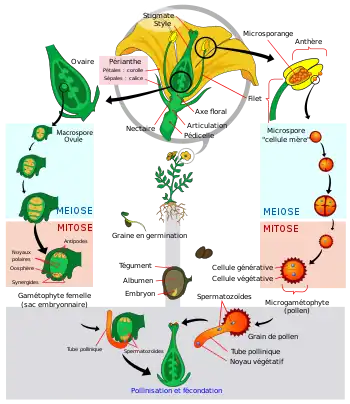
Comme toutes les plantes, les Angiospermes présentent une alternance entre deux états : l'état sporophytique et l'état gamétophytique. Cependant cette alternance fait partie d'un cycle très déséquilibré : la phase gamétophytique est très réduite dans l'espace et dans le temps, ce qui correspond à une meilleure adaptation au milieu de vie non aquatique des Angiospermes. En effet l'exposition au soleil augmentant les risques de mutations, une dominance de la phase sporophytique (au plus grand niveau de ploïdie) évite d'exprimer directement les mutations récessives. De plus le sporophyte (par exemple un arbre) est invariablement plus résistant chez les plantes.
Les gamétophytes mâle et femelle correspondent respectivement au grain de pollen et au sac embryonnaire chez les Angiospermes. On aurait donc tort de penser que le grain de pollen ou que le sac embryonnaire (lui-même contenu dans l'ovule, d'où la confusion) sont des gamètes : c'est en effet complètement faux puisqu'ils contiennent les gamètes ou les futurs gamètes.
Le grain de pollen
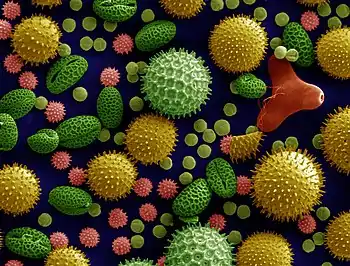
Généré par les anthères, le grain de pollen correspond au gamétophyte mâle. Il renferme deux à trois cellules et est entouré d'une double paroi formée du matériau le plus résistant du monde vivant: la sporopollénine qui le rend fossilisable. Cette paroi est constituée de deux couches non cellulaires: l'intine, interne qui est continue et sécrétée par le gamétophyte et l'exine, externe, qui présente des apertures et qui est sécrétée par le sporophyte. Dans le cas d'un pollen bicellulaire, le grain de pollen contient une cellule végétative (qui germera pour former le tube pollinique) et une cellule génératrice (qui correspond aux futures gamètes mâles, il s'agit d'une cellule n'ayant pas accompli sa deuxième division de méiose). Dans le cas du pollen tricellulaire, la cellule génératrice a déjà accompli sa deuxième division de méiose.
Le sac embryonnaire
Il peut être monosporé ou tétrasporé, c'est-à-dire provenir d'une seule mégaspore du sporophyte ou d'une tétrade de spores issues de la même méiose. C'est un tissu (non pas un gamète) gamétophytique (contenant le gamète femelle). Il peut présenter 7 ou 4 cellules. Dans le cas d'un sac embryonnaire à sept cellules, y sont présentes:
- l'oosphère, c'est-à-dire la cellule fécondable ou le gamète femelle.
- deux synergides, cellules adjuvantes de la fécondation qui forment un tore autour de l'oosphère et qui assumeront le rôle de sas pour faire transiter le gamète mâle. Ces cellules peuvent éventuellement générer un embryon non zygotique dans certains cas de reproduction asexuée.
- Trois antipodes situés à l'autre bout du sac embryonnaire.
- Une cellule centrale à deux noyaux (dits polaires) qui fusionneront avec le deuxième gamète mâle lors de la double fécondation pour éventuellement donner l'albumen.
Le sac embryonnaire renferme donc et protège le gamète femelle dont il favorisera la fécondation. Il est lui-même enfermé dans le nucelle à l'intérieur de l'ovule bitégumenté.
La pollinisation
.JPG.webp)
Du fait de leur immobilité, la pollinisation d'un végétal terrestre par un autre géographiquement éloigné pose une difficulté. Si une possibilité est de s'en remettre au vent (pollinisation anémophile), les Angiospermes présentent la particularité que leur pollen est très souvent transporté par des espèces animales (pollinisation zoophile), principalement des insectes (pollinisation entomogame) mais aussi des chauve-souris et des marsupiaux (pollinisation cheiroptérogame, rencontrée chez le baobab) et des oiseaux (pollinisation ornithogame), qui se trouvent être attirés par la couleur, la forme, l'odeur ou le nectar des fleurs (ce qui permet aux auteurs de dire Dans une fleur, les pétales participent également à la rencontre des gamètes[25]). Et en effet l'organisation des pièces florales et les mécanismes créés par la fleur jouent un rôle très particulier dans la fécondation. Par exemple, un insecte pollinisateur ne va tirer le nectar d'une fleur à symétrie bilatérale que s'il peut l'atteindre d'un certain angle. Ce mécanisme augmente la probabilité pour l'insecte que le pollen soit déposé sur une partie de son corps et qu'il soit distribué au sein d'une même espèce de fleur quand l'animal va butiner de fleur en fleur. Ces particularités de transfert entrainent la diminution du flux de gènes entre populations divergentes et favorise la spéciation des végétaux.
Ceci est le cas de Rafflesia arnoldii, la fleur la plus grosse du monde qui existe seulement en Indonésie. Cette fleur, de la taille d'un pneu de voiture, attire les mouches pollinisatrices par une odeur de putréfaction[26]. C'est pourquoi des phénomènes comme la disparition des abeilles (syndrome d'effondrement des colonies d'abeilles) pourraient avoir des conséquences sur l'évolution de la biodiversité des plantes à fleurs dans les années à venir.
La fécondation
La fécondation se fait par germination du pollen sur le pistil, sans nécessité d'humidité comme dans le cas des fougères (caractère qu'ils partagent avec les autres Spermaphytes).
Chez les Angiospermes la fécondation présente trois caractéristiques essentielles:
- elle est siphonogame : le grain de pollen aperturé possédant deux ou trois cellules voit sa cellule végétative germer et former un tube pollinique qui acheminera, à l'aide de son cytosquelette, le gamète mâle (cas du pollen tricellulaire) ou la cellule génératrice (cas du pollen bicellulaire) qui y effectuera sa seconde division de méiose. En ceci la siphonogamie correspond à un total affranchissement de l'eau pour la fécondation.
- elle est anisogame : le gamète femelle est de loin le plus massif des deux (le grain de pollen étant souvent très déshydraté, les cellules qu'il contient ont un espace cytoplasmique très réduit). Ceci implique que l'embryon possède systématiquement les caractères cytoplasmiques de sa mère. La transmission des gènes chloroplastiques et mitochondriaux (qui jouent un rôle important dans certains cas de résistance aux pesticides comme l'atrazine ou aussi dans des cas de stérilité mâle) n'est pas mendelienne. La mère transmet son cytoplasme en bloc et donc son génome mitochondrial et chloroplastique.
- elle est double : les gamètes mâles acheminés par le grain de pollen vont fusionner leurs noyaux (caryomixie) avec ceux de deux cellules différentes. Une première caryomixie entre gamète mâle et oosphère donnera l'embryon, une autre entre le second gamète mâle et les noyaux centraux de l'ovule conduira à une cellule triploïde qui formera l'albumen de la graine.
Voir aussi : le tube pollinique, le stigmate
La graine
Une fois fécondée, l'oosphère se développera en embryon. L'ovule contenant le sac embryonnaire qui la renfermait va donc former la graine (quant à l'ovaire, il formera le fruit vrai, l'ensemble graine et fruit étant appelé diaspore). On détermine trois catégories principales de graines en fonction de leur lieu de stockage des réserves :
- Les graines albuminées ou graines à albumen. Les deux produits de la double fécondation s'y développent ensemble : le zygote polarisé donne l'embryon et le noyau triploïde (3x) de la cellule centrale se divise très vite au sein de la même cellule (coenocyte), puis a lieu une étape de cloisonnement cellulaire pour former un tissu nourricier : l'albumen. La noix de coco par exemple présente un « lait » qui correspond en fait à la phase coenocytique de son développement. Observé au microscope, le « lait » de coco révèle qu'il est en fait un continuum de cytoplasme : c'est une cellule géante ayant un très grand nombre de noyaux. Une fois cellularisé, ce coenocyte formera le coprah ; Exemples : Magnoliacées, Euphorbiacées (Hévéa, ricin, manioc), Ombellifères, Poacées (ou Graminées).
- Les graines exalbuminées, sans albumen. Les divisions du noyau triploïde central s'interrompent très vite mais l'embryon se développe normalement à partir du zygote. Il stockera ses réserves dans ses cotylédons ; Exemples : Rosacées (pommier), Fabacées (ou Légumineuses), Composées, Juglandées (noyer).
- les graines à périsperme, sans albumen. Les divisions du noyau triploïde central s'interrompent aussi très rapidement. L'embryon ne stocke pas ses réserves lui-même, c'est le nucelle qui assumera cette fonction en devenant le périsperme. Exemples : Musacées (bananier), Nymphéacées, Chénopodiacées (betterave, épinard).
La graine peut être plus ou moins déshydratée. La longévité étant proportionnelle au degré de déshydratation, certaines graines (notamment pour les plantes des régions intertropicales sans saison défavorable) le sont peu (exemple: fève du cacaoyer), d'autres le sont à des niveaux extrêmes (masse d'eau inférieure à 1 % de la masse totale chez Nelumbo, le lotus d'Asie dont la longévité est de l'ordre du millier d'années.)
Le fruit
La formation du fruit résulte de la transformation du pistil après la fécondation, ou parfois sans fécondation (on parle dans ce cas de parthénocarpie). C'est plus précisément la paroi de l'ovaire (partie du pistil qui renferme l'ovule) qui devient la paroi du fruit, appelée péricarpe, entourant les graines. L'épiderme externe de cette paroi devient l'épicarpe, le parenchyme devient le mésocarpe, et l'épiderme interne, l'endocarpe. Selon les transformations de cette paroi, on obtient les différents types de fruits : charnus (baie, drupe), secs déhiscents ou indéhiscents.
Dans certains cas, le fruit peut avoir une origine plus complexe et résulter soit :
- de la transformation d'autres parties de la fleur, notamment le réceptacle floral. On parle dans ce cas de faux-fruit. L'exemple le plus connu de faux-fruit est la pomme ou la fraise.
- soit de la transformation de plusieurs fleurs d'une inflorescence. C'est par exemple le cas du fruit du mûrier, la mûre, l'ananas.
Voir aussi : péricarpe, akène, baie, drupe, fruit parthénocarpique, fruit charnu, fruit sec.
La dispersion des descendants
L'ensemble fruit et graine est appelé diaspore, le fruit est une structure uniquement ovarienne (c'est pourquoi on parle dans de nombreux cas de « faux fruits », la pomme, la fraise en faisant partie) tandis que la graine provient de l'ovule.
La graine et le fruit correspondent à une certaine forme de viviparité. L'embryon des Angiospermes se développe dans un premier temps protégé et alimenté par son parent femelle, puis est libéré, dans un état de vie ralentie (diapause), muni de protections et de réserves alimentaires (le fruit). Certains fruits présentent en plus des caractéristiques permettant la dispersion sur des distances importantes. On peut citer les aigrettes des pissenlits, qui font que le vent transporte les graines sur des dizaines de mètres. Citons aussi la mise à contribution de mammifères pour le transport (par accrochage dans les poils ou, moins important il faut l'admettre dans les chaussettes de campeurs). Un autre mode de dispersion s'observe quand des animaux consomment certains fruits : ils peuvent alors lâcher la graine et ses enveloppes non comestibles loin de son parent (avant ou après transit intestinal, selon). Il est par ailleurs clair qu'un mimétisme et une coévolution peuvent être en cause dans l'adaptation des plantes à fleurs à la faune capable de disperser leur progéniture. On connaît par exemple certaines graines dont la dormance est spécifiquement levée par des enzymes digestives d'animaux spécifiques (par exemple certains acacias africains).
Spécificité des conditions naturelles
Étant fixées et en milieu non aqueux, les Angiospermes ont à faire face à un très grand nombre de pressions sélectives. c'est en particulier pour cette raison qu'elles sont beaucoup plus diversifiées que les Thallophytes (algues) qui, elles, se développent au sein d'un milieu très peu changeant. De fait les Angiospermes représentent le sous-embranchement le plus diversifié des Chlorobiontes (lignée verte). Cette diversification passe nécessairement par une diversité génotypique. Ainsi la descendance d'une angiosperme en conditions sauvages a toujours tendance à ne pas être homogène, et donc à présenter une très large gamme de génotypes différents.
Pour entretenir cette diversité génétique, les plantes ont recours à l'allogamie (régime de reproduction sexuée chez les espèces dont les individus s'interfécondent systématiquement, par opposition à l'autogamie qui a été sélectionnée par l'Homme, nous verrons pour quelles raisons) qui rend incontournable la large diffusion du pollen. Une seule descendance compte ainsi un très grand nombre de génotypes différents qui conduiront à des phénotypes dont certains seront certainement très bien adaptés au milieu (les autres mourront). Les plus adaptés disposant ensuite de la reproduction asexuée pour se multiplier avant d'avoir atteint la maturité sexuelle. On connaît divers modes favorisant l'allogamie (s'opposant à l'autogamie).
- Les systèmes d'(auto)Incompatibilité sporophytiques et gamétophytiques (SIS et SIG). Il s'agit de réactions de rejet de l'autopollen (pollen provenant du soi). On l'a vu, le grain de pollen est composé de deux à trois cellules et est entouré du sporoderme essentiellement composé du matériau le plus résistant chez le Vivant : la sporopollenine. ce sporoderme se compose de deux couches : l'intine et l'exine dont les origines sont très différentes. L'exine (qui présente les apertures) a été synthétisée par le sporophyte, et présente donc certaines molécules (RNAses et glycoprotéines) qui résultent de l'expression d'allèles sporophytiques. Ces protéines sont reconnues lorsque l'autopollen arrive au niveau du stigmate, et elles déclenchent l'autoincompatibilité Sporophytique (par reconnaissance de molécules synthétisées par le sporophyte). Ce rejet se rencontre dans le cas de pollen tricellulaire.
L'autoincompatibilité Gamétophytique repose sur le même principe, mais est basée sur la reconnaissance de substances synthétisées par le gamétophyte mâle (c'est-à-dire le grain de pollen chez les Angiospermes). Ces substances sont contenues dans l'intine et sont reconnues au moment de la germination du pollen qui est alors rejeté. Le SIS se rencontre chez des espèces à pollen bicellulaire. - Les décalages de maturité. Chez certaines espèces les pièces mâles de la fleur sont matures avant les pièces femelles (protandrie) ou après (protogynie, plus rare), ce qui réduit considérablement le nombre d'autofécondations.
- Le dimorphisme floral : les espèces ayant développé ce système présentent deux types d'individus en proportions égales dans leur population. Des individus à fleurs longistylées (style long, stigmate au-dessus des étamines, petits grains de pollen et grosses papilles stigmatiques) et des individus à fleurs brévistylées (style court, étamines au-dessus du stigmate mais gros grains de pollen et petites papilles stigmatiques). Ce dimorphisme empêche l'autofécondation car dans les deux cas l'autopollen ne peut pas pénétrer le stigmate du style, soit parce qu'il est trop gros, soit parce que le style est trop haut.
Les plantes à fleurs de haute altitude[27] (notamment la saussurée cotonneuse (vi) et le lepidostemon de l'Everest (vi), découverts en 1937 par l'explorateur Eric Shipton, qui atteignent 6 400 m d'altitude ; la sabline à feuilles de mousses, la saxifrage de l'Everest (vi) et l'androsace du Khumbu collectées en 1952 par le botaniste Albert Zimmerman à une altitude de 6 350 m) sont de plus en plus étudiées pour analyser leur mécanisme de résistance au gel[28].
La multiplication asexuée
Les Angiospermes disposent d'un très grand nombre de possibilités de multiplication asexuée (mode de reproduction uniparental mais pas nécessairement clonal). On a déjà cité les diverses parthénogenèses, mais existent aussi des procédés plus connus liés à la fragmentation du thalle (certaines graminées non sélectionnées par l'Homme ayant besoin d'être modérément piétinées pour mieux se répandre par multiplication asexuée clonale dans le milieu). Ces procédés sont liés à la totipotence des cellules végétales non apoptotiques (c'est-à-dire les cellules dont la mort n'est pas « programmée », soit la quasi-totalité des cellules végétales, celles constituant les divers systèmes circulatoires étant apoptotiques ou semi-apoptotiques). On pourra citer l'exploitation de cette potentialité par l'Homme, notamment les techniques de bouturage, de marcottage forcé ou simplement la fragmentation des rhizomes ou des tubercules. Les Angiospermes utilisent des extensions racinaires ou caulinaires comme les stolons et les drageons, notamment chez Populus, un peuplier pouvant ne résulter que d'un drageon, un bois entier peut n'être en réalité qu'un seul individu. C'est aussi le cas chez le bambou qui, pour compenser sa grande lenteur à générer des fleurs (parfois plusieurs dizaines d'années avant d'atteindre la maturité sexuelle) se multiplie d'une façon surabondante par émission de rhizomes.
Enfin on pourra aussi citer la multiplication asexuée clonale par apoflorie : formation de bourgeons mitotiques appelé bulbilles, qui deviennent de petits individus développant leurs cormus (feuilles, tige et racine) sur la plante elle-même avant d'en être détachés. On observe ce mode de reproduction chez Kalanchoe pinnata en particulier (plante sacrée des Aztèques).
L'atout essentiel du succès évolutif des Angiospermes vis-à-vis des Gymnospermes aura été le recours massif à la multiplication asexuée qui permet de multiplier les phénotypes adaptés à leur environnement sans que les individus n'aient nécessairement atteint la maturité sexuelle.
L'anatomie et la croissance
Les Angiospermes ont des tailles de quelques millimètres à une centaine de mètres (eucalyptus par exemple).
Les Angiospermes sont en majorité phototrophes, tirant leur énergie chimique de la lumière solaire et leur carbone du dioxyde de carbone atmosphérique. Quelques espèces sont partiellement parasites (gui), d'autres le sont totalement, ou sont saprophytes et, dans ces deux derniers cas, sont dépourvues de chlorophylle. Citons le cas de mycotrophes, des Angiospermes sans chlorophylle vivant en relation symbiotique avec des champignons (certaines orchidées, et les monotropes).
Les Angiospermes, comme les autres Spermatophytes, développent un système racinaire important leur permettant de puiser dans le sol l'eau et les sels minéraux dont ils ont besoin. Les racines sont souvent le siège de symbioses avec les bactéries du sol, en particulier pour le métabolisme de l'azote. Certaines espèces, vivants fréquemment sur des sols très pauvres, complètent leur apport en azote par la capture d'animaux (plantes carnivores).
Voir aussi : méristème, liber, phloème, xylème, racine, mode de ramification des plantes à fleur, feuille
Systématique
Les 369 000 espèces sont réparties en 12 000 genres appartenant à environ 445 familles, elles-mêmes réunies en 56 ordres (contre seulement 700 espèces de Gymnospermes selon les estimations les plus larges). Elles dominent la flore terrestre. La clé de leur succès évolutif réside dans l'amélioration des modes de fécondation et de dissémination des graines en relation étroite avec les animaux, en particulier la coévolution entre les insectes pollinisateurs et les plantes du Crétacé, ce qui entraîne chez ces dernières une augmentation de leur diversité génétique et leur permet de coloniser tous les milieux[29] - [30].
En France, les angiospermes comprennent environ 150 familles contenant 6 000 espèces[31].
On distingue différents ordres de divergences anciennes, et deux grands ensembles, les monocotylédones, qui incluent entre autres les graminées (blé, maïs, bambou), les dattiers ou les plantes à bulbes (jonquille, oignon, poireau), et les dicotylédones vraies, qui incluent aussi bien le chêne que la pomme de terre, les orties ou les artichauts. Les monocotylédones rassemblent près de 20 % des espèces et les dicotylédones près de 80 %[32].
L'histoire des classifications botaniques montre que les systématiciens essayent de se rapprocher d'une description de plus en plus précise des groupes végétaux en fonction des liens de parenté entre espèces. Les derniers systèmes de classification publiés sont celui d'Arthur Cronquist en 1981, utilisé dans de nombreux ouvrages, et plus récemment, la classification APG IV (proposée par l'Angiosperm Phylogeny Group) en 2016 fondée sur la phylogénie moléculaire[33].



 Ceratophyllum submersum, de l'orde des Ceratophyllales.
Ceratophyllum submersum, de l'orde des Ceratophyllales.
 Pomme de terre (Solanum tuberosum), une Astéridée du groupe 1 (Lamiidées).
Pomme de terre (Solanum tuberosum), une Astéridée du groupe 1 (Lamiidées). Camomille (Matricaria chamomilla), une Astéridée du groupe 2 (Campanulidées).
Camomille (Matricaria chamomilla), une Astéridée du groupe 2 (Campanulidées).
Classification
Selon les classifications, les plantes à fleurs sont :
- la division des Magnoliophyta, contenant deux classes, les Liliopsida (monocotylédones) et les Magnoliopsida (dicotylédones) : classification classique de Cronquist (1981)[34] et classifications classiques de Takhtajan (1987[35], 1997[36] et 2009[37]) ;
- la classe des Magnoliopsida (cependant, le nom Magnoliopsida se rapporte le plus souvent aux Dicotylédones[38]) :
- la classe des Magnoliopsida divisée en deux sous-classes, les Liliidae (monocotylédones) et les Magnoliidae (dicotylédones) : Dahlgren (1980)[39], Thorne (1992)[40] ;
- la classe des Magnoliopsida divisée en 12 sous-classes : Thorne et Reveal (2007)[41] ;
- la classe des Magnoliopsida, divisée en de nombreux super-ordres, de la division de Tracheophyta (plantes vasculaires) : ITIS (9 juillet 2022)[42], World Register of Marine Species (9 juillet 2022)[43] ;
- la super-classe des Angiospermae contenant la seule classe des Magnoliopsida, de la division de Tracheophyta : Ruggiero et al. (2015)[44], IRMNG (9 juillet 2022)[45] ;
- la sous-classe des Magnoliidae, de la classe des Equisetopsida qui regroupe toutes les plantes terrestres : classification APG III selon Chase et Reveal (2009)[46], Tropicos (9 juillet 2022)[47], INPN (9 juillet 2022)[48].
Quand au nom Angiospermae, il a pu prendre les rangs de sous-règne, division (ou phylum), sous-division, infra-division, super-classe et classe[49].
Selon Chase et Reveal[46], d'après la classification phylogénétique APG III (2009)[50], applicable à la classification phylogénétique APG IV (2016)[33] :
(angiospermes) sous-classe des Magnoliidae Novák ex Takht., 1967
- super-ordre des Amborellanae M.W.Chase & Reveal, 1948
- super-ordre des Nymphaeanae Thorne ex Reveal, 1992
- super-ordre des Austrobaileyanae Doweld ex M.W.Chase & Reveal, 2009
- non classé : Chloranthales Mart., 1835 (ou super-ordre des Chloranthanae Doweld, 2001)
- super-ordre des Magnolianae Takht., 1967
- ordre des Canellales Cronquist, 1957
- ordre des Laurales Juss. ex Bercht. & J.Presl, 1820
- ordre des Magnoliales Juss. ex Bercht. & J.Presl, 1820
- ordre des Piperales Bercht. & J.Presl, 1820
- super-ordre des Lilianae Takht., 1967 (monocotylédones)
- ordre des Acorales Mart., 1835
- ordre des Alismatales R.Br. ex Bercht. & J.Presl, 1820
- ordre des Asparagales Link, 1829
- ordre des Dioscoreales Mart., 1835
- ordre des Liliales Perleb, 1826
- ordre des Pandanales R.Br. ex Bercht. & J.Presl, 1820
- ordre des Petrosaviales Takht., 1997
- non classé : famille des Dasypogonaceae Dumort., 1829 (ou ordre des Dasypogonales Doweld, 2001)
- ordre des Arecales Bromhead, 1840
- ordre des Commelinales Mart., 1835
- ordre des Poales Small, 1903
- ordre des Zingiberales Griseb., 1854
- super-ordre des Ceratophyllanae Takht. ex Reveal & Doweld, 1999
- ordre des Ceratophyllales Link, 1829
- super-ordre des Buxanae Takht. ex Reveal & Doweld, Novon 9: 549 30 Dec 1999
- ordre des Buxales Takht. ex Reveal, 1996
- super-ordre des Proteanae Takht., 1967
- ordre des Proteales Juss. ex Bercht. & J.Presl, 1820
- super-ordre des Ranunculanae Takht. ex Reveal, 1992
- ordre des Ranunculales Juss. ex Bercht. & J.Presl, 1820
(noyau des dicotylédones vraies)
- super-ordre des Myrothamnanae Takht., 1997
- ordre des Gunnerales Takht. ex Reveal, 1992
- non classé : famille des Dilleniaceae Salisb., 1807 (ou ordre des Dilleniales DC. ex Bercht. & J. Presl, 1820, super-ordre des Dillenianae Takht. ex Doweld, 2001)
- non classé : ordre des Saxifragales Bercht. & J.Presl, 1820 (ou super-ordre des Saxifraganae Reveal, 1994)
- super-ordre des Rosanae Takht., 1967
- ordre des Vitales Juss. ex Bercht. & J.Presl, 1820
(fabidées : eurosidées I)
- ordre des Celastrales Link, 1829
- ordre des Cucurbitales Juss. ex Bercht. & J.Presl, 1820
- ordre des Fabales Bromhead, 1838
- ordre des Fagales Engl., 1892
- ordre des Malpighiales Juss. ex Bercht. & J.Presl, 1820
- ordre des Oxalidales Bercht. & J.Presl, 1820
- ordre des Rafflesiales Mart., 1835
- ordre des Rosales Bercht. & J.Presl, 1820
- ordre des Zygophyllales Link, 1829
- ordre des Brassicales Bromhead, 1838
- ordre des Crossosomatales Takht. ex Reveal, 1993
- ordre des Geraniales Juss. ex Bercht. & J.Presl, 1820
- ordre des Huerteales Doweld, 2001
- ordre des Malvales Juss. ex Bercht. & J.Presl, 1820
- ordre des Myrtales Juss. ex Bercht. & J.Presl, 1820
- ordre des Picramniales Doweld, 2001
- ordre des Sapindales Juss. ex Bercht. & J.Presl, 1820
- super-ordre des Berberidopsidanae Thorne & Reveal, 2007
- ordre des Berberidopsidales Doweld, 2001
- super-ordre des Caryophyllanae Takht., 1967
- ordre des Caryophyllales Takht., 1967
- super-ordre des Santalanae Thorne ex Reveal, 1992
- ordre des Santalales R.Br. ex Bercht. & J.Presl, 1820
- super-ordre des Asteranae Takht., 1967
- non classés : familles des Boraginaceae Juss., 1789, des Icacinaceae Miers, 1851, des Metteniusaceae H.Karst. ex Schnizl., 1860–1870, des Oncothecaceae Kobuski ex Airy Shaw, 1965 et des Vahliaceae Dandy, J.Hutchinson, 1959 (ou ordre des Boraginales Juss. ex Bercht. & J.Presl, 1820, des Icacinales Tiegh., 1900, des Metteniusales Takht., 1997, des Oncothecales Doweld, 2001 et des Vahliales Doweld, 2001)
- ordre des Garryales Mart., 1835
- ordre des Gentianales Juss. ex Bercht. & J.Presl, 1820
- ordre des Lamiales Bromhead, 1838
- ordre des Solanales Juss. ex Bercht. & J.Presl, 1820
(campanulidées : euastéridées II)
- ordre des Apiales Nakai, 1930
- ordre des Aquifoliales Senft, 1856
- ordre des Asterales Link, 1829
- ordre des Bruniales Dumort., 1829
- ordre des Dipsacales Juss. ex Bercht. & J.Presl, 1820
- ordre des Escalloniales Link, 1829
- ordre des Paracryphiales Takht. ex Reveal, 1992
Phylogénie
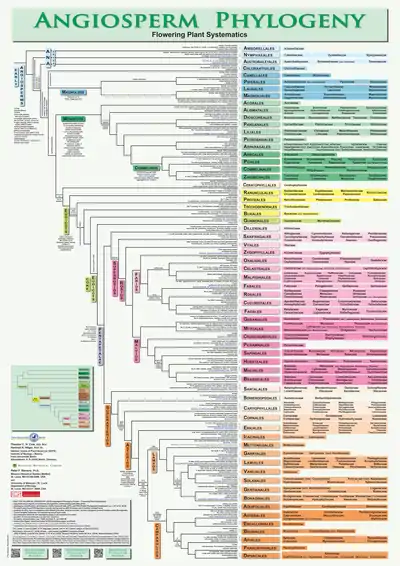

Différentes propositions d'arbre phylogénétique
| angiospermes | |
1. Phylogénie des plantes à fleurs, à partir de la classification phylogénétique APG III (2009)[50].
| angiospermes | |
2. Exemple de phylogénie alternative (2010)[51]
angiospermes basaux
angiospermes centraux |
3. APG IV (2016)[33]
| Cladogramme détaillé de la phylogénie des angiospermes, classification (APG) IV[33]. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Dernier ancêtre commun
La reconstruction du dernier ancêtre commun des angiospermes est rendue difficile par le grand nombre de polyploïdisations intervenues au cours de leur histoire évolutive. De proche en proche, on a pu reconstituer le caryotype ancestral des poacées (7 chromosomes), des monocotylédones (5), des eudicotylédones (7) puis du dernier ancêtre commun (15), comportant plus de 20 000 gènes conservés. Selon l'horloge moléculaire, cet ancêtre aurait vécu au Trias, vers 214 Ma (comme les premiers insectes pollinisateurs, diptères et hyménoptères). La fleur ancestrale était bisexuée et de symétrie radiale. Ele comportait au moins quatre verticilles d'organes de trois types, tous libres : plus de dix tépales (non différenciés en sépales et pétales), plus de cinq carpelles distribués en spirale et plus de dix étamines à anthères introrses[52] - [53].
Importance pour l'Homme
Les Angiospermes ont une importance économique de premier ordre pour les sociétés humaines.
Non seulement ils fournissent la plupart de nos aliments, directement (céréales, légumes, fruits) ou indirectement (alimentation du bétail, de la volaille), mais encore ils fournissent, avec certains Poacées (Bambou…) et Euphorbiacées (Hévéa) une large diversité de matières premières pour la construction, depuis au moins le Néolithique. Ainsi, ils fournissent des matériaux de construction (bois, bambou) que ce soit pour l'habitation, le transport (bateaux, brouettes), le mobilier ou l'outillage ; des fibres textiles (coton, lin), du combustible (bois), des fibres de cellulose (papier), des substances médicinales, des colorants naturels, des éléments de décors (plantes vertes, jardinage), etc.
La sélection et la culture intensive des Angiospermes est le domaine de l'agronomie, de l'agriculture ou de la sylviculture. Et justement, l'Homme a réalisé un très rigoureux travail de sélection pour conserver les caractères l'intéressant le plus. L'immense majorité des espèces domestiquées présente des caractères que la sélection naturelle défavorise. En effet l'Homme cherche essentiellement à fixer des caractères intéressants (gros fruits, belles fleurs, nombreuses graines, gros tubercules…) et en cela il doit s'opposer au très fort brassage génétique que réalisent naturellement les Angiospermes. Aussi l'Homme a donc tendance à contourner les systèmes favorisant l'allogamie et à sélectionner les rares systèmes favorisant l'autogamie (comme les systèmes basés sur l'anatomie de la fleur organisée de telle sorte que l'autofécondation est obligatoire : carène enroulée, cleistogamie sélectionnée chez les blés Triticum et chasmogamie). Eu égard à l'intérêt économique que suscitent les plantes cultivées, l'Homme a réalisé de nombreux travaux de recherche pour répondre à des problématiques de rendement : « quels sont les moyens d'obtenir une descendance homogène du même sexe chez des espèces dioïques » quand, chez les asperges par exemple, les pieds mâles sont systématiquement plus productifs, ce qui a donné lieu à la création des « super mâles » d'asperges (une sorte d'équivalent d'un génotype YY chez l'Homme) capables de donner une descendance 100 % mâle. D'importants travaux ont été menés en ce qui concerne la famille des Cannabacées (Houblon et Chanvre) qui elle aussi génère un intérêt économique (légal ou non) évident.
Il résulte de ces procédés de sélection que les plantes ainsi choisies par l'Homme sont souvent homozygotes pour tous leurs couples d'allèles (car nées d'un régime d'autogamie entretenu sur un très grand nombre de générations), voire qu'elles constituent tout simplement un clone (ensemble d'individus partageant le même génotype) comme ce fut le cas chez la pomme de terre cultivée Solanum tuberosum dont toutes les cultures européennes étaient en fait un clone au XIXe siècle. Ceci entraîna une réponse homogène face au mildiou (Phytophtora infestans) et les récoltes furent invariablement détruites. Le polymorphisme étant la seule réponse des systèmes vivants aux épidémies et aux pressions sélectives, le monomorphisme imposé par l'Homme pour la pomme de terre provoqua la destruction des récoltes et la dernière grande famine de l'histoire en Europe, notamment en Irlande où presque 50 % de la population trouva la mort, ce qui favorisa une large vague d'immigration vers les États-Unis.
Annexes
Publication originale
- Lindley, J (1830): Introduction to the Natural System of Botany. London: Longman, Rees, Orme, Brown, and Green. Page xxxvi. (Lire en ligne).
Bibliographie
- Spichiger, Rodolphe-Édouard et al. - Botanique systématique avec une introduction aux grands groupes de champignons. - 4e édition entièrement revue et augmentée. - Lausanne: Presses polytechniques et universitaires romanes (PPUR), 2016. - x, 448p. - (ISBN 978-2-88915-134-9). - Voir : Chapitre 5 - Les Angiospermes, p. 95-376 [Ce volumineux chapitre traite de 39 ordres et 106 familles considérés comme les plus importants et les plus représentatifs des Angiospermes.]
- (en) V.N. Naik, Taxonomy of Angiosperms, Tata McGraw-Hill Education, , 304 p. (lire en ligne)
Articles connexes
Liens externes
- (en) « Angiosperm Phylogeny Website », sur www.mobot.org (consulté le )
- (en) KLaus-Peter Kelber, « Angiosperms, Introductions to both Fossil and Recent Plant Taxa, Links for Palaeobotanists », sur www.equisetites.de (consulté le )
Angiospermae
- (en) Référence Angiosperm Phylogeny Website : Angiospermae Lindley (consulté le )
- (en) Référence BioLib : Angiospermae (consulté le )
- (en) Référence Trees and shrubs of the Andes of Ecuador : Angiospermae (consulté le )
- (en) Référence IRMNG : Angiospermae (consulté le )
- (fr+en) Référence ITIS : Angiospermae (consulté le )
- (en) Référence NCBI : Angiospermae (taxons inclus) (consulté le )
- (en) Référence Paleobiology Database : Angiospermae Mabberley 2000 (consulté le )
- (en) Référence The Taxonomicon : Angiospermae (consulté le )
Magnoliophyta
- (en) Référence BioLib : Magnoliophyta Cronquist, Takht. & W.Zimm. (consulté le )
- (fr+en) Référence GBIF : Magnoliophyta (consulté le )
- (en) Référence International Fossil Plant Names Index (IFPNI) : Magnoliophyta Reveal Phytologia, 1995, 79(2): 70. 29 Apr 1996 (consulté le )
- (en) Référence IRMNG : Magnoliophyta (consulté le )
- (fr+en) Référence ITIS : Magnoliophyta (consulté le )
- (en) Référence NCBI : Magnoliophyta (taxons inclus) (consulté le )
- (en) Référence OEPP : Magnoliophyta (consulté le )
- (en) Référence Paleobiology Database : Magnoliophyta Cronquist et al. (consulté le )
- (en) Référence The Taxonomicon : Magnoliophyta Cronquist, Takht. & Zimmerm. (1966) (consulté le )
- (en) Référence Tropicos : Magnoliophyta Cronquist, Takht. & W. Zimm. ex Reveal (+ liste sous-taxons) (consulté le )
Magnoliopsida
- (en) Référence BioLib : Magnoliopsida Brongn. (consulté le )
- (en) Référence Catalogue of Life : Magnoliopsida (consulté le )
- (fr+en) Référence GBIF : Magnoliopsida (consulté le )
- (en) Référence International Fossil Plant Names Index (IFPNI) : Magnoliopsida Brongn. Énum. Pl. Mus. Paris xxvi, 95. 5-12 Aug 1843 (consulté le )
- (en) Référence IRMNG : Magnoliopsida (consulté le )
- (fr+en) Référence ITIS : Magnoliopsida (consulté le )
- (en) Référence NCBI : Magnoliopsida (taxons inclus) (consulté le )
- (en) Référence Paleobiology Database : Magnoliopsida Cronquist et al. 1996 (consulté le )
- (en) Référence The Taxonomicon : Magnoliopsida Brongn. (1843) (consulté le )
- (en) Référence Tropicos : Magnoliopsida Brongn. (+ liste sous-taxons) (consulté le )
- (en) Référence World Register of Marine Species : taxon Magnoliopsida (+ liste espèces) (consulté le )
Magnoliidae
- (en) Référence BioLib : Magnoliidae Novák ex Takht. (consulté le )
- (fr) Référence INPN : Magnoliidae Novák ex Takht., 1967 (TAXREF) (consulté le )
- (en) Référence International Fossil Plant Names Index (IFPNI) : Magnoliidae Takht. 51. (consulté le )
- (fr+en) Référence ITIS : Magnoliidae (consulté le )
- (en) Référence The Taxonomicon : Magnoliidae Novák ex Takht. (1967) (consulté le )
- (en) Référence Tropicos : Magnoliidae Novák ex Takht. (+ liste sous-taxons) (consulté le )
Notes et références
- Guillaume Lecointre et Hervé Le Guyader, Classification phylogénétique du vivant, t. 1, Belin, , 4e éd., 584 p. (ISBN 978-2-7011-8294-0), p. 304.
- (en) Royal Botanic Gardens, State of the World's Plants Report. 2016, Kew The Board of Trustees of the Royal Botanic Garden United Kingdom, 84 p., 2016 (ISBN 978-1-84246-628-5), p. 7.
- « Les plus grandes familles des Angiospermes (les plantes à fleurs) », sur La Gazette des Plantes, (consulté le ).
- (en) Gurcharan Singh, Plant Systematics. An Integrated Approach, Science Publishers, , p. 302.
- Extrait d'une lettre de Charles Darwin adressée le 22 juillet 1879 au botaniste Joseph Dalton Hooker (« Pour autant que nous pouvons en juger, le développement rapide des végétaux supérieurs dans les temps géologiques récents est un abominable mystère »). En parlant d'« abominable mystère », Darwin ne fait pas référence au manque de fossiles présentant des caractères primitifs de fleurs (pollen colporé, bois hétéroxylé, feuilles à nervation réticulée) et à l'ordre inconnu dans lequel les innovations sont apparues, mais évoque sa perplexité concernant l'origine des plantes à fleurs et leur diversification si rapide à l'échelle des temps géologiques. Ces brusques modifications confortent en effet la théorie saltationniste de l’évolution que rejette Darwin. Cf. (en) W.E. Friedman, « The meaning of Darwin's 'abominable mystery' », American Journal of Botany, vol. 96, no 1, , p. 5-21 (DOI 10.3732/ajb.0800150).
- François Parcy, L'histoire secrète des fleurs, Humensis, , p. 47
- A. Bartiromo, G. Barale, M.R.B. Lumaga, S. Bravi et F. Barattolo, « An Early Cretaceous flora from Cusano Mutri, Benevento, southern Italy », Cretaceous Research, vol. 33, no 1, , p. 116-34 (lire en ligne)
- C. Coiffard, B. Gomez et F. Thévenard, « Early Cretaceous angiosperm invasion of western Europe and major environmental changes », Annals of Botany, vol. 100, no 3, , p. 545-53 (lire en ligne)
- B. Gomez, V. Daviero-Gomez, C. Coiffard, C. Martín-Closas et D.L. Dilcher, « Montsechia, an ancient aquatic angiosperm », PNAS, vol. 112, no 35, , p. 10985-8 (lire en ligne)
- Gomez B, Daviero-Gomez V, Martin-Closas C & Fuente, M. (2006). Montsechia vidalii, an early aquatic angiosperm from the Barremian of Spain. In 7th European Palaeobotany and Palynology Conference, sept. 2006 (p. 49).
- V. A. Krassilov, « On Montsechia, an angiospermoid plant from the Lower Cretaceous of Las Hoyas, Spain: new data and interprétations », Acta Palaeobot, vol. 51, no 2, , p. 181-205 (lire en ligne)
- « Les plantes à fleurs seraient apparues plus tôt que prévu », Science et vie, (lire en ligne)
- Peter A. Hochuli et Susanne Feist-Burkhardt, « Angiosperm-like pollen and Afropollis from the Middle Triassic (Anisian) of the Germanic Basin (Northern Switzerland) », Front. Plant Sci., vol. 4, , p. 344 (DOI 10.3389/fpls.2013.00344, lire en ligne)
- M.J. Moore, C.D. Bell, P.S. Soltis et D.E. Soltis, « Using plastid genome-scale data to resolve enigmatic relationships among basal angiosperms », PNAS, vol. 104, , p. 19363–8 (lire en ligne)
- (en) Fu, Diez, Pole, Ávila, Liu, Chu, Hou, Yin et Zhang, « An unexpected noncarpellate epigynous flower from the Jurassic of China », eLife, (consulté le )
- (en) « Fossils suggest flowers originated 50 million years earlier than thought », ScienceDaily (consulté le )
- (en) Georges B. Johnson, Peter H. Raven, Jonathan B. Losos, Jules Bouharmont, Susan R. Singer, Biologie, De Boeck Supérieur, , p. 15
- (en) millions%20d'années « 99-Million-Year-Old Flower Beetle with Pollen Grains on Its Legs Found Encased in Amber », sur www.sci-news.com/, (consulté le )
- (en) Tong Bao, Bo Wang, Jianguo Li et David Dilcher, « Pollination of Cretaceous flowers », Proceedings of the National Academy of Sciences of the United States of America, vol. Online edition, (DOI 10.1073/pnas.1916186116)
- (en) Anne-Claire Chaboureau, Pierre Sepulchre, Yannick Donnadieu et coll., « Tectonic-driven climate change and the diversification of angiosperms », Proceedings of the National Academy of Sciences USA, vol. 111, no 39, , p. 14066–14070 (DOI 10.1073/pnas.1324002111)
- F. Murat et al., Reconstructing the genome of the most recent common ancestor of flowering plants, 2017 DOI:10.1038/ng.3813.
- (en) Kevin A. Simonin, Adam B. Roddy, « Genome downsizing, physiological novelty, and the global dominance of flowering plants », Proceedings of the National Academy of Sciences USA, vol. 16, no 1, (DOI 10.1371/journal.pbio.2003706)
- La soudure des pièces florales participe à cette protection (rôle du calice lors de la formation du bourgeon floral, rôle des étamines et carpelles soudés protégeant les ovules), la corolle participant en plus à la pollinisation (rôle vexillaire, de vexillum, « étendard »).
- Yves Tourte, Michel Bordonneau, Max Henry et Catherine Tourte, Le monde des végétaux. Organisation, physiologie et génomique, Dunod, (lire en ligne), p. 97-100.
- Le monde du vivant, Purves & al., Flammarion
- Campbell BIOLOGIE Pearson, "Chapitre 30: La diversité des Végétaux II:l'évolution des plantes à graines"
- Il existe des plantes non vasculaires parvenant à vivre encore à plus haute altitude : lichens trouvés à 7 400 m d'altitude sur le Makalu et des bactéries trouvées en 1963 à 8 600 m d'altitude sur l'Everest. Cf « Écologie verticale et les plantes les plus hautes du monde », sur ecrins-parcnational.fr, .
- (en) Cédric Dentant, « The highest vascular plants on Earth », Alpine Botany, vol. 128, no 2, , p. 97–106 (DOI 10.1007/s00035-018-0208-3).
- (en) David Grimaldi, « The Co-Radiations of Pollinating Insects and Angiosperms in the Cretaceous », Annals of the Missouri Botanical Garden, vol. 86, no 2, , p. 373-406 (DOI 10.2307/2666181)
- Paul-André Calatayud, Interactions insectes-plantes, IRD Éditions, , p. 565-567
- Philippe Jauzein, Flore des champs cultivés, éditions Quæ, , p. 91
- (en) John W. Kimball, Biology, Wm. C. Brown Publishers, , p. 707
- (en) Angiosperm Phylogeny Group, « An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV », Botanical Journal of the Linnean Society, Wiley-Blackwell, Linnean Society of London et OUP, vol. 181, no 1, , p. 1-20 (ISSN 0024-4074 et 1095-8339, DOI 10.1111/BOJ.12385)
- (en) Arthur Cronquist, An Integrated System of Classification of Flowering Plants, New York, Columbia University Press, (ISBN 0-231-03880-1, OCLC 1136076363, lire en ligne)
- (ru) Armen Takhtajan, Systema Magnoliophytorum, (lire en ligne)
- (en) A. Takhtajan, Diversity and Classification of Flowering Plants, New York, Columbia University Press,
- (en) Armen Takhtajan, Flowering Plants, Saint-Pétersbourg, Institut de botanique Komarov, , 2e éd. (ISBN 978-1-4020-9608-2, DOI 10.1007/978-1-4020-9609-9, lire en ligne)
- (en) Philip D. Cantino, James A. Doyle, Sean W. Graham, Walter S. Judd, Richard G. Olmstead, Douglas E. Soltis, Pamela S. Soltis et Michael J. Donoghue, « Towards a phylogenetic nomenclature of Tracheophyta », Taxon, Utrecht, IAPT (d) et Wiley, vol. 56, no 3, et , p. 822–846 (ISSN 0040-0262 et 1996-8175, DOI 10.1002/TAX.563001, JSTOR 25065865, lire en ligne)
- (en) R. M. T. DAHLGREN, « A revised system of classification of the angiosperms », Botanical Journal of the Linnean Society, Wiley-Blackwell, Linnean Society of London et OUP, vol. 80, no 2, , p. 91-124 (ISSN 0024-4074 et 1095-8339, DOI 10.1111/J.1095-8339.1980.TB01661.X)
- (en) Robert F. Thorne, « Classification and geography of the flowering plants », The Botanical Review et inconnu, Springer Science+Business Media, vol. 58, no 3, , p. 225-327 (ISSN 0006-8101 et 1874-9372, DOI 10.1007/BF02858611, JSTOR 4354190)
- (en) Robert Folger Thorne et James Lauritz Reveal, « An updated classification of the class Magnoliopsida (“Angiospermae”) », The Botanical Review, Springer Science+Business Media, vol. 73, no 2, , p. 67-181 (ISSN 0006-8101 et 1874-9372, DOI 10.1663/0006-8101(2007)73[67:AUCOTC]2.0.CO;2, JSTOR 4354528)
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 9 juillet 2022
- World Register of Marine Species, consulté le 9 juillet 2022
- (en) Michael A. Ruggiero, Dennis P. Gordon, Thomas M. Orrell, Nicolas Bailly, Thierry Bourgoin, Richard C. Brusca, Thomas Cavalier-Smith, Michael D. Guiry et Paul M. Kirk, « Correction: A Higher Level Classification of All Living Organisms », PLOS One, PLoS, vol. 10, no 6, , e0130114 (ISSN 1932-6203, OCLC 228234657, PMID 26068874, PMCID 5159126, DOI 10.1371/JOURNAL.PONE.0130114)
- Rees, T. (compiler). The Interim Register of Marine and Nonmarine Genera. Available from https://www.irmng.org at VLIZ, consulté le 9 juillet 2022
- (en) Mark Wayne Chase et James Lauritz Reveal, « A phylogenetic classification of the land plants to accompany APG III », Botanical Journal of the Linnean Society, Wiley-Blackwell, Linnean Society of London et OUP, vol. 161, no 2, , p. 122–127 (ISSN 0024-4074 et 1095-8339, DOI 10.1111/J.1095-8339.2009.01002.X, lire en ligne)
- Tropicos.org. Missouri Botanical Garden., consulté le 9 juillet 2022
- MNHN & OFB [Ed]. 2003-présent. Inventaire national du patrimoine naturel (INPN), Site web : https://inpn.mnhn.fr, consulté le 9 juillet 2022
- (en) The Taxonomicon, « Scientific name: Angiospermae - Entity Index », sur taxonomicon.taxonomy.nl (consulté le )
- (en) Angiosperm Phylogeny Group, « An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III », Botanical Journal of the Linnean Society, Wiley-Blackwell, Linnean Society of London et OUP, vol. 161, no 2, , p. 105–121 (ISSN 0024-4074 et 1095-8339, DOI 10.1111/J.1095-8339.2009.00996.X)
- Bell CD, Soltis DE, Soltis PS, « The age and diversification of the angiosperms re-revisited », American Journal of Botany, vol. 97, no 8, , p. 1296–303 (PMID 21616882, DOI 10.3732/ajb.0900346)
- Hervé Le Guyader, « À la recherche de la fleur ancestrale », Pour la science, no 531, , p. 92-94.
- (en) Florent Murat, Alix Armero, Caroline Pont, Christophe Klopp et Jérôme Salse, « Reconstructing the genome of the most recent common ancestor of flowering plants », Nature Genetics, vol. 49, , p. 490-496 (DOI 10.1038/ng.3813).