Coévolution
En biologie, la coévolution décrit les transformations qui se produisent au cours de l’évolution entre deux espèces (coévolution par paire) ou plus de deux espèces (coévolution diffuse) à la suite de leurs influences réciproques.
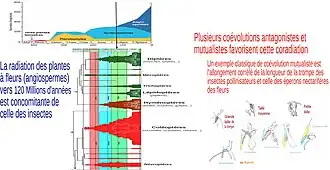

Ce phénomène de coévolution s’observe dans différents cas :
- coévolution compétitive entre espèces antagonistes : système hôte-parasite, ou proie-prédateur ;
- coévolution coopérative entre espèces mutualistes.
La coévolution peut également avoir lieu entre individus de sexes différents au sein de la même espèce via la sélection sexuelle.
Origine du concept
Le terme de coévolution est introduit pour la première fois en 1964 par Ehrlich et Raven[1], dans un article portant sur les interactions entre les plantes et les papillons. Leur théorie selon laquelle il y a eu coévolution entre ces espèces repose sur le fait que les papillons, insectes phytophages, ont exercé une pression de sélection sur les plantes, qui ont développé certains mécanismes de défense, entraînant en retour l’émergence, chez certains papillons, de caractères leur permettant de contrer ces mécanismes. Cette sélection réciproque aurait joué un rôle majeur dans l’évolution de ces deux taxons, en favorisant l’apparition de nouvelles lignées de plantes et de papillons, aboutissant à la diversité que nous connaissons aujourd’hui.
Daniel Hunt Janzen (en), en 1980, redéfinit précisément le terme comme un changement évolutif d’un trait chez une espèce en réponse à un trait chez une deuxième espèce, suivie d’une adaptation évolutive de cette deuxième espèce.
En 1973, le biologiste Leigh Van Valen affirme que la persistance d’une espèce dans un environnement variable (comme le système hôte-parasite) n’est possible que par un effort adaptatif permanent. Dans ce système, il n’y a pas un protagoniste de mieux en mieux adapté à un autre, mais bien coadaptation qui les pousse à se modifier réciproquement pour rester, sur le plan adaptatif, à la même place. Il s'agit de l'hypothèse de la reine rouge, en référence au conte d’Alice au pays des merveilles de Lewis Caroll.
Coévolution par paire
Coévolution compétitive
Le phénomène de coévolution compétitive par paire est fréquemment observé dans les interactions proies-prédateurs et les interactions parasite-hôte[2] - [3]. Ces relations peuvent induire une véritable « guerre » à l'échelle évolutive, qui se poursuit aussi longtemps que l'un des protagonistes ne disparaît pas. Quand un caractère d'une espèce est modifié en réponse à l'évolution d'un caractère correspondant chez une autre espèce antagoniste, il se produit une « course aux armements » qui n'est rien d'autre qu'une escalade adaptative[4].
Système hôte-parasite
Un parasite est un organisme qui exploite les ressources énergétiques d’un autre organisme (l’hôte) et le prend comme habitat, en établissant une interaction durable. L’énergie absorbée par le parasite diminue l’énergie disponible pour l’hôte. Or, la diversité génétique au sein de la population hôte permet une diversité des mécanismes de défense susceptibles de lutter contre le parasite. Les individus dont le génotype leur procure un avantage dans la défense contre le parasite par rapport aux autres individus ont un succès reproductif ou fitness supérieur. Par sélection naturelle, les gènes de défense contre le parasite se répandront donc au sein de la population. Ce phénomène ne sera pas sans conséquence sur le parasite, qui devra à son tour s’adapter à ce nouveau mécanisme de défense. Cette adaptation se fera par sélection des parasites qui possèdent un avantage dans la capacité à lutter, par exemple, contre les défenses du système immunitaire de l’hôte, ou dans la capacité à se faire accepter par diminution de sa virulence. Un nouveau génotype parasite, plus performant dans sa faculté de cohabitation avec l’hôte, sera sélectionné et augmenter la pression de sélection sur l’hôte. La guerre peut ainsi continuer éternellement entre le parasite et l’hôte sous forme de « course aux armements ».
Pendant l’infection, le système immunitaire de l’hôte développe une réponse rapide aux antigènes présents sur le parasite. Il est donc nécessaire pour le parasite de modifier ses signaux maintenant reconnus par le système immunitaire de l’hôte. Ces modifications passent par des réarrangements d’ADN, modifiant ainsi l’expression des gènes et créant une hétérogénéité de caractère au sein de la population de parasites. Les processus de sélection naturelle reposent sur cette hétérogénéité, pilotés par le système immunitaire de l’hôte. Les mutations génétiques permettent une survie du parasite à l’intérieur d’un hôte, mais c’est le polymorphisme allélique qui permet la survie du parasite dans la population des hôtes. La diversité des hôtes encourage une forte diversité allélique des parasites.
Définition
Le mutualisme est une interaction hétérospécifique, généralement entre deux espèces, entraînant un gain réciproque de valeur sélective (fitness)[5]. Les conditions nécessaires pour la sélection du mutualisme sont la variabilité génétique d’un trait, l'héritabilité du trait et l'effet du trait sur le fitness du porteur) permettent de dire qu'il y aura sélection du mutualisme à condition que les coûts de réalisation de cette interaction par l’individu soient compensés par les gains de valeur sélective de celui-ci[6].
Ce gain de fitness interindividuel est défini comme la « réponse proximale » : la différence de fitness entre individus avec ou sans partenaire[6]. Ils peuvent également tricher pour exploiter les ressources, par exemple par pollinisation[7]. Il y aura coévolution si les traits contribuant au mutualisme chez les espèces impliquées sont sélectionnés.
Différents traits peuvent être sélectionnés :
- traits favorisant le mutualisme, par exemple : les plantes sécrètent des acides gras par leurs racines, ce qui facilite la colonisation de champignons mutualistes racinaires[8] ;
- traits luttant contre la triche, par exemple : Bignoniaceae est adapté de par son réseau de tricheurs dans sa pollinisation. Ce sont des réseaux particuliers qui contiennent plusieurs tricheurs par rapport celui de Malpighiaceae. Même des êtres vivants (oiseaux, diptère, etc.) utilisent Bignoniaceae pour tricher. Les Bignoniaceae sont adaptés à la présence de tricheurs pour leur moduralité[9] ;
- contre sélection de traits antagonistes au mutualisme.
Cette sélection minimise les coûts et maximise les gains de fitness, ce qui crée une dépendance évolutive entre les deux partenaires[6]. Le fitness des deux partenaires seuls est inférieur à celui d’un individu de la même espèce incapable de mutualisme[6]. Le temps utilisé pour le contact interspécifique et pour arriver a un réel bénéfice, donc une augmentation du fitness, peut être considéré comme un indice de cette interaction mutualiste.
K. R. Foster et T. Wenseleers[10] ont identifié trois facteurs majeurs primordiaux dans l’évolution des mutualismes : le ratio coûts/avantages, la parenté au sein des espèces et la fidélité interespèces. Ils opèrent selon trois mécanismes distincts de rétroaction génétique dans le cas de l’association de coopération et de rétroactions phénotypiques de fidélité des partenaires, de choix des partenaires et de sanctions.
La « réponse ultime », ou effet ultime, est expliquée par un mécanisme de dépendance évolutive plus fort, et par le fait que les individus dépendent l’un de l’autre. En effet, sans leur partenaire mutualiste, le fitness de chaque individu est inférieur à celui d’un individu non mutualiste de la même espèce. Le degré de dépendance peut être considéré comme un indice de coévolution. La plupart de cette réponse ultime montre un aspect positif interspécifique. Par conséquent, l’absence de l’un des deux partenaires mutualistes peut causer des effets très négatifs à l’autre espèce[6]. Exemples : plante—herbivores, poisson-clown—anémone.
En revanche, l’obligation du mutualisme n’est pas un lien direct avec le mutualisme ultime. La dépendance évolutive au niveau de la réponse immédiate peut causer une perte de trait à l’autre individu à cause du remplacement de certains rôles qui sont plus efficaces en termes de rendement. Exemple : guêpe (Asobara tabida) et Wolbachia — ils sont obligés d’être mutualisme proximate mais pas la mutualisme ultime.
Stabilité de l'interaction[11]
Même si les interactions mutualistes sont considérées hautement stables à l‘échelle de l’évolution, une interaction peut être mutualiste dans certains contextes mais tourner au parasitisme dans d’autres conditions. Cette dépendance au contexte est liée à la disponibilité des ressources dans le milieu ainsi qu’à la plasticité des espèces et à l’évolution. En effet, cette disponibilité peut influencer le ratio coûts/avantages de l’échange et mener à un continuum mutualisme-parasitisme (J. Clark et al, 2017).
Exemple : le mutualisme fourmi-acacia

Un exemple majeur d’interaction mutualiste est l’interdépendance entre les acacias (ex. : Acacia cornigera) et les fourmis (ex. : Pseudomyrmex ferruginea). Dans ce cas de mutualisme, l’acacia procure des ressources alimentaires et un habitat à la colonie de fourmis (épines enflées), et en échange, les fourmis assurent la protection de l’acacia contre les insectes phytophages et les plantes avoisinantes (piqûres, morsures).
Daniel H. Janzen[12] et M. Heil[13] décrivent des adaptations phénotypiques portées exclusivement par les espèces impliquées l’interaction mutualiste fourmi-acacia, favorables au maintien et à l’efficacité du partenariat. Les acacias procurent des corps beltiens (excroissances foliaires) et du nectar extrafloral extrêmement nutritifs, contenant notamment des inhibiteurs d’enzymes digestives, toxiques pour les herbivores. Les fourmis ne sont pas affectées, du fait d’enzymes digestives spécifiques, résistantes à l’action de ces inhibiteurs.
Ces adaptations renforcent l’interaction mutualiste, mais préviennent aussi l’évolution de tricheurs : les adaptations digestives des fourmis les conduisent à se nourrir exclusivement à partir des ressources procurées par leur partenaire, les contraignant à défendre leur unique source de nourriture.
Coévolution diffuse
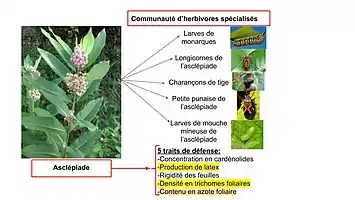

On parle de coévolution diffuse (terme inventé en 1980 par l'écologiste évolutionniste Daniel H. Janzen (en))[14] lorsque plus de deux guildes incluant plusieurs espèces de chaque côté, sont impliquées. L'écologiste John N. Thompson la nomme coévolution par guilde[15].
Ce type de coévolution a été beaucoup moins étudié que les systèmes de coévolution par paire, et pourtant elle joue un rôle important dans la coévolution. Le cas le plus étudié concerne les interactions entre plusieurs herbivores et une plante, notamment les vertébrés qui sont plus enclins à faire partie de ce processus de coévolution car ce sont en grande partie des généralistes (notamment en matière de nourriture et d'habitat) contrairement aux insectes qui sont des organismes plus spécialistes[16].
Dans l’étude d’un système impliquant plusieurs herbivores, K. Iwao et M. D Rauscher[17] ont proposé en 1997 un modèle pour identifier la coévolution diffuse. Trois critères de la coévolution par paire sont énoncés, lorsqu’un de ces critères n’est pas respecté, la coévolution est dite diffuse.
Ces trois critères sont :
- la résistance aux différents herbivores est non corrélée génétiquement ;
- la présence ou l’absence d’un herbivore n’a pas d’effet sur la quantité de dommages causés par les autres herbivores ;
- la pression de broutage d’un herbivore sur l'état de la plante ne dépend pas de la présence d’un autre herbivore.
Quelle est alors la force de la sélection naturelle sur la résistance sur une plante face à une communauté d’herbivores[18] ? Quels traits retrouvés chez cette plante sont génétiquement corrélés avec l’abondance et la performance de sa communauté d’herbivores spécialisés[19] ?
Afin de tester les hypothèses associées à la coévolution diffuse au niveau des interactions entre une plante hôte toxique et ses herbivores spécialisés, une étude de deux ans sur le terrain sur l’asclépiade (Asclepias syriaca), cinq de ses mécanismes de défense et cinq de ses herbivores spécialisés principaux (Danaus plexippus, Tetraopes tetrophthalmus, Rhyssomatus lineaticollis (en), Lygaeus kalmii (en) et Liriomyza asclepiadis) a testé si :
- Les espèces herbivores varient dans leur abondance selon les différents génotypes retrouvés chez l’Asclépiade ;
- Le dommage tôt dans la saison affecte les herbivores plus tardifs en induisant une production accrue de défenses ;
- Certaines défenses sont généralisées et efficaces sur toute la communauté d’herbivores.
Après deux ans d’observations et une quantification des traits de défense associés à des gènes mesurables, ainsi qu’une analyse de la sélection génétique il fut ainsi établi que la sélection directionnelle favorise la résistance à l’herbivorie par la production de latex, de trichomes et une concentration accrue d’azote dans les feuilles. De plus, tous ces traits sont génétiquement variables et quantifiables, et l’abondance en trichomes et en latex était négativement corrélée à l’abondance en herbivores, mais pas les dommages soutenus. Finalement, une corrélation négative fut aussi tracée entre la croissance des monarques et la production induite de défenses plus tôt dans la saison[19].
Il fut établi que la variabilité génétique au niveau des mécanismes de défense à l’herbivorie chez les plantes cause des modifications structurelles dans sa communauté d’herbivores, ce qui est un facteur important dans la médiation de la coévolution[19]. Les chercheurs concluent alors que la sélection des mécanismes de défense des plantes est influencée par :
- une corrélation génétique entre la susceptibilité des plantes à plusieurs herbivores ;
- des traits de défenses qui affectent certains, mais pas tous les herbivores de la communauté ;
- les effets de l’herbivorie tôt dans la saison qui induisent des changements chez l’asclépiade affectant les herbivores plus tardifs.
Cette étude illustre la médiation de la coévolution entre une plante hôte toxique et ses herbivores par la variation génétique de ses mécanismes de défense. La pression de sélection exercée de façon réciproque entre la plante et ses herbivores ainsi que les réponses phénotypiques ou comportementales induites affecteraient tous les organismes impliqués. Ainsi, même si un trait de défense vise une seule espèce d’herbivore, il est probable que la pression de sélection qui en résulte affecte les autres herbivores de façon à avoir un rôle primordial dans la structure de la communauté d’organismes impliqués[19].
Coévolution dans le cadre de la sélection sexuelle
Le phénomène de coévolution peut aussi avoir lieu au sein d’une espèce, entre individus de sexe opposé. Il a été montré (Coevolution of male and femal genital morphology in waterfowl, Brennan & al., 2007[20]) que la raison la plus vraisemblable quant à l’évolution des appareils génitaux chez plusieurs espèces de canards était due à la coévolution.
En effet, dans le cadre de la sélection sexuelle, afin d’éviter les accouplements forcés et mieux contrôler le choix du partenaire, les femelles ont développé une structure particulière du vagin, grâce notamment à une forme en spirale et des poches « cul de sac ». De plus une grande variabilité de la taille des phallus des mâles, non corrélée avec la taille des individus a été mise en évidence, ainsi qu’une forme spiralée inverse de celle des vagins des femelles. L’étude a prouvé que le nombre de spirales et de poches « cul de sac » des vagins étaient corrélées à la taille des phallus et des vagins. Ces résultats montrent une coévolution chez ces espèces, et donc que ce phénomène n’est pas uniquement destiné à des interactions inter-espèces.
Coévolution et biodiversité
La sélection réciproque entre espèces, notamment entre plantes et espèces phytophages, agit comme un moteur évolutif et un engin de diversification (concept déjà énoncé par Ehrlich et Raven en 1964). En effet, les interactions de type hôte/parasite, proie /prédateur, mutualistes, amènent certaines espèces à une perpétuelle évolution qui façonne leurs traits d’histoire de vie, leur physiologie et leur morphologie. L’espèce de passereau Bec-croisé des sapins (Loxia curvirostra) est par exemple aujourd’hui connue pour être un complexe de sous-espèces, chacune morphologiquement adaptée à des cônes de conifère différents.
La perte d’une espèce, en particulier celles dites « clé de voûte », n’entraîne pas simplement la perte d’une combinaison génétique, mais aussi du cortège d’interactions dynamiques dans lesquelles l’espèce était placée. Toute espèce hôte est une ressource clé pour ses parasites et symbiontes spécifiques. Un faible appauvrissement du nombre d’espèces entraîne un bouleversement dans le fonctionnement du milieu dans lequel vivaient ces espèces. Les interactions de type coévolution jouent donc un rôle important dans le maintien de la biodiversité.
Au sein d’une communauté, le changement d’une interaction affectera directement ou indirectement d’autres interactions, qui, par effet domino, déstabiliseront les liens entre individus. Par ce processus, certaines interactions évolueront ou coévolueront plus vite que d’autres, dans différentes directions, ce qui entraînera un remaniement du paysage communautaire.
Coévolution gène-culture
Au tout début des années 1980, les sociobiologistes Charles J. Lumsden et Edward O. Wilson ont proposé dans un ouvrage intitulé Genes, Mind and Culture : The Coevolutionary Process que les phénomènes culturels devaient être intégrés dans l'étude de l’évolution humaine[21]. Pour ces auteurs, la transmission culturelle est fortement influencée par la nature de l’esprit humain et réciproquement, un trait culturel peut favoriser l'évolution génétique via la stabilisation de certains gènes qui donnent un avantage sélectif dans le groupe où ce comportement culturel est observé.
À l’époque le concept d’une coévolution gène-culture n’est cependant pas totalement nouveau puisque dès 1971, l’anthropologue Claude Levi-Strauss invitait à une « collaboration positive entre généticiens et ethnologues, pour rechercher ensemble comment et de quelle façon les cartes de distribution des phénomènes biologiques et des phénomènes culturels s’éclairent mutuellement »[22]. Mais tant les biologistes que les chercheurs en sciences humaines sont restés réticents à considérer sérieusement cette hypothèse. Ce n’est qu’à partir des années 1990 qu’elle trouvera un plus large écho notamment grâce aux travaux menés en psychologie évolutionniste.
D’après ces théories, le processus de coévolution gène-culture se poursuit donc encore aujourd’hui au sein de l’espèce humaine. Claude Combes, spécialiste français de la coévolution note que l’humanité introduit en effet des processus nouveaux dans le jeu de la coévolution en ayant supprimé ses prédateurs, en domestiquant ou altérant les modes de vie de nombreuses espèces qui l’entourent, en agissant sur le climat de la planète, sur les paysages. Les conséquences de l’activité humaine qui résulte d’une culture transgénérationnelle incluant des savoirs médicaux, vétérinaires et techniques (clonage, génie génétique…) sont donc d’éloigner de plus en plus l’homme des processus de la sélection naturelle.
Coévolution gène-culture chez les cétacés
Même si l’hypothèse d’une coévolution gène-culture a souvent été appliquée à l’espèce humaine, des travaux en génétique et en éthologie ont mis en évidence un processus similaire à l’œuvre chez certains cétacés (cachalot, orque, globicéphale)[23]. En effet, chez ces espèces, des traditions culturelles ont été observées, notamment concernant les régimes alimentaires ou la communication vocale. Le résultat de ces divergences culturelles au sein de ces espèces dont la structure sociale est matrilinéaire est une réduction très importante de la diversité génétique de l’ADN mitochondrial.
Notes et références
- [PDF] Ehrlich & Raven, Butterflies and plants : a study in coevolution, Evolution, no 4, p. 586-608, décembre 1964.
- Multiple reciprocal adaptations and rapide genetic change upon experimental coevolution of animal host and its microbial parasite. Schulte & al, Proceeding of the National Academy of Sciences, 20 avril 2010, vol. 107 no 16
- Bacterial Antigenic Variation, Host Immune Response, and Pathogen-Host Coevolution. Robert C. Bruhnam, Francis A. Plummer, Richard S. Stephens, Infection and immunity, juin 1993, p. 2273-2276, vol. 61, no 6
- Claude Combes, Laurent Gavotte, Catherine Moulia, Mathieu Sicard, Parasitisme. Écologie et évolution des interactions durables, Dunod, (lire en ligne), p. 120.
- Bronstein, Judith L.,, Mutualism (ISBN 978-0-19-967565-4, 0-19-967565-1 et 978-0-19-967566-1, OCLC 909326420, lire en ligne)
- (en) Claire De Mazancourt, Michel Loreau et Ulf Dieckmann, « Understanding mutualism when there is adaptation to the partner », Journal of Ecology, vol. 93, no 2, , p. 305–314 (ISSN 0022-0477 et 1365-2745, DOI 10.1111/j.0022-0477.2004.00952.x, lire en ligne, consulté le )
- Gilbert, Lawrence E., Raven, Peter H. et International Congress of Systematic and Evolutionary Biology, 1st, Boulder, Colo., 1973., Coevolution of animals and plants : Symposium V, First International Congress of Systematic and Evolutionary Biology, Boulder, Colorado, August 1973, University of Texas, (ISBN 0-292-71056-9 et 978-0-292-71056-6, OCLC 6511746, lire en ligne)
- (en) Yina Jiang, Wanxiao Wang, Qiujin Xie et Na Liu, « Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi », Science, vol. 356, no 6343, , p. 1172–1175 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.aam9970, lire en ligne, consulté le ).
- (en) Julieta Genini, L. Patrícia C. Morellato, Paulo R. Guimarães et Jens M. Olesen, « Cheaters in mutualism networks », Biology Letters, vol. 6, no 4, , p. 494–497 (ISSN 1744-9561 et 1744-957X, DOI 10.1098/rsbl.2009.1021, lire en ligne, consulté le ).
- (en) K. R. Foster et T. Wenseleers, « A general model for the evolution of mutualisms », Journal of Evolutionary Biology, vol. 19, no 4, , p. 1283–1293 (ISSN 1010-061X et 1420-9101, DOI 10.1111/j.1420-9101.2005.01073.x, lire en ligne, consulté le )
- (en) Teresa J. Clark, Colleen A. Friel, Emily Grman et Yair Shachar-Hill, « Modelling nutritional mutualisms: challenges and opportunities for data integration », Ecology Letters, vol. 20, no 9, , p. 1203–1215 (DOI 10.1111/ele.12810, lire en ligne, consulté le )
- Daniel H. Janzen, « Coevolution of Mutualism Between Ants and Acacias in Central America », Evolution, vol. 20, no 3, , p. 249 (DOI 10.2307/2406628, lire en ligne, consulté le )
- (en) Martin Heil, Domancar Orona-Tamayo, Sascha Eilmus et Stefanie Kautz, « Chemical communication and coevolution in an ant–plant mutualism », Chemoecology, vol. 20, no 2, , p. 63–74 (ISSN 0937-7409 et 1423-0445, DOI 10.1007/s00049-009-0036-4, lire en ligne, consulté le )
- (en)Janzen, D.H. (1980). When is it coevolution ? Evolution 34, 611-612.
- (en) Thompson, J.N. (1989). Concepts of coevolution. Trends in Ecology and Evolution 4, 179-183.
- Robert Barbault, Écologie des peuplements. Structure, dynamique et évolution, Masson, , p. 89
- Evolution of plant resistance to mutiple herbivores : quantifying diffuse coevolution, Iwao & Rauscher, The American Naturalist, février 1997, vol. 149, no 2
- communauté d’herbivores
- Robin A. Bingham et Anurag A. Agrawal, « Specificity and trade-offs in the induced plant defence of common milkweed Asclepias syriaca to two lepidopteran herbivores », Journal of Ecology, vol. 98, no 5, , p. 1014–1022 (ISSN 0022-0477, DOI 10.1111/j.1365-2745.2010.01681.x, lire en ligne, consulté le )
- Coevolution of Male and Female Genital Morphology in Waterfowl, Brennan & al, PLos One, 2 mai 2007
- Voir aussi (en) Gene-culture translation in the avoidance of sibling incest
- Cité par Jean Gayon, in L’évolution culturelle : théories et modèles, L’Origine des Cultures / Le Pouvoir des réseaux, Les Grands Dossiers de Sciences Humaines, no 1, décembre 2005 / janvier-février 2006
- Cultural Selection and Genetic Diversity in Matrilineal Whales, Hal Whitehead, Science 27 novembre 1998, vol. 282, no 5394, p. 1708-1711
Voir aussi
Articles connexes
Liens externes
- Web-conférence de Claudes Combes sur la coévolution et l’Homme
- (en) John N. Thompson, Evolutionary ecology and the conservation of biodiversity, Elsevier Science, 7 juillet 1996, vol. 11.