Coévolution antagoniste
En écologie évolutive, la coévolution antagoniste peut se définir comme étant les conséquences évolutives des interactions écologiques de types hôtes/parasites, proies/prédateurs et de compétition. On peut définir la coévolution comme « un changement évolutif dans un trait des individus d'une population qui survient en réponse à un trait des individus d'une deuxième population et provoque une réaction évolutive de celle-ci »[1].
Modèles expérimentaux
Course aux armements
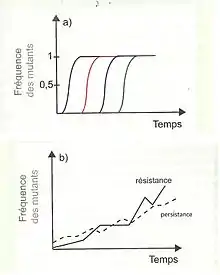
La lutte évolutive oppose une espèce persistante (qui "attaque") à une espèce résistante (qui se "défend"). Notons cependant que dans le cas de la coévolution antagoniste des sexes, les partenaires sont issus de la même espèce (le plus souvent, le sexe persistant est le mâle et le sexe résistant la femelle), il s'agit alors d'une lutte intra-spécifique et inter-sexuelle.
Évolution des fréquences alléliques
Dans une population (persistante ou résistante) :
- Apparaît un allèle X conférant aux individus un avantage par rapport à leurs semblables face à l’adversaire (innovation X). Au cours des générations, cet allèle est sélectionné et va donc se répandre dans la population jusqu’à l’envahir complètement (fréquence(X) tend vers 1).
- Apparaît ensuite un allèle Y conférant de même un avantage. Il sera sélectionné de la même façon.
Il en découle une succession de vagues sélectives au cours desquelles des allèles s’imposent dans la population qui acquiert ainsi de nombreuses innovations.
En parallèle, dans la population antagoniste :
- L’allèle X entraîne l’émergence d’un allèle X’ conférant une résistance à l’innovation X. La mise en place de la réponse prend un certain temps, ce qui explique le temps de latence observé entre l’apparition de X et X’.
- De même pour Y et les autres innovations à venir.
Chaque nouveau trait sélectionné va s’ajouter aux traits sélectionnés ancestralement afin que l'individu reste le plus performant possible face à l’antagoniste contemporain. La combinaison de ces traits confère un avantage au mutant, qui s’impose dans la population, donc diminue la diversité génétique.
Coûts énergétiques liés aux innovations
On appelle persistance, l’intensité de la pression exercée par l’espèce persistante sur l’espèce résistante. On appelle résistance, l’intensité avec laquelle l’espèce résistante pare les offensives de l’espèce persistante. La mise en place et le maintien de l’ensemble des innovations est coûteux en énergie pour l’individu, puisque c’est autant d’énergie qui n’est pas allouée aux autres traits d'histoire de vie. Comme le nombre d’armes va croissant, il y a augmentation de la persistance. En réponse à cela, la résistance croît aussi.
Cette escalade évolutive, entre persistance et résistance, s’accompagne de coûts de plus en plus importants. Lorsque les limites physiologiques de l’organisme ne lui permettent pas d’allouer davantage dans l’attaque ou la défense, l’apparition de nouvelles innovations n’est plus possible. On peut alors observer différents scénarios :
- Les allèles mutants se fixent définitivement dans la population en éliminant les anciens génotypes (le polymorphisme des gènes est transitoire).
- Le polymorphisme se maintient (conservation des allèles rares), offrant la possibilité d’un recyclage des allèles rares. La course aux armements débouche alors sur une dynamique de type Reine Rouge.
Modèle de la Reine Rouge et NFDS (negative frequence-dependent selection)[2]

Ce modèle proposé par Leigh Van Valen en 1973, utilise l’image d’Alice et la reine Rouge, dans le conte « De l’autre côté du miroir » de Lewis Caroll, où les espèces sont entraînées dans une course à l'adaptation pour pouvoir « rester à la même place » l’une par rapport à l’autre. La Reine Rouge qualifie donc une interaction de coévolution antagoniste à l’équilibre.
Évolution des fréquences alléliques
Dans ce modèle alternatif, le maintien du polymorphisme se traduit par une sur-représentation des allèles qui confèrent un avantage sélectif et donc une sous-représentation des allèles moins avantageux.
Ainsi, si l’allèle X confère un avantage à l’individu persistant, alors il sera sélectionné et donc les porteurs de cet allèle seront majoritaires dans la population. En conséquence, dans la population résistante, les individus porteurs de la résistance X’ seront sélectionnés (car la population résistante s’adapte aux traits les plus représentés dans la population persistante).
Par conséquent, la pression de sélection exercée par la population résistante sera plus forte envers les phénotypes largement représentés d’individus persistants. À l’inverse, les phénotypes rares d’individus persistants connaissent peu de résistance de la part de la population résistante. La faible pression de sélection sur les allèles rares Y entraînera l’augmentation de leur fréquence dans la population alors que les allèles les plus représentés seront contre-sélectionnés (sélection fréquence-dépendante négative). Après un temps de latence, l’allèle Y’ résistant sera à son tour sélectionné, et le rapport de force s’inversera, créant des oscillations périodiques au cours du temps.
Coûts énergétiques liés aux innovations
Dans une population donnée, à chaque temps, il y autant « d’armes » : au temps t1, la somme des X et des X’ est égale à la somme des X et des X’ à t2... Autrement dit, la persistance et la résistance sont stables au cours du temps.
À la différence de la course aux armements, les allèles contre-sélectionnés sont recyclés et remobilisés au cours du temps, ce qui diminue les coûts.
Time-shift experiments[3]
Ce type d’expérience a pour objectif de déterminer si on a affaire à une coévolution de type course aux armements ou Reine Rouge. L’idée est de comparer l’infectivité d’un parasite (la résistance d’un hôte) face à des hôtes (parasites) qui lui sont contemporains ou issus d’une génération asynchrone (antérieure ou future). Cela suppose d’avoir accès à différentes générations d’hôtes/parasites (congélation, réactivation de stades dormants…).
Patterns de coévolution
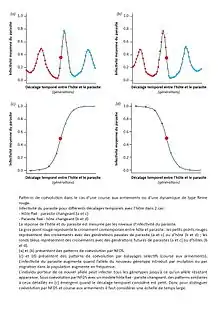
La figure présente les résultats de l’expérience. En (a) on compare la résistance d’un hôte H face à :
- Un parasite qui lui est contemporain (gros rond rouge)
- Des parasites du futur (petits ronds bleus)
- Des parasites du passé (petits ronds rouges)
(Le présent, le futur et le passé sont définis relativement à l’hôte H.) L’infectivité moyenne des parasites permet d’évaluer à la fois la virulence du parasite et la résistance de l’hôte. On voit que la résistance de H aux parasites futurs suit des oscillations (résistance diminuée dans un futur proche, puis en hausse etc.). De même pour la résistance aux parasites du passé. Ce type de résultat caractérise une dynamique de type Reine Rouge.
Dans le graphe (b) c’est le parasite qui est « fixé » (on compare sa virulence face à des hôtes du passé, du présent et du futur). On a aussi une dynamique de type Reine Rouge.
Dans le graphe (c) où l’hôte est « fixé », on observe que l’hôte est :
- Plus résistant face aux parasites du passé que face aux parasites contemporains
- Moins résistant face aux parasites du futur que face aux parasites contemporains
Ceci indique un gain de virulence des parasites, qui s’adaptent à leur hôte avec un certain décalage temporel (« time-lagged adaptation »). Ce gain de virulence est lié à l’apparition d’un nouvel allèle de virulence qui augmente en fréquence et « contamine » tous les génotypes. Il est à noter que si l’on considère un temps de décalage court entre hôte et parasite, les patterns observés dans les cas (a) et (c) sont similaires. Il faut donc considérer une large gamme de générations pour pouvoir trancher entre course aux armements et NFDS.
Application : expérience historique de Buckling et Rainey (2002)[4]
.jpg.webp)
Étude de la coévolution entre la bactérie Pseudomonas fluorescens et son phage. Les auteurs ont voulu comparer la performance de la bactérie face au phage contemporain et à des phages provenant d’une autre génération asynchrone (obtenus par congélation). Ils ont pour cela réalisé différentes combinaisons bactérie-phage :
- Bactérie + phage ancestral
- Bactérie + phage contemporain
- Bactérie + phage du futur
Dans chaque cas, ils ont suivi l’évolution de la résistance bactérienne au cours du temps.
Cette expérience a été débutée avec un seul génotype (toute variabilité génétique est donc générée de novo par mutation). Du fait de l’absence de variabilité génétique initiale, l’expérience devait nécessairement évoluer (au moins au début) par balayages sélectifs (car une dynamique NFDS suppose d’avoir plusieurs génotypes de fréquences déséquilibrées). Cela se vérifie par les résultats observés :
- Les auteurs ont observé que les bactéries résistantes à leur phage contemporain étaient toujours résistantes aux phages ancestraux, ce qui témoigne d’une adaptation des bactéries au phage avec lequel elles coévoluent (gain de résistance au cours du temps).
- De même, les phages, quelle que soit leur génération, étaient tous capables d’infecter la bactérie ancestrale, ce qui prouve qu’ils gagnent en virulence avec le temps.
Ainsi, en moyenne, la résistance bactérienne et l’infectivité des phages augmentent avec le temps : on met donc en évidence une course aux armements.
Mise en évidence biologique des conflits
Autour de la coévolution antagoniste s’articulent différents types d’interactions conflictuelles de type course aux armements, soit entre deux espèces, soit chez la même espèce. Le conflit peut être symétrique (les pressions de sélections en jeu sur les espèces vont dans la même direction, c’est-à-dire que les antagonistes ont le même but) ou asymétrique (qui implique des sélections de pression contrastées, autrement dit leurs buts sont exclusifs l’un de l’autre)[5].
Interspécifique symétrique
D’après le principe d’exclusion, la compétition entre deux individus d’espèces différentes pour la même ressource limitante mène l’une à exclure l’autre de la niche écologique. L’espèce exclue évolue soit vers une autre niche écologique (divergence évolutive) soit vers l’extinction.
Intraspécifique symétrique
Deux individus de la même espèce convoitent une même ressource. Exemple de compétition dans le conflit sexuel : deux mâles convoitent la même femelle.
Hôte/parasite
Une interaction asymétrique s'observe notamment dans le cadre d'un interaction hôte/parasite. Course aux armements : Apparition de parasites de plus en plus virulents et d’hôtes de plus en plus résistants. Les nouveaux mutants sont plus performants que les anciens face à tous les adversaires et se fixent donc dans la population en éliminant de façon définitive tous les anciens génotypes (polymorphisme génétique transitoire). On a donc une succession de balayages sélectifs et une augmentation régulière de la résistance moyenne des hôtes et de la virulence moyenne des parasites.
Cette escalade évolutive crée une grande intimité entre l’hôte et son parasite. En effet, au cours de la coévolution, le parasite se spécialise pour son hôte. De plus l’acquisition des traits liés au parasitisme s’accompagne de la perte des traits propres à la vie libre. Donc plus le temps passe et plus le parasite devient dépendant de son hôte. La coévolution est donc un processus à sens unique (impossible pour un parasite d’évoluer vers une forme libre).
Prédateur/proie[6]
L’interaction entre proie et prédateurs est soumise à deux forces opposées : le prédateur sur la proie et la proie sur le prédateur. Les forces de sélection en jeu dans cette interaction sont asymétriques : la sélection sur la proie est plus forte que celle sur le prédateur. En effet, les conséquences de l’interaction entre la proie et le prédateur ne sont pas les mêmes : La proie joue sa vie tandis que le prédateur joue son repas, il peut capturer la prochaine proie. C’est ce qu’on appelle le principe de life-dinner ("vie-diner"). De cette asymétrie résulte une évolution plus rapide de la proie par rapport au prédateur. Dans ce type d’interaction, un changement évolutif bénéfique pour l’un a toujours un coût pour l’autre.
Le mimétisme est une stratégie couramment adoptée autant par les prédateurs que par leurs proies. Les prédateurs peuvent utilisés le mimétisme agressif tandis que les proies adopteront plutôt un mimétisme batésien ou mullérien.
Les prédateurs peuvent réguler eux-mêmes la dynamique de population de leurs proies en oscillant entre différents types de proies selon leurs abondances. En réponse à ce type de prédation, les proies vont développer un polymorphisme afin de paraître moins abondante.
Plante/insecte
Les insectes phytophages se nourrissent de matières végétales. Certains sont généralistes ou polyphages, ils peuvent se nourrir d’une grande variété d’ordres de plantes. D’autres sont spécialistes : les oligophages se nourrissent de plante d’une seule et même famille et les monophages se nourrissent d’une seule espèce de plantes[7]. Les insectes polyphages n’exercent pas assez de forces de sélection sur les plantes pour provoquer une réponse. En revanche, les insectes spécialisés dans certains types de plantes exercent une pression de sélection suffisante pour entrainer l’apparition de défenses des plantes contre les herbivores[8].
Pour pouvoir continuer à exploiter les plantes comme ressources alimentaire, les insectes ont dû développer des moyens pour contourner ces défenses comme des adaptations morphologiques, des évolutions comportementales ou la détoxification des produits chimiques[9].
La capacité d’un insecte à utiliser une plante toxique lui confère un avantage sélectif puisque cela lui permet d’utiliser une niche écologique peu exploitée donc où il y a moins de compétition.
Intraspécifique asymétrique

On prend ici l’exemple de la coévolution antagoniste dans le cadre sexuel.
La coévolution antagoniste dans le cadre de la sélection sexuelle repose, en écologie évolutive, sur les différences de stratégies reproductives entre mâles et femelles pouvant entraîner des adaptations pour la reproduction chez un des deux sexes afin de favoriser leur fitness au détriment de l’autre. En réponse à cela, l’autre sexe tentera de s’adapter pour le contrer[10]. Le conflit sexuel potentialise la coévolution antagoniste sexuelle mais ne lui est pas équivalent[11].
La sélection sexuelle découle de l’anisogamie. En effet, le mâle produit de nombreux gamètes de petite taille tandis que la femelle en produit moins mais de plus grosse taille. Ceci indique que les mâles trouveront davantage d’intérêt à multiplier les partenaires que les femelles[12]. L’élément femelle devient donc ici le facteur limitant lors de la reproduction. Les optima de fitness entre mâle et femelle sont donc différents pour une même activité (accouplement, investissement parental...). Dans ce cas, le conflit sexuel est asymétrique[11](figure Holland & Rice 1998)[13].
Cette coévolution antagoniste commence par un sexe (généralement le mâle) qui, afin d’assurer ses chances de reproduction, développe un certain trait augmentant sa fitness et, indirectement, réduisant celle de la femelle. Pour contrebalancer le trait désavantageux, la femelle développera un trait résistant, entraînant les 2 sexes dans une course aux armements, mettant en scène un mâle persistant (pénétration forcée, sperme toxique, dards d’amour…) et une femelle résistante.
La sélection sexuelle encourage donc une coévolution antagoniste entre des gênes influençant le succès reproducteur du mâle et la résistance de la femelle.
Les conflits peuvent être de deux sortes :
Précopulatoire
Les intérêts tournent essentiellement autour du choix du partenaire et de la résistance de la femelle.
D’après le modèle de Chase-away[13], cela se traduit par deux aspects :
- L’exploitation sensorielle encourageant le dimorphisme sexuel : la femelle ayant besoin de moins d’accouplements que les mâles qui cherchent à disséminer, elle devient le sexe limitant et a donc le choix. D’après la théorie de la sélection sexuelle (Darwin 1871), les mâles deviendront compétiteurs pour la ressource femelle (sélection intra-sexe) et développeront alors des stratégies pour gagner ses faveurs, soit par l’évolution d’armes pour se combattre entre compétiteurs soit par le développement d’ornements. Ils peuvent ainsi avoir recours à des caractères sexuels secondaires désavantageux face à la prédation (diminution de la survie) mais avantageux pour la reproduction (préférence de l’ornement par la femelle).
- La résistance de la femelle face au biais sensoriel : si les mâles utilisent la préférence pour l’ornement en trichant (les signaux ne sont pas honnêtes, ils ne rendent pas compte de la qualité du reproducteur ni de sa fitness dans l’environnement), la femelle se verra développer une résistance à ces traits.
Postcopulatoire
1. Adaptation spermatique et sélection
L’intérêt du mâle concerne principalement le nombre de rapports et l’efficacité de son sperme. En effet, il est plus avantageux pour un mâle de se reproduire plusieurs fois avec les femelles, tout en s’assurant que les autres mâles n’aient pas accès aux mêmes femelles. Afin d’augmenter sa fitness, il peut donc avoir recours à un sperme de plus en plus performant, capable de détruire le sperme de ses prédécesseurs. Ce phénomène, observé chez les drosophiles et décrit par Rice en 1996[10], s’accompagne aussi de la production de protéines séminales ayant un effet néfaste sur la fitness de la femelle (toxicité et/ou diminution du nombre de rapports futurs).
La femelle, quant à elle, peut produire des phénotypes résistants comme des enzymes capables de détruire le sperme du mâle. L’objectif de la femelle n’est pas ici de ne plus être fécondée, mais de « sélectionner » le mâle, en fonction du niveau de compétitivité[14].
2. Fitness et descendance
- Effets paradoxaux entre survie et fitness chez la femelle manipulée
Dans un modèle classique de « Chase-away »[13], la femelle évolue en réponse à un mâle manipulateur afin de le contrer. Or, on a pu constater des cas[15] où la femelle « se laisse faire » par le mâle manipulateur, ce qui, apparemment, semble réduire sa fitness via son espérance de vie. Pour ces femelles, avoir des descendants mâles possédant des traits manipulateurs, donc plus à même de transmettre les gênes maternels et paternels à leur propre descendance, représente un avantage. La fitness du gène (via la descendance) serait plus importante que la fitness de la femelle elle-même[15].
Les femelles peuvent aussi résister afin d’augmenter les chances de sélectionner le mâle et ainsi avoir des filles qui feront de même, cela augmentant la fitness des femelles dans la lignée[15].
Un des aspects fondamentaux du conflit sexuel repose sur « l’éducation » des enfants par un des parents, le plus souvent la femelle. En effet, la prise en charge de la descendance par un des sexes permet à l’autre de passer plus de temps à se reproduire. Il est donc important à la fois pour la survie des jeunes mais aussi pour la fitness du géniteur, que l’autre parent puisse s’en occuper/les protéger.
En conséquence, d’après l’exemple des Diamants mandarins[16] dans les couples où les deux parents s’investissent, la part de chacun est beaucoup plus faible que si la femelle élève seule la descendance. Une explication serait ici d’une part un conflit d’intérêts sexuel (les deux parents se déchargent l’un sur l’autre afin de limiter l’impact sur leur propre fitness) et par ailleurs que la mère seule s’occupant davantage de ses oisillons augmente leur chances d’être plus attirants à l’âge adulte, donc augmente les chances de transfert de ses gènes, augmentant indirectement sa propre fitness.
Devenir de la coévolution antagoniste
La coévolution antagoniste, coûteuse en énergie, va pouvoir se stabiliser en évoluant vers d'autres types d'interactions :
- Cycle : hypothèse NFDS
La course aux armements suppose une allocation d’énergie sans cesse croissante à l’attaque/la défense. C’est autant d’énergie qui ne sera pas allouée aux autres fonctions vitales (notion de trade-off). Par conséquent la course aux armements ne peut se poursuivre indéfiniment. Il arrive un moment où l’allocation d’énergie supplémentaire à l’attaque/la défense entraîne un sacrifice vis-à-vis des autres traits de vie qui résulte en une baisse de la fitness. Le plus souvent, la dynamique de coévolution se transforme alors en une dynamique type Reine Rouge.
- Coévolution mutualiste
Après un certain nombre de générations, la relation très spécifique antagoniste peut se traduire par une persistance/résistance de moins en moins agressive et donc tendre vers du mutualisme. Dans la nature, on observe des relations ambiguës entre ces deux extrêmes. Par exemple, on qualifie généralement les interactions insectes-plantes comme étant du mutualisme : la plante offre son nectar en contrepartie du transfert de son pollen à d’autres plantes via le pollinisateur. Cependant, cela pourrait aussi s'apparenter à une conséquence de la course aux armements qui sélectionne les plantes maximisant le profit du transfert de pollen par rapport au coût de production de nectar tandis que les insectes sont sélectionnés selon leur efficacité et leur rapidité dans la récolte du nectar. L’insecte et la plante atteignent ainsi un état optimal et stable.
Cas particulier de la monogamie
Des études[17] ont montré que l’espérance de vie de la femelle, ainsi que le taux net de reproduction (nombre de descendants arrivant à l’âge adulte par femelle) étaient augmentés dans des relations monogames créées artificiellement. Le mâle et la femelle co-évoluent donc en trouvant des optima compatibles. Dans le cas de la monogamie, les partenaires investissent autant dans la survie et le bien-être de leur partenaire qu’en eux-mêmes[14], montrant une forme particulière de coévolution mutualiste.
- La "victoire" de l'un des antagonistes[18]
Plus radicalement, on pourrait penser que la course aux armements s’arrête lorsque l’un des partis tend à diminuer tellement la fitness de l’autre qu’il finit par l’éradiquer totalement. Mais cela reviendrait alors à provoquer sa propre perte, comme dans le cas d’un parasite sans hôte ou d’une population de mâles sans femelles. La « virulence » du trait persistant ou résistant doit donc être modérée pour que l’interaction soit durable.
Articles connexes
Notes et références
- Janzen D. H. (1980) When is it coevolution ? Evolution, Vol. 34(3):611-612
- Thomas, Lefèvre, Raymond (2010) Biologie évolutive. Édition De Boeck : Bruxelles. p. 635-636
- S. Gaba et D. Ebert(2009) Time-shift experiments as a tool to study antagonistic coevolution. Trends in Ecology and Evolution. Vol24(4): 226-232.
- Buckling A. and Rainey P. B. (2002) Antagonistic coevolution between a bacterium and a bacteriophage. Proceedings of the Royal Society of London B. Vol. 269(1494): 931-936.
- Dawkins, R. & Krebs, J. R. (1979) "Arms races between and within species". Proceedings of the Royal society of London B 205: 489–511.
- Brodie E. D. III and Brodie E.D. Jr. (1999) Predator-Prey Arms Races. Bioscience Vol 49(7): 557-568.
- Nicolas Sauvion, Paul-André Calatayud, Denis Thiéry, Frederic Marion-Poll. (2013) Interactions insectes-plantes. Quae 784.
- Bernays E. A. and Chapman R.F. (2000). Plant secondary Compounds and Grasshoppers : Beyond Plant Defenses. Journal of Chemical Ecology. Vol 26 (8): 1773-1794.
- Dussourd D.E. and Eisner T.(1987) Vein-cutting behavior : insect counterploy to the latex defense of plants. Science (Washington D.C.) Vol 237: 8986-901.
- Rice W. (1996) Sexually antagonistic male adaptations triggered by female evolution. Nature 381 : 232-234.
- Parker G.A. (2006) Sexual conflict over mating and fertilization: an overview. Philosophical Transaction of the Royal society of London B: Biological Sciences 361(1466): 235–259.
- Darwin C. (1871) The Descent of Man, and Selection in Relation to Sex. Vol 1, 1er edn John Murray, London.
- Holland B.& Rice W. (1998) Perspective: Chase-Away Sexual Selection: Antagonistic Seduction Versus Resistance. Evolution, 52(1): 1-7.
- Gangestad S. W. (2003) Sexually antagonistic coevolution : theory, evidence and implications for patterns of human mating and fertility. In Offspring : Human fertility behaviour in biodemographic perspective. Issue 8.1er edn. National academic press, Washington DC. K.W. Watcher and R. A. Butalo.
- Cordero & Eberhard (2003) Female choice of sexually antagonistic male adaptations: a critical review of some current research. Journal of evolutionary biology 16: 1-6.
- Royle N.J., Hartley I. R., Parker G.A. (2002) Sexual conflict reduces offspring fitness in zebra finches. Nature 416: 733-736. doi:10.1038/416733a.
- Holland & Rice (1999) Experimental removal of sexual selection reverses intersexual antagonistic coevolution and removes a reproductive load. Proceedings of the National Academy of Sciences of the United States of America. 96: 5083-5088.
- Dawkins R. and Krebs J.R. (1979) Arms race between and within Species. Proceedings of the Royal Society of London B, Biological Sciences, Vol. 205 (1161): 489-511.