Clonage
Le clonage désigne principalement deux processus. C'est d'une part la multiplication naturelle ou artificielle à l'identique d'un être vivant, c'est-à-dire avec conservation exacte du même génome pour tous les descendants (les clones). C'est donc un synonyme de certaines formes de multiplication asexuée telles que le bouturage. C'est d'autre part la multiplication provoquée d'un fragment d'ADN par l'intermédiaire d'un micro-organisme. Ainsi, en biologie, le mot clonage désigne plusieurs choses :
- d'une part, le fait de reproduire des organismes vivants pour obtenir des êtres génétiquement identiques ; ceci peut s'appliquer à de simples cellules (clonage cellulaire, par prélèvement d'une seule cellule, qui est mise en culture de manière individuelle) ou bien à des animaux – donc y compris les êtres humains – et des végétaux (clonage reproductif, bouturage). L'ensemble de ces cellules, ou individus, forme un seul et même clone (tant que le patrimoine génétique est identique) ;
- d'autre part, une technique de biologie moléculaire qui consiste à isoler un fragment d'ADN et à le multiplier à l'identique en l'« insérant » dans une molécule d'ADN « porteuse » appelée vecteur permettant son amplification. Cette technique de biologie moléculaire peut être utilisée pour un clonage partiel, ne portant que sur un fragment de matériel génétique (ADN), mais aussi pour le clonage d'un gène entier permettant la production de la protéine recombinante correspondante. L'« insertion » est souvent réalisée à l'aide d'un vecteur, les plus communément utilisés étant les virus ou les plasmides (petites molécules d'ADN cycliques).
Au sens scientifique, le clonage est l'obtention d'un être vivant génétiquement identique à l'original qui a fourni son génome.
Des vrais jumeaux, monozygotes, chez les animaux et chez l'Homme sont des clones naturels. Ils démontrent à la fois les ressemblances et les différences que l'on peut attendre chez des clones artificiels, en raison du contexte différent où ils peuvent être placés (alimentation, traitement différents par l'éleveur ou les parents, etc.).
Le terme clone est utilisé pour la première fois en 1903 par le botaniste H. J. Webber en désignant des plantes reproduites par multiplication asexuée. Ce mot sera ensuite réutilisé par J. B. S. Haldane.
Clonage naturel
Dans la nature, le clonage n'est rien de plus qu'un mode de reproduction parmi tous ceux à la disposition des êtres vivants. C'est même le plus répandu puisqu'il concerne toutes les cellules procaryotes (division), presque tous les eucaryotes unicellulaires (mitose) à l'exception de ceux qui pratiquent la reproduction sexuée (faisant intervenir la méiose), mais également de nombreux végétaux et animaux multicellulaires.
Le clonage peut être naturel chez les plantes (fraisier, ail, etc.); il est dans ce cas le plus souvent appelé multiplication végétative. Il a lieu par émission de rejets, par marcottage naturel, par division naturelle de rhizomes ou de stolons, par création d'organes spécialisés bulbilles, etc.
Certaines espèces végétales émettent des rejets, comme l'olivier. Lorsque l'ortet initial vieillit, il émet des rejets sur le pourtour de sa souche. Ces ramets deviennent ensuite autonomes et se séparent entre eux lors de la disparition de la souche initiale avec le temps. D'autres, comme les fraisiers, produisent des stolons, rameaux dont le bourgeon terminal s'enracine au contact d'un substrat favorable et reproduit ainsi, par marcottage naturel, une plante identique à la plante mère. Par bouturage naturel des morceaux de plante peuvent repousser s'ils se retrouvent placés dans de bonnes conditions, et redonner une plante adulte complète.
Clonage artificiel
Clonage végétal
En horticulture et en culture, les techniques de reproduction des plantes par clonage peuvent être pratiquées en laboratoire, sous serres ou sur le terrain. Elles sont applicables chez beaucoup de dicotylédones produisant des méristèmes en abondance et sur quelques monocotylédones également (le bananier peut se multiplier par rejets, la canne à sucre par bouturage). On peut citer le greffage, le bouturage et d'autres techniques cette fois inspirées de la multiplication végétative naturelle : (le marcottage, le démariage de rejets ou la division de rhizomes et de stolons, etc.).
En laboratoire, on pratique la culture in vitro de méristèmes (ou d'autres parties de la plante) produisant des embryons puis des plantules complètes (voir embryogenèse somatique et embryogenèse zygotique). Les techniques in vitro sont les seules qui peuvent être employées pour des monocotylédones comme le palmier dattier, le palmier à huile. Les producteurs parlent de « vitroplants »[1].
Le comportement et la forme des clones peuvent différer selon la partie de la plante d'où sont extraites les cellules destinées à les produire. Par exemple, chez les fraisiers des bourgeons adventifs stipulaires ou donnent des fraisiers à feuilles plus claires et plus rondes. Ils présentent un métabolisme différent, un nombre plus élevé de stolons, un réceptacle floral plus court, des étamines aux anthères plus grosses, alors que le clone axillaire est, lui, moins bien pollinisé et produit pour cette raison des fruits plus souvent difformes, notamment en l'absence d'agents pollinisateurs[2].
Le clonage végétal a déjà permis de réinsérer des espèces disparues. Comme la Cylindrocline lorencei qui a pu être réimplantée par le conservatoire botanique national de Brest en 2007, à partir de vieilles semences[3].
Clonage animal
Dans le domaine animal, un pas est franchi au XXe siècle grâce au clonage à partir de noyaux de cellules différenciées, réimplantés dans des ovocytes préalablement énucléés. Cette technique au taux de réussite encore faible et qui n'a abouti que chez quelques espèces en est à ses balbutiements. Des problèmes de vieillissement accéléré semblent pouvoir être reliés à l'état des télomères.
La technique du clonage par implantation d'un noyau dans un ovocyte énucléé est mise au point en 1952 par Briggs & King[4]. Ils introduisent un noyau provenant de la blastula d'une grenouille dans un ovocyte dont le noyau a été éliminé. Le stade blastula étant issu du développement embryonnaire précoce des vertébrés, il a fallu attendre 10 ans de plus pour voir l'avènement du premier organisme cloné à partir d'un noyau de cellule différenciée. En effet, en 1962, Gurdon introduit le noyau d'une cellule intestinale de têtard dans un ovocyte énucléé de Xénope et obtient des amphibiens viables et fertiles[5].
Au début des années 1960, l'embryologiste chinois Tong Dizhou, fut le premier à cloner un poisson à partir du noyau d'une cellule d'embryon. Il publia ses recherches dans un magazine scientifique chinois qui ne semble pas avoir été traduit à l'époque[6]. C'était 33 ans avant la brebis Dolly, mais Dolly, elle, fut clonée à partir d'une cellule provenant d'un individu adulte.
Cette technique a permis de cloner les animaux suivants :
- 1952 : clonage de grenouille à partir de cellules de blastula.
- 1962 : clonage de Xénope à partir de cellules intestinales de têtard.
- Poisson rouge : 1963, premier clone artificiel issu de cette technique.
- 1983 : clonage du premier mammifère, le rat Masha par des experts soviétiques[7].
- Dolly, une brebis, premier mammifère cloné à partir d'une cellule spécialisée en 1996 (et née le ). Elle est euthanasiée en 2003 à la suite d'une maladie pulmonaire qu'ont les brebis normalement à 11 ou 12 ans.
- « Cumulina », une souris clonée en 1997.
- « Marguerite », une vache, clonée par l'INRA en 1998.
- « Millie », « Christa », « Alexis », « Carrel » et « Dotcom », 5 petits cochons, clonés en .
- « Noah », un Gayal (une espèce de bœuf sauvage, premier clone d'animal en voie d'extinction), en .
- taureaux:
- « Carbon Copy », ou Copie carbone un chat, cloné fin 2001.
- souris : 2002
- Six lapins, clonés en 2002 par l'INRA.
- « Idaho Gem », « Utah Pioneer », « Idaho Star », trois mules, clonées en 2003.
- daim : 2003
- « Prometa », une jument, clonée en 2003.
- « Ralph », le rat, cloné en 2003
- drosophile : 2004
- « Little Nicky », en 2004, un chat, premier clone produit à but commercial.
- Le docteur Hwang annonce avoir cloné la première cellule humaine, mais quelques mois plus tard il est obligé d'avouer la supercherie.
- « Snuppy », un chien, cloné en 2005 en Corée du Sud par le controversé docteur Hwang.
- « Paris Texas », un cheval, cloné en 2005.
- Une souris congelée depuis 16 ans à −20 °C est clonée : treize souriceaux ont vu le jour en 2008[8].
- « Injaz », le premier dromadaire, est cloné le .
- Le professeur sud-coréen Park Se-Pill clone en 2010 une cellule congelée d’une vache noire aujourd’hui décédée.
- Des coyotes en 2011 en Corée du Sud par le controversé docteur Hwang.
- Les tout premiers clones issus d'animaux clonés naissent en Corée du Sud en [9]
- Début 2018 : les premiers primates, deux macaques crabiers, sont clonés en Chine par la même méthode que pour Dolly[10] - [11].
- Fin 2019, un groupe de l'université d'État de Pennsylvanie a publié 70 % du génome de mammouth laineux, donnant accès aux données les plus élémentaires nécessaires à la "fabrication" d'un mammouth[12].
Toutes ces expériences ont montré que le clonage des mâles est en général plus délicat que celui des femelles. De plus, pour des raisons encore inconnues, seuls 5 à 10 % des œufs fabriqués et réimplantés produisent des clones viables ou en bonne santé apparente. On ne comprend pas non plus pourquoi certaines cellules d'un organisme se clonent mieux que d'autres.
Un second pas est franchi avant le nouveau millénaire par le clonage de seconde génération (obtention d'organismes clonés à partir d'autres organismes clonés) sur des souris, puis un taureau.
En 2007, il existe près d'un millier de cochons clonés et près de 3 000 bovins[13].
Les clones ne sont pas des copies conformes
Seul le matériel génétique du noyau est transféré lors d'un clonage. L'ADN mitochondrial reste celui de la cellule réceptrice tout comme la machinerie nécessaire à la transcription de l'ADN pendant les premières phases du développement embryonnaire. Une autre source de variation est la régulation épigénétique. L'épigénétique conserve une même séquence ADN mais en modifiant l'expression de certains gènes en régulant la condensation de l'ADN (modifiant la production de protéines entre autres effets), ceci permet par exemple aux différentes cellules humaines de devenir des cellules différenciées sans modifications de leur séquence ADN. De même, des facteurs environnementaux peuvent modifier le devenir des embryons. En pratique les animaux clonés diffèrent sur plusieurs paramètres et sont moins ressemblants que de vrais jumeaux monozygotes (ayant le même patrimoine génétique)[13]. Cela est particulièrement visible en cas d'animaux tachetés, les taches du clone n'ayant pas de raison particulière de se trouver à la même place[14], marquant de façon visible que les deux animaux sont différents.
Le clonage moléculaire
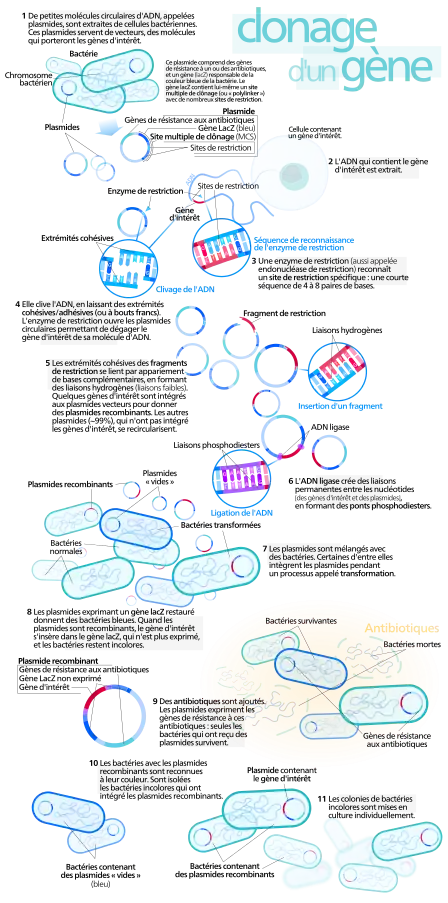
Lorsque l'on parle de clonage moléculaire cela fait référence à une technique de biologie moléculaire qui consiste a l'insertion d'un fragment d'ADN dans un vecteur. Le plus souvent le vecteur est de nature plasmidique. Un plasmide est un fragment d'ADN double brins et circulaire qui possède sa propre origine de réplication. Dans le domaine de la recherche biologique, les plasmides sont utilisés afin d'insérer des fragments d'ADN que l'on appelle gènes dans le but d'étudier leurs fonctions. Le clonage moléculaire est notamment utilisé pour restaurer la fonction d'un gène préalablement supprimé, muté ou rendu inactif. L'insert d'un gène peut également permettre la production de la protéine codée par celui-ci. Idéalement, cette production est contrôlée via des séquences dites d'induction telles que celles de l'opéron lactose. Différentes souches de Escherichia coli sont classiquement utilisées selon les étapes et les besoins.
Méthode par restriction ligation
La méthode la plus ancienne pour cloner des fragments d’intérêt appelé insert dans un vecteur plasmidique est l'utilisation des enzymes de restrictions. Ces enzymes sont purifiées à partir des organismes procaryotes[15]. Initialement se sont des enzymes qui servent a cliver l'ADN considéré comme étranger (par exemple l'ADN de virus infectant les bactéries, les bactériophages). Ce système de reconnaissance de l'ADN étranger chez les procaryotes a été détourné par les scientifiques pour en faire des outils de biologie moléculaire. Les enzymes de restrictions reconnaissent des courtes séquences d'ADN qui correspondent à leur domaine de fixation à l'ADN. Une fois fixées elles sont capables de couper l'ADN double brins de deux manières : i) coupure à bout franc, cela correspond a une coupure que l'on peut se représenter comme vertical du double brin d'ADN, l'extrémité 5' est positionnée au même niveau que l'extrémité 3', ii) coupure a bout cohésive, l'ADN double brin est coupé en forme d'escalier. Cela correspond à un brin 5' plus long que le brin 3'. La technique de clonage mise au point consiste dans un premier temps à l'amplification en PCR "Polymerase chain reaction" autrement appelé réaction de polymérisation en chaine du gène d’intérêt. Les amorces utilisées pour amplifier l'insert permettent d'ajouter aux extrémités de l'amplicon des sites de fixation des enzymes qui ont été préalablement choisies. Le choix des enzymes dépend de plusieurs facteurs. Il faut impérativement que les enzymes de restrictions ne soient pas présentes dans l'insert, ou sinon l'insert sera clivé. En revanche elles doivent être présentes dans le plasmide vecteur, mais ne doivent couper qu'une fois dans une zone dédiée à l'ouverture du plasmide, on parle de linéarisation du plasmide. La plupart du temps il existe des MCS "Multiple cloning sites" dans les vecteurs. Cela correspond à une zone ou il y a beaucoup de site d'enzyme de restriction unique pour le clonage. Après avoir purifié l'insert coupé avec les enzymes de restriction, ainsi que le plasmide linéarisé a l'aide des mêmes enzymes de restriction on peut cloner l'insert dans le vecteur en effectuant une ligation grâce à une enzyme appelé ligase. Le vecteur doit être préalablement déphosphorylé pour éviter une recircularisation du vecteur. En revanche l'insert doit être phosphorylé en 5' pour pouvoir être assemblé avec le résidu OH en 3' du vecteur.
Méthode de clonage par Gibson assembly
La technique de clonage par Gibson assembly[16] a été mise au point pour pallier les limites du clonage par restriction ligature. En effet la dépendance aux sites de restriction qui peuvent être naturellement présents dans les fragments à cloner peut rendre la tâche difficile. C'est pourquoi, cette technique de clonage est fondé sur le rajout de séquences complémentaires aux extrémités des amorces sur chaque fragments amplifié. Ces séquences sont ajoutées lors de la PCR et sont appelé "overlap". Le vecteur est linéarisé en PCR (ou en restriction) et on y ajoute entre 10 et 20 pb qui sont complémentaire du ou des fragments a cloner. On fait de même pour le ou les fragments à cloner. Chaque fragment d'ADN est ainsi orienté par sa complémentarité avec les autres fragments d'ADN en amont et en aval, cette complémentarité est unique ce qui permet d'assembler de nombreux fragments simultanément, de manière polarisé. Le clonage s’effectue in vitro, avec un mix d'enzyme : i) une exonucléase qui possèdent une activité 5', ii) Une polymérase qui a une activité en 3' et iii) Une ADN ligase. Avec cette technique on peut donc assembler de nombreux fragments dans un vecteur, de manière indépendante des enzymes de restriction.
Méthode de clonage TAR "Transformation-associated recombination"
Plus récemment les scientifiques ont été capables de cloner le génome complet de certain virus, comme le SARS-Cov-2[17]. Cette technique particulière de clonage est appelé clonage TAR pour "Transformation-associated recombination". Elle permet d'amplifier en PCR une multitude de fragments qui correspondent à la totalité du génome du virus. Chaque fragment amplifié est complémentaire de manière exclusive du fragment situé en amont et en aval, comme dans le principe du clonage par Gibson. Ce qui permet de polariser chaque fragment. Ce type de clonage repose sur la capacité des levures à reconstruire le génome sous la forme d'un très gros plasmide, appelé YAC "Yeast artificial chromosome". L'assemblage des fragments complémentaires les uns des autres est donc effectué par la levure elle-même. Le chromosome artificiel de levure est ensuite extrait de la levure sous la forme d'un très grand ADN circulaire correspondant a l'intégralité du génome viral.
Avantages
Le clonage, in vitro notamment permet – à faibles coûts – la création délocalisée de grands nombres d'individus. Il permet de recréer des plantes en voie de disparition, mais recherchées par les collectionneurs ou amateurs (ex : orchidées qu'il n'est alors plus nécessaire de prélever dans la nature pour les vendre par exemple). Plus important : il assure à la recherche que l'on va travailler sur des spécimens identiques, éliminant un facteur de bruit dans les mesures.
Controverses
L'utilisation croissante de clones dans l'agriculture et la sylviculture est source d'une importante perte de biodiversité, et par là de fragilisation d'espèces qui sont des ressources agricoles et pour l'élevage. Les plans issus de clones ou de greffes sont souvent à terme plus fragiles et sensibles aux épidémies de pathogènes, c'est un fait déjà noté, il y a presque 200 ans, par un fonctionnaire français François-Joseph Grille, qui, sans employer le vocabulaire des écologues modernes, protestait déjà contre l'appauvrissement génétique des populations d'ormes trop volontiers clonés et/ou greffés au détriment de la richesse adaptative que permet le semis :
« Les planteurs d'ormes se bornent trop souvent au moyen le plus facile, qui est de planter par rejeton et par éclats de racines ; mais ils en sont les dupes et ils n'obtiennent que des sujets rabougris qui ne rapportent presque rien. On distingue au premier coup-d'œil, à la beauté de leur port et à la vigueur de leur végétation, les ormes de semis, et ceux à feuilles étroites greffés sur sujets écossais, dans les plantations d'agrément, dans les parcs, et sur les pelouses qui environnent les maisons de campagne[18]. »
— François-Joseph Grille, Description du département du Nord
Cette homogénéisation génétique a effectivement peut-être contribué à la rapide explosion de la graphiose de l'Orme.
Des sylviculteurs tels que Akira Miyawaki ou l'école de sylviculture Prosilva ont développé des techniques visant au contraire à utiliser la biodiversité pour augmenter la résilience forestière, ce qu'encourage aussi l'écolabel forestier FSC.
Plusieurs rapports provenant d’agences de sécurité et en particulier de l’AFSSA, de l’AESA (Agence Européenne de Sécurité Alimentaire) et la FDA tentent d’établir des règles permettant de déterminer si les produits issus des clones sont sains ou non pour les consommateurs. Selon ces rapports, après six mois, un clone ne se distingue presque en rien qui soit mesurable des animaux contrôlés. Un vétérinaire appliquant les règles classiques permettant de déterminer si la carcasse d’un animal peut être introduite dans les circuits de consommation, donnerait apparemment sans hésiter son autorisation pour la consommation des carcasses des clones de plus de six mois. Cependant certains vétérinaires et scientifiques suggèrent que les clones ont une sensibilité un peu augmentée vis-à-vis de certaines maladies infectieuses, mais surtout qu’ils ne doivent pas être totalement sains étant donné leurs débuts souvent difficiles dans la vie[19]. Jean-Louis Peyraud, chercheur à l'Institut national de recherche agronomique a déclaré : «Des cas de veaux à trois pattes ou d'animaux à deux têtes ont été rapportés»[20]. Toutes ces observations ont conduit la FDA et l’AESA à publier, en 2008, chacune un rapport sur les risques alimentaires de la consommation des produits issus des clones, après avoir pris en compte les avis des représentants de la société civile. Les deux organisations ont alors conclu que rien ne pouvait faire supposer que la consommation de produits issus du clonage comporte un risque alimentaire, mais que cependant cette observation ne reposait pas sur assez de données et qu'il serait souhaitable d'augmenter les études sur le clonage[19].
En 2020, la viande issue d'animaux ayant été clonés est de plus en plus fréquente, elle est légale dans certains pays comme les États-Unis, où la Food and Drug Administration (l'Agence américaine du médicament et de l'alimentation) a déclaré que la consommation de lait et viande produites par des animaux clonés était sans risque. Le Brésil et le Canada autorisent également la consommation de ce genre de produits. En Europe, certes aucune demande d'autorisation de vente de viande ou lait de clones n'a été faite, mais il n'est pas impossible que quelques-uns de leur descendants y aient été mangés car jusqu'en 2015 les clones ne faisaient pas l'objet d'une législation, et la viande a pu aussi être importée d'Amérique[21]. L'Agence européenne de sécurité des aliments n'a cependant pas d'inquiétudes, en 2017, pour la santé humaine[22]. Rien n’interdit non plus l’importation directe de viande ou de lait issus des enfants de ces clones, nés à l’étranger[23].
Aspects éthiques
Le Groupe européen d'éthique[24] a conclu dans son avis : « Étant donné le niveau actuel de maladies et de problèmes de santé des mères porteuses et des animaux clonés, le groupe doute que le clonage d'animaux à des fins alimentaires soit justifié d'un point de vue éthique. La question de savoir si cela s'applique également à la progéniture demande une recherche scientifique plus poussée. À l'heure actuelle, le GEE ne voit pas d'arguments convaincants pouvant justifier la production d'aliments à partir d'animaux clonés et de leur progéniture »[25]. Ce groupe a aussi listé des mesures à prendre en cas d'introduction d'aliments issus d'animaux clonés dans l'UE. Les eurodéputés ont donc adopté une législation le mardi , interdisant le clonage d'animaux à des fins d'élevage et d'alimentation dans l'Union européenne, mais aussi l'importation de descendants et de produits issus d'animaux clonés (viande, lait, matériel reproducteur, etc.). Les autres pays devront quant à eux, garantir que les produits qu'ils exportent en Europe ne sont pas issus de clones; par un système de certificats[26].
Les promoteurs du clonage d'animaux d'élevage estiment qu'il répond à des enjeux de recherche agronomique (accélérer la sélection animale, sauver des races en voie de disparition) et scientifique (mieux comprendre les mécanismes de la régulation épigénétique des premières phases du développement embryonnaire). La sécurité des aliments issus d'animaux clonés reste discutée, malgré la publication d'un avis favorable de la Food and Drug Administration (organisme fédéral américain chargé de contrôler la qualité des produits alimentaires mis en vente sur le marché américain) estimant que « la viande et le lait issus de bovins, de porcs et de chèvres clonés, ainsi que de la progéniture de clones d'espèces traditionnellement consommées sous forme d'aliments, ne présentent pas plus de dangers que ceux issus d'animaux élevés selon les méthodes classiques […] L'agence n'exige pas l'étiquetage, ni aucune autre mesure supplémentaire, pour les aliments issus de clones de bovins, porcs ou chèvres clonés, ou de leur progéniture, car les aliments issus de ces sources ne diffèrent aucunement de ceux issus de bêtes élevées selon des méthodes classiques […] Étant donné que les clones seraient utilisés pour l'élevage, leur introduction dans la chaîne alimentaire ne se ferait pas en nombres importants. Au contraire, leur progéniture issue de la reproduction sexuelle serait utilisée pour la production de viande et de lait destinés à la commercialisation. À l'heure actuelle, l'agence continue de recommander que les aliments issus d'espèces clonées autres que les bovins, porcs et chèvres (ex. les ovins) ne soient pas introduits dans la chaîne alimentaire ».
Début 2008, l'EFSA (Agence européenne de la sécurité alimentaire) prépare un nouvel avis sur ces questions[27]. D'après un rapport de la FDA publié en 2006, et d'un rapport de l'EFSA publié en 2008, il n'existe pas de différence ni de danger en matière de sécurité sanitaire entre les produits alimentaires dérivés d'animaux clonés et ceux traditionnels. Selon ce rapport, compte tenu du manque d'études à l'époque il y avait des incertitudes dans l'évaluation des risques[28] - [29].
En 2008, 58 % des sondés par la Commission européenne se prononcent en défaveur du clonage animal, en raison de la considération du bien-être animal[30].
Conséquences évolutives
Le clonage, par copie d'un génome, ne permet pas la diversification et recombinaison du gène caractéristique de la reproduction sexuée. Or cette dernière est selon la théorie de l'évolution le moyen de l'adaptation du Vivant et de la biosphère aux changements environnementaux, et le gage de coévolution des organismes à reproduction sexuée avec celle de leurs prédateurs, pathogènes et parasites.
Clonage humain
Au-delà des questions techniques relevant du clonage animal en général, le clonage de l'humain pose des problèmes philosophiques nouveaux, débouchant sur la question d'une législation spécifique. Quelques chercheurs travaillent actuellement sur le clonage humain reproductif. Sans nier l'exploit technologique que constituerait une telle réalisation, la tendance internationale semble pencher vers l'interdiction, pour l'instant, des recherches sur le domaine. Ceci étant, un sondage CNN[31] montre un intérêt toujours grandissant du public pour la technique. Arnold Schwarzenegger, ex-gouverneur de la Californie a milité en faveur du clonage humain[32]. Les opposants au clonage semblent d'autant plus pressés d'arriver à un consensus international. Les États-Unis, avec plus de cinquante autres pays, ont signé un appel à une interdiction totale du clonage humain. Un autre texte interdisant seulement le clonage reproductif a été rédigé par la Belgique et soutenu par plus de vingt pays, dont la Russie, le Japon, le Royaume-Uni, la Corée du Sud et le Danemark. La recherche en faveur du clonage humain reproductif exprime une quête encore fantasmatique, de l'homme, pour son immortalité.
Fin 2002, la firme Clonaid, associée au mouvement raélien, a affirmé par voie médiatique avoir réalisé le clonage d'êtres humains mais aucune preuve scientifique de leur existence ne fut apportée. Le tout est tombé dans l'oubli depuis.
Il est admis scientifiquement que l'identité de l'être ne se résume pas à son génotype, ce qui signifie qu'il est impossible de produire deux êtres identiques simplement en dupliquant un génome. Le cas de vrais jumeaux (dits monozygotes), qui peut être techniquement apparenté au clone, ne peut être considéré comme un exemple de clonage humain, au sens où le principe de reproduction sexué entre deux parents est assuré naturellement, sans intervention technologique, et après brassage génétique.
Mais tout ceci pose des questions éthiques, philosophiques, et religieuses importantes en ce début de XXIe siècle conduisant à de nombreux débats. Devons nous considérer le clone, comme un Homme à part entière ou comme une pâle reproduction, une sorte de sous-homme ? Devons nous les considérer comme notre égal ? Faut-il créer une législation nouvelle pour les clones ? Tant de questions qui sont à débattre.
Cette nouvelle forme de génération présente par exemple des difficultés juridiques concernant le statut légal du clone. Notamment lorsque l'on parle de clonage « thérapeutique », qui implique que le clone soit mis au service d'autrui par sa destruction partielle, voire totale.
En , des chercheurs de Corée du Sud ont annoncé les premiers clonages d’embryons humains à des fins de recherches thérapeutiques. Après une controverse scientifique qui amène la publication dans Science à être retirée, il s'avère qu'il s'agit d'une reproduction par parthénogenèse et non par clonage.
En 2008, des chercheurs américains, des entreprises Stemagen et Reproductive Science Center, ont annoncé avoir obtenu trois embryons clonés à partir de cellules adultes (cellules de peau) et d'ovocytes énucléés. C'est la première fois que des embryons sont obtenus à partir de cellules qui ne sont pas des cellules souches[33].
Oppositions au clonage
Après l'intervention des scientifiques Ian Wilmut et Keith Campbell en relation avec le mouton Dolly, l'Académie pontificale pour la vie a publié un document intitulé «Réflexions sur le clonage». Ce document condamne fermement toute expérimentation avec des humains ou leurs cellules à des fins de clonage humain[34].
Notes et références
- Processus d'obtention des « vitroplants »
- Voir résumé étude (INIST/CNRS)
- Sylvie Rouat, « REPORTAGE. A Brest, on ressuscite les plantes disparues », sur sciencesetavenir.fr, sciences et avenir,
- R. Briggs et T. J. King, « Transplantation of Living Nuclei From Blastula Cells into Enucleated Frogs' Eggs », Proceedings of the National Academy of Sciences of the United States of America, vol. 38, , p. 455-463 (ISSN 0027-8424, PMID 16589125, PMCID 1063586, lire en ligne, consulté le )
- J. B. Gurdon, « The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles », Journal of Embryology and Experimental Morphology, vol. 10, , p. 622-640 (ISSN 0022-0752, PMID 13951335, lire en ligne, consulté le )
- www.pbs.org
- https://elpais.com/diario/2010/12/05/eps/1291534018_850215.html
- Émilie Rauscher, L'exploit : Teruhiko Wakayama a cloné une souris congelée, Science et Vie, , page 21.
- Emilie Gillet, « les tout premiers clones de...clones sont nés », Sciences et Avenir,
- (en) Ben Hirschler, « Chinese scientists break key barrier by cloning monkeys », sur Reuters, (consulté le ).
- (en) Zhen Liu, Yijun Cai, Yan Wang, Yanhong Nie, Chenchen Zhang et al., « Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer », Cell, vol. 172, no 4, , p. 881-887.e7 (DOI 10.1016/j.cell.2018.01.020).
- Tom Mueller, « La recette de la résurrection des espèces disparues », sur National Geographic, (consulté le )
- Renard JP, Le clonage : une fin ou un moyen, Pour la Science, , p. 34-40.
- https://www.pbs.org/wgbh/nova/sciencenow/3411/images/vidthumb-02-extr.jpg
- (en) Duncan R. Smith, « Restriction Endonuclease Digestion of DNA », dans Transgenesis Techniques, vol. 18, Humana Press, (ISBN 978-0-89603-245-3, DOI 10.1385/0-89603-245-0:427, lire en ligne), p. 427–432
- (en) Daniel G Gibson, Lei Young, Ray-Yuan Chuang et J Craig Venter, « Enzymatic assembly of DNA molecules up to several hundred kilobases », Nature Methods, vol. 6, no 5, , p. 343–345 (ISSN 1548-7091 et 1548-7105, DOI 10.1038/nmeth.1318, lire en ligne, consulté le )
- (en) Natalay Kouprina et Vladimir Larionov, « TAR cloning: insights into gene function, long-range haplotypes and genome structure and evolution », Nature Reviews Genetics, vol. 7, no 10, , p. 805–812 (ISSN 1471-0056 et 1471-0064, DOI 10.1038/nrg1943, lire en ligne, consulté le )
- Description du département du Nord par François-Joseph Grille (d'Angers) Paris, éd. Sazerac & Duval, 1825–1830 (livre commencé en 1824)
- (en) Xiangzhong Yang, X Cindy Tian, Chikara Kubota, Ray Page, Jie Xu, Jose Cibelli, George Seidel Jr, « Risk assessment of meat and milk from cloned animals », Perspective, , p. 77-83 (lire en ligne)
- Fleur Olagnier, « Mange-t-on de la viande clonée ? », sur ladepeche.fr, La depêche, (consulté le )
- Rédaction Sciences & Vie, « Consomme-t-on de la viande de clones ? », sur https://www.science-et-vie.com, Science et Vie,
- Fleur Olagnier, « Mange-t-on de la viande clonée ? », La Depêche, (lire en ligne)
- « Mange-t-on déjà des animaux clonés ? », Terraeco, (lire en ligne)
- Groupe européen d’éthique des sciences et des nouvelles technologies (GEE)
- Source : EFSA, consultée le Voir
- Audrey Garric, « le parlement européen bannit les animaux clonés », le monde, , p. 6
- À propos du projet d'Avis de l'EFSA
- Audrey Garric, « Le parlement européen bannit les animaux clonés », Le Monde, , p. 6
- « Manger de la viande clonée, c'est sans danger? », sur LExpress.fr, (consulté le )
- Audrey Garric, « Le Parlement européen bannit les animaux clonés », Le Monde, , p. 6.
- Sondage CNN sur le clonage
- article
- Revue La Recherche no 417,
- Académie pontificale pour la vie, « Réflexions sur le clonage », (consulté le )
Voir aussi
Pages connexes
Liens externes
- « Le clonage : un mouton, deux moutons, trois moutons... », Eurêka ! , France Culture, .
