Sélection sexuelle
La sélection sexuelle constitue l'un des deux mécanismes de la sélection naturelle, celui qui est lié à la « lutte pour la reproduction », distincte et complémentaire de la « lutte pour la survie » (ou sélection de survie). Cette théorie comprend deux mécanismes de base, la compétition intrasexuelle et la sélectivité intersexuelle.

Proposée par Charles Darwin dès 1859, l'idée d'une sélection sexuelle a été rejetée pendant plus d'un siècle, victime des a priori des biologistes. Ce n'est que dans les années 1990 que ce domaine de recherche a pris son essor, la sélection sexuelle se révélant en réalité une pierre angulaire de la sélection naturelle.
Présentation générale
Le concept de sélection sexuelle désigne, dans la compétition entre les individus d'une même espèce en vue de l'accouplement, l'évolution de certains traits héréditaires de façon indépendante des facteurs de survie propres (ex : le plumage de parade nuptial du paon est un phénotype clairement désavantageux pour échapper aux prédateurs mais très avantageux dans la séduction d'une femelle). Cette compétition entre individus d'une même espèce (compétition « intraspécifique ») exerce une pression de sélection différente sur les individus mâles et femelles d'une même population (compétition « sexe-dépendante »).
En biologie évolutive, la sélection naturelle correspond à toute sélection d'une meilleure capacité de survie ou de se reproduire dans un contexte donné (écosystème à l'équilibre, écosystème en crise, etc). Parler spécifiquement de « sélection sexuelle » permet de circonscrire un des aspects de l'Évolution : la capacité à se reproduire. Cette sélection sexuelle fait principalement appel à deux phénomène moteurs : le choix du partenaire (sélection intersexuelle) et la compétition pour l'accès aux membres du sexe opposé (sélection intrasexuelle)[2]. Une troisième composante, la compétition spermatique[3], participe aussi de la sélection sexuelle une fois les accouplements effectués (il s'agit de la compétition entre spermatozoïdes de différents individus au sein d'une même femelle). La sélection sexuelle est un mécanisme complexe parallèle à la sélection naturelle de survie (ou « sélection écologique »), qui peut parfois prendre le pas sur celle-ci (exemple de cas extrême : les éphémères adultes ont perdu toute capacité de survie au profit des fonctions copulatoires). La sélection naturelle est en toute rigueur une combinaison sinon un compromis de ces deux types de sélections (sexuelle et écologique).
Parmi les illustrations frappantes et étudiées du phénomène de la sélection sexuelle :
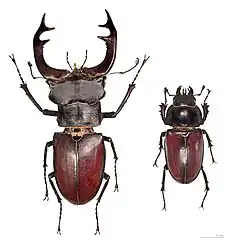
- Le dimorphisme sexuel : les différences morphologiques entre mâles et femelles d'une même espèce reposant sur des parties et organes autres que génitaux. C'est notamment le cas avec le plumage nuptial des oiseaux de paradis ou encore du paon mâles (les plumes du dos formant la fameuse « queue » chatoyante associé à l'animal).
- la variété de la faune des Galápagos, où existaient peu de prédateurs ; en un tel cas, la sélection de reproduction prend le pas sur la sélection de survie et peut conduire à l'émergence de nouvelles espèces par spéciation sympatrique
- La différence d'espérance de vie : dans beaucoup d'espèces, les mâles ont une espérance de vie plus courte (ex : cas des hyménoptères) ou modifiée du fait des activités liées à la preproduction (ex : combats et quasi-jeûne chez les mâles cervidés à la saison du brâme). L'inverse existe aussi (ex : les pieuvres femelles meurent rapidement après éclosion de leurs œufs).
Selon la théorie du handicap, parce qu'un trait est facteur de risque pour la survie, il fait parfois l'objet d'une sélection sexuelle : les individus survivant malgré ce handicap sont potentiellement de bons reproducteurs car possédant d'autres traits (plus favorables) pour compenser. Par exemple la couleur foncée de la crinère du lion mâle est un autre phénomène de sélection sexuelle par les femelles, bien qu'un tel mâle souffre d'autant plus de la chaleur.
Historique
Charles Darwin et L'Origine des espèces

En publiant L'Origine des espèces[4] (1859), Charles Darwin révolutionne ce qui n'était alors que l'hypothèse de l'évolution en proposant le mécanisme de sélection naturelle fondé sur la reproduction différentielle des individus en fonction de leur capacité à survivre. Conscient de ce que l'aptitude à la survie est insuffisante pour expliquer certaines variations, il y propose également la sélection sexuelle comme mécanisme complémentaire, arguant que la compétition entre individus pour la reproduction sexuée peut aussi être un facteur majeur d'évolution de certains traits inexplicables dans le seul cadre de la sélection écologique, l'exemple le plus connu cité par Darwin étant celui de la queue du paon :
- « …Et ceci me conduit à dire quelques mots de ce que j'appelle la sélection sexuelle. Celle-ci dépend non pas d'une lutte pour la survie, mais d'une lutte entre mâles pour la possession des femelles ; et le résultat en est non pas la mort du perdant, mais le fait qu'il aura aucun ou peu de descendants. » (L'Origine des espèces, Charles Darwin)
L'idée que les espèces peuvent évoluer était connue, avec les travaux de Lamarck, Geoffroy Saint-Hilaire ou Cuvier ; l'idée de sélection naturelle était dans l'air, et Alfred Russel Wallace l'exprime dans son essai de 1858, un an avant Darwin ; mais l'idée d'une sélection sexuelle était en revanche originale et révolutionnaire[5]. Pour Darwin, la « sélection sexuelle » se présente comme une intermédiaire entre la « sélection naturelle » aveugle et la « sélection artificielle » de l'éleveur visant une qualité particulière de l'espèce domestique : la sélection sexuelle est une sélection intéressée, fondée sur un processus cognitif, mais qui ne vise que l'intérêt reproductif du sélectionneur[1]. Mais alors que sélections naturelle ou artificielle peuvent s'appliquer à n'importe quelles espèces, Darwin considère que la sélection sexuelle ne peut s'opérer qu'à travers l'action d'un système cognitif élaboré, ce qui la rapproche plus de la sélection artificielle de l'éleveur que de la sélection naturelle imposée par les forces de la nature[5] :
- « Si un éleveur arrive en peu de temps à créer une variété de poule naine belle et de port élégant, suivant ses propres critères de choix, je ne peux trouver de raison de mettre en doute que des oiseaux femelles, en sélectionnant sur des milliers de générations les mâles les plus beaux ou les plus mélodieux, sont susceptibles de produire un effet marquant. » (L'Origine des espèces, Charles Darwin)
La Filiation de l'homme et la sélection liée au sexe

Bien que la sélection sexuelle soit donc mentionnée dans L'Origine des espèces, elle n'est exposée qu'en trois pages, ne faisant même pas l'objet d'un chapitre. Il y consacre par la suite tout un ouvrage, la Filiation de l'homme et la sélection liée au sexe[6] (1871).
Dans la Filiation de l'homme et la sélection liée au sexe, Darwin souligne par exemple que chez l'éperonnier chinquis, la tache blanche est toujours en haut de l'ocelle quand le mâle fait la roue, et que la seule fonction possible de ce trait est la parade nuptiale ; ce qui démontre à la fois que la sélection sexuelle peut produire des traits extrêmement complexes, et que la femelle dispose d'une capacité cognitive capable d'en apprécier la régularité et de sanctionner d'éventuelles imperfections. Mais il souligne également qu'un tel « choix » n'implique pas nécessairement de conscience, et peut intervenir chez toute espèce animale disposant d'un système nerveux suffisamment discriminant, comme des crustacés ou des insectes[5].
- « …ces traits ornementaux ont été acquis indirectement par l'un ou l'autre sexe, modelés sous l'influence du désir et de la jalousie, modelés par une certaine idée de la beauté d'un son, d'une couleur ou d'une forme, et par l'exercice d'un choix ; et ces facultés de l'esprit dépendent manifestement du développement du système cérébral. » (la Filiation de l'homme et la sélection liée au sexe, Charles Darwin)
Pour Darwin, la sélection sexuelle peut prendre deux formes : la compétition entre mâles, conduisant à une course aux armements, et la compétition pour attirer les femelles, conduisant à une course à l'ornementation. Ces compétitions ont pour conséquences d'accentuer le dimorphisme sexuel, et d'induire des divergences rapides entre espèces[5].
Mais il ne sait pas expliquer pourquoi ce sont les mâles qui font leur parade et les femelles qui choisissent[5].
Une théorie rejetée
Expliquer l'évolution des espèces non par la volonté divine mais par la pression de la Nature était une chose, mais prétendre remplacer la main du Créateur par les pulsions lubriques de créatures aux cerveaux guère plus gros que des pois était dépasser les bornes : ce n'était plus de l'athéisme, mais de la pornographie athée[5]. La théorie de la sélection se voit d'autant moins acceptée que Darwin la développe dans un ouvrage, la Filiation de l'homme et la sélection liée au sexe, où il défend aussi l'idée que certains attributs humains sont des purs produits de la sélection sexuelle. Il cite ainsi des traits dimorphiques comme la barbe présente chez les seuls individus mâles[7] ou la relativement faible pilosité humaine comparée aux autres mammifères[8] comme exemples de produits de la sélection sexuelle chez l'être humain.
La majorité des savants de l'époque refusait en effet de voir dans la sélection sexuelle autre chose qu'une forme de sélection de survie liée à la compétition entre les mâles d'une espèce, refusant l'idée que le choix des femelles puisse exercer une quelconque pression évolutive. Dans l'esprit de l'époque, s'il était acceptable que des mâles puissent se disputer les faveurs d'une femelle, c'est naturellement la jeune femme qui se pare de brillants atours pour attirer l'attention des célibataires. L'idée que des mâles puissent être des produits acceptés ou rejetés par le choix des femmes était impensable[5].
Dans l'Angleterre victorienne, Darwin eut beaucoup de difficultés à défendre cet aspect de sa théorie contre ses contemporains, comme face à son collègue Alfred Wallace qui était pourtant simultanément arrivé à une formulation analogue de la théorie de la sélection écologique. Pour Wallace, par exemple, les traits brillants et excessifs résultent naturellement de l'exubérance de la vie elle-même ; quand ils sont partagés entre mâles et femelles ils correspondent à une fonction de reconnaissance mutuelle de l'espèce ; mais les femelles ont une pression sélective plus forte pour gagner un meilleur camouflage et protéger leur portée[5].
Les critiques de Wallace furent meurtrières, et jusque vers 1930, l'idée d'une sélection sexuelle n'a été considérée que comme une curiosité aberrante dans l'histoire de la sélection naturelle[5].
Ronald Fisher et l'indicateur d'adaptation
Le physicien et statisticien Ronald Fisher[9] contribue à renouveler la notion en appliquant des méthodes statistiques à la génétique des populations.
Fischer s'intéresse à la sélection sexuelle dès 1915, dans une publication[10] où il se demande ce qui conduit le choix des femelles à être déterminé par tel ou tel trait du mâle, ou plus exactement, quel peut être l'avantage sélectif pour elles de choisir tel ou tel ornement apparemment inutile, et donc, quelle peut être l'origine évolutive d'une telle préférence[5].
Il suppose alors que ces ornements ont pu être d'une manière ou d'une autre un indicateur de vitalité, de bonne santé, et donc en fin de compte d'une bonne adaptation due aux gênes et héritable. Dans ce cas, une préférence de la femelle pour cet ornement lui confère une descendance mieux adaptée que la moyenne, et donc un avantage reproductif, qui se traduit par plus de descendants de ce couple. De ce fait, cette meilleure adaptation du mâle et la préférence associée de la femelle se répandront dans la population, et deviennent des caractères corrélés[5].
Ainsi, une préférence femelle pour un trait indicateur de bonne adaptation générale du mâle contribue à accélérer l'effet qu'aurait eu la sélection naturelle sur cette bonne adaptation, et a en fin de compte non seulement un effet sur la bonne adaptation, mais également sur la préférence de la femelle (et accentuera le trait chez le mâle)[5].
Cette idée d'un trait pouvant être un indicateur général d'adaptation restera cependant négligée jusque dans les années 1960.
L'emballement fisherien
Dans son livre de 1930, The Genetical Theory of Natural Selection (la théorie génétique de la sélection naturelle)[11], Fisher montre par exemple qu'un léger biais dans la préférence des femelles qui les ferait préférer des mâles dotés de longues plumes à des mâles dotés de plumes plus courtes peut conduire à une situation évolutive où de génération en génération, le plumage des mâles augmente, car à chaque génération les mâles ayant le meilleur succès reproductif sont ceux qui ont les plumes les plus longues dans la population. Dans le même temps, le biais de préférence des femelles s'accentue : celles qui choisissent les mâles les plus reproductifs sont aussi celles dont les descendants seront les plus nombreux. Ainsi dans la démonstration de Fisher, un léger biais dans la préférence d'un sexe pour les attributs de l'autre sexe peut conduire à une situation extrême jusqu'au point où l'avantage reproductif est compensé par le désavantage en termes de survie (risque d'être repéré par un prédateur, par exemple).
- « …la grande taille du plumage du mâle, et la préférence sexuelle de ce trait chez la femelle, doivent donc aller de pair ; et tant que ce processus n'est pas mis en échec par une contre-sélection drastique, ces biais progresseront d'une manière sans cesse accélérée. En l'absence d'une contre-sélection, il est facile de voir que la vitesse d'évolution sera proportionnelle au développement déjà atteint, lequel augmentera donc de manière exponentielle avec le temps, ou suivant une progression géométrique » (Ronald Fisher, 1930).
Une théorie toujours refusée

Ces travaux de 1930 restèrent longtemps sans suite. La sélection sexuelle n'était tout simplement pas de mise à cette époque, non pas parce qu'elle ne décrivait pas correctement des faits (les éléments présentés par Darwin dans la Filiation de l'homme n'ont jamais été sérieusement contestés), mais à cause de facteurs internes à la discipline biologique elle-même, largement idéologiques : le manque d'outil mathématique permettant de la modéliser, l'analyse des ornements sexuels comme jouant un simple rôle d'identification de l'espèce, la négation par principe de toute psychologie animale, une sélection naturelle vue comme orientée vers le bien de l'espèce, et une esthétique fonctionnelle considérant l'ornementation comme une marque de décadence réactionnaire[5].
Les deux idées de Fisher, l'indicateur d'adaptation et l'emballement fisherien, ont en particulier été critiqués en 1938 en deux articles influents par le biologiste Julian Huxley, pour qui ces mécanismes étaient immoraux car contraire au bien de l'espèce[5]. Ces critiques destructrices furent renouvelées en 1942 dans son livre de référence Evolution: The Modern Synthesis (en), où il présente les ornements sexuels comme des dérives décadentes et anti-progressistes, dans un discours marqué par un idéalisme socialiste, une pruderie puritaine, et une préoccupation eugéniste — un cocktail idéologique fréquent chez les biologistes de cette époque[5].
Ce n'est qu'après la seconde édition du livre de Ronald Fisher, en 1958, que ces idées se répandront dans une nouvelle génération de biologistes mieux formés mathématiquement et moins conditionnés idéologiquement, comme Peter O'Donald. Cet aspect de la théorie darwinienne sera pleinement accepté comme un mécanisme à part entière: l'emballement fisherien.
Au cours des années 1960, William Hamilton poursuivra les travaux de Fisher. Il contribuera par exemple à la théorie de la reine rouge expliquant l'avantage de la reproduction sexuée en ce qu'elle permet de résister de façon plus efficace aux parasites.
Maynard Smith et la robustesse génétique
À partir des années 1970, John Maynard Smith, ingénieur aéronautique de formation, s'intéresse à la parade nuptiale de la mouche du vinaigre. Il constate que les mâles fortement consanguins ne sont pas acceptés par les femelles : les mouches femelles semblent sélectionner la robustesse génétique de leur partenaire sexuel en fonction de la qualité de sa parade nuptiale[5].
Il réalise ainsi la première expérience scientifique démontrant la réalité de la sélection sexuelle.
L'expérience montre que la parade nuptiale sert d'indicateur globalisant de la robustesse génétique du candidat partenaire. Dans la mesure où la parade est un comportement complexe, elle dépend en effet du bon état d'un grand nombre de gènes. Dans les espèces sexuées, un défaut génétique est le plus souvent récessif, et masqué par la bonne version du gène sur l'autre chromosome. Mais chez les individus fortement consanguins, ces défauts ne sont plus masqués, et la parade nuptiale présente des anomalies perceptibles. La mouche femelle a donc un avantage sélectif à rejeter les candidats présentant de telles anomalies, parce que leur patrimoine génétique s'écarte trop de la normale et que les défauts génétiques en deviennent manifestes.
Amotz Zahavi

Un des problèmes posés par les ornements sexuels est d'expliquer en quoi les sélectionner peut être un avantage adaptatif pour la femelle. S'il ne s'agit que d'une préférence arbitraire, restreindre son choix est un désavantage sélectif ; et si le trait se répand néanmoins, il n'implique pas d'information particulière sur ce que sera l'adaptabilité des descendants qui le porteront — tous les mâles pourront en hériter, qu'ils soient ou non bien adaptés à leur environnement.
L'idée d'évolution désavantageuse sera poussée plus avant par Amotz Zahavi, qui explique, en 1975[12], par sa théorie du handicap, que le fait qu'un attribut soit un handicap — c'est-à-dire qu'il soit coûteux à produire — entraîne précisément qu'il soit préféré par les membres de l'autre sexe. En effet, dans ce cas, ce handicap est aussi un signal — dit « honnête » — faisant la preuve directe de la qualité de l'individu, puisque ce dernier est capable de survivre malgré ce handicap. Les individus mal adaptés, inversement, seront trop faibles pour produire le trait sélectif au même niveau d'intensité.

Dans l'année qui suivit l'article de Zahavi, Richard Dawkins en donne une présentation élogieuse dans son best-seller Le Gène égoïste (1976), déclenchant une controverse parmi les biologistes sur la place réelle de la sélection sexuelle. En 1980, Peter O'Donald publie son Genetic Models of Sexual Selection, dans lequel il récapitule vingt années de recherches sur la modélisation mathématique de la sélection sexuelle. Ces controverses alimentèrent un double mouvement de recherche, à la fois sur la modélisation mathématique du phénomène, et vers des études de terrain sur les mécanismes réels de choix des partenaires sexuels, révélant toujours plus d'exemples où la femelle démontre des préférences dans le choix du mâle[5].
Il fallut une quinzaine d'années pour que cette théorie du handicap soit acceptée par les biologistes. Le handicap étant fondamentalement un indicateur de bonne adaptation, ce débat permit d'établir les fondements de la théorie moderne des indicateurs d'adaptation[13].
Enfin, en s'appuyant sur le rôle du conflit sexuel défini par William Rice, Locke Rowe et Göran Arnvist, Thierry Lodé réintroduit la divergence d'intérêt entre mâle et femelle comme une force fondamentale de la théorie évolutive. Mâles et femelles pratiquent une guerre des sexes, depuis la mante religieuse jusqu'au combat des otaries. Le conflit sexuel entraîne un processus de coévolution antagoniste dans lequel un des sexes évolue en développant des traits manipulateurs, tandis que l'autre sexe (souvent les femelles) contre cette évolution en manifestant des caractéristiques de résistance. Ce phénomène détermine ce que Thierry Lodé appelle « le tir à la corde évolutif ». C'est l'existence de la diversité des stratégies sexuelles et le conflit sexuel qui favorisent la spéciation.
Pression sélective induisant une sélection sexuelle
Sélection naturelle et dérive génétique
.jpg.webp)
La sélection naturelle de survie conduit à éliminer différentiellement les individus « les moins adaptés » — parce que ce sont les premiers à mourir de faim ou de maladie, ou à être la victime de prédateurs ou de parasites — et de ce fait, le succès reproductif des individus moins performants est statistiquement moindre, parce que quand les temps sont durs, ce sont les premiers à mourir avant d'avoir pu se reproduire.
Ces différences dans l'état général sont en partie dues au hasard de la vie, mais également aux différences dans les formules génétiques des individus. Concrètement, les génotypes « moins performants » sont —par définition, c'est une tautologie— ceux qui produisent toutes choses égales par ailleurs des individus moins bien adaptés à leur environnement, ce qui se traduit physiquement dans le phénotype, par des carences dans le développement ou des insuffisances dans les performances. Il y a donc une corrélation entre le bon état général d'un individu et la bonne adaptation de son génotype ; et à terme, la sélection naturelle de survie tend à limiter le pool génétique aux seules combinaisons de gènes performantes.

Si la sélection naturelle tend à favoriser l'uniformité d'une espèce, l'effet des mutations génétiques est au contraire d'introduire des variations aléatoires. On estime que chez l'homme, il se produit de une à trois mutations par génération[13]. En principe, à partir du moment où le génotype s'écarte de l'optimum, la variation aura presque toujours un effet non optimal —donc nuisible— sur le phénotype. En pratique, les variations autour d'un optimum ne conduisent pas à des variations très marquées (d'autant moins que ces mutations sont le plus souvent récessives), si bien que la pression sélective sur ces variations est relativement faible, et l'effet réel des mutations génétiques est d'entretenir une certaine variabilité dans les phénotypes.
Mais si ces mutations s'accumulent, l'organisme produit s'éloignera de plus en plus de l'optimum. Plus un individu supporte de mutation, plus il est dégénéré, et moins il est adapté. La sélection naturelle se fait sentir sur l'accumulation de telles mutations, progressivement, et d'autant plus violemment qu'elles induisent un phénotype trop éloigné de l'optimum écologique de l'espèce. L'enjeu est alors de supprimer les mutations non optimales au moins aussi rapidement qu'elles se produisent, de manière à maintenir l'espèce globalement proche de son optimum : plus l'élimination est rapide et efficace, et plus l'espèce sera bien adaptée à son environnement[13].
Investissement parental

L'investissement parental joue un rôle important dans la sélection sexuelle en raison de la taille des gamètes et des dépenses énergétiques de la gestation. C’est la femelle qui, dans la plupart des cas, exerce la plus forte sélection sexuelle, ce qui peut être expliqué par un plus grand investissement d'énergie nécessaire à la production de ses gamètes.
En effet, les femelles produisent un petit nombre de gamètes de plus grande taille comparés à ceux des mâles, alors que les mâles produisent un très grand nombre de gamètes mais d’une taille moindre (Trivers 1972)[14]. Dans la mesure où la ressource rare est le gamète femelle, il est logique que les mâles entrent en compétition pour se l'approprier ; et inversement, il est logique que la femelle puisse effectuer un choix sur les gamètes mâles qui seront retenus[15]. La sélection sexuelle est particulièrement importante parmi de nombreux groupes de vertébrés (oiseaux, mammifères) chez qui la production de gamètes par la femelle est relativement restreinte — un œuf est beaucoup plus coûteux à produire qu'un spermatozoïde, et l'investissement d'une gestation est incomparablement plus coûteux que celui d'un simple coït. L'accès au partenaire sexuel est donc un facteur important de la différence de fécondité entre les individus.
La théorie décrite par Trivers (1972) affirme que le sexe qui s’investit le plus dans les soins de la progéniture (allaitement, nourriture, protection) est celui qui, au moment de l'accouplement, exercera une plus grande pression de sélection sexuelle sur le sexe opposé. À l'inverse, le sexe qui s’investit le moins dans les soins parentaux doit avoir un investissement sexuel plus important et fera face à une concurrence plus grande pour trouver un partenaire, tout en veillant à se reproduire le plus possible afin d'assurer son succès reproducteur.
Stratégies d'investissement
L'investissement reproductif d'une femelle sur un accouplement est souvent à la fois important et bien plus grand que celui du mâle : pour elle, le nombre de descendants possibles est assez limité, et dans un cycle reproductif, le nombre de partenaire sexuel impliqué se réduit souvent à un individu unique. Inversement, l'investissement reproductif du mâle est le plus souvent négligeable dans la production des gamètes, et se limite le plus souvent à la parade nuptiale.
Le faible investissement reproductif nécessaire au mâle implique que le nombre de ses descendants peut être très variable ; sa stratégie de reproduction naturelle est alors de prendre plus de risques pour pouvoir remporter des succès plus importants — quantité plutôt que qualité. La femelle a un nombre de descendants limité par son nombre de cycles reproductifs, et par la portée de chaque cycle, si bien que sa stratégie de reproduction est plutôt d'optimiser la qualité de chaque portée[15].
La sélection sexuelle peut alors prendre deux modalités non exclusives[16] :
- Compétition en vue d'être le plus attirant pour les membres du sexe opposé (on parle de sélection intersexuelle).
- Compétition entre individus du même sexe pour s'arroger l'accès aux partenaires sexuels (on parle de sélection intrasexuelle).
Dans la plupart des cas, du fait de cet investissement reproductif, c'est la femelle qui choisit son partenaire. On peut noter que le mâle peut tout autant avoir subi une pression sélective et être celui qui choisit son partenaire, dès lors que son investissement reproductif devient important. C'est en particulier le cas, par exemple, de nombreuses espèces d'oiseaux nidicoles. Dans ce cas, inversement, les femelles seront également en compétition pour obtenir les faveurs du mâle. Par la suite, sauf mention contraire, on supposera que la sélection est effectuée par la femelle, étant entendu que ce n'est pas une nécessité.
Sélection sexuelle

La reproduction représentant un investissement important pour la femelle, la pression sélective la pousse à protéger son investissement et à choisir le partenaire sexuel le mieux adapté à son environnement, de manière à maximiser la probabilité de succès reproductif de sa propre descendance. Dans ce but, il lui faut identifier et choisir les individus dont le succès reproductif sera le plus probable.
Cette sélection sexuelle peut donc être à l'œuvre en permanence, mais elle ne fait en général qu'anticiper et renforcer la sélection naturelle de survie, dans la mesure où les individus qui seront probablement un jour les moins performants sur le plan de la survie (par eux-mêmes, ou via leurs descendants) se voient refuser la possibilité de procréer, et ont donc un moindre succès reproductif. Là où la sélection naturelle de survie éliminera à terme et statistiquement les moins adaptés, à cause de leur potentiel de survie limité, la sélection sexuelle le fait de manière ciblée et plus rapidement, en limitant leur potentiel reproductif. Cette exclusion est réversible : si le mâle reproducteur disparaît accidentellement, les candidats rejetés restent en lice pour assurer la continuité de l'espèce.
Résultant d'une pression sélective sur l'individu pour protéger son investissement reproductif, la sélection sexuelle a donc pour effet principal de maintenir le pool génétique de l'espèce proche de l'optimum, encore plus fermement que ne le fait la sélection naturelle de survie[13].
La sélection sexuelle induit deux types d'avantages sélectifs : pour la femelle, la capacité d'identifier les candidats partenaires en bonne santé et harmonieusement développés ; et pour le mâle, la capacité à se mettre en valeur pour répondre à ces critères. Les génotypes « moins performants » sont ceux qui produisent, toutes choses égales par ailleurs, des individus moins bien adaptés à leur environnement, et le choix effectué par les femelles fait partie de l'environnement auquel le mâle doit s'adapter s'il veut assurer son succès reproductif[13]. La femelle choisit un mâle en fonction de certains traits (taille du corps, couleur, dominance, etc.) censés lui garantir un meilleur succès reproducteur et exerce une sélection sexuelle en ce sens[17] - [13].
Ces spécificités peuvent avoir des conséquences contre-intuitives.
Base génétique de la sélection sexuelle
 |
 | |
P. Pundamilia (g) et P. Nyererei (d) sont biologiquement interféconds, mais leur préférence de couleur constitue une barrière comportementale à l'hybridation ; ils s'hybrident en revanche en lumière monochromatique[20]. | ||
Au niveau génétique, une espèce correspond à un pool génétique dont le brassage génétique est assuré par la reproduction sexuée. Au sein de ce pool, les allèles d'un même gène sont constamment créés par mutation génétique, et le gène dominant est ainsi toujours entouré d'un nuage de petites variations. Ces allèles sont en compétition permanente, dans le sens où ceux qui se traduisent en moyenne par un avantage sélectif auront tendance à se répandre dans la population et supplanter les autres (une des conditions de survie de l'espèce est que le taux de mutation doit être suffisamment faible pour que les allèles défavorables puissent être supplantés suffisamment rapidement par les allèles performants).
S'agissant des conditions aboutissant à la sélection d'un partenaire sexuel, les petites variations dans la manifestation des allèles peuvent conduire d'un côté à de petites variation du phénotype des mâles, et de l'autre à de petites variations comportementale dans ce que préfèrent les femelles. Pour un mâle présentant une légère différence x1 sur le trait x, il pourra peut-être y avoir une femelle présentant une préférence pour cette même variante x1 du trait x. Dans ce cas, le choix du partenaire conduira préférentiellement à apparier ces deux variantes. Leur descendance tendra à porter à la fois la différence du mâle sur le trait x1, et la préférence des femelles pour cette même variante ; ce couplage des deux traits tendant à s'auto-entretenir dans une sous-population qui tend à s'isoler à travers son choix de partenaire.
Si l'une ou l'autre des variantes sur le phénotype ou le comportement procure un avantage sélectif, la différence x1 étant le marqueur de cet avantage sélectif, cette sous-population tendra alors à se répandre. Inversement, si ces variantes diminuent l'avantage sélectif, la population qui les porte s'éteindra d'elle-même. Si la variation est neutre, la séparation peut néanmoins être stable, la sélection sexuelle étant alors le seul facteur comportemental prévenant l'hybridation de deux sous-populations parfaitement interféconde par ailleurs.
Indicateurs de valeur sélective
Indicateurs de charge mutationnelle

Comme souligné précédemment, la sélection sexuelle a pour origine une pression sélective poussant à choisir comme partenaire de copulation l'individu qui paraît le mieux adapté —c'est-à-dire le moins dégénéré par des mutations néfastes—, afin de maximiser la probabilité de succès reproductif de sa propre descendance. Généralement les mutations sont récessives, mais la dominance de la version saine est souvent incomplète, et la présence d'une mutation peut transparaître dans de légères différences somatiques ou comportementales[13]. Un examen attentif de la conformité somatique et comportementale permet donc de se faire une opinion de la conformité du génotype à son optimum. Mais un examen complet est complexe, et donc coûteux.
De ce point de vue, des traits complexes (comme l'apparence de la queue du paon) et qui présentent des variations notables d'un individu à l'autre peuvent représenter une information synthétique, et beaucoup moins coûteuse à déterminer[13]. La complexité du trait signifie que son apparence dépend de l'interaction harmonieuse de nombreux gènes ; et par conséquent, le trait reflète d'autant plus d'information génétique qu'il est compliqué.
La « vulnérabilité aux mutations » d'un trait donné correspond à la proportion des mutations du génome qui auront un impact sur ce trait, c'est-à-dire, la proportion du génome (en longueur d'ADN codant quelque chose) impliquée dans l'expression d'un trait. Plus le trait est complexe, plus la proportion du génome impliquée sera grande, et plus la charge mutationnelle du trait sera représentative de la charge mutationnelle de l'ensemble du génome. Par exemple, certains généticiens estiment que la moitié des gènes humains interviennent dans le développement de son cerveau[13], ce qui signifierait qu'une mutation sur deux a un impact sur l'expression de l'esprit humain.
La pression sélective conduit alors à s'intéresser à de tels traits complexes et variables, qui deviennent alors des indicateurs de non-dégénérescence, ou de bonne adaptation de la formule génétique individuelle[13].
Sélection sexuelle sur un indicateur synthétique
En règle générale :
- la charge mutationnelle influe sur l'adaptation génétique à l'environnement,
- cette adaptation influe sur le bon état général de l'individu,
- le bon état de l'individu influe sur ses indicateurs de valeur sélective,
- et ces indicateurs influent sur le choix du partenaire sexuel.
Clairement, un trait présentant une variabilité dépendant fortement de la charge mutationnelle n'est pas quelque chose qui peut être favorisé par une sélection naturelle de survie ; mais c'est au contraire quelque chose dont l'émergence est favorisée par la sélection sexuelle, et ceci, d'autant plus facilement que le trait n'a pas par lui-même de valeur adaptative de survie. De ce point de vue, un indicateur de non-dégénérescence portera plus facilement sur le comportement de parade sexuelle, qui peut être très complexe sans créer de handicap physique ; mais tout trait complexe et variable peut servir à cet examen.
Alors que les traits génétiquement simples sont préférentiellement modelés par la sélection naturelle de survie, les traits complexes le sont donc préférentiellement par la sélection sexuelle[13]. En règle générale, un tel indicateur paraît sans fonction de survie, inutilement complexe et plutôt coûteux à produire[13], et leur réalisation présente une variabilité observable (pour le partenaire sexuel) dans la population. Le fait de dépendre de nombreux gènes signifie que la défaillance de l'un d'eux n'entraîne pas un handicap significatif, susceptible d'être éliminé par la sélection naturelle de survie. Et sa variabilité implique qu'un écart génétique peut être apprécié rapidement lors de la sélection du partenaire.
S'il suffisait de produire un indicateur conforme pour être sélectionné sexuellement, la sélection sexuelle aurait vite fait de réduire la variabilité de l'indicateur, le rendant alors inutile. Un bon indicateur ne peut être sélectionné que s'il est très difficile à rendre parfait, soit parce que sa bonne expression dépend d'une grande fraction du génotype, ce qui le rend par conséquent sensible aux mutations, soit parce que son élaboration demande de l'énergie, et dépend donc du bon état général de l'individu.
Pour Amotz Zahavi, les traits correspondant à un handicap sont les seuls ornements sexuels pouvant conduire à une stabilité évolutive, parce que ce sont les seuls qui apportent effectivement une information sur l'adaptation génétique générale du candidat partenaire[13]. Mais dans ce cas, la sélection sexuelle ne limite alors pas ses conséquences à l'adaptation génétique, mais se traduit par une pression sélective sur les indicateurs eux-mêmes[13].
Signaux honnêtes

On définit un signal honnête comme un caractère — physique ou comportemental — dont la mise en place et le maintien nécessitent une importante allocation d'énergie. L'idée de « handicap » introduite par Amotz Zahavi n'est qu'une manière de parler de dépendance à la condition physique de l'individu, elle-même dépendante de sa bonne adaptation génétique par rapport à son écosystème. Seuls les individus en bonne condition physique peuvent supporter le coût de production de tels signaux. Pour le choix des partenaires sexuels par les femelles, un signal honnête renseigne donc d'une façon fiable les femelles sur l'aptitude du mâle, qui ne peut pas « tricher » : c'est ce qu'on appelle la « théorie du handicap ». Ce processus permet d'expliquer le maintien au cours de l'évolution de tels signaux handicapants, qui seraient contre-sélectionnés (car réduisant la fitness) s'ils n'étaient pas intégrés à un processus de sélection sexuelle.
Pour qu'il corresponde à un trait évolutivement stable, un handicap honnête présente une variabilité dans sa réalisation. En effet, s'il était uniformément atteint par toute la population, les individus les plus faibles n'y survivraient pas, et les individus les plus performants ne pourraient pas être distingués de ceux qui sont simplement « suffisamment performants »[13].
Les signaux honnêtes peuvent prendre n'importe quelle forme, du moment qu'ils représentent un coût pour celui qui les produit. Des couleurs vives augmentent le risque de prédation. Des chants complexes demandent de l'énergie et de la mémoire. La parade nuptiale demande de l'énergie et du temps. Des dons alimentaires impliquent une privation pour le donneur. Un diamant représente deux mois de salaire. Dans tous les cas, ce qui caractérise un signal honnête, par opposition aux traits représentant une adaptation de survie, c'est le gaspillage apparent de ressources qu'ils représentent : dilapider des ressources serait un trait inadapté s'agissant de la « survie du plus apte », mais c'est précisément ce qui en fait un signal honnête, utilisable dans le cadre d'une sélection sexuelle[13].
Un gaspillage inutile de ressources est généralement le résultat d'une sélection sexuelle à l’œuvre. Quelques exemples de signaux honnêtes en lien avec la sélection sexuelle :
- Caractères physiques : chez les espèces du genre Pavo (les paons), plus les plumes de la queue sont longues, plus le mâle a du succès, quand bien même ces plumes handicapent fortement les déplacements de l'animal, et en font donc une proie d'autant plus facile.
- Ornements colorés : les processus métaboliques aboutissant à la synthèse de pigments sont coûteux énergétiquement. En particulier, les caroténoïdes, qui donnent des colorations orangées, sont également impliqués dans la mise en œuvre du système immunitaire. De vives colorations sont donc des signaux honnêtes de la bonne santé (absence de maladie ou de parasites) des individus les possédant. On peut aussi donner l'exemple des guppies (Poecilia reticulata) ou des plumes colorées chez les oiseaux.
- Chants et cris : les cerfs (Cervus elaphus) se servent du brame dans la compétition entre mâles pour l'accès aux femelles. Le brame utilisant les mêmes muscles que ceux impliqués dans la charge pour le combat, il est un signal honnête de la capacité de combat des mâles.
Biais sensoriel de la sélection sexuelle
Les indicateurs intervenant dans la sélection sexuelle et dans la parade nuptiale (au sens large) constituent des signaux d'interprétation complexe, parce qu'ils peuvent aussi bien correspondre à une signalisation de coopération qu'à une signalisation de manipulation et tromperie[21].
- Pour l'individu performant qui fait sa parade nuptiale devant une femelle a priori circonspecte, les deux individus ont intérêt à coopérer dans cette signalisation honnête, pour conclure en une copulation fructueuse pour les deux.
- Mais pour le candidat moins performant, le filtre cognitif de la femelle circonspecte apparaît plutôt comme les dispositifs de sécurité barrant l'accès à la valeur essentielle et précieuse qu'est son système reproductif, qu'il faut neutraliser en montrant les « pattes blanches » et accomplissant les « passes secrètes » qui lui donneront accès à ce trésor. Dans ce cas, la signalisation est une signalisation fondamentalement égoïste, qui vise à provoquer sur la cible un comportement favorable à l'émetteur, indépendamment de l'intérêt de la femelle circonspecte.
La pression de sélection conduit à ce que l'expression phénotypique (physique et comportementale) du candidat mâle doit s'adapter d'une manière ou d'une autre à ce que le système cognitif de la femelle est prêt à accepter de laisser passer comme candidat acceptable[22] - [23].
Les traits sur lesquels se fonde une sélection sexuelle tendent à la fois à être ornementaux et à être de bons indicateurs de bon état général. En effet, si un trait a initialement fonctionné comme indicateur, la pression de sélection tendra à le doter d'une ornementation complexe, qui sera d'autant plus efficace qu'elle exacerbera les préférences sensorielles du partenaire cible. Inversement, un trait qui aurait été initialement un indicateur purement esthétique, capturé dans un emballement fisherien, tendra à acquérir par lui-même une capacité à refléter un bon état général, parce que la production d'ornements complexes tend à dépendre d'une grande part du génotype, et demande des ressources plus importantes[22].
Pression de sélection sur une collection d'indicateurs

Le paradoxe du lek : comment un trait unique, la parade nuptiale, peut-il être un indicateur pertinent de bon état général pour la sélection sexuelle ?
En théorie, la sélection sexuelle consiste pour la femelle à repérer le moins dégénéré des candidats possibles, en examinant la conformité de son phénotype (physique et comportemental) à ce que son propre système cognitif lui présente comme le candidat idéal. Comme indiqué ci-dessus, l'examen sera donc d'autant plus révélateur qu'il portera sur des traits complexes.
Au départ, tout trait complexe peut théoriquement participer à une telle sélection sexuelle : étant complexe il a une certaine variabilité ; et étant le fruit d'une sélection naturelle il a un certain coût de production. Les individus les plus performants seront capables d'exhiber des traits pleinement développés, et la pression de sélection consistera, pour leur partenaire sexuel, à sélectionner les traits les plus épanouis. Cependant, l'examen d'une collection de traits serait une stratégie évolutive instable, parce qu'elle a un coût cognitif inutilement important.
Du moment qu'un trait est un indicateur correct, il est presque aussi efficace de fonder ses comparaisons sur ce trait comme critère prioritaire, des traits secondaires pouvant partager ensuite d'éventuels exæquos[24]. Pour cette raison, la pression de sélection sur le système cognitif de la femelle conduit à favoriser comme indicateur l'un ou l'autre des traits complexes, au détriment des autres[13]. Une telle sélection présente alors un avantage sélectif, parce qu'elle sélectionne (avec une bonne approximation) les individus les mieux adaptés, tout en exigeant un investissement moindre dans les capacités cognitives de l'examinateur.
Cette sélection visant un indicateur particulier met à son tour une double pression sélective sur la population choisie[25].
- Par rapport à la variabilité naturelle des différents traits potentiellement indicateur, les individus qui auront investi plus de ressource dans l'indicateur privilégié retenu par l'examinateur seront eux-mêmes favorisés, toutes choses égales par ailleurs. Le fait pour le système cognitif de la femelle de privilégier un trait particulier conduit donc, en réaction, à développer ce trait chez le mâle, ce qui initie un emballement fisherien lui faisant mobiliser de plus en plus de ressources, pour devenir toujours plus grand, plus complexe, plus mobilisateur et plus coûteux.
- L'indicateur ne se limite pas sur le plan du phénotype à mobiliser de plus en plus de ressources ; sa complexité croissante le conduit également à dépendre d'une part de plus en plus grande du génotype de l'individu. En effet, parmi les solutions possibles à une complexité croissante du trait, la pression de sélection sur les préférences cognitive conduira à sélectionner les variantes qui dépendent d'une part croissante du génotype, parce que c'est un tel choix qui a posteriori donnera l'indicateur le plus représentatif, et maximisera donc le succès reproductif.
Importance fondamentale de la sélection sexuelle
Lorsqu'elle est présente, dans les organismes capable de faire une discrimination entre partenaires potentiels, la sélection sexuelle apparaît comme le moteur prédominant de la sélection naturelle, refoulant la sélection de survie à un simple rôle de second plan, comme garde-fou contre les effets d'une sélection sexuelle poussant à des traits de plus en plus complexes et exacerbés.
Les ornements et parades nuptiaux sont en effet l'unique moyen pour un organisme de transmettre ses gènes, en étant conforme aux préférences sexuelles du sexe opposé. La survie de l'individu n'a d'intérêt pour l'espèce que si elle lui permet d'être sélectionné par un partenaire sexuel ; s'il n'a pas la capacité à être ainsi sélectionné, il n'aura pas de descendance, et sa survie est indifférente pour le futur de l'espèce[22].
Dans la mesure où elle s'appuie sur des indicateurs de bonne adaptation, cette forme de sélection accélère ce qu'aurait été la sélection naturelle de survie.
Traits modelés par une sélection sexuelle
Types de traits concernés
.jpg.webp)
Les traits qui peuvent faire l'objet d'une sélection sexuelle peuvent prendre n'importe quelle forme accessible au phénotype étendu.
De manière immédiate, la sélection sexuelle peut modeler les traits anatomiques d'une espèce. Sa présence est particulièrement évidente dans le cas où cette pression de sélection conduit à un dimorphisme sexuel. Elle peut également être à l’œuvre à chaque fois que des traits non fonctionnels sont partagés par les deux sexes. De tels traits arbitraires pour ce qui est de la sélection de survie ont longtemps été présentés comme des signes de « reconnaissance mutuelle » au sein de l'espèce ; leur interprétation dans le contexte d'une sélection sexuelle est plus précisément qu'ils permettent (ou ont permis dans le passé évolutif de l'espèce) de reconnaître les individus non dégénérés de l'espèce[24].
La parade sexuelle constitue évidemment un trait comportemental faisant l'objet d'une sélection sexuelle, puisque c'est elle qui conduit au choix immédiat du partenaire reproductif. Cependant, la sélection sexuelle ne se limite pas nécessairement à la parade sexuelle proprement dite, mais peut englober l'ensemble du comportement animal. Ainsi, tous les comportements de dominance et de parentèle chez les primates conditionnent quels seront les accouplements les plus fréquents, et sont donc de ce fait l'objet d'une pression de sélection sexuelle[24].
Un exemple extrême de phénotype étendu est le comportement « artistique » des Ptilonorhynchidae (oiseaux jardiniers), dont les mâles construisent des œuvres complexes attirant l'admiration des femelles : celles-ci ne sont pas attirées directement par le comportement du mâle, mais par la qualité de la production matérielle de ce comportement. Si l’œuvre démontrée par le mâle est convaincante, elle servira de chambre nuptiale à un accouplement bref, et la femelle s'en ira pour construire seule son propre nid et élever ses poussins en solitaire[26].
Pour Geoffrey Miller, ce dernier exemple illustre que la sélection sexuelle pourrait même expliquer le tempérament artistique de l'homme. Il considère, de même, que la pression de sélection sexuelle peut expliquer le développement d'un instinct d'altruisme, suivant le même mécanisme que celui observé par Amotz Zahavi chez le Cratérope écaillé (Turdoides squamiceps), l'altruisme s'analysant comme un trait comportemental, dont l'origine est irréductible à toute relation évoquée pour l'évolution de l'altruisme (réciprocité ou népotisme), et dont l'affichage donne à son porteur une sorte de « prestige social » pouvant faire l'objet d'une sélection sexuelle. Comme le souligne Miller, une telle origine ne signifie pas que les gens sont généreux pour améliorer leur score reproductif : ils veulent être généreux parce que ça satisfait en eux une tendance réelle, qui constitue leur motivation. Mais justifier un comportement objectif par une « tendance » subjective n'explique rien en termes d'évolution. La question, en amont, est de savoir quelle pression sélective a pu être à l'origine d'une telle tendance ; et de fait, ce comportement présente de nombreux traits communs à ceux ayant fait l'objet d'une sélection sexuelle — il est sans bénéfice de survie, coûteux, complexe, facilement observable et d'une grande variabilité[27]. De plus, le comportement attire l'attention et paraît séduisant, ce qui donne à son auteur un avantage sélectif s'agissant de se faire choisir comme partenaire sexuel.
Signes d'une sélection sexuelle active

Les traits faisant l'objet d'une sélection sexuelle active tendent à présenter des caractères distinctifs[1] :
- Dans la mesure où c'est le plus souvent la femelle qui tend à être regardante sur son choix de partenaire, les traits tendent à être plus présents ou accentués chez le mâle.
- Ayant pour principale cible de permettre le succès d'une parade sexuelle, ils n'apportent pas de bénéfice immédiat à la survie de l'individu, mais peuvent au contraire souvent lui être un handicap dans le reste de son existence.
- La cible étant une réaction subjective du partenaire potentiel, ils ne répondent pas à une nécessité fonctionnelle objective et paraissent arbitraire à l'observateur extérieur.
- Étant liés au succès d'une parade sexuelle, ces traits sont souvent apparents chez l'adulte mais pas chez le juvénile ; et ces traits capturent l'attention du partenaire et lui paraissent séduisants.
- Dans la mesure où ces traits sont à la fois des indicateurs de bonne santé physique et de bonne santé génétique, ils présentent une grande variance dans la population, ces différences dépendent du bon état général du patrimoine génétique de l'individu, et sont corrélées d'une génération à l'autre.
- Dans la mesure où le choix du partenaire sexuel repose sur une comparaison de performance, ces traits tendent à être inégalement répartis dans la population, à être d'autant plus manifestes que l'individu est en bonne santé générale, et à être coûteux et difficiles à acquérir pour l'individu en mauvaise santé.
Effet d'une pression de sélection
La sélection sexuelle conduit à des évolutions rapides, dans des directions arbitraires et imprévisibles ; différents sous-groupes isolés dans une population auront une évolution divergente. Les traits qui évoluent sous cette pression sélective n'apportent généralement pas de bénéfice à l'individu en termes d'aptitude à la survie dans son contexte écologique.
Au contraire, la sélection naturelle conférant un avantage de survie dans un contexte écologique donné stabilise les caractéristiques d'une espèce tant que le contexte écologique est stable, en éliminant les individus qui s'écartent de l'optimum.
Signes d'une sélection de survie
Des traits optimisés par une sélection naturelle tendent à présenter des caractéristiques inverses[1] :
- Ils ne présentent plus de variation entre individus, ou du moins ne présentent plus qu'une variation résiduelle aléatoire, parce que les versions moins bien adaptées du pool génétique auront été éliminées au fil des générations.
- Leur valeur d'équilibre répond à une fonction biologique apparente, le trait permet à l'individu de bénéficier d'une meilleure adaptation à son environnement, et un écart trop important par rapport à cette valeur conduit à un détriment sélectif.
- Étant modelés par une fonction biologique objective, les traits adaptatifs font souvent l'objet d'une convergence évolutive d'espèces non apparentées.
- Les innovations conduisant à un avantage sélectif important sont souvent à l'origine d'une radiation évolutive.
Dans ces comparaisons, il faut faire attention à ce qu'un trait peut avoir fait dans le passé l'objet d'une sélection sexuelle conduisant à un emballement fisherien, mais lorsqu'une contre-sélection se fait sentir, ces traits redeviennent modelés par la sélection naturelle. Ainsi la longueur de la queue du paon est à présent régulée à la fois par le détriment sélectif que représenterait une queue significativement plus longue et le détriment reproductif que représenterait une queue significativement plus courte ; la sélection sexuelle ne portant plus à présent que sur l'énergie dépensée à la parade nuptiale.
Séduction cognitive
Une équipe de l’Institut de zoologie de l’Académie chinoise des sciences de Pékin, a examiné si les perruches avaient modifié leur préférence pour les mâles après avoir observé la capacité d’un prétendant potentiel à faire quelque chose d’intelligent que son rival ne pouvait accomplir. L'expérience montre que l’observation directe des aptitudes cognitives peut influer sur la préférence du partenaire et, par conséquent, que les aptitudes cognitives peuvent être choisies directement par le partenaire[28].
Conséquences évolutives d'une sélection sexuelle
Spéciation

Francis Bacon, commentant l'apparente inutilité de la diversité des plantes et des animaux, y voyait « la simple fantaisie de la nature »[29]. Dans la grande majorité des cas, les traits distinctifs qui différencient une espèce d'une autre ne peuvent pas être rattachés à un avantage sélectif de survie. Mais si l'évolution n'est poussée que par l'avantage de survie qu'y trouvent les individus, pourquoi y a-t-il une telle variété de formes, mais finalement si peu d'innovation réelle?
En taxinomie, ce sont le plus souvent les ornements particuliers du mâle, et les détails de l'appareil génital mâle, qui permettent de différencier les espèces au sein d'un genre donné. C'est une expérience courante de l'ornithologue, que la vue d'une femelle ne permet souvent que d'identifier le genre, l'observation du mâle permettant de préciser l'espèce[22]. Dans le domaine botanique, ce sont plutôt les détails de l'appareil génital femelle que sont les fleurs, qui fournissent les critères les plus discriminants.
Les micro-innovations qui caractérisent une espèce sont souvent des traits que peuvent sélectionner une sélection sexuelle[22]. À un certain niveau, on peut y voir l'effet d'une sélection sexuelle effective, conduisant à singulariser des traits phénotypiques à travers le choix d'un partenaire d'accouplement. Comme le souligne William Eberhard, l'appareil génital mâle est souvent la première chose à diverger quand une espèce se sépare d'une autre[30], et ce n'est évidemment pas une pression sélective de survie qui explique une telle focalisation sur le sexe, mais bien plutôt une pression de sélection sexuelle.
Mais inversement, la sélection sexuelle est un mécanisme très efficace pour induire une barrière de sélection entre espèces sœurs. Comme le soulignait le biologiste Hugh Paterson, les espèces sont avant tout un système consensuel de sélection de partenaire d'accouplement. Dans la mesure où les taxinomistes cherchent à distinguer les espèces, ils se retrouvent à utiliser les mêmes distinctions que celles suivies par les espèces elles-mêmes : des différences dans les ornements sexuels, et dans les comportements des parades sexuelles[22].
Les traits modelés par une sélection sexuelle ne répondent généralement pas à une fonctionnalité de survie, et sont donc le plus souvent spécifiques à une espèce particulière. Lorsqu'au contraire un trait présente un avantage adaptatif, il est généralement à l'origine d'une spéciation rayonnante où la même fonctionnalité nouvelle est appliquée à des environnements écologiques variés ; dans ce cas il tend à caractériser un genre plutôt qu'une espèce[31].
Mais un trait initialement porté par la sélection sexuelle peut s'avérer a posteriori porteur d'un avantage adaptatif.
Amplification de traits adaptatifs

La sélection sexuelle est aussi responsable du développement d'adaptations spécifiques. Un des problèmes auquel doit répondre la théorie de la sélection naturelle est : comment des fonctionnalités anatomiques innovantes peuvent-elles émerger d'une succession de micro-changements quantitatifs? Même s'il est clair, pour un regard extérieur, que l'investissement initial nécessaire à une proto-aile est de toute manière largement rétribué par le bénéfice ultérieur que constitue le vol, justifier ainsi ces évolutions serait de la téléologie. La sélection naturelle ne travaille pas sur le long terme, chaque génération doit en principe recevoir « cash » le bénéfice d'une évolution, même minime, si celle-ci doit être effectivement sélectionnée.
Autant des traits simples, comme la longueur du cou d'une girafe ou le camouflage parfait d'un phasme peuvent s'expliquer par une lente dérive réalisant un progrès continu sous une pression de sélection de direction constante, autant des traits complexes dépendant de l'interaction harmonieuses de nombreuses caractéristiques sont plus difficiles à expliquer[22]. Le problème était connu de Darwin, et a toujours été la principale objection à sa théorie : comment la sélection naturelle peut-elle par exemple favoriser le coût biologique d'une proto-aile, avant que celle-ci ne soit suffisamment grande et complexe pour constituer un avantage de survie? C'est un paradoxe sorite : à partir de quel point une sélection a priori quantitative peut-elle finalement conduire par accumulation à une évolution qualitative?
Au début d'une évolution, en effet, les changements impliquent un coût croissant, puisqu'ils éloignent la population concernée de son équilibre écologique ; mais ils n'apportent pas systématiquement un bénéfice net en termes de survie, parce qu'un développement plus important est nécessaire pour qu'une fonctionnalité nouvelle puisse émerger[22]. Cet effet de seuil apparent a pu être minimisé par certains biologistes comme Richard Dawkins ou Manfred Eigen, pour lesquels ce n'est pas parce qu'un chemin évolutif n'est pas imaginable avec nos connaissances qu'il n'existe pas ; mais l'obstacle reste réel pour ceux qui n'acceptent pas d'adhérer à un tel acte de foi[22].
La sélection sexuelle est une réponse possible à ce paradoxe, dans la mesure où elle peut précisément favoriser le développement de traits complexes et relativement coûteux, sans qu'ils aient par eux-mêmes d'avantage en termes de survie de l'individu[22]. En effet, la sélection sexuelle a pour effet d'entraîner pour la population une marche aléatoire parcourant l'espace des phénotypes physiques et comportementaux, au cours de laquelle le long terme de la pression de sélection de survie est largement compensée par la pression immédiate de la sélection sexuelle. Chaque sous-espèce invente sa propre variante, qui peut conduire à des spéciations foisonnantes. Tant que la sélection sexuelle est active, elle pousse le trait à croître en complexité et à conserver sa variabilité ; puis lorsque le trait atteint une limite pratique, la sélection en réduit la variabilité, il cesse d'être un indicateur pertinent, et se fossilise dans le phénotype de l'espèce, où n'étant plus porté par une sélection active il est alors susceptible de dégénérer et même de disparaître.
Mais dans cette démarche aléatoire, l'élaboration de traits complexes peut parfois conduire, par sérendipité, à offrir à la population une capacité fonctionnelle nouvelle. Dans ce cas, la pression de sélection de survie prend le relai de la sélection sexuelle, et pousse l'évolution dans une direction où le trait complexe devient optimisé pour sa nouvelle fonction et cesse d'être un indicateur cible de la sélection sexuelle.
L'évolution de l'aile des oiseaux à partir de leurs ancêtres théropodes est peut-être un bon exemple de ce relai entre sélection sexuelle et sélection de survie sur une fonctionnalité nouvelle. Un animal comme Protarchaeopteryx avait des ailes bien développées, mais à quoi servaient-elles? Son aile n'a pas l'asymétrie nécessaire pour fournir une portance suffisante, et il ne présente aucune trace du squelette allégé nécessaire au vol. En revanche, une aile ornée de plumes constitue un écran particulièrement lisible, au moyen duquel peuvent s'exprimer des variantes complexes à souhait d'un phénotype physique et comportemental. Cette fonction est encore présente dans de nombreuses parades nuptiales chez les oiseaux. Dans ce cadre, il est facile d'imaginer que la parade nuptiale de certains ancêtres a pu comporter des sauts en hauteur, le meilleur sauteur étant sélectionné pour son bon état physique. Dans ce cas, la poussée supplémentaire que donne le coup d'aile a pu faire l'objet d'une sélection sexuelle, avant même de pouvoir fournir un réel avantage sélectif de survie en matière de vol[22].
Sélection sexuelle en situation monogame

La stratégie typiquement mâle de multiplier le nombre de ses « placements reproductifs » suppose qu'une copulation est relativement « gratuite » pour lui. Elle ne peut plus fonctionner lorsque chaque placement représente un « investissement reproductif » important. C'est en particulier le cas lorsque la parade nuptiale correspond à une longue période d'observation ou à la préparation d'un nid : en général, dans ce cas, le mâle n'a pas le temps ou les moyens, pendant la saison reproductrice, de renouveler l'activité qui lui aura été nécessaire pour convaincre une femelle de consentir à une copulation. Un investissement important du mâle lui impose une monogamie pratique, au moins pendant la saison de reproduction[24].
Lorsque l'investissement mâle sur une copulation devient comparable à celui de la femelle, les deux partenaires subissent alors une pression de sélection comparable pour choisir le partenaire qui optimisera les chances de survie de leur descendance, pour ce cycle de reproduction. Dans cette situation, si la femelle continue à choisir classiquement son partenaire en fonction des indicateurs de valeur sélective qu'elle perçoit, le mâle en fera autant, et n'acceptera de s'accoupler qu'avec une femelle présentant elle-même des indicateurs de valeur sélective performants. La sélection sexuelle tend alors à être une sélection mutuelle et symétrique.
Dans une population donnée, pour les individus présentant les indicateurs les plus performants, la sélection sexuelle consiste alors simplement à se reconnaître comme le couple idéal, et à s'apparier — et puis vivre heureux en ayant beaucoup d'enfants. La situation est plus complexe pour ceux dont les indicateurs sont moins performants : dans l'idéal ils préféreraient avoir comme partenaire les plus performants, mais ceux-ci sont déjà pris, ayant tendance à s'appareiller avec leurs semblables ; il ne reste que du second choix. Pour assurer un minimum de succès reproductif, le principe de réalité conduit alors à s'apparier avec du second choix, faute de mieux. De proche en proche, la superposition d'un indicateur de valeur sélective avec une pratique monogamique conduit donc à appareiller les couples : la reproduction se fait en pratique avec un partenaire de dont la valeur sélective est de rang semblable au sien[24].
L'effet global de cette sélection mutuelle est qu'elle maximalise la dispersion de la valeur sélective dans la génération suivante. Dans la mesure où la performance est héritable, les individus réalisant l'idéal de l'espèce se reproduisent entre eux à une extrémité de l'échelle, et ont une descendance optimale ; et les couples les plus dégénérés à l'autre extrémité auront la pire descendance possible[24]. Dans la mesure où l'indicateur est effectivement un indicateur d'adaptation, ce sont les descendants les plus dégénérés qui seront ensuite éliminés préférentiellement par la sélection naturelle de survie.
Ce mécanisme d'appareillement des indicateurs de valeur sélective conduit toutes choses égales par ailleurs à une pression de sélection similaire sur l'indicateur considéré. Cet indicateur tendra donc à se réaliser de la même manière indépendamment du sexe, et donc à ne pas présenter de dimorphisme sexuel[24].
La tendance à la monogamie en présence d'un investissement reproductif partagé n'est pas absolue, dans la mesure où indépendamment de toute activité coûteuse de parade et de séduction mutuelle, la tendance biologique de base reste présente, pour la femelle de se prêter à une copulation rapide avec le mâle le plus performant, et pour le mâle, d'accepter des passades sans lendemain lorsque l'opportunité s'en présente. Même dans un contexte de monogamie apparente, des écarts restent donc toujours possibles, dans la mesure où ils ne compromettent pas la solidité nécessaire au couple : les études génétiques d'espèces d'oiseaux supposées monogames montrent que la paternité réelle des poussins n'est souvent pas celle que laisserait supposer les couples formés[24].
Sélection sexuelle et dimorphisme
.jpg.webp)
La différence d'investissement parental entre mâles et femelles fait que le plus souvent, le mâle n'a aucune raison de refuser de copuler avec une femelle qui le choisirait, tandis que la femelle a un avantage sélectif à sélectionner le mâle qui paraît le mieux adapté. De ce fait, la sélection sexuelle produit les différences de phénotype étendu, anatomiques et comportementales, que l'on voit entre sexes dans la plupart des espèces : des mâles empressés et parés d'attributs sexuels extravagants, courtisant des femelles plus ternes[15].
Cependant, dans la plupart des cas, les traits sélectionnés chez le mâle par une sélection sexuelle faite par la femelle n'induisent pas nécessairement de différence entre mâle et femelle de l'espèce, parce que ces traits sont a priori hérités aussi bien chez les descendants mâles que chez les femelles[15].
Le trait sélectionné par la femelle peut être un trait s'exprimant spécifiquement chez les mâles, comme une parade nuptiale, mais peut aussi bien s'exprimer chez les deux sexes, comme la longueur de la queue ou la couleur des pattes.
Toutefois, dans ce dernier cas, si le développement du trait conduit à un handicap de survie, l'expression de ce trait chez la femelle fera l'objet d'une sélection négative, parce que le trait n'est pas intéressant pour le choix du mâle et n'apporte donc pas d'avantage reproductif pour la femelle. Typiquement, cette pression sélective conduira à accrocher au gène un mécanisme faisant dépendre son expression de la présence d'hormones sexuelles, et inhibant son expression chez la femelle[15]. Cette dissymétrie dans l'expression du gène conduit alors seulement à un dimorphisme sexuel.
De nombreux traits, par exemple la taille, la couleur, une musculature puissante, peuvent être non seulement un avantage pour la collecte de nourriture tout en constituant aussi des attracteurs sexuels importants.
Ces traits, qui donnent un avantage à un individu par rapport à ses rivaux lors de la recherche d'un partenaire sexuel, sont appelés caractères sexuels secondaires. Ils peuvent être de plusieurs types :
- Morphologique et physiologiques (organes de séduction et/ou de duel entre individus du même sexe. Exemple : les bois du cerf ; plumes de couleur chez les oiseaux).
- Éthologiques (comportement de recherche de partenaire, de défense du territoire, parade nuptiale, aire de parade...).
Les différences sexuelles directement liés à la reproduction et ne servant pas spécifiquement à la recherche d'un partenaire sont appelés caractères sexuels primaires.
Sélection sexuelle chez l'être humain
Historique
Dès qu'il propose sa théorie de la sélection sexuelle en 1871, Charles Darwin envisage que celle-ci s'applique autant à l'espèce humaine qu'aux autres espèces animales. Par exemple, la pilosité particulière de notre espèce, quasi absente sur l'ensemble du corps mais très présente sur la tête (barbe et cheveux), constituait pour Darwin un produit de la sélection sexuelle en l'absence d'avantage sélectif pour la survie. De même expliquait-il l'origine des races humaines qui ne semblait pas être le résultat de la sélection naturelle. La bipédie, l'accroissement du cerveau, ont été aussi supposés provenir de la sélection sexuelle[32]. Il remarque à ce propos qu'il est heureux que cette sélection n'a pas fait l'objet d'une évolution vers le dimorphisme[15] :
- « Il est vraiment heureux que la loi de l’égale transmission des caractères aux deux sexes ait généralement prévalu dans toute la classe des mammifères ; autrement, il est probable que l’homme serait devenu aussi supérieur à la femme par ses facultés mentales que le paon par son plumage décoratif relativement à celui de la femelle. » (la Filiation de l'homme et la sélection liée au sexe, Charles Darwin)
Plus récemment, il a été suggéré que le pénis de l'homme, et notamment le gland, est le produit d'une compétition post-copulatoire entre les individus mâles : la forme de cet organe sexuel est telle qu'il agit comme un aspirateur qui élimine le sperme d'éventuels autres mâles qui l'auraient précédé[33].
Spécificités humaines
Toutefois, dans l'espèce humaine, les mécanismes de la sélection sexuelle restent difficiles à mettre en évidence du fait des traditions culturelles qui régissent les comportements sexuels (séduction, rapport sexuel...), et des capacités intellectuelles individuelles qui se superposent aux conduites plus instinctives.
Les recherches menées sur le sujet ont donc étudié les phénomènes associés aux possibles formes de sélection sexuelle dans l'espèce humaine sous deux angles principaux :
- la psychologie interculturelle qui recherche dans les comportements sexuels des universaux indépendants des pratiques culturelles ;
- la psychologie expérimentale, qui étudie l'influence de différents facteurs expérimentaux sur le choix effectué par les sujets interrogés sur leur préférence concernant un partenaire sexuel.
Traits valorisés
Les travaux menés par le psychologue évolutionniste David Buss auprès de plusieurs dizaines de cultures différentes montrent que, dans l'espèce humaine, certains traits sont universellement valorisés chez un partenaire sexuel : la gentillesse, l'intelligence, la bonne santé... Par ailleurs, certaines caractéristiques physiques sont jugées plus attirantes que d'autres, comme la symétrie du visage ou du corps. Mais outre ces facteurs communs aux deux sexes, la théorie de la sélection prédit des différences entre les hommes et les femmes quant à leurs préférences, en raison de la différence dans l'investissement parental entre les deux sexes.
En effet, dans la majorité des cultures, les hommes sont influencés par certains critères morphologiques liés à la fertilité des femmes, comme un jeune âge, le volume des seins ou encore un faible rapport taille-hanche. À l'inverse, aux yeux des femmes, un partenaire est jugé en moyenne plus attractif s'il est plus âgé qu'elles-mêmes ; comparativement aux hommes, les caractéristiques physiques sont moins importantes que celles liées au statut social[34].
Des travaux menés en laboratoire semblent aussi montrer que les humains sont aussi sensibles à de multiples autres facteurs de façon plus ou moins explicite. Une série d'expériences ont ainsi mis en évidence que les êtres humains étaient sensibles aux odeurs. Les femmes rapportent être de meilleure humeur après avoir senti des stéroïdes produits par les glandes sudoripares des aisselles, telles qu'on peut les recueillir chez des hommes adultes. Sans les voir, les femmes préfèrent les odeurs des hommes dont la morphologie est symétrique[35]. Le rôle du baiser sur la bouche est aussi évoqué par Thierry Lodé comme favorisant une exploration du système immunitaire. Enfin, les odeurs semblent aussi utilisées (de façon implicite) pour favoriser la diversité génétique : un individu juge plus agréable une odeur provenant d'une personne de sexe opposé dont le système HLA présente une plus grande dissemblance avec le sien[36].
Dimorphisme humain
Si le dimorphisme anatomique entre les deux sexes suggère que la sélection sexuelle a un rôle significatif dans l'évolution des traits anatomiques et physiologiques de l'être humain, les conséquences de celle-ci sur les comportements sexuels restent controversées. Les éléments les plus probants viennent des comparaisons trans-culturelles qui montrent que les conséquences comportementales d'une forme de sélection sexuelle dans l'espèce humaine semblent bien universelles — ce qui n'exclut pas de nombreuses variations tant entre qu'à l'intérieur même de chaque tradition culturelle. Par contre, les mécanismes neurocognitifs sous-jacents restent eux encore peu explorés.
Appareil génital
La sexualité humaine et la reproduction humaine se distinguent de celle des autres grands singes. La femme humaine n'a pas d'œstrus visible, ce qui implique que le succès reproductif du mâle repose non sur le succès d'un coït ponctuel, mais sur une séquence de monogamie exclusive suffisamment prolongée[31].
De ce fait, le succès reproductif du mâle suppose un investissement suffisant dans une relation particulière. Même si cet investissement est moindre que celui de la femelle, il est suffisant pour que la formation d'un couple raisonnablement stable justifie une pression de sélection de la part de l'homme choisissant sa compagne pour un certain temps[31].
Le mâle humain a un pénis long, flexible et épais, se distinguant des pénis de la taille d'un petit crayon et rigidifié par un baculum des autres grands singes[31] ; la copulation d'un couple humain est beaucoup plus variée et prolongée que celle de ses cousins [31] ; et la partenaire femelle heureusement stimulée peut atteindre un orgasme clitoridien inconnu de ses cousines[31] ; l'ensemble suggérant que pénis et clitoris ont co-évolué dans un effet de sélection sexuelle comme organe respectivement émetteur et récepteur d'une mesure de valeur sélective mesurée à la capacité à donner du plaisir sexuel[31].
Répartition adipeuse chez les femmes
Initialement, la glande mammaire des femelles hominidés (et des mammifères en général) n'est gonflée par la lactation que pendant la grossesse et l'allaitement, et est peu manifeste le reste du temps. De ce fait, une « poitrine avantageuse » pour un grand singe démontre une situation d'infertilité, et pour ce qui est de l'attrait sexuel, fonctionne comme un signal négatif sur le mâle (au contraire donc du signal positif qu'est l'œstrus apparent). Or la grossesse et l'allaitement peuvent se prolonger très longtemps, d'autant plus qu'avec un rythme de maturation plus lent, le sevrage définitif peut n'intervenir que vers trois ans, ce qui est un facteur naturel d'espacement des grossesses.
Avec une différenciation croissante des rôles entre mâles et femelles, ces dernières ont intérêt à rechercher l'attachement permanent d'un mâle protecteur, afin de ne pas s'exposer à la charge de devoir gérer sa progéniture sans aide extérieure. De ce fait, favoriser un comportement sexuel opportuniste devient pour elles un désavantage sélectif[37]. Dans la lignée qui a conduit à l'homme moderne, la pression écologique étant pour les femelles de favoriser une disponibilité sexuelle quasi-permanente, afin de maintenir le lien d'interdépendance avec le mâle, une pression de sélection favorise alors les femelles dont la poitrine est de taille sensiblement constante, plutôt que de varier visiblement en fonction de la fertilité. Symétriquement, et dans la mesure où la poitrine ne devient apparente qu'avec la puberté, la même pression de sélection va favoriser les mâles pour lesquels la poitrine féminine volumineuse devient un signal positif, parce que l'attrait spécifique d'une poitrine plate, qui dirigerait le désir sexuel vers des copulations infertiles, ne constitue alors plus un avantage sélectif[38]
Selon le psychologue Geoffrey Miller dans son ouvrage The Mating Mind, une forte poitrine serait ainsi l'objet d'une sélection sexuelle (mais le signal négatif d'une telle poitrine peut continuer à se manifester comme atavisme). Cette poitrine importante n'est pas corrélée à une meilleure capacité de lactation, puisqu'elle est due à une accumulation de tissus adipeux au niveau du sein[31]. Elle présenterait tous les signes d'une sélection sexuelle effective (effectuée de manière atypique par le mâle, puisque l'indicateur se développe chez la femelle). En revanche, l'indicateur constitue un bon indicateur de la valeur sélective, le volume des seins variant rapidement en fonction de l'état général de l'individu[31]. Il peut jouer un rôle important lors de la parade sexuelle au sens large : les seins n'apparaissent qu'à la puberté, ils sont généralement considérés comme plaisants à regarder, et attirent d'autant plus le regard qu'ils oscillent pendant la marche[31].
La même attirance de l'œil pour les formes plutôt rondes aurait selon lui conduit chez la femme à une accumulation secondaire de graisse au niveau des fessiers et des cuisses[31], accentuant la bosse naturelle formée par le grand glutéal, et soulignant la différence d'orientation dans l'attache de celui-ci, due à la fois à la différence anatomique du petit bassin entre l'homme et la femme, et au ratio taille / hanche plus faible chez celle-ci. Chez la femme, la ligne principale du relief converge de bas en haut, suivant un angle de l'ordre de 25 à 30° de la verticale ; et le geste des deux mains reproduisant un tel angle à hauteur de hanches est généralement compris comme évoquant une femme.
Les études psychologiques montrent que l'homme a une préférence pour les femmes au ratio taille / hanches plus faible, les jeunes femmes en début de fertilité ayant typiquement un ratio de 0,7, contre plutôt 0,9 pour les hommes[31] selon une idée défendue par de nombreux psychologues évolutionnistes, mais fortement contestée[39] - [40] - [41] - [42]. Ce taux de 0,7 pour les femmes résulte d'une étude portant sur 14 hommes, soumis à des mesures par imagerie cérébrale, et à qui il était demandé de noter l'attractivité de photos de femmes avant et après chirurgie plastique, l'opération de chirurgie ayant conduit à amener ce ratio à 0,7 présupposé comme étant idéal[43].
Mais ces réserves de graisse fondent dans les corps féminins soumis à stress physique intense, comme chez les coureurs de fond, les ballerines ou les anorexiques, qui tendent à avoir moins de fesses et de poitrine, et souffrent souvent d'aménorrhée[31].
Exemples et interprétations de sélection sexuelle
Sélection pré- et post-copulatoire
Même si elle est moins visible, la sélection sexuelle peut se prolonger après l'acte copulatoire. En effet, avant l'accouplement proprement dit, lors de la phase pré-copulatoire, les individus sont en compétition pour accéder au partenaire. Mais cette compétition ne cesse pas après que l'acte sexuel a eu lieu. Ainsi, chez les vertébrés, la femelle, qui est en général le sexe qui produit le moins de gamètes et pour qui l'investissement parental est le plus élevé, peut chercher à se reproduire avec d'autres mâles : c'est ce qu'on appelle la polyandrie. Dans ce cas, les spermatozoïdes de ses différents partenaires sexuels se mêleront dans son système reproducteur et entreront en compétition (intra-sexe) pour féconder le ou les ovule(s). D'un point de vue évolutif, la femelle a donc intérêt à mettre en concurrence les gamètes de plusieurs partenaires afin de se reproduire avec le meilleur fécondateur. Dès lors, il peut s'établir une compétition inter-sexe par laquelle l'un des deux partenaires (en général, le mâle) contraint la femelle à ne pas avoir de relations sexuelles avec d'autres individus.
Le choix qu'exerce la femelle par l'intermédiaire d'une sélection sur les gamètes mâles a été baptisé « choix femelle cryptique ».
Signaux sexuellement sélectionnés et immunocompétence
La sélection sexuelle repose en partie sur l’existence de caractères sexuels secondaires dont la production a un coût énergétique et physiologique : ils sont alors perçus comme des signaux honnêtes de bonne qualité du mâle par la femelle.
La théorie du handicap d'immunocompétence définit le mécanisme général pour expliquer les coûts de ces caractères sexuels secondaires, en particulier celui des ornements. Elle stipule que les individus mâles portent des ornements aux dépens de leur propre résistance aux parasites et aux maladies. Ce compromis se présente comme une conséquence de la dualité des effets des androgènes sur ces caractères sexuels secondaires et la fonction immunitaire : un fort taux d'androgènes aura pour résultat des ornements plus développés, mais aussi une action immunosuppressive[44]. Mais il peut aussi se présenter en l'absence d'effets directs médiés par les hormones sexuelles.
La testostérone est une molécule androgène qui a pour effet d’accroître les ornements, mais aussi de diminuer la capacité immunitaire de l’individu[45]. En conditions naturelles, les ornements qu’arborera un individu mâle seront d’autant plus importants que son immunocompétence sera élevée, donc que son génome sera adapté pour faire face aux parasites et/ou maladies ou que sa capacité à trouver de la nourriture dans le milieu sera bonne [44]. Un mâle très immunocompétent pourra ainsi maintenir une concentration élevée de testostérone et, malgré les effets immunosuppresseurs de cet androgène, garder une bonne immunocompétence. Une femelle qui choisira un mâle portant ces signaux exagérés témoignant de sa qualité sera ainsi assurée de transmettre de bons gènes à sa descendance.
Mais la variation d’allocation des ressources n’est pas toujours liée à l’effet d’un androgène :
- Des recherches menées chez le diamant mandarin[46] ont montré que les caroténoïdes qu’il prélève dans son environnement améliorent à la fois son immunocompétence et son caractère sexuel secondaire, ici la couleur du bec. En accord avec la théorie du handicap d’immunocompétence, les mâles ayant une bonne immunocompétence allouent préférentiellement les caroténoïdes à la couleur de leur bec, et attirent donc plus les femelles.
Signaux sexuellement sélectionnés et parasitisme
L'existence d’une influence du parasitisme sur la sélection sexuelle a longtemps été discutée, mais il est désormais admis qu'il existe une corrélation entre parasitisme et succès reproducteur.
De nombreuses études ont mené à l’émergence des théories suivantes :
- En 1982, les travaux effectués par William Hamilton et Marlene Zuk sur des passereaux d’Amérique du Nord et leurs parasites sanguins les amènent à émettre « l’hypothèse des bons gènes »[47]. Ils proposent un modèle de sélection sexuelle dans lequel le choix du(des) partenaire(s) sexuel(s) par les femelles se fait via certains traits mâles jouant un rôle de signal de leur résistance aux parasites, tels que l’éclat ou le chant. L’expression de ces traits étant liée à des gènes de résistance parasitaire, leur degré d’expression indiquerait l’héritabilité de la résistance des mâles au parasitisme. Choisir un partenaire possédant des « signaux honnêtes » (voir la définition dans le paragraphe « Historique ») indicateurs d’une certaine « qualité » permettrait donc aux femelles d’avoir des descendants jouissant eux aussi d’une résistance à l’infection par des parasites. Cela conduit à la prédiction que l’intensité de la charge parasitaire serait inversement corrélée au succès reproducteur du mâle. Il est important de noter que la théorie de Hamilton et Zuk présente certaines limites. Par exemple, elle ne permet pas d'expliquer les résultats d'études dans lesquelles aucune relation entre la charge parasitaire du mâle et son succès reproducteur n'a été trouvée[47].
- En 1986, Gerald Borgia, reprenant les travaux de Hamilton et Zuk au travers d’une étude sur le Jardinier satiné (Ptilonorhynchus violaceus) et de l’un de ses ectoparasites (le pou blanc Cuclotogaster sp.), les complète en proposant la « théorie de l’évitement du parasitisme »[48]. Dans ce nouveau modèle, l’évitement d’une infection parasitaire est un bénéfice potentiel direct pour les femelles. En effet, en évitant tout contact avec un mâle parasité, la femelle évite d’être elle-même parasitée et, dans le cas où le partenaire participerait à l’élevage des petits, elle écarte toute transmission possible de parasites vers ses descendants, et garantit par ailleurs de meilleurs soins parentaux (un mâle infesté sera en moins bonne santé et procurera donc de moins bons soins parentaux qu’un mâle non parasité). Ce modèle diffère de celui de Hamilton et Zuk dans lequel le choix des femelles se fait en vue de l’acquisition de bons gènes pour leur descendance (bénéfices indirects pour les femelles). Mais il connaît des limites ; par exemple il n’explique pas la corrélation négative entre la virulence du parasite et le degré d’expression de certains caractères mâles affectés par le parasitisme.
- En 1995, David J. Able propose la « théorie de l’indicateur de contagion »[48]. Il définit la notion de parasite « associativement transmissible » (« associatively transmissible »), qui correspond à un parasite pouvant être transmis du mâle vers la femelle et/ou vers sa descendance par contact direct ou indirect. Il prédit que les caractères mâles importants dans le choix des femelles indiqueraient l’éventuelle présence d’un parasite « associativement transmissible ». De ce fait, l’intensité de l’infection engendrée par un tel parasite serait négativement corrélée au succès reproducteur du mâle et au degré de développement de ses caractères. À l’inverse, ces caractères ne pourraient pas indiquer la présence d’un parasite « non associativement transmissible ». Les mâles infectés par un tel parasite ne verraient donc pas leur succès reproducteur se modifier. Contrairement à l’hypothèse de Hamilton et Zuk, Able fait la distinction entre parasite « associativement transmissible » et « non associativement transmissible ». Il reprend la théorie de Borgia et ajoute qu’il y a bénéfice direct pour les femelles lorsqu’elles évitent les mâles parasités, mais uniquement si le parasite est « associativement transmissible ».
Il est toutefois important de garder à l’esprit qu’aucune des théories citées ci-avant ne permet de fournir une explication applicable et généralisable à toutes les catégories de parasites et d'hôtes. Leur diversité, ainsi que la diversité de leur environnement et des processus impliqués dans leurs interactions, sont en effet extrêmement importantes.
De nombreuses études concernant l’influence du parasitisme sur des traits sexuellement sélectionnés ont été menées, certaines confortant une ou plusieurs des théories définies ci-dessus :
- Une étude[49] a montré que chez les guppies (Poecilia reticulata) mâles, une infection par le parasite Gyrodactylus turbulliqui donnait lieu à une diminution générale des trois paramètres caractérisant leur motif de couleur en caroténoïdes : teinte, éclat, valeur. Il a par ailleurs été démontré qu’après le traitement, les femelles avaient une nette préférence pour les mâles non infectés.
- D’autres travaux[50], s’appuyant sur des études montrant que les chants complexes des oiseaux mâles sont préférés des femelles, ont mis en évidence les conséquences d’une infection par le parasite Plasmodium relictum (responsable du paludisme des oiseaux) sur la qualité et la complexité des chants de canaris (Serinus canaria) juvéniles. Il résulte de cette infection une diminution significative de l'hématocrite et de la taille du noyau HVC (High Vocal Centre) du cerveau, impliqué dans le contrôle du syrinx (organe de chant), ainsi qu’une réduction significative de la complexité et du répertoire de chant. Cette étude suggère que la complexité des chants aurait évolué comme étant un indicateur honnête du statut parasitaire de l’oiseau.
- Peu d’études ont été menées dans le domaine des signaux chimiques. On peut toutefois noter certains travaux sur des souris (Mus musculus) infectées par différents parasites tels qu'Eimeria vermiformis et Heligmosomoides polygyrus (en)[51]. Il a notamment été montré que les souris femelles peuvent discriminer de par leurs urines, les mâles parasités et non parasités. Par ailleurs, il a été observé au cours de cette étude que l'urine des mâles infectés perd son attractivité et influence donc directement le choix des femelles en faveur de l'urine des mâles non infectés.
- Chez les jardiniers satinés (Ptilonorhynchus violaceus), espèce hautement polygyne, la charge parasitaire en poux (Cuclotogaster sp.) n’est pas une cause majeure dans les variations du succès reproducteur entre mâles. Cependant un niveau d’infection bas est indicateur des bonnes conditions de santé des mâles. De plus, des mâles vigoureux réalisent un « berceau nuptial » de meilleure qualité ce qui, aux yeux des femelles, est un indicateur de la condition des mâles qui vont donc être préférés[52].
- Les demoiselles mâles de la sous-espèce Calopteryx splendens xanthostoma possèdent de larges taches mélanisées sur leurs ailes. La déposition de la mélanine pour ce signal sexuel se fait via la cascade enzymatique de la phénoloxidase, cascade qui assure également la défense contre leur endoparasite unicellulaire, une grégarine. Il existe une corrélation positive entre l’hétérogénéité des taches et la charge parasitaire chez les mâles infectés par le grégarine : les mâles possédant des taches alaires foncées et homogènes résistent mieux au parasitisme que les mâles avec des taches plus claires et plus hétérogènes[53]. Cela suggère que la distribution de la pigmentation sur les ailes des mâles est un signal honnête de leur résistance au parasitisme, en accord avec la « théorie du handicap d’immunocompétence » (voir le paragraphe « Signaux sexuellement sélectionnés et immunocompétence »). De plus, ces mâles possédant un signal honnête sont préférés des femelles. Si la résistance au parasite est héritable, ce choix sera indirectement bénéfique pour les femelles (meilleure descendance) ; un résultat qui confirme l’hypothèse des « bons gènes » de Hamilton et Zuk.
Signaux sexuellement sélectionnés chez les femelles
Dans la majorité des cas, l’apparition des ornements et des caractères sexuels secondaires développés chez le mâle résulte de la sélection sexuelle exercée par les femelles. Cependant des études récentes ont montré que chez certaines espèces, les mâles peuvent également effectuer une sélection chez les femelles (sélection intersexuelle). Les femelles se retrouvent alors en compétition pour avoir accès aux mâles, les attirer et se reproduire (sélection intra-sexuelle). Les espèces où se produit ce phénomène sont qualifiées d’espèces à rôle sexuel inversé[54] - [55].
La sélection est réalisée par le mâle dans les cas où le coût de la recherche de partenaires est faible et lorsque l’investissement parental et le coût de l’accouplement des mâles sont également importants. De même cette sélection est observée lorsque le sex-ratio est biaisé en faveur des femelles et que le potentiel reproducteur de celles-ci varie[56].
Le choix des mâles est orienté par les caractères sexuels secondaires développés par la femelle tels qu’un plumage/pelage très coloré, des ornements élaborés ou encore des armements. Ces signaux que la femelle exhibe sont des indicateurs de la qualité génétique et phénotypique ainsi que de son succès de reproduction[57]. On observe certains de ces signaux chez différentes espèces.
- Chez les fous à pieds bleus (Sula nebouxii), espèce socialement monogame, l’intensité de la coloration des pieds donne une indication sur la qualité de la femelle. Selon l’intensité, la fréquence des parades entre partenaires est affectée. Une coloration moins foncée est préférée parce qu’elle montre que l’oiseau est en bonne condition. En effet, les femelles avec des pieds moins foncés pondent un plus grand nombre d’œufs[57].
- Dans le cas des gobies de lagune (Knipowitschia panizzae), la taille de la tache jaune est un indicateur de fécondité et révèle probablement d’autres indices qui n’ont pas encore été mis en évidence comme, la qualité des œufs. Les mâles ont une préférence pour des femelles possédant une tâche plus large au niveau du ventre[58].
- Chez le coq domestique (Gallus gallus), il a été montré que la taille des crêtes reflète la fécondité et la bonne santé des femelles et influence le choix des mâles. Ils choisissent préférentiellement les femelles possédant les crêtes les plus larges, qui reçoivent une quantité de sperme plus importante[56].
- La coloration grise de la queue chez les faucons crécerelles (Falco tinnunculus) semble être un indicateur de la qualité des femelles. Les plus grises paraissent avoir de meilleures capacités à obtenir un partenaire. La coloration favoriserait donc la sélection des femelles chez cette espèce. Cette coloration, induite par la mélanine, est plus présente chez les femelles adultes, et il y a une corrélation entre ce trait et la taille des couvées[59]. La coloration du plumage pourrait être un signal que l’on retrouve également chez d’autres espèces d’oiseaux, par exemple le gobemouche noir (Ficedula hypoleuca)[55] et le rollier d'Europe (Coracias garrulus)[60].
- Un autre cas de sélection sexuelle par les mâles a été démontré chez l’araignée sauteuse (Phidippus clarus), une espèce à rôle sexuel partiellement inversé. Les mâles P. clarus visitent et gardent plusieurs femelles pendant une période de plusieurs semaines précédant la maturation des femelles ; ce système de garde pré-copulatoire favorise la sélection sexuelle par les mâles. En effet, les mâles s’accouplent préférentiellement avec des femelles de grande taille, utilisant la taille des tibias ainsi que des signaux associés à la soie tissée par les femelles comme critères de sélection[61].
- Chez les siphonostomes (Syngnathus typhle), les femelles présentent des rayures temporaires sur les flancs. On a montré que cet ornement attire les mâles et en même temps fait fuir les autres femelles. En effet les mâles sont plus attirés par les femelles qui exhibent ce trait, car il est le signe d’une femelle plus compétitive[62].
Cependant, il est facile d'interpréter la présence des ornements comme le résultat de la sélection sexuelle, mais ce n'est peut-être pas toujours le cas. Darwin (1871) pensait qu'à l'exception des espèces à rôle sexuel inversé, il était peu probable qu'un mâle sélectionne une femelle. Il croyait qu'un ornement retrouvé chez la femelle était, chez la plupart des espèces, le résultat d'une sélection de ce trait chez le mâle. En effet, dans ce cas, la femelle choisit de s’accoupler avec un mâle possédant un trait particulier, qui sera alors transmis aussi bien à la descendance mâle qu’à la descendance femelle[63]. Cette idée paraît aujourd’hui trop simpliste[63], mais l'hypothèse demeure : on l'appelle l'hypothèse de la corrélation génétique[64]. De plus, il n’est pas toujours facile de distinguer l’importance relative de la sélection sexuelle par rapport à la sélection naturelle. Par exemple, la longueur de la queue de l’hirondelle rustique (Hirundo rustica) n’étant apparemment pas aérodynamique, elle était supposée résulter de la sélection sexuelle, car elle représentait un inconvénient et induisait donc un coût pour l’individu en question. Mais une étude récente a montré que cette queue était en fait aérodynamique et donc naturellement sélectionnée dans une population étudiée. Cela remet donc en cause l'explication de la présence de ce trait par la sélection sexuelle[65].
Notes et références
- (en) « Central Parc », in The mating mind, Geoffrey Miller (chap. 1).
- Male-Male Competition, www.oxfordbibliographies.com
- Sperm Competition and Sexual Selection
- Charles Darwin, L'Origine des espèces [édition du Bicentenaire], trad. A. Berra sous la direction de P. Tort, coord. par M. Prum. Précédé de Patrick Tort, « Naître à vingt ans. Genèse et jeunesse de L’Origine ». Paris, Champion Classiques, 2009.
- « Darwin's prodigy », in The mating mind, Geoffrey Miller (chap. 2).
- Charles Darwin, La Filiation de l’Homme et la sélection liée au sexe, trad. sous la direction de P. Tort, coord. par M. Prum. Précédé de Patrick Tort, « L’anthropologie inattendue de Charles Darwin ». Paris, Champion Classiques, 2013.
- Charles Darwin (trad. Edmond Barbier, préf. Carl Vogt), La descendance de l'homme et la sélection sexuelle [« The descent of man, and selection in relation to sex »], C. Reinwald & Cie, 707 p. (lire en ligne), partie II, chap. XX (« Caractères sexuels secondaires chez l'homme (suite) »), p. 658-660.
- Charles Darwin (trad. Edmond Barbier, préf. Carl Vogt), La descendance de l'homme et la sélection sexuelle [« The descent of man, and selection in relation to sex »], C. Reinwald & Cie, 707 p. (lire en ligne), partie II, chap. XX (« Caractères sexuels secondaires chez l'homme (suite) »), p. 656-658.
- (en) R. A. Fisher, The Genetical Theory of Natural Selection, .
- (en) Fisher, R.A., « The evolution of sexual preference », Eugenics Review, vol. 7, no 3, , p. 184–192 (PMCID 2987134).
- The Genetical Theory of Natural Selection : a complete variorum edition, Oxford, Oxford university press, , 318 p. (ISBN 0-19-850440-3, lire en ligne).
- (en) Zahavi H. (1975) Mate selection - a selection for a handicap. Journal of Theoretical Biology, Vol. 53, no 1, 205-214.
- « A mind fit for mating », in The mating mind, Geoffrey Miller (chap. 4).
- R. L. Trivers, Sexual selection and the descent of man, 1871-1971, Chicago, IL : Aldine, 1972, 378 p.
- « The runaway brain », in The mating mind, Geoffrey Miller (chap. 3).
- (en) John Hunt, Casper J. Breuker, Jennifer A. Sadowski et Allen J. Moore, « Male-male competition, female mate choice and their interaction: determining total sexual selection », Journal of Evolutionary Biology, vol. 22, no 1, , p. 13-26 (DOI 10.1111/j.1420-9101.2008.01633.x).
- (en) A. P. Moller et R. Thorhill, « Male parental care, differential parental investment by females and sexual selection », Animal Behaviour, vol. 55, , p. 1507-1515 (lire en ligne).
- Richard Dawkins, The Cichlid's Tale, in The ancestor's tale (Il était une fois nos ancêtres).
- Richard Dawkins, The Cichlid's Tale, in The ancestor's tale (Il était une fois nos ancêtres).
- Richard Dawkins, The Cichlid's Tale, in The ancestor's tale (Il était une fois nos ancêtres).
- Animal signals: information or manipulation? (Ed. by T. H. Clutton-Brock), p. 99-1 17. Chicago: University of Chicago Press. Krebs, J. R. & Dawkins, R. 1978.
- « Ornamental genius », in The mating mind, Geoffrey Miller (chap. 5).
- Guilford, T., & Dawkins, M.S. (1991). Receiver psychology and the evolution of animal signals. Animal Behavior, 42, 1-14.
- « Courtship in the Pleistocene », in The mating mind, Geoffrey Miller (chap. 6).
- Rowe L, Houle D (1996) The lek paradox and the capture of genetic variance by condition dependent traits. Proc R Soc B 263: 1415–1421. doi: 10.1098/rspb.1996.0207.
- « Arts of Seduction », in The mating mind, Geoffrey Miller (chap. 8).
- « Virtues of good mating », in The mating mind, Geoffrey Miller (chap. 9).
- Dans le jeu de la séduction entre perruches, l’intelligence semble prendre le dessus.
- The Works of Francis Bacon, Lord Chancellor of England, Volume 14.
- Sexual Selection and Animal Genitalia, William G. Eberhard, (ISBN 9780674330702), décembre 1985.
- « Bodies of Evidence », in The mating mind, Geoffrey Miller (chap. 7).
- Richard Dawkins, il était une fois nos ancêtres, chapitre les sauropsidés.
- Male Genital Morphology and Function: An Evolutionary Perspective. M. Simmons, J. Jones. The Journal of Urology, volume 177, numéro 5, p. 1625-1631.
- Buss, D. M. (1989). Sex differences in human mate preferences: Evolutionary hypotheses tested in 37 cultures. Behavioral & Brain Sciences, 12, 1-49. PDF.
- K. Grammer, B. Fink, N. Neave. Human pheromones and sexual attraction. European Journal of Obstetrics & Gynecology and Reproductive Biology, volume 118, numéro 2, p. 135-142.
- Wedekind C, Füri S. Body odour preferences in men and women: do they aim for specific MHC combinations or simply heterozygosity? Proc. R. Soc. Lond. B 264, 1471−1479 (1997). .
- The paleolithic glass ceiling, in Women In Human Evolution, Adrienne Zihlman.
- Why did female Homo sapiens evolve to hide their fertile periods?.
- Article d'Odille Fillot sur le sujet, Arrêt sur images, lemonde.fr
- (en) Swami V., Knight D., Tovee M.J., Davies P., Furnham A. Preferences for female body size in Britain and the South Pacific. Body Image, 4(2):219-223, 2007
- (en) Swami V., Furnham A., Chamorro-Premuzic T., Akbar K., Gordon N., Harris T., Finch J., Tovee M.J. More than just skin deep? Personality information influences men's ratings of the attractiveness of women's body sizes. J. Soc. Psychol., 150(6):628-647, 2010
- (en) Yu D.W., Shepard G.H., Jr. Is beauty in the eye of the beholder? Nature, 396(6709):321-322, 1998
- Platek, S. M., & Singh, D. (2010). Optimal Waist-to-Hip Ratios in Women Activate Neural Reward Centers in Men. PLoS ONE, 5(2), e9042. http://doi.org/10.1371/journal.pone.0009042
- (en) Verhulst, S., Dieleman, S. J., Parmentier, H. K. (1999) A tradeoff between immunocompetence and sexual ornementation in a domestic fowl, Proc. Natl. Acad. Sci. USA, Vol. 96, 4478-4481, avril 1999.
- (en) Mougeot, F., Irvine, J. R., Seivwright, L., Redpath, S. M., Piertney, S. (2004) Testosterone, immunocompetence, and honest sexual signaling in male red grouse, Behavioral Ecology, Vol. 15, no 6, 930-937, juin 2004.
- (en) Blount, J. D., Metcalfe, N. B., Birkhead, T. R., Sural, P. F. (2003) Carotenoid Modulation of Immune Function and Sexual Attractiveness in Zebra Finches, Science, Vol. 300, 125-127, (avril 2003).
- (en) Hamilton W. D., Zuk M. (1982) Heritable true fitness and bright birds: a role for parasites? Science, Vol. 218, no 4570, 384-387.
- (en) Able D. J. (1996) The contagion indicator hypothesis for parasite-mediated sexual selection. Proceedings of the National Academy of Sciences, Vol. 93, no 5, 2229-2233.
- (en) Houde A. E., Torio A. J. (1992) Effect of parasitic infection on male color pattern and female choice in guppies. Behavioral Ecology, Vol. 3, no 4, 346-351.
- (en) Spencer K. A., Buchanan K. L., Leitner S., Goldsmith A. R., Catchpole C. K. (2005) Parasites affect song complexity and neural development in a songbird. Proceedings of the Royal Society B, Vol. 272, no 1576, 2037–2043.
- (en) Penn D., Potts W. K. (1998) Chemical signals and parasite-mediated sexual selection. Trends in Ecology & Evolution, Vol. 13, no 10, 391–396.
- (en) Borgia G. (1986) Satin bowerbird parasites: a test of the bright male hypothesis. Behavioral Ecology and Sociobiology, Vol. 19, no 5, 355-358.
- (en) Siva-Jothy M. T. (2000) A mechanistic link between parasite resistance and expression of a sexually selected trait in a damselfly. Proceedings of the Royal Society B, Vol. 267, no 1461, 2523-2527.
- (en) Alcock, J. (2005) Animal Behavior: An Evolutionary Approach (8th Ed). MA, USA: Sinauer Associates, Inc.
- (en) Morales, J., Moreno, J., Merino, S., Sanz, J. J., Tomás, G., Arriero, E., Lobato, E., & Martínez-de la Puente, J. (2007) Female ornaments in the Pied Flycatcher Fidecula hypoleuca : associations with age, health and reproductive success. Ibis, 149, 245-254.
- (en) Cornwallis, C. K., & Birkhead, T. R. (2007) Experimental evidence that female ornamentation increases the acquisition of sperm and signals fecundity. Proc. R. Soc. B., 274, 583-590.
- (en) Torres, R., & Velando, A. (2005) Male preference for female foot colour in the socially monogamous blue-footed booby, Sula nebouxii. Animal Behaviour, 69, 59-65.
- (en) Pizzolon, M., Rasotto, M. B., Mazzoldi, C. (2008) Male lagoon gobies, Knipowitschia panizzae, prefer more ornamented to larger females. Behav. Ecol. Sociobiol., 62, 521-528.
- (en) Vergara, P., Fargallo, J. A. MartÍnez-Padilla, J., & Lemus, J. A. (2009) Inter-annual variation and information content of melanin-based coloration in female Eurasian kestrels. Biological Journal of the Linnean Society, 97, 781-790.
- (en) Silva, N., Avilés, J. M., Danchin, E., & Parejo, D. (2008) Informative content of multiple plumage-coloured traits in female and male European Rollers. Behav. Ecol. Sociobiol., 62, 1969-1979.
- (en) Hoefler, C.D. (2007) Male mate choice and size-assortative pairing in a jumping spider, Phidippus clarus. Animal behavior, 73, 943-954.
- (en) Berglund, A., & Rosenqvist, G. (2001) Male pipefish prefer ornamented females. Animal Behaviour, 61, 345-350.
- Reading, K. L., & Backwell, P. R. Y. (2007) Can beggars be choosers? Male mate choice in a fiddler crab. Animal Behaviour, 74, 867-872.
- (en) Lande, R. (1980) Sexual dimorphism, sexual selection and adaptations in polygenic characters. Evolution, 34, 292-305 dans: (en) Morales, J., Moreno, J., Merino, S., Sanz, J. J., Tomás, G., Arriero, E., Lobato, E., & Martínez-de la Puente, J. (2007) Female ornaments in the Pied Flycatcher Fidecula hypoleuca : associations with age, health and reproductive success. Ibis, 149, 245-254.
- (en) Cuervo, J. J. & Ayala, R. M. (2005) Experimental tail shortening in Barn Swallows (Hirundo rustica) affects haematocrit. Ecology, 19, 828-835.
Voir aussi
Articles connexes
- Sélection intrasexuelle
- Sélection intersexuelle
- Sélection fréquence-dépendante et Phénomène densité-dépendant
- Sélection température-dépendante
- Compétition (biologie)
- Course aux armements
- Théorie de la reine rouge
- Opinions de Darwin sur les femmes
- The Mating Mind
- Conflit sexuel
- Attirance sexuelle
- Stratégie de reproduction
Liens externes
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Les spermatozoïdes géants de la drosophile, par les biologistes Dominique Joly, Béatrice Dejonghe et Nathalie Luck dans la revue Insectes, no 128(1), 2003.
- www.unice.fr/neurobiol/neurocomp/enseignement/cleren/L3psycho/Cpt_sexuel_internet.pdf.
- (en) D. M. Buss, The Evolution of Desire (Basic, New York, 1994/2003). * [PDF] Cours sur la sélection sexuelle de l'université de Lille.
- (fr) Alain Lenoir, « SÉLECTION SEXUELLE ET CONFLITS SEXUELS », (cours de maîtrise).
- (fr) « Comportement et stratégie de reproduction en biologie évolutive », Université de Lille
- CNRS. La guerre des sexes : Trois questions à Thierry Lodé.
- The mating mind, How Sexual Choice Shaped the Evolution of Human Nature (chap. 1). Geoffrey Miller, Knopf Doubleday Publishing Group, 2011. (ISBN 0307813746), 9780307813749.

.jpg.webp)