Transpiration végétale
La transpiration végétale est, chez les plantes, le processus continu causé par l'évaporation d'eau par les feuilles (plus de 90 % de la perte d'eau par ces organes)[5], les tiges et les fleurs (et la reprise qui y correspond à partir des racines dans le sol).

.jpg.webp)

2) Une fois dans le xylème, les forces d'adhérence et de cohésion[N 1] agissent sur l'eau (capillarité). Elles provoque l'adhérence des molécules aux parois des vaisseaux, et la cohésion amène les molécules à adhérer les unes aux autres, formant une colonne d'eau qui s'étend de la racine à la partie supérieure de la plante.
3) L'eau du xylème arrive dans le mésophylle spongieux, où elle est éventuellement exposée à l'air extérieur si les stomates sont ouverts ; l'évaporation se produit alors, créant des tensions dans la colonne d'eau, que les forces de cohésion des molécules voisines tirent vers le haut, créant une force de traction sur toute la longueur du xylème[2].


Quand la température diminue et que l'eau est à nouveau disponible, les feuilles se gorgent d'eau et reprennent leur forme normale (à droite);

Le rôle de la transpiration chez les végétaux
Il est multiple :
- La transpiration est le moteur principal de la circulation de la sève brute dans le xylème. Elle engendre une force de succion analogue à la force générée par l'aspiration dans une paille. La remontée capillaire et la poussée radiculaire contribuent également à cette circulation, mais ces deux processus sont relativement négligeables par rapport au flux transpiratoire[6]. La transpiration se traduit par l'émission de vapeur d'eau au niveau des feuilles de plus de 98 % du volume d'eau absorbée par les racines[7] ; elle se produit essentiellement dans les feuilles, à 90-95 % au niveau des stomates, le reste au niveau de la cuticule[8] (la régulation de leur ouverture influence donc directement l'intensité de la transpiration). L'appel transpiratoire est un des moteurs de la circulation de la sève brute.
Lors de la photosynthèse les stomates s'ouvrent afin de laisser rentrer du CO2. Il y a alors mise en contact de la solution des feuilles avec l'air extérieur. La différence entre le potentiel hydrique atmosphérique et celui des feuilles induit la sortie de l'eau (présente dans les feuilles) dans l'atmosphère. La pression relative dans le xylème diminue et devient plus faible que la pression atmosphérique. Le xylème est alors sous tension, ce qui permet la montée de la sève brute. - Elle contribue, dans une certaine mesure, au rafraîchissement des plantes et elle permet le transfert des sels minéraux aux endroits où la plante en a besoin, principalement dans les feuilles qui sont le siège de la photosynthèse.
- Avec la vapeur d'eau, la plante émet aussi dans l'air des gaz (surtout de l'oxygène) et des aérosols comprenant notamment des phytohormones qui lui permettent de communiquer avec d'autres plantes ou d'émettre des « messages chimiques » perceptibles par certains animaux (insectes).
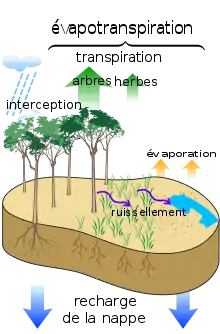
- C'est une composante majeure de l'évapotranspiration qui est particulièrement importante en termes de quantité d'eau (ré)introduite dans l'atmosphère, ce qui a notamment pu être montré ou confirmé par des analyses isotopiques du cycle de l'eau en Amazonie[9].
Chez les Angiospermes
La transpiration foliaire chez les Angiospermes se réalise à travers la cuticule (transpiration cuticulaire), mais surtout par les stomates (transpiration stomatique). Elle est plus importante au sein de ce groupe car les plantes disposent dans leurs feuilles d'un réseau de nervures quatre fois plus dense que celui des autres plantes[10].
Le transport de sève depuis le sol est induit par la baisse de pression hydrostatique dans les parties supérieures de la plante, elle-même due à la perte d'eau à travers les stomates. L'eau du sol est absorbée au niveau des racines par osmose, et les solutés accompagnent la montée de l'eau dans le xylème.
Le volume d'eau stockée dans les arbres varie en fonction de plusieurs facteurs : la taille de l'arbre, les propriétés hydrauliques spécifiques à chaque espèce, incluant l'anatomie du bois, sa densité, la tolérance à la sécheresse, le fonctionnement stomatique selon le stress hydrique (stratégie[N 2] isohydrique ou anisohydrique)[11].
Les conifères et les plantes désertiques ont des structures qui limitent la transpiration, notamment des aiguilles ou des feuilles succulentes.
La quantité d'eau rejetée dans l'atmosphère par la transpiration des plantes
Pour les végétaux de grande taille et les hélophytes, elle peut être très importante. Un végétal perd en moyenne quotidiennement l'équivalent de son poids en eau par transpiration[12].
Le taux de transpiration est directement lié au degré d'ouverture des stomates. La quantité d'eau perdue par la plante dépend de sa taille ainsi que des conditions extérieures (luminosité, température, humidité, vitesse du vent et apport hydrique). Environ 90 % de l'eau qui pénètre dans les racines est consommée par ce processus. Selon l'espèce de l'arbre, son développement et sa surface foliaire, la transpiration varie de quelques dizaines de litres par jour à plusieurs centaines de litres par jour pour un individu, la consommation en eau d'un arbre pouvant varier du simple au décuple selon son âge et les conditions dans lesquelles il se trouve[13]. Une plante peut transpirer plus de cinq fois sa biomasse durant une chaude journée d'été, et près de 500 fois sa biomasse finale au cours de son cycle végétatif[14].
Cette transpiration détermine une consommation hydrique bien plus importante que les animaux qui consomment généralement assez peu d'eau, de l'ordre du vingtième de leur poids par jour[15]. Pour un chêne pédonculé de forêt alluviale, la consommation moyenne est de 260 litres/ jour[16]. Selon différentes études, les besoins hydriques issus de 10 à 50 % de la transpiration végétale des arbres sont satisfaits par l'eau stockée dans ces végétaux ligneux, le reste étant fourni par l'eau stockée dans le sol[17] - [18] - [11]. Les plantes, et plus particulièrement les arbres, perdent l'eau stockée par transpiration la journée et rechargent leur stock par l'extraction racinaire principalement la nuit[19] - [20].
En zone tempérée et s'il ne manque pas d'eau, un hectare de hêtre (Fagus sylvatica) émet dans l'atmosphère environ 25 tonnes de vapeur d'eau par jour durant une saison de végétation, ce qui représente une transpiration de 250 kg d'eau par jour pour chaque arbre. Cela explique le rôle joué par les grandes formations végétales, notamment les forêts sur le cycle de l'eau et sur le climat. Un hectare de forêt tropicale humide en évapotranspire bien plus encore (1 530 mm ± 7 % selon les bassins, en Guyane, sous une pluviométrie de 2 000 à 4 000 mm selon la mesure faite par le bilan hydrologique[21]; résultats proches de ceux de Madec obtenus avec la méthode de Thornthwaite en 1963[22]).
Le besoin en eau liée à la transpiration
Le besoin en eau des plantes représente 50 à 80 % de l'eau issue des précipitations. Pour une forêt des régions tempérées, ce besoin correspond à 30 tonnes d'eau par hectare chaque jour (soit une lame d'eau de 3 mm/ha). Pour un besoin de 200 jours/an avec des feuilles (absence de flux de sève en automne et en hiver), cela correspond à 600 mm de pluie par an. Or, les météorologues relèvent en moyenne une pluviométrie de 500 à 1500 mm/an selon les régions françaises marquées par un excès ou un déficit pluviométrique par rapport aux besoins en eau des forêts. Ce déficit dans le sud méditerranéen est un facteur, avec la température, qui explique le développement de formations xérophytiques (maigre couverture végétale, forêts, terres boisées et broussailles méditerranéennes)[23].
Les facteurs influençant la transpiration
Facteurs structuraux
Surface et épaisseur des feuilles : Une feuille plus petite transpirera moins vite qu’une feuille plus grande, car il y a moins de pores disponibles pour la perte d’eau. L’épiderme de la plupart des végétaux terrestres est recouvert d’une cuticule. Cet atout apporte une protection imperméabilisante qui prévient de l’assèchement. Plus la cuticule est épaisse plus la transpiration sera faible[24].
Nombre de stomates : L’eau de la transpiration étant évacuée par les stomates est proportionnelle au nombre de pores des stomates. Plus il y en a, plus la transpiration sera forte.
Nombre de feuilles : Un nombre de feuilles, ou autres organes photosynthétiques, plus grand augmente aussi le nombre de stomates disponibles pour la transpiration. Il y aura donc plus d’échanges gazeux avec le milieu externe.
Facteurs externes
Disponibilité de l’eau : Quand l’humidité du sol passe en dessous d’un seuil normal (entre -1,0 MPa et -4,0 MPa pour les mésophytes)[25] pour la plante, les stomates se fermeront jusqu’à temps que la condition s’améliore et la transpiration sera ainsi réduite.
Humidité relative : La diminution de l’humidité relative, rendant l’air plus sec, abaisse considérablement le gradient potentiel hydrique atmosphérique ce qui contribue à augmenter la transpiration. La plus grande différence entre le potentiel hydrique interne des feuilles et externe encourage l’eau à quitter celles-ci.
Vent : Le vent défait la couche limite qui sert à protéger la surface des feuilles en accumulant une vapeur d’eau qui réduit le niveau d’eau à évacuer de ces dernières. Le vent augmente donc le dessèchement. Le changement d’air autour de la plante plus fréquent favorise l’évaporation de l’eau. Puis, la différence de potentiels hydriques entre les milieux, interne et externe, est augmentée, ce qui accroît alors tout de suite la transpiration, cherchant le renouvellement de sa couche limite.
Luminosité : Comme la plupart des plantes ouvrent leurs stomates durant le jour pour faire de la photosynthèse, à l’exception des plantes de la famille CAM[26], la vitesse de transpiration augmente avec l’intensité de la lumière laissant l’eau s’évaporer par les pores des feuilles. La sensibilité des plantes à la luminosité varie selon les espèces. La transpiration est donc plus élevée le jour et diminue fortement durant la nuit.
Température : La température encourage l’ouverture des stomates pour permettre l’évaporation de l’eau cellulaire. Plus il fait chaud, plus les stomates s'ouvriront et donc, plus il y aura de transpiration. Ceci se produit jusqu’à ce que la température atteigne un certain seuil, de 25 à 30 °C[27]. À ce seuil, les stomates commenceront à se refermer et ainsi à abaisser la transpiration pour éviter le dessèchement.
Notes et références
Notes
- En raison de leur réseau pseudo-cristallin, les molécules d'eau sont très cohésives, et la tension est transmise de proche. Ce mécanisme constitue le modèle cohésion-tension.
- En réponse à ce stress, les plantes adoptent une stratégie isohydrique (fermeture des stomates précocement pour limiter la transpiration) ou anisohydrique (maintien des stomates ouverts pour privilégier la photosynthèse, en s’exposant à un risque d’accident hydraulique plus important). En cas d'évapotranspiration importante et de sécheresse édaphique marquée, les tensions dans les vaisseaux conducteurs peuvent devenir telles qu'il se produit une rupture des colonnes d’eau (phénomène de cavitation), suivie d'une embolie mais de nombreux arbres sont faiblement vulnérables à la cavitation. Cf (en) McDowell N, Pockman WT, Allen CD, Breshears DD, Cobb N, Kolb T, Plaut J (2008) Mechanisms of plant survival and mortality during drought: why do some plants survive while others succumb to drought? New Phytol 178:719-739.
Références
- Marc-André Selosse, L'origine du monde. Une histoire naturelle du sol à l'intention de ceux qui le piétinent, Actes Sud Nature, , p. 59.
- Mader, Sylvia S (2010) Biology, Tenth. New York:.. McGraw Hill
- La taille maximale d'un séquoia sempervirent est limitée à 122 ou 130 m. Cf (en) George W. Koch, Stephen C. Sillett, Gregory M. Jennings & Stephen D. Davis, « The limits to tree height », Nature, vol. 428, , p. 851–854 (DOI 10.1038/nature02417).
- La taille maximale d'un sapin de Douglas est limitée entre 131 et 145 m. Cf (en) Jean-Christophe Domec, Barbara Lachenbruch, Frederick C. Meinzer, David R. Woodruff, Jeffrey M. Warren, and Katherine A. McCulloh, « Maximum height in a conifer is associated with conflicting requirements for xylem design », PNAS, vol. 105, no 33, , p. 12069-12074 (DOI 10.1073/pnas.0710418105).
- William G. Hopkins, Physiologie végétale, De Boeck Supérieur, (lire en ligne), p. 38
- (en) Guillaume Lobet, Charles Hachez, François Chaumont, Mathieu Javaux, Xavier Draye, in Eshel, A. and Beeckman, T. (Eds.) Plant Roots: The Hidden Half, 2013, 24-1 - 24-18
- Daniel Richard, Martine Hausberger, Patrick Chevalet, Sylvie Fournel, Nathalie Giraud, Frédéric Gros, Patrick Laurenti, Fabienne Pradere, Thierry Soubaya, Frédéric Ysnel, Biologie, Dunod, , p. 290
- (en) Ernst Steudle, « Transport of water in plants », Environment Control in Biology, vol. 40, no 1, , p. 29-37 (DOI 10.2525/ecb1963.40.29)
- Gat JR & Matsui E (1991) Atmospheric water balance in the Amazon Basin: an isotopic evapotranspiration model. Journal of Geophysical Research: Atmospheres (1984–2012), 96(D7), 13179-13188.
- Maurice Mashaal, « De la fraîcheur grâce aux plantes à fleurs », Pour la Science (consulté le ), p. 28 juin 2010
- (en) Kocher, P., V. Horna, and C. Leuschner. 2013. Stem water storage in five coexisting temperate broadleaved tree species: significance, temporal dynamics and dependence on tree functional traits. Tree Physiology 33:817–832
- François Couplan, Les plantes, Editions Quae, , p. 50.
- (en) Michael Allaby, Encyclopedia of weather and climate, Bukupedia, , p. 485.
- Michel-Claude Girard, Christian Walter, Jean-Claude Rémy, Jacques Berthelin, Jean-Louis Morel, Sols et environnement, Dunod, , p. 75.
- Sané de Parcevaux, Laurent Huber, Bioclimatologie. Concepts et applications, Editions Quae, , p. 235.
- (en) J. Cermak, J. Ulehla, J. Kucera & M. Penka, « Sap flow rate and transpiration dynamics in the full grown oak (Quercus robur L.) in floodplain forest exposed to seasonal floods as related to potential evapotranspiration tree dimensions », Biologia Plantarum, vol. 24, no 6, , p. 446-460.
- (en) Phillips, N. G., M. G. Ryan, B. J. Bond, N. G. McDowell, T. M. Hinckley, & J. Cermak. 2003. Reliance on stored water increases with tree size in three species in the Pacific Northwest. Tree Physiology 23:237–245
- (en) Meinzer, F. C., S. A. James, and G. Goldstein. 2004. Dynamics of transpiration, sap flow and use of stored water in tropical forest canopy trees. Tree Physiology 24:901–909
- (en) Van Emmerik, T., Steele-Dunne, S. C., Judge, J., and van de Giesen, N. C.: Impact of Diurnal Variation in Vegetation Water Content on Radar Backscatter From Maize During Water Stress, IEEE T. Geosci. Remote Sens., 53, 3855–3869
- Nicolas Baghdadi et Mehrez Zribi, Observation des surfaces continentales par télédétection II. Hydrologie continentale, ISTE Editions, (lire en ligne), p. 112.
- Roche MA (1982) Évapotranspiration réelle (ETR) de la forêt amazonienne en Guyane. Orstom Serie Hydrologie, 19, 37-44 (PDF, 8 pages).
- Madec H (1963) L’évapotranspiration potentielle et le bilan de l’eau en Guyane, d’après les méthodes de Thornthwaite. Météo nat., Cayenne, 12 p.
- Marc-André Selosse, Petites histoires naturelles. Chroniques du vivant, Actes Sud Nature, , p. 18
- Campbell, N.A. et Reece, J.B., Biologie, 3e édition., ERPI, , 1454 p.
- (en) Gurevitch, J., Scheiner, S.M. andFox G.A., The ecology of plants, secondedition., Sinauer., , 578 p.
- Hopkins, W.G., Physiologie végétale., Boeck., , 516 p.
- Raven P.H.,Evert R.F. et Eichhorn S.E., Biologie végétale., Boeck., , 926 p.