Forêt
Une forêt ou un massif forestier est un écosystème, relativement étendu, constitué principalement d'un peuplement d'arbres, arbustes et arbrisseaux (fruticée), ainsi que de l'ensemble des autres espèces qui lui sont associées et qui vivent en interaction au sein de ce milieu. Elle peut être naturelle ou exploitée en sylviculture. Les espèces animales, végétales ainsi que les champignons qui vivent au sein des forêts sont qualifiées d'espèces forestières.

- Inlandsis et déserts polaires
- Toundra
- Taïga ou forêt boréale
- Forêts feuillues caducifoliées tempérées
- Prairies
- Forêts sempervirentes subtropicales
- Forêts sempervirentes méditerranéennes
- Forêts de mousson
- Déserts arides
- Déserts et broussailles xérophytes
- Steppe aride
- Déserts semi-arides
- Savanes
- Savanes et forêts claires
- Forêts tropicales caducifoliées
- Forêts sempervirentes tropicales
- Toundra alpine
- Forêts de montagne






îles San Juan, État de Washington.
Un boisement de faible étendue est dit bois, boqueteau ou bosquet selon son importance.
Divers types de forêts existent ; des forêts primaires aux forêts dites urbaines, avec les gradients intermédiaires[5]. Elles peuvent être naturelles ou exploitées par l'homme. Dans ce cas il existe de nombreux types d'exploitation des forêts (sylviculture, ligniculture, agrosylviculture…).
Les forêts sont aussi un milieu de vie et une source de revenus pour l'être humain : au début du XXIe siècle, plus de cinq cent millions de personnes[6], dont plusieurs peuples autochtones, vivent en forêt ou à ses abords. Elles abritent une grande richesse écologique, concentrant 80 % de la biodiversité terrestre mondiale recensée.
L'action de l'Homme dans plusieurs régions de la planète conduit à une destruction ou une surexploitation des forêts. Cela engendre une importante déforestation qui concerne surtout actuellement les forêts tropicales et la taïga. La moitié des forêts de la planète a été détruite au cours du XXe siècle[7]. Il n'y a pas de gouvernance mondiale des forêts, ni de convention internationale, mais l'ONU a mis en place un Forum des Nations unies sur les forêts (FNUF).
Étymologie
Le terme générique forêt


L'origine du mot forêt est complexe. Il a remplacé à partir du XIIe siècle, sous la forme forest « vaste étendue de terrain peuplée d'arbres »[8], l'ancien français selve, du latin silva, « forêt ». L'anglais forest est un emprunt au français[9] - [10], l'allemand Forst, forêt exploitée (vieux haut allemand forst, attesté vers 800)[11] est sans doute également apparenté.
Le mécanisme de cette substitution semble passer par les rois mérovingiens puis carolingiens, sous lesquels le terme de bas latin foresta désignait un territoire à part, dont la jouissance était réservée au roi, les forêts royales. Ces territoires pouvaient aussi bien être des bois, des landes, ou des terres en eau (rivière, étang, lac et même mer), mais étaient généralement non cultivés et réservés à la chasse ou à la pêche.
Ainsi Jacques-Joseph Baudrillart écrit-il en 1825, dans son Dictionnaire général des Eaux et Forêt[12] à l'article « Forêt » : « Nos premiers rois avaient des domaines particuliers, appelés villa regia, ou foreste dominicum, qu'ils faisaient administrer par des officiers désignés sous le nom de juges, auxquels ils recommandaient particulièrement la conservation de leurs forestae, mot générique qui comprenait alors les étangs royaux pour le poisson, en même temps que le bois pour le pâturage. »
On pouvait par exemple parler, sous Charles-le-Chauve, de la foresta des pêches de la Seine. On trouve dans les capitulaires de Charlemagne (747-814) l'expression silva forestis pour désigner des étendues boisées relevant du domaine royal. Les termes foresta, ou silva forestis ont alors valeur juridique, désignant un « territoire soustrait à l'usage général »[13] zone dans laquelle il est défendu de défricher et où la chasse ou la pêche sont gardées. Progressivement, le terme s'est spécialisé pour ne plus désigner que les étendues boisées relevant du roi ou d'un seigneur, tandis que d'après Baudrillart (op. cit.) apparaissait l'expression les eaux et forêts, ou les eaux-forêts, dans un sens proche du sens initial de forestae.

L'origine de foresta est plus controversée. On a longtemps évoquée une origine germanique, par un terme vieux bas francique *forhist non attesté, avec perte du [h] à l'époque mérovingienne *forist, qui serait un dérivé du vieux bas francique *forha « sapin » (cf. allemand Föhre « pin sylvestre », anglais fir « sapin »), le suffixe -ist ayant une valeur collective, d'où le sens de « sapinière, forêt de sapins ». Cette explication est aujourd'hui délaissée, l'origine de foresta semblant bien plutôt romane, mais avec deux hypothèses concurrentes cependant.
Selon une première hypothèse, fondée sur le sens juridique donné à foresta par les mérovingiens et les carolingiens, il proviendrait du latin classique forum (forum puis tribunal)[14]. Bien que favorisée par les ouvrages étymologiques français, aucune forme intermédiaire permettant d'appuyer cette hypothèse n'est cependant donnée.
Une hypothèse alternative beaucoup plus argumentée fait dériver foresta directement du latin foris, « dehors, extérieur »[15] (forum dérivant lui-même de foris) et plus précisément de forestis « ce qui est en dehors, hors de l’enclos » au sens de ce qui est en dehors de là où l’homme vit, où réside le pouvoir[16]. Le grammairien Placidus connaît déjà un adjectif forasticus (« extérieur »)[15] dérivé de foris ; cet adjectif subsiste dans l'italien forastico, le sicilien furestico, l’ancien occitan foresgue (« sauvage », « rude », « rétif »). De plus, l'italien forestiere a le sens d'« étranger, homme du dehors », de même que l'ancien provencal forestiero « qui est en dehors (de la commune), étranger ». L'ancien français forestier avait également le sens d'étranger, et l'italien actuel foresta conserve le sens de « vaste zone inculte, où la végétation, et en particulier les arbres, croissent spontanément ».
Ainsi le terme foresta aurait pu désigner à l'époque gallo-romaine les espaces restés sauvages, en dehors, à l'extérieur, de ceux mis en valeur par les communautés villageoises (ces derniers contenant aussi des bois aménagés et exploités), les rois et seigneurs francs se réservant par la suite l'usage de ces territoires. On aurait ainsi un croisement de sens intéressant entre foresta « espace sauvage, en dehors du domaine cultivé », et sauvage, de l'ancien français salvage, du latin silvaticus, « forestier ».
Autres mots pour désigner la forêt ou le bois
Le mot gaulois brogilos dérive de broga (« champ »), devenant broglius désignant au IXe siècle un bois humide, clos ou entouré d'une haie. Il a donné breuil du dictionnaire de l'Académie française et des toponymes tels que Breuil ![]() ou le Breuil
ou le Breuil ![]() par exemple.
par exemple.
Les Romains appelaient la forêt silva, mais Virgile et Cicéron la nomment nemus (« bois » en latin, qui proviendrait de nēmō, -inis, contraction de ne homo, -inis signifiant « nul homme »). Ce mot figure souvent dans les chartes capétiennes pour désigner des petites zones boisées. Salluste utilisait le terme saltuosus pour désigner un espace boisé. À l'époque romaine les saltuarii ou les silvarum custodes administraient les forêts. Aux époques mérovingienne (481-751) et carolingienne (751-987), le mot saltus désigne fréquemment les zones de bois et landes, plutôt semble-t-il quand elles appartenaient au fisc royal. Le mot nemus ne s'est pas perpétué en gallo-roman et saltus (> ancien français sault) n'a pas survécu en français moderne.
Un autre terme existe en ancien français, il s'agit de gaut (ou gault, guault, dialectes septentrionaux waut, mot masculin). Il peut désigner le bois, la forêt ou le bocage. Il est issu du vieux bas francique *wald « forêt » (cf. vieil anglais weald, allemand Wald « forêt »).
Le terme bois apparaît sous la forme latinisée boscus en latin médiéval en 704 et en français vers 1100 sous sa forme actuelle. Il est issu du vieux bas francique *bŏsk- « buisson » Contrairement au mot forêt, il est sans connotation juridique. Les formes modernes bosc, trouvées dans l'onomastique essentiellement sont d'origine normande et occitane. Forêt et bois ont remplacé tous les termes précédents, ainsi que le terme latin lignum « bois » désignant le matériau (cf. italien legno, espagnol leña).
Une microsylve désigne une forêt de haute altitude (montagne) ou latitude, composée de minuscules arbres (sous-arbrisseaux)[17].
Définitions
Le monde antique romain oppose ce qui est du « sauvage » (silvaticus) – relatif aux bois – et ce qui est de la civilisation : la cité, la culture, etc[18].
Débat sur la définition
La définition du terme de forêt pour sa classification est variable car elle se réfère à des seuils dont la nature et l'importance varient selon les pays : couvert forestier minimum, surface minimale du peuplement, etc. À l'échelle internationale, la FAO définit les forêts comme des terres occupant une superficie de plus de 0,5 hectare (5 000 m2) avec des arbres atteignant une hauteur supérieure à 5 mètres et un couvert forestier de plus de 10 %. Cette définition exclut les terres dont la vocation prédominante est agricole ou urbaine[19]. Par ailleurs l'observation de l'évolution de séries chronologiques continues nécessitent une stabilité des nomenclatures. Comme le montre une étude de la CEE commandée en 1989 la plupart des pays n'ont pas adopté, ni conservé au fil des ans, la même méthode[20].
Pour le géographe, la complexité de l'espace forestier, empêche de l'enfermer dans une approche numérique univoque ; elle concerne le dedans, et le dehors de la forêt, son caractère ancien ou non[21], voire ses marges[22].
Des définitions plus spécifiques sont données par d'autres organisations : le Programme des Nations unies pour l'environnement (PNUE) utilise 40 % de couverture comme le seuil pour les « forêts fermées » et 10 à 40 % de couverture pour les « forêts ouvertes », tandis que le projet Tropical Ecosystem Environment Observations by Satellite (TREES)[23], fondé en 1991 par la Commission européenne, classifie les surfaces avec plus de 70 % de couverture de canopée comme étant des « forêts denses » et celles avec 40-70 % de couverture comme des « forêts fragmentées ». L'Inventaire forestier national définit la forêt comme « un territoire occupant une superficie d'au moins 50 ares avec des arbres capables d'atteindre une hauteur supérieure à cinq mètres à maturité in situ, un couvert arboré de plus de 10 % et une largeur [de houppier] d’au moins 20 mètres[24]. Les sites momentanément déboisés ou en régénération sont classés comme forêt même si leur couvert est inférieur à 10 % au moment de l’inventaire »[25].
Les chiffres de surface forestière varient donc selon les sources. Ainsi, tout l'Est de la Taïga russe, formé de formations basses de conifères nains, sera, selon les sources, comptabilisé ou non en forêt, ce qui fera varier la surface forestière de plus ou moins 20 %.
Du point de vue botanique, une forêt est une formation végétale, caractérisée par l'importance de la strate arborée, mais qui comporte aussi des arbustes, des plantes basses, des grimpantes et des épiphytes. Plusieurs arbres forestiers vivent en symbiose avec des champignons et d'autres micro-organismes, et beaucoup dépendent d'animaux pour le transport de leur pollen, de leurs graines ou de leurs propagules.
Du point de vue de l'écologie, la forêt est un écosystème complexe et riche, offrant de nombreux habitats à de nombreuses espèces et populations animales, végétales, fongiques et microbiennes entretenant entre elles, pour la plupart, des relations d'interdépendance.
Malgré une apparente évidence, définir la forêt reste donc délicat : où arrêter les limites de hauteur de végétation (une plantation de jeunes pousses est-elle une forêt ?), de superficie minimale (à partir de quelle superficie passe-t-on d'un jardin boisé à un bois puis à une forêt ?), de degré de proximité ou de « sociabilité » des arbres (un terrain portant des arbres distants de plusieurs dizaines de mètres est-il encore une forêt ?) ou de qualité (un boisement monospécifique d'eucalyptus ou de peupliers, de pins ou de sapins d'une même classe d'âge, plantés en alignements stricts est-il une forêt ou une simple culture sylvicole ?).
Évolution

La plus ancienne forêt fossile qui soit aujourd’hui connue a longtemps été présentée comme celle de Gilboa (en)[32]. Figée par une inondation, cette forêt est mise au jour en 1870 dans l'État de New-York. Son arbre le plus ancien, du genre Archaeopteris, date de 370 millions d'années, et montre aux paléobotanistes que les premières forêts sont assez vite apparues dans l'histoire évolutive des végétaux, 100 millions d'années après l'adaptation des plantes marines à la vie terrestres. La reconstitution de la forêt de Gilboa montre déjà un écosystème complexe avec plusieurs étages de végétation[33].
Pendant les 50 millions d'années qui suivent leur apparition sur terre, certaines plantes vasculaires terrestres s'affranchissent du milieu aquatique et de la poussée d'Archimède en adoptant un port érigé qui sépare les zones végétatives éclairés des zones d'ancrage et d’absorption dans le sol, ce qui implique la différenciation en organes et en tissu végétal spécialisé. Elles s'équipent ainsi d'un cormus (racines et feuilles) et se diversifient considérablement. La différenciation chez les mousses ne va pas jusqu'à la mise en place de tissus de soutien lignifiés, alors que ce processus est observé chez les fougères qui mettent en place des tissus conducteurs (phloème et xylème avec éléments lignifiés typiques, les trachéides)[34]. Grâce à la lignine, polymère solide, inerte, poreux et difficilement putrescible, ces plantes ligneuses se mettent à supplanter tous les autres concurrents du règne végétal. Alors que les premières plantes terrestres demeurent à la surface du sol, la compétition pour la lumière (source d'énergie nécessaire à la photosynthèse) s'exprime chez tous les groupes de végétaux (fougères arborescentes, prêles, lycopodes, plantes à graines). Cette course à la lumière favorise le développement de plantes ligneuses de plus en plus hautes[35] - [36], grâce à la rigidité de leur tronc (tige dont le cœur est constitué de bois, tissu ligneux dont la résistance et l'emploi économique constituent des avantages adaptatifs), et plus particulièrement chez les arbres des forêts dont l'architecture végétale permet de déployer une grande surface feuillue[37].
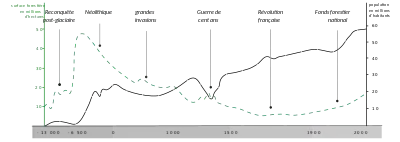
L'histoire des forêts au Quaternaire est encore mal connue en raison des avancées et reculs des peuplements, imposées par les trois dernières glaciations. Lors des maximums glaciaires, les espèces des forêts tempérées trouvent refuge dans des zones abritées, là où les conditions écologiques locales (températures plus clémentes, hivers moins rigoureux en raison de barrières montagneuses, régions restées humides grâce à la fonte estivale de la calotte et des grands glaciers) permettent leur survie, et sont remplacées dans leur aire d'origine par des espèces végétales de steppes et de toundras. Celles des forêts tropicales subissent une sécheresse importante et trouvent refuge dans des zones d'altitude ou des plaines marécageuses. Ces zones refuges se caractérisent par une diversité génétique plus ou moins importante : dans les milieux favorables, similarité des haplotypes rencontrés intra-refuge mais enrichissement du réservoir génétique par forte divergence génétique inter-refuges liée à l’isolement géographique ; effet de goulot d'étranglement génétique dans les milieux moins favorables, les espèces ligneuses étant marquées par une faible élasticité génétique, d'autant plus si elles se sont spécialisées dans des niches étroites. La reconquête postglaciaire, plus ou moins importante selon le potentiel d'adaptation des espèces ligneuses, correspond à la recolonisation des essences forestières à partir de ces zones, entraînant une redistribution de la végétation en quelques milliers d'années. La vitesse de recolonisation (généralement quelques centaines de mètres par an) varie selon les périodes et régions en fonction du climat, des barrières géographiques (montagnes, mers, déserts) mais aussi de la végétation concurrente. Cette reconquête entraîne un appauvrissement génétique au fur et à mesure que l’on s’éloigne de la zone refuge, appauvrissement pouvant être contrebalancé par l’apparition de nouvelles mutations dans les zones recolonisées (signal d’expansion)[38].
De nombreux épisodes de déforestation ont marqué l'histoire de la Terre, notamment l'effondrement de la forêt tropicale du Carbonifère, ou la révolution néolithique qui voit les hommes se servir des zones de faible couverture forestière (landes, pelouses, bois clairs, garrigues et maquis) pour étendre les clairières et les prairies, pratiquant pendant plusieurs millénaires, de multiples défrichements par brûlis, de mises en culture ou en pacage[39]. Si la surface totale des forêts tropicales mondiales n'est guère modifiée jusqu'au début du XXe siècle[40], celle des forêts tempérées a été considérablement réduite par les grands défrichements qui s'accélèrent à partir du Moyen Âge, notamment en Europe où la forêt caducifoliée a diminué en surface de manière continue jusqu'au XIXe siècle, et ses différentes caractéristiques — composition en essences, structure, sol — en ont été également grandement modifiées[41]. Dans les régions tempérées chaudes du pourtour méditerranéen où se diffusent la culture des céréales et l'élevage, en provenance du Moyen-Orient, les forêts massivement converties en terre agricole ou dégradées par l'utilisation pastorale, sont réduites en quelques millénaires à la formation de garrigues et de maquis[42].
Les grandes découvertes qui s'étendent du début du XVe siècle jusqu'au début du XVIIe siècle, puis l'âge de la voile (généralement daté entre 1571 et 1862) qui voit l'essor du commerce maritime international et de la guerre navale, mettent le bois au cœur du développement économique de plusieurs puissances maritimes. Ces puissances mettent en place des politiques sylvicoles visant à améliorer la gestion et l'aménagement des forêts pour juguler les pénuries de bois[43]. Au cours du XIXe siècle, la révolution industrielle libère les espaces sylvestres de la pression humaine avec le début de l'exode rural et le remplacement du charbon de bois par le charbon de terre et l'hydro-électricité pour la fourniture d'énergie, permettant à la forêt de s'étendre à nouveau dans toute l'Europe[44]. Le mouvement en faveur de la protection des forêts (en) prend de l'ampleur dans les dernières décennies du XIXe siècle. La gestion durable des forêts est progressivement reconnue à partir des années 1990 dans un contexte de surexploitation des ressources naturelles des forêts d'Amazonie, de l'Afrique équatoriale et de la zone Malaisie/Indonésie en Asie[45].
Caractéristiques
Structure
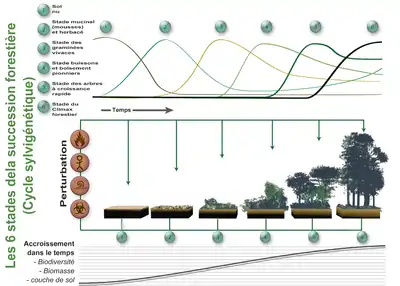
Après un certain temps survient une perturbation qui fait reprendre le « cycle » à son début (ou à un stade intermédiaire si la perturbation est peu importante).
Dans le bas de l'image est représentée l'accroissement de biomasse (sur pied et dans le sol, animale, végétale et fongique..) de biodiversité et d'épaisseur de sol (qui a une importance en ce qui concerne les puits de carbone). Au fur et à mesure de cette succession, les communautés végétales (et les communautés microbiennes, fongiques et animales qui leur sont associées) évoluent en se remplaçant les unes les autres.
De sa lisière (ourlet forestier) à la forêt intérieure, et selon le contexte géo-morpho-écopaysager, un massif boisé est caractérisée par une grande diversité en habitats, en niches écologiques, et surtout par une structuration en hauteur (atteignant plusieurs dizaines de mètres, de la sphère racinaire à la canopée) plus complexe que dans les autres écosystèmes terrestres.
Cette diversité évolue dans le temps et l'espace, au gré de perturbations (naturelles ou anthropiques) selon un pattern et des structures récurrentes, correspondant à un cycle théorique dit « cycle sylvogénétique » (illustré ci-contre, à gauche) :
- verticalement, la forêt possède grossièrement quatre « étages » de végétation qui sont les strates muscinales (mousses), herbacées, arbustives et arborescentes, auxquels il faudrait ajouter les étages souterrains des systèmes racinaires, symbiosés aux mycéliums fongiques ;
- horizontalement, elle comporte de nombreux micro-milieux ou microstations (écosystèmes boisés distincts, au sein d'un même massif forestier) dépendant de facteur abiotiques différents.
- En suivant la flèche du temps, la structure forestière tend à évoluer vers un stade fermé dit climacique, mais qui finit toujours localement par s'ouvrir à la lumière, à la suite d'une perturbation (chablis, feu, inondation, glissement de terrain, etc.), permettant le retour au stade pionnier et aux stades suivants ;
- Le bois mort constitue lui-même un habitat essentiel, irremplaçable pour de nombreuses espèces qui contribuent au recyclage de la nécromasse ligneuse, et à la fertilité des forêts ;
- Les ressources alimentaires sont également abondantes, variant selon l'étage de la forêt : détritus, racines, mousses, lichens, champignons, feuilles, sève élaborée, bois vivant ou mort, fleurs, fruits et graines, nécromasse végétale, animale, fongique…
Forêt primaire et forêt secondaire
Il est courant de distinguer la forêt primaire (forêt naturelle) de la forêt secondaire ou forêt plantée (forêt entièrement ou fortement façonnée par l'homme). La première est considérée comme n'ayant pas fait l'objet d'intervention humaine y ayant laissé des séquelles importantes ou observables, elle correspond à la végétation naturelle potentielle ; la dernière étant modifiée à la suite du travail des forestiers ou sylviculteurs. Moins de 10 % de la planète est encore couverte de forêts primaires. Ces forêts sont en forte régression, en raison des coupes faites pour l'élevage ou les cultures destinées à nourrir les animaux d'élevages et/ou pour gagner des terres agricoles ou pour l'exploitation commerciale du bois[46].
Superficie


Dans le monde, la forêt - au sens le plus large - couvrait en 2005 environ 30 % des terres émergées.
Selon les définitions retenues, la superficie estimée de la forêt mondiale varie de 2,5 à 6 milliards d'hectares sur la base des chiffres envoyés par les États au début du XXIe siècle[47], l'Organisation des Nations unies pour l'alimentation et l'agriculture estimant la forêt mondiale à presque 4 milliards d'hectares, soit 0,62 ha/habitant. Mais la forêt est mieux préservée sur la ceinture tropicale humide et au nord de la zone tempérée dans l'hémisphère nord. Ailleurs, dans 64 pays abritant un total de 2,0 milliards d'habitants, on compte en 2005 moins de 0,1 hectare de forêt par personne, chiffre qui diminue inéluctablement alors que le taux de population augmente et que la forêt régresse.
Sept pays ou territoires ne possèdent plus aucune forêt et dans 57 autres pays, elles ne couvrent plus que moins de 10 % des terres.
En Europe occidentale, avant l'intégration des pays d'Europe du Nord, le pays le plus boisé était le Luxembourg, avec 34 % de taux de boisement. C'est l'ancien département des Forêts du temps de l'Empire napoléonien. En Lettonie elle couvre 52 % du territoire national[48]. La forêt européenne tend à se reconstituer, mais parfois de façon très artificielle. Elle couvrait au début du XXIe siècle près de 40 % de la superficie européenne, générant près de 3,5 millions d'emplois directs ou indirects selon la filière bois. un Institut forestier européen (EFI, basé en Finlande) impliquant près de 120 organismes dans 37 pays européens, vise à durablement renforcer la filière bois, les politiques forestières et la recherche. L'Union européenne a engagé un Plan d´Action pour l´Application des réglementations forestières, gouvernance et échanges commerciaux (FLEGT ; Forest Law Enforcement, Governance and Trade), et une Conférence ministérielle[49] sur la Protection des Forêts en Europe (MCPFE) est prévue à Oslo en 2011.
Les grands types de forêts

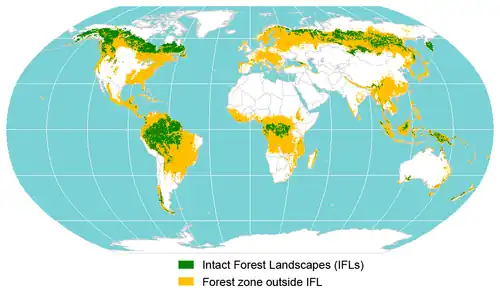
Classement biogéographique
Les forêts naturelles sont comme toutes les formations végétales conditionnées par un certain nombre de facteurs : la latitude, l'altitude, la nature du sol, le climat[50], les habitats forestiers[51] et « espèces typiques » qu'elles abritent, l'action des animaux, etc.
La latitude influence fortement la biodiversité dans les forêts. Celle-ci augmente d'autant plus que l'on s'éloigne des pôles et que l'on se rapproche de l'équateur.
Selon les latitudes on distingue :
- forêt boréale ou taïga (forêt de conifères, au nord du 60e parallèle). Pour le Canada, la taïga ne représente qu'une des nombreuses écozones de la forêt boréale et que celle-ci s'étend en dessous du 60e parallèle ;
- forêt tempérée :
- forêt tempérée sempervirente ;
- forêt tempérée décidue (formée d'arbres à feuilles caduques) ;
- forêt tempérée de résineux ;
- forêt tempérée mixte ;
- forêt méditerranéenne (formée de conifères et de feuillus à feuilles persistantes, un arbre caractéristique : le chêne vert) ;
- forêt tropicale :
- forêt tropicale humide (ou pluvieuse) sempervirente (toujours verte) ou semi-décidue (une partie des arbres sont à feuilles caduques) ;
- forêt galerie (le long des fleuves) ;
- forêt inondée (Cf. la mangrove formée de palétuviers) ;
- forêt tropicale sèche décidue ou semi-décidue ;
- forêt tropicale de résineux.
Naturalités des forêts
Dans beaucoup de pays où l'humanité est présente depuis des siècles, voire des millénaires, la forêt a perdu sa naturalité (environnement).
Les faciès actuels des forêts du Nord-ouest de l'Europe, par exemple, résultent en grande partie de l'influence de l'homme sur le plan :
- de la composition : Colbert avait en France besoin de chênes pour la marine. Dans plusieurs pays, pour bénéficier de subventions et/ou déductions fiscales, il faut planter des essences imposées (Ainsi le Fonds forestier national français a, par exemple, imposé les résineux sur de vastes surfaces après-guerre, en France) ;
- de la superficie : en trois siècles (XVIIIe-XXe), la superficie des forêts françaises a presque doublé (Cf. Forêt de guerre, enrésinement des Landes, enfrichement sur zones d'exode rural, plantations encouragés par le Fonds forestier national…). Mais dans le même temps, dans la moitié ouest du pays, les haies du bocage et les arbres dispersés ou d'alignement reculaient très fortement ;
- de la structure : la forêt française a dû, très longtemps, répondre aux besoins des communautés humaines qui les entouraient : depuis l'Empire romain, les forêts ont souvent été transformées en taillis qui alimentaient les forges, fonderies, boulanges et autres industries en charbon de bois ; le bois d'œuvre provenant souvent d'arbres émondés dans le bocage et les alignements de bords de routes.
En France, ce n'est qu'au XIXe siècle, en 1827, que l'institution d'un code forestier (faisant suite à une longue série d'ordonnances), ainsi que la création d'un corps d'État forestier (l'Administration des Eaux et Forêts) et l'utilisation de plus en plus massive de la houille, en remplacement du charbon de bois, vont permettre aux forêts françaises d'évoluer vers la futaie ; au XXe siècle, les terres libérées par la déprise agricole vont être plantées d'arbres, ou colonisées par des accrues spontanées, offrant respectivement des limites très géométriques à la forêt ou au contraire un faciès plus naturel et exubérant ; - des espèces : une part significative de la forêt française est encore composée d'espèces qui avaient été favorisées en réponse aux besoins des communautés humaines locales (les chênes pour leurs glandées) ou même d'impératifs économiques nationaux, par exemple (des légions d'épicéas et de douglas ont été plantés par le Fonds forestier national, au sortir de la Seconde Guerre mondiale, dans le contexte d'une balance commerciale déficitaire vis-à-vis des bois d'œuvre et d'industrie résineux).
Classement paysager
- Forêt claire et forêt dense
- Par type d'arbres : aulnaie, chênaie, boulaie, frênaie, ormaie, hêtraie, châtaigneraie, sauçaie, sapinière, pessière, pinède…
Classement patrimonial et écologique


Grâce aux approches phytosociologiques et écologiques, aux forêts modèles canadiennes, des outils d'évaluation qualitative se constituent depuis la fin du XXe siècle. Ils varient selon le contexte géographique ou social (ville, campagne, milieux plus naturels…). Ils permettent de mieux prendre en compte la taille, la qualité et l'intégrité des habitats forestiers dans les plans de gestion, les écolabels forestiers, et parfois dans les lois (directive Habitats en Europe par exemple).
Les critères retenus sont par exemple :
- la superficie forestière (par type et stade de la succession) rapportée à la superficie des terres (en pourcentage) ;
- la superficie des massifs ou aires boisées encore d'un seul tenant (patch, pour l'écologie du paysage) et la connectivité écologique entre les taches[52] ; et l'inverse, c'est-à-dire le degré de fragmentation écologique par les routes est aussi possible, ainsi que le nombre de kilomètres de routes par massif, ou rapporté au linéaire de lisière.
Par exemple, au Canada, un système d'évaluation qualitative des forêts accorde :- trois points aux boisements de plus de 4 ha en ville et de plus de 200 ha ailleurs (sauf îles) ;
- deux points aux surfaces de 2 à 4 ha en ville, et à celles qui couvrent de 20 à 200 ha ailleurs (sauf îles) ;
- un point aux bois de moins de 1 ha en ville et de moins de 20 ha ailleurs ;
- la superficie et la forme des cœurs forestiers.
Dans le système précédent de classement :- trois points aux boisements dont un cœur d'au moins 4 ha est éloigné de plus de 200 m de toute lisière ou bord de route ;
- deux points aux boisement dont un cœur d'au moins 4 ha est éloigné de plus de 150 m de toute lisière ou bord de route ;
- un point aux boisement dont un cœur d'au moins 4 ha est éloigné de plus de 100 m de toute lisière ou bord de route ;
- la connectivité ou la proximité avec d'autres massifs ou structures boisées (⇒ corridors écologiques boisés, gués…) :
- trois points si la distance au boisement le plus proche est de moins de 100 m ;
- deux points si la distance au boisement le plus proche est comprise entre 100 et 250 m ;
- un point si la distance au boisement le plus proche est de plus de 250 m ; (critère également retenu par la ville de Londres) ;
- la présence ou proximité d'eau, et de systèmes hydrographiques naturels (Hydrological Linkages Criteria), avec par exemple :
- un point si le boisement est à plus de 50 m de la berge d'un cours d'eau ou d'une étendue d'eau ;
- deux points si la distance est comprise entre 30 et 50 m ;
- trois points si l'eau est à moins de 30 m de la lisière boisée ou si elle est dans le boisement même ;
- La distance à une zone humide de type tourbière à sphaignes ou roselière vaut de même ;
- la qualité du sol, et de sa biomasse microbienne, sa diversité en nématodes, des vers de terre[53] ainsi qu'en champignons qui jouent un rôle majeur en forêt, en tant que symbiotes des arbres[54].
- la valeur de service écosystémique[55] dont en tant que protection des sols et effet-tampon contre l'érosion et le ruissellement :
Au-dessus de 30 % de pente, la forêt est seule garante de la protection du sol ;
De 15 à 30 % elle joue également une fonction de protection très importante (voir illustration ci-contre) ; - les îles boisées proches du continent ou sur des lacs ou fleuve, si le boisement est naturel ou « proche de la nature » sont également considérées comme de bons refuges pour certaines espèces en raison d'un moindre dérangement. Dans le cas d'îles véritables, les critères d'isolement prennent alors un sens positif, comme dans le cas des inselbergs ; à étudier au cas par cas relativement au contexte. En cas de présence de prédateurs introduits et devenus invasifs, elles peuvent aussi devenir des « puits écologiques » ou « pièges écologiques » ;
- le pourcentage de la forêt en aire protégée (par type, stade de la succession et catégorie de protection en % la superficie forestière totale) ;
- le taux de couvert forestier (par type) déjà converti ou en cours de conversion à d'autres usages (y compris routier) ;
- la superficie et le pourcentage de forêts touchées par une perturbation anthropique et/ou naturelle ;
- la complexité et l'hétérogénéité de la structure forestière ;
- le nombre d'espèces tributaires de la forêt ;
- le pourcentage d'essences indigènes et pourcentage de ces essences qui seraient menacées. Attention, c'est un indicateur relatif au contexte biogéographique. Il n'y a par exemple que trois essences indigènes dans toute l'Islande, contre 7 780 répertoriées en 2005 dans le seul Brésil (sous-espèces non comprises)[56]. De plus, les forêts tropicales comportent beaucoup d'essences, mais quelques-unes sont dominantes. En Afrique de l’Ouest et du Centre, en Asie du Sud et du Sud-Est et en Amérique centrale, on trouve naturellement une très grande diversité d’espèces d’arbres (jusqu'à près de 300 espèces différentes par ha), alors qu'en zone tempérée, boréale ou subsaharienne, les dix espèces d’arbres les plus fréquentes (en volume) concernent au moins 50 % de la biomasse forestière (en volume de bois sur pied).
Les espèces d’arbres les plus rares, surtout celles dont la valeur commerciale est élevée, sont souvent en danger d’extinction pour une partie de leur lignée. La FAO estime qu'en moyenne, 5 % des espèces indigènes d’un pays sont vulnérables, en danger ou en danger critique d’extinction ; - l'état de conservation des espèces tributaires de la forêt ;
- les indicateurs de la variation génétique sont exclus du présent examen car ils exigent normalement des analyses complexes de laboratoire (Namkoong et al., 1996 ; mais voir aussi Jennings et al., 2001) ;
- la présence, la masse, le volume, la qualité (bois durs, tendres, résineux, feuillus) et la répartition du bois mort, l'âge moyen des arbres, la présence de grands carnivores, de castors ou d'une grande richesse en champignons prennent ainsi des significations nouvelles, parfois opposées à celles qui étaient enseignées au siècle précédent en écoles de sylviculture ;
- l'état de pollution de la forêt (comment par exemple évaluer la qualité de la forêt, qui, dans les zones interdites de Biélorussie se restaure naturellement, mais sur des sols ayant reçu 70 % environ des retombées radioactives de la catastrophe de Tchernobyl ?).
Régimes juridiques
Ils ont beaucoup varié selon les époques et les pays, et varient dans un même pays à la même époque (La forêt peut être communautaire, royale, publique, privée, régionale, communale, etc.).
Il existe de nombreux classements des forêts correspondant à des statuts juridiques différents, avec par exemple pour la forêt française : la Forêt domaniale, la Forêt communale, la Forêt privée, la Forêt de protection ou encore la Réserve biologique domaniale (RBD ; intégrale ou non)
En Allemagne, ce sont :
- Markwald
- Landesherrlichkeit
- Säkularisierung
- Privatwald
- Hauberg
- Waldinteressentenschaft
- Kommunalwald
- Kirchenwald
- Landeswald
- Bundeswald
Aux États-Unis, on différencie le « Timberland » (2/3 de la surface totale enforestée) ouvert à l'exploitation, et le 1/3 restant de la forêt qui en est préservée, jouant le rôle de « tiers sauvage » (Wilderness), dont la vocation de puits de carbone pourrait prendre de l'importance[57].
Au Canada, le classement des forêts se fait grâce à la nature de l'écosystème forestier déterminé par le ministère des Ressources naturelles et de la Faune qui protègent différents milieux forestiers. Ces territoires sont protégés en vertu de la loi sur les forêts[58]. Il y a 3 types d'écosystèmes forestiers exceptionnels: Les forêts anciennes (77 sites, 191 km2)[59], les forêts rares (30 sites, 26 km2)[60] et les forêts refuges (16 sites, 13 km2)[61].
Fonctions de la forêt
La forêt remplit trois fonctions essentielles : écologique, économique et sociale.
Le fait de conduire ces trois fonctions simultanément se nomme la « multifonctionnalité » qui est une des caractéristiques majeures voulue par la politique forestière française[62]. Cependant cette position officielle ne fait pas consensus au sein des professionnels et propriétaires privés de la forêt, certains voulant une spécialisation des territoires, c'est-à-dire une « monofonctionnalité » orientée par exemple sur certaines zones vers la production optimisée de bois (fonction économique exclusive) et sur d'autres zones vers une libre évolution naturelle de la forêt sans exploitation de bois (fonction écologique exclusive)[63].
Fonction écologique


- Réservoir de biodiversité et d'habitats, ainsi que de ressources génétiques et phytopharmaceutiques, elles sont pour cette raison étudiées et parfois classées en réserves biologiques, naturelles, parcs nationaux, Espace boisé classé dans le PLU (Plan local d'urbanisme), etc.).
- Fonctions écopaysagères : « noyaux » ou « nœuds » du réseau écologique, et parfois corridor biologique pour la forêt galerie, les forêts linéaires, les mangroves, et les haies vives qui peuvent s'y rattacher.
- Protection contre certains risques naturels[65] (avalanches, inondations, sécheresse, désertification et éléments de résilience écologique…).
- Qualité de l'air : outre que la forêt produit une partie significative de l'oxygène de l'air sur les continents, elle a une capacité extraordinaire à fixer les poussières (comme certains polluants non dégradables), grâce notamment aux mousses, aux lichens, à la rosée et aux sols.
- Protection des sols (lutte contre l'érosion) : la forêt est un lieu de restauration du sol si elle n'est pas surexploitée.
cf. forêt des Landes en France ou la ceinture verte du sud algérien[66]. - Fonction macro et micro climatique, grâce à l'évapotranspiration et à la protection de la canopée qui atténuent considérablement les chocs thermiques, et la déshydratation due au vent.
- Puits de carbone, par fixation du gaz carbonique dans le bois et le sol, au moins pour les forêts tempérées[67] non soumises aux incendies et pour les forêts tropicales en phase de croissance.
cf. les plantations faites en Amazonie qualifiées de « puits de carbone ». - Fonction aménitaire.
- Les lisières forestières naturelles, éminemment complexes, ont des fonctions écotoniales importantes, notamment pour les forêts rivulaires et les mangroves.
Oxygène et climat
Une métaphore qualifie souvent la forêt de « poumon de la planète ». En dépit des fonctions nombreuses et essentielle voire « vitales » qu'elle remplit, la forêt ne peut être directement comparée à un poumon. Le poumon ne produit pas d'oxygène et c'est le plancton qui produit l'essentiel de l'oxygène planétaire disponible dans l'air et solubilisé dans l'eau[68]. Néanmoins, les forêts peuvent jouer le rôle de puits de carbone — et donc de producteur d'oxygène — pendant leurs phases de croissance. Lorsqu’elles atteignent l'équilibre, c'est-à-dire que leur biomasse est stabilisée, le bilan de photosynthèse-respiration pour ces écosystèmes climaciques est alors nul du point de vue de l'oxygène[69]. Néanmoins, la forêt a des fonctions essentielles micro et macro-climatique et pour la qualité de l'atmosphère, sur le plan de l'équilibre thermo-hygrométrique et de la pureté de l'air notamment. D'un certain point de vue, un peu à la manière du poumon, mais à une autre échelle, elle est une sorte d'écotone complexe et fonctionnel entre l'atmosphère et le sol, lié au cycle du carbone notamment, mais aussi à tous les cycles biogéochimiques importants.
Puits de carbone
Le bilan en carbone d'un écosystème est difficile à estimer.
- Il varie selon les zones biogéographiques, les époques, l'histoire du site, le stade de croissance de la forêt, les risques d'incendie, de sécheresse et d'inondation, et de nombreux autres facteurs tels que l'action d'insectes défoliateurs ou d'autres parasites des arbres. Le devenir du bois est aussi à considérer : bois de chauffage, papier-cellulose, bois d'œuvre, ou bois mort auront des impacts très différents quant aux émissions de dioxyde de carbone.
- Certaines forêts peuvent - au moins provisoirement - avoir un bilan nul (forêt tropicale mature) ou négatif (en zone d'incendies récurrents, ou en début de phase de croissance), tout en contribuant indirectement à enrichir les cours d'eau en nutriments (phosphore, potassium, calcium, fer, etc. et par les phénomènes d'acidification, humification, décolmatation et minéralisation et structuration des sols) en offrant ainsi une source constante de nutriments pour le plancton marin en aval, plancton qui produit 80 % de l'oxygène que nous respirons et qui constitue un important puits de carbone.
- En théorie, la photosynthèse consomme du dioxyde de carbone et produit du dioxygène et de la matière organique. De l'oxygène est consommé lors de la respiration des plantes elles-mêmes, des animaux de la forêt et de la biomasse cachée du sol forestier, ainsi que par les incendies naturels et moindrement par l'oxydation naturelle des éléments chimiques rendus disponibles par le processus de formation des sols.
En phase de croissance, après une dizaine d'années de bilan négatif s'il s'agit d'une régénération à partir d'un sol nu, la biomasse augmente régulièrement, principalement sous forme de cellulose et de lignine. Elle stocke aussi du carbone sous forme de nécromasse et de biomasse animale, microbienne et fongique. - En zone tropicale, la forêt pousse souvent sur des sols pauvres et acides ; l'humus ne s'y forme pas, et la nécromasse est rapidement recyclée ou minéralisée. La forêt tropicale en croissance stocke du carbone, mais finit (après plusieurs siècles, voire plus de 1000 ans) par arriver à un équilibre entre production primaire et décomposition du bois mort. À ce stade elle semble produire autant d'oxygène que ce qu'elle consomme. De plus, les émissions de méthane liées à la fermentation de bois immergés ou issus de l'activité des termites complexifient encore les calculs des émissions de gaz à effet de serre.
Un « point de basculement » dans le système climatique va être atteint beaucoup plus tôt que prévu. De puits de carbone, les forêts tropicales vont devenir des sources de carbone dès le milieu des années 2030[70].
- En zone tempérée ou froide, il en va autrement avec respectivement les sols forestiers (incluant les tourbières associées à certaines forêts) et les pergélisols qui, en zone circumpolaire, qui peuvent stocker des quantités considérables de carbone (sous forme d'hydrate de méthane).
Enfin, le devenir et la durée de vie du méthane émis par les écosystèmes forestiers ne sont pas encore bien compris. Il pourrait avoir été surestimé ou sous-estimé.
Effets biophysiques
Un tiers de la contribution des forêts au climat vient de leurs effets biophysiques, comme leur rôle dans la formation des nuages, l’humidification de l’air ou la production de composés organiques volatils. Une étude parue en 2022[71] détaille les trois principaux effets biophysiques : l'albédo, l'évapotranspiration des arbres et la « rugosité » de la canopée, qui produit des microturbulences quand elle est soumise au vent, ce qui dissipe la chaleur et contribue à refroidir le milieu. À ces trois effets principaux s’ajoutent ceux liés aux composés organiques volatils que les arbres émettent en condition de stress. Combinés, ces effets biophysiques refroidissent la température de la planète d’environ 0,5 °C[72].
Enjeux de biodiversité
- La forêt est un réservoir de biodiversité important. Les forêts tropicales humides concentrent 80 % de la biodiversité terrestre mondiale recensée. « En l'état actuel de nos connaissances, on peut estimer qu'elles abritent environ 80 % des insectes, plus de 80 % des reptiles, environ 90 % des amphibiens et des primates et près de 70 % des espèces végétales terrestres[73] ». Elles sont également un réservoir dans les régions à la fois urbanisées et très agricoles[74]).
- Certains économistes ont tenté d'intégrer les valeurs aménitaires de la biodiversité forestière. Ainsi en France, dans le cadre des travaux de l'ONU visant à donner une valeur économique à la biodiversité, le Conseil d'analyse stratégique (CAS) a-t-il le 29 avril 2009 communiqué les résultats de ses premières évaluations, estimant à 970 euros par hectare et par an en moyenne la valeur d'un boisement intégrant celle des produits de cueillette et de puits ou stockage du carbone, aménités, etc.
Selon un sondage (de 4 500 ménages, en 2002), les Français seraient prêts à payer 15,20 € par ménage et par an pour contribuer au maintien de la biodiversité dans la forêt, soit au total 364 millions d'euros par an ou 22,80 €/ha, ce qui peut contribuer à estimer la valeur ressentie de la biodiversité[75]. - Une étude du Fonds mondial pour la nature (WWF) et de la Société zoologique de Londres (ZSL) publiée en 2019 relève que la population animale des forêts à travers le monde a baissé de près de 53 % depuis 1970. Un phénomène qui s'expliquerait principalement par la destruction d'espaces vitaux par l’activité humaine[76].
Économie forestière
_(19176444888).jpg.webp)

Le bois compte pour une part importante du PIB d'une dizaine de pays tropicaux ou nordiques. L’emploi forestier (hors industrie de transformation et emplois informels) payait encore près de 10 millions de personnes en 2005[77], 400000 dans la filière bois 2010 en France[78] mais ;
- l'emploi forestier décline régulièrement relativement au tonnage extrait des forêts qui lui n'a cessé d'augmenter, et ce depuis l'invention de la tronçonneuse. Il diminue en moyenne de 1 % par an dans le monde (-10 % de 1990 à 2000), surtout en Asie et en Europe, alors qu’il augmentait légèrement ailleurs. La FAO impute ce déclin à l'augmentation de productivité du secteur, et -pour l'Europe de l'Est - à la restructuration des économies planifiées[79]. Cependant, l’industrie forestière représente l’unique source de revenus de plusieurs communautés rurales du Canada. Le taux d’emploi lié à ce secteur augmente d’année en année. En effet, le taux d’emploi direct de l’industrie forestière de 2012 a augmenté de «0,9 % par rapport au taux enregistré en 2011, pour atteindre 235 900 emplois.» Le secteur de l’industrie forestière fournissant le plus grand nombre d’emplois au Canada, soit dans celui de la fabrication des produits du bois, a lui aussi connu une hausse de 3,2 % de son taux d’emplois de 2011. Il y a toutefois, le secteur de pâte et papier qui a connu une diminution de 9,2 % de son taux d’emploi entre 2011 et 2012. « Ce recul s’explique par les énormes défis auxquels s’est heurté ce secteur, notamment le déclin structurel du papier journal et du papier d’impression et d’écriture en raison de l’essor des médias électroniques et du ralentissement cyclique des marchés mondiaux de pâtes de bois »[80]. De plus, l’industrie forestière a amené la création d’environ 363 700 emplois indirects au Canada en 2012. Donc, si ses tendances se maintiennent l’industrie forestière créerait plusieurs nouveaux emplois au Canada ce qui profitera tant à son économie qu’a sa population.
- Le prix moyen du bois brut diminue : L'augmentation moyenne des prix payés (grumes ou bois sur pied) était de 11 à 15 % dans les années 2000-2005 (source FAO, FRA 2005), mais est toujours resté inférieur à l’inflation ; il y a donc baisse du prix moyen (notamment pour le bois tropical) au niveau mondial, ce qui n'exclut pas en aval et pour le consommateur de fortes hausses du bois-énergie là où il devient rare ou après les « chocs pétroliers » et des bois écocertifiés ou écosociocertifiés pour lesquels l'offre reste très supérieure à la demande, pour le FSC notamment.
- Le secteur informel reste très mal connu. Via la vente de gibier notamment, il est important.
- Une partie importante des prélèvements et bénéfices est illégale, menaçant des essences et des espèces théoriquement protégées et/ou menacées. Les populations autochtones pâtissent de la corruption et des pressions des exploitants. 10 à 15 milliards d’euros par an seraient ainsi blanchis dans le monde, dont près 3 milliards € dans l'UE, provenant de six régions où la production de bois est un enjeu important. Vingt États membres de l’UE sont en 2006 encore suspectés d’importer du bois illégal (Finlande, Suède et Royaume-Uni en tête)[81]. Le « réseau TRAFFIC[82] » du WWF et de l'UICN sur le Commerce International des Espèces Sauvages estime que le commerce légal et illégal d'espèces atteindrait 15 milliards d’euros de chiffre d'affaires annuel (juste derrière le trafic d'armes et de la drogue). Une étude[83] du gouvernement britannique a estimé que l'interdiction du bois illégal en Europe est possible et crédible, avec les outils existants et des contrôles efficaces, au profit des filières légales et durables aujourd'hui confrontées à une concurrence déloyale. Des dizaines d'ONG dont Greenpeace et WWF depuis une vingtaine d'années dénoncent le bois illégal et promeuvent des écocertifications crédibles et transparentes, telles que décrites par le groupe d'ONG FERN, dans une évaluation[84] publiée en 2001.
- De nouvelles fonctions émergent : sociales, agrosylvicoles, touristiques, pédagogiques, scientifiques et de protection environnementale (en 2005, 11 % des forêts du monde sont déclarées par les États « affectées à la conservation de la diversité biologique » ; ce taux est en augmentation, mais ne correspond pas toujours à une réalité de terrain[85]). La fonction de puits de carbone semble devoir prendre de l'importance. L'importance économique de ces nouvelles fonctions est mal évaluée, mais pourrait localement rapporter plus que l'exploitation du bois.
Production de bois
- Bois de chauffage et bois de feu, la plus importante utilisation de par le monde mais essentiellement en Afrique et Amérique du Sud (et derrière la destruction de la forêt pour étendre les terres agricoles ou d'élevage) ;
- Bois d'industrie : bois de trituration (pâte à papier), déroulage placage, panneaux de fibres, emballage ;
- Bois d'œuvre : charpente, bois de mine, traverses de chemin de fer, ameublement ;
- Bois de service (poteaux, piquets, perches) ;
- Produits ligneux dérivés (copeaux de bois caulinaire pour le paillage des arbres et arbustes, bois raméal fragmenté).
Produits forestiers non ligneux (PFNL)
Selon la FAO les PFNL sont « des produits d'origine biologique, autres que le bois, dérivés des forêts, d'autres terres boisées et d'arbres hors forêts ».
Les PFNL peuvent être récoltés dans la nature ou produits dans des plantations forestières ou des périmètres d'agroforesterie, ou par des arbres hors forêt.
Les PFNL comprennent des produits utilisés comme nourriture et additif alimentaire (noix comestibles, champignons, fruits, herbes, épices et condiments, plantes aromatiques, viande de gibier), des fibres (utilisées dans la construction, les meubles, l'habillement ou les ustensiles), des résines, gommes et produits végétaux et animaux utilisés dans des buts médicinaux, cosmétiques ou culturels[86].
Voici quelques exemples de PFNL :
- Champignons ;
- Gibiers ; Comme en témoignent en France les anciennes « cartes des chasses » (Carte des Chasses du Roi (Louis XV), Carte des chasses des environs de Brunoy, etc.) certaines forêts ont été conservées, aménagées et gérées pour conserver le grand gibier recherché par le roi, la cour et la noblesse plus que pour la production de bois.
- Fruits des bois ;
- Plantes médicinales et tinctoriales ;
- Tourisme lié à la forêt.
Loisirs

Les forêts sont des lieux privilégiés de loisirs, de détente, de tourisme, de découverte de la faune et de la flore et des paysages[87]. Chaque année, les forêts françaises reçoivent des centaines de millions de visites. La forêt rend de nombreux services à la société, de nature écologique et sociale. Elle est, par exemple à la fois un lieu sûr d'aménités et de détente, et un lieu de protection des espèces. Ces fonctions nécessitent un entretien des chemins par les forestiers (ouverture, sécurisation, nettoyage…). Bien que considérée comme un bien commun pour une partie de ses fonctions, en France toute forêt a un propriétaire (privé ou public). Quand on se promène en forêt, on se promène sur une propriété. Le promeneur doit en tenir compte et respecter ces lieux. L'accueil du public est la règle en forêt publique et souvent en forêt privée.
Patrimoine et bien commun

Il y a 8 000 ans environ qu'avec l'aide du feu, nos ancêtres ont commencé à déforester l’hémisphère nord (en commençant par la Chine) pourtant la forêt est restée présente dans de nombreux contes, mythes et légendes[88], dans presque toutes les civilisations.
La valeur spirituelle et culturelle de la forêt réelle ou mythique n’est pas contestée. Le nom de Brocéliande en évoque encore les druides et la magie. Nemeton était le mot celte qui signifiait à la fois sanctuaire, et forêt. Bien après qu'on eut oublié la forêt de Dodone des Grecs, on continue de comparer les piliers des cathédrales gothiques aux troncs d'une forêt dont les branches seraient les arcs qui soutiennent la voûte. Au siècle dernier, de nombreux bûcherons allemands murmuraient une petite prière d'excuse à l'arbre qu'ils allaient couper. En Inde, les sannyâsa se retirent et se recueillent en forêt, comme le faisaient certains ermites européens. En Chine, les sommets boisés abritaient presque toujours un temple. Au Japon, la forêt que reflètent ou symbolisent en miniature certains jardins est sacrée, comme l'indique le Torii qui marque parfois son entrée, comme celle d'un temple. L'arbre de vie est omniprésent dans les mythes fondateurs des pays forestiers, mais aussi des pays déforestés, avec un arbre de la connaissance à connotation ambiguë dans la bible.
.jpg.webp)
La forêt est souvent symboliquement interprétée comme reliant ciel et terre, par les branches, les troncs et ses racines.
La forêt est aussi le domaine de l'Homme sauvage, présent dans de nombreux mythes d'Europe de l'Ouest ou d'Asie ; l'Homme sauvage qui est comme l'arbre présent dans l'héraldique européenne[89].
La forêt fait également peur ; lieu de Nature où l'on se perd, lieu où l'on perd les enfants, où l’on rencontre le loup, où des dieux, les esprits et les animaux sauvages vivent, où la nuit se fait plus noire, dernier refuge des loups et des ours pourchassés. C'est le lieu où les hors-la-loi, bons (Robin des Bois) ou méchants, se cachaient, bien que les forêts soient parfois exclusivement réservées aux chasses royales.
En Europe, à partir du siècle des Lumières et du modèle royal français, on s'est employé à les humaniser, à les nommer et à les fragmenter pour mieux les maîtriser en les quadrillant d'allées et de layons, puis on les a plantées et « rationnellement » gérées.
C'est localement un lieu de mémoire avec les forêts royales, la forêt de guerre.
C'est enfin et surtout le lieu de vie des peuples de la forêt, amérindiens, africains, et d'Asie du Sud-Est notamment, là où ils ont survécu. Lieu séculaire de l'initiation, refuge des esprits, lieu de vie et d'aventure pour de nombreux peuples… lieu aménitaire de détente et de découverte de la nature pour d'autres, la forêt est reconnue pour toutes ces fonctions par certaines lois nationales et par l'écosociolabel FSC.
La plupart des populations et des élus se disent très attachés à l'idée de protection d'arbres remarquables, de la forêt et/ou de forêt qui protège, pour des raisons bien plus larges que pour les services qu'elle rend comme espace de détente et de loisirs ou comme lieu de cueillette familiale de fleurs, de fruits et champignons.
Partout dans le monde, des fragments de biodiversité ont été protégés dans des « bois sacrés » qui ont échappé aux coupes et on repère ou classe des arbres parce que vénérables et remarquables ou pour leur intérêt paysager ou écologique ou de protection. Il devient délicat de gérer les forêts uniquement pour la coupe du bois. Pour les artistes et les touristes, comme pour les scientifiques et les industriels, elles recèlent des trésors qu'il convient de léguer aux générations futures et sont un gage d'adaptation et de résilience face au réchauffement climatique.
Un quart de la France vit à l'ombre des arbres. Certains sont millénaires et ont connu la Gaule chevelue, les cultes anciens. Citadins et ruraux souhaitent la conservation d'un nombre significatif de vieux arbres. La première réserve de la forêt de Fontainebleau (552 ha de « réserve artistique ») a été demandée par des artistes, et non par des forestiers.
Pour certains collectifs et associations (telles que Prosilva, le Réseau pour les Alternatives Forestières – RAF, le collectif SOS Forêts France…) la forêt est désormais à réexaminer en tant que « bien commun », c’est-à-dire qu’il conviendrait de dépasser le seul droit de propriété pour aller vers le droit d’usage apporté par les services écosystémiques fournis par la forêt à tout un chacun. Chaque parcelle, chaque forêt représente un enjeu important pour les sociétés humaines, car jouant un rôle primordial dans la qualité de l’eau et de l'air, dans le stockage de CO2… Il devient alors essentiel de redonner à la forêt son statut de bien commun, volontairement effacé par le politique au service des lobbies financiers. Pour ces associations environnementales, la tendance actuelle, qui ne conçoit la forêt qu’en termes de peuplements d’arbres constitutifs d’une ressource à extraire, allant jusqu’à oublier les autres composantes de l’écosystème forestier, est à arrêter impérativement. La forêt est, selon cette analyse, un bien commun à défendre[90].
Habitat de l'Homme, lieu nourricier et cynégétique

Plus de 500 millions d’humains vivent en forêt ou à ses abords et en dépendent directement. Même quand elle n'est plus habitée, elle reste un lieu traditionnel de cueillette et de chasse (aux grands animaux surtout, qui ont disparu ou régressé dans les plaines cultivées et habitées). Pour environ 150 millions d'autochtones appartenant à des centaines de tribus et peuples autochtones, la biodiversité de la forêt est encore la source vitale d'eau, de matériaux, de plantes, fruits, animaux et champignons comestibles ou utiles (médicaments, ornements…). La « viande de brousse » reste localement la première source de protéine dans de nombreux pays tropicaux, bien qu'elle soit menacée par l'augmentation de la pression de chasse, des armes de plus en plus performantes, et des moyens de transports tels que le quad.
Dans les pays riches et tempérés, la chasse reste également importante, les revenus cynégétiques approchent ou dépassent souvent 50 % du revenu forestier global dans des pays tels que la France.
La chasse est un revenu complémentaire considérable du forestier qui atteint, par exemple, souvent 50 % des revenus des grandes forêts publiques de France où en 2006, les baux de chasse ont rapporté 41,1 millions d'€ à l'ONF (soit 2,4 millions de plus que l'année précédente), alors que le bois a rapporté 199,6 millions d'€ (soit 15 % de plus qu'en 2005)[91].
Mais le « grand gibier » quand il est trop abondant, notamment à la suite d'un agrainage important et à la disparition de ses prédateurs naturels, peut provoquer des dégâts assez importants pour freiner ou bloquer la régénération forestière.
Une vraie gestion cynégétique demanderait aussi de prendre en compte les problèmes sanitaires (peste porcine, CWD, maladies véhiculées par les tiques, apparition du SIDA ou de virus hémorragiques, type Ebola, etc.), notamment en l'absence de prédateurs.
Plus localement, des problèmes nouveaux sont posés avec la contamination du gibier (sanglier notamment) par des toxiques issus de séquelles de guerre ou retombés avec les pluies qui ont lessivé le nuage de Tchernobyl. Les forêts tropicales produisent l'essentiel de la viande de brousse, avec des pressions de chasses qui ont raréfié ou fait disparaître le gibier sur de vastes zones.
La question de la pollution par le plomb de chasse, liée à la toxicité des munitions (grenaille et balles) s'y pose moins que dans les zones humides, mais elle semble pouvoir avoir été sous-estimée.
Environnement et santé
Très tôt, certains arbres ont été réputés assainir l'air (sapin, épicéa, pin sylvestre, eucalyptus plantés autour des hôpitaux et des lieux de cure), ou au contraire, plus rarement le corrompre (ne pas dormir sous un noyer). La marche en forêt était recommandée, et des parcours-santé y sont encore fréquemment installés, de même que dans les parcs urbains boisés.
Les forêts jouent un rôle majeur en matière d'épuration physique et physicochimique, et probablement biologique de l'air et de l'eau. Les produits de la forêt et toutes les parties des arbres ont été utilisés pour produire des médicaments et de nombreuses médecines traditionnelles. Une sylvothérapie et des cures sylvatiques ont été développées dans certains pays au XIXe et début du XXe siècle pour faire profiter certains malades (tuberculeux notamment) de l'air forestier enrichi en oxygène (trois fois plus d'oxygène produit par la forêt tempérée qu'en prairie[92]), en Ozone (notamment en bord de mer et dans les forêts de résineux) et en phytoncides (molécules réputées bactéricides et fongicides, dont terpènes) et de la pureté de l'air. On a récemment montré que l'activité biochimique est beaucoup plus développée dans la canopée que dans la strate herbacée.
Après Louis Pasteur, diverses mesures citées par G. Plaisance ont comparé différents airs et montré que l'air forestier contenait moins de microbes que l'air urbain (50 microbes par m³ d'air, contre 1 000 dans le parc Montsouris de paris, 88 000 sur les Champs-Élysées, 575 000 sur les grands boulevards et 4 000 000 dans les grands magasins à Paris selon Georges Plaissance[93]).
Forêt cinéraire
Les forêts cinéraires, ou lieu du dernier repos en forêt (voir Cimetière naturel), existent depuis très longtemps en Allemagne[94]. En France, en Haute-Garonne, la première forêt cinéraire est ouverte[95].
Ennemis de la forêt
Ennemis « naturels »
Le forestier craint surtout le feu et des insectes ravageurs tels la chenille processionnaire du pin, celle du chêne, certains xylophages, des bactéries ou des champignons (ex : graphiose de l'orme, maladie de l'encre du châtaignier). Les attaques qui prennent l'apparence d'épidémies et de pullulations suivent généralement un affaiblissement des arbres dû à des évènements de type sécheresse, tempête, pollution, drainage, fragmentation, etc. Les arbres stressés par une sécheresse sont ensuite beaucoup plus vulnérables au froid (jusqu'à une dizaine d'années après)[96].
Il semble que dans les milieux extrêmes (polaires, subsahariens), les pullulations fassent partie de cycles naturels et régulateurs, dans des forêts dont le nombre d'essences est réduit, et plus exposées aux chocs climatiques.
La biodiversité forestière peut aussi être menacée par des essences introduites qui peuvent devenir invasive ou poser des problèmes de pollution génétique et/ou d'allélopathie.
Dans l'hémisphère nord, des mammifères rongeurs (ex : mulots, campagnol des champs), les lapins et des espèces-gibier (cerfs, daims, chevreuils, wapitis, etc.) sont localement considérés comme "nuisibles" par les forestiers parce qu'ils broutent les jeunes pousses et rongent les écorces. En forêt méditerranéenne, les moutons et surtout les chèvres sont des ennemis redoutables des arbres.
Ainsi, la diversité génétique est au centre des préoccupations actuelles sur l’avenir des forêts menacées par ces ennemis. On prévoit notamment, pour les espèces qui les composent, des pressions de sélection d’une ampleur et d’une rapidité inédites, en liaison avec les changements climatiques[97].
Chiffres : Selon les chiffres fournis par les états à la FAO ; en 2000-2005, en moyenne, 104 millions d'hectares de forêts ont été annuellement ravagés par des incendies, des insectes et maladies, des sécheresses, tempêtes, grands froids ou inondations. Ce chiffre est sous-estimé car certains pays (africains notamment) n’ont pas réunis ou fourni de statistiques, alors que l’imagerie satellitaire montre d’importants dégâts par le feu en Afrique.
D'un point de vue historique, l'Homme a eu une relation ambiguë à la forêt et notamment à la forêt primaire, parfois protecteur ou n'y développant pas d'impact visible durant des millénaires (en forêt équatoriale, hormis sur certaines îles), et souvent destructeur en zone tempérée européenne, asiatique et au Moyen-Orient ou en Australie, depuis plusieurs milliers d'années.
Accidents climatiques
.JPG.webp)
Les périodes de sécheresse, comme 1976, ou de forte canicule (2003) peuvent provoquer le dessèchement des feuilles qui tombent alors prématurément. On peut constater aussi des brûlures de l'écorce exposée au soleil (hêtres).
Les effets peuvent se faire sentir des années après. La sécheresse aggrave le plus souvent les effets d'autres agents, tels les incendies ou les insectes ravageurs. Ainsi, en 1976, les incendies accentués par la sécheresse brûlèrent plus de 800 km2 en France.
En période hivernale, le gel n'est généralement pas à redouter, sauf les cas extrêmes, comme en 1956 en France ou en 1985, lorsque 30 000 pins maritimes landais gelèrent. Les gelées tardives, sont, elles, nuisibles pour les jeunes plants. La neige peut être dangereuse dans certaines conditions, lorsqu'elle forme des manchons autour des branches, qui finissent par casser sous le poids accumulé.
Les tempêtes, comme celle de décembre 1999 en Europe de l'Ouest, provoquent le déracinement et l'abattage des arbres, qui forment les « chablis » ou leur cassure par le milieu du tronc, laissant en place les « chandeliers » et au sol les « volis ». En France, la tempête de 1999 a ainsi abattu 146 millions de m³ de bois.
Action de l’homme

La déforestation

La déforestation résulte d'une surexploitation de la ressource forestière et/ou d'une destruction des forêts (défrichements) par l'homme telles aboutissant à un changement de l'occupation du sol (forêt remplacée par des milieux agricoles ou des pâturages, l'urbanisation, les voies de transport, voire un désert…).
Les grands défrichements sont très anciens en Europe méditerranéenne et occidentale, au Moyen-Orient et en Chine, où ils datent du Néolithique et du Moyen Âge (la seconde phase de grands défrichements en Europe de l'Ouest se déroule au milieu du Moyen Âge). Ils se poursuivent à moindre échelle pour faire place à certains équipements, autoroutes, à l'urbanisation, aux réservoirs hydro-électriques, aux aménagements pour les sports d'hiver, etc. De nos jours, en Europe comme en Chine, et dans une moindre mesure en Amérique du Nord, on assiste globalement à une phase de reboisement. Ce reboisement a commencé au XIXe siècle en Europe sur les terres peu productives, et se poursuit de nos jours avec la déprise agricole dans les zones peu propices à l'agriculture mécanisée, en particulier dans les régions montagneuses.
À l'heure actuelle, ce sont surtout les forêts tropicales qui souffrent de la déforestation, soit pour des raisons de développement économique, comme en Asie du sud-est et en Amazonie, soit par surexploitation des ressources en bois tropicaux, comme en Afrique. La déforestation entraîne la destruction des habitats naturels de nombreuses espèces endémiques et contribue pour une grande part à l'extinction des espèces sur la planète, en particulier dans les régions tropicales où la biodiversité est beaucoup plus riche que dans les régions tempérées.
En 2006, bien qu’il n’y ait toujours pas de convention internationale sur la Forêt (le principal échec de Rio, avec abandon de la convention au profit d'une simple déclaration[99]), plus de 100 pays avaient institué un programme forestier national, incluant généralement un volet protection (bien que les programmes portent encore essentiellement sur le développement de l’exploitation du bois) et parfois un volet sur l'état de conservation[100] (ou restauration) des sols, de l’eau, de la diversité biologique et d’autres richesses et services environnementaux.
La sylviculture durable vise à récolter le bois de forêts sans entraîner la déforestation. Ces programmes quand ils existent sont parfois peu respectés dans les pays très pauvres ou ceux subissant des troubles civils.
Il resterait en 2006 environ 4 milliards d’hectares plus ou moins boisés sur la planète, soit environ 30 % des superficies émergées. De 1990 à 2005, 3 % de la forêt a disparu, (- 0,2 % par an) selon la FAO.
De 2000 à 2005, 57 pays ont signalé un accroissement de leur taux de boisement (mais s’agit souvent de plantations industrielles (eucalyptus, peupliers, résineux, palmiers à huile) de peu d’intérêt pour la biodiversité). 83 pays ont reconnu que leur forêt reculait. La perte nette serait de 7,3 millions d’ha/an (soit 20 000 hectares/jour).
Les 10 pays les plus riches en forêts représentent à eux seuls 80 % des forêts primaires de la terre, dont l’Indonésie, le Mexique, la Papouasie-Nouvelle-Guinée et le Brésil. Ce sont aussi ceux qui ont subi la déforestation la plus intense et rapide de 2000 à 2005, en dépit de plantations de forêts secondaires commerciales.
L'Asie de l'Est qui avait perdu la plupart de ses forêts a enregistré le principal accroissement à la suite des centaines de millions d’arbres plantés en Chine (mais ce sont de jeunes boisements et non des forêts au sens écologique du terme) et ces accroissements ne compensent pas les taux élevés de déforestation d’autres zones. Globalement la déforestation s’est encore accélérée en Asie du Sud-Est de 2000 à 2005 et plus encore en Afrique et en Amérique latine/Caraïbes ; l’Afrique représente encore 16 % de la superficie boisée totale, mais elle a perdu plus de 9 % de ses forêts de 1990 à 2005, pendant que la Chine, l'Europe et l'Amérique du Nord pouvaient accroître leurs superficies forestières dans le même temps. New Scientist a publié une étude sur les 50 pays les plus boisés : 22 présentaient en 2006 une nette reforestation. La situation au Brésil et en Indonésie est préoccupante, tandis que la Chine crée la surprise : depuis 2002, on y a replanté une surface équivalente à celle de la Californie.
La déforestation est aussi une cause d'apparition et de diffusion de maladies émergentes.
La pollution
Les polluants liés à l'activité humaine sont nombreux : anhydride sulfureux qui provoque les fameuses « pluies acides » auxquelles fut attribué le dépérissement des forêts constaté en Europe dans les années 1970-80, mais qui devait beaucoup aussi à la sécheresse et aux pesticides véhiculés par l'air et/ou solubilisés par les pluies, les oxydes d'azote, l'acide fluorhydrique, émis localement par certaines industries notamment dans certaines vallées alpines, les particules émises par la combustion du charbon et des carburants pétroliers, l'ozone… avec aussi en montagne et dans les zones froides le sel de déneigement. Par ailleurs, les mousses et les lichens piègent très efficacement les particules de l'air, dont ils se nourrissent. Par ce biais, ils fixent aussi les métaux lourds de plus en plus présents dans l'air, ainsi que d'autres polluants (au point d'en mourir parfois, ce qui en fait, selon la sensibilité de espèces de bons bio-indicateurs). Les champignons qui font la richesse du sol forestier se montrent également capable de bioconcentrer de nombreux polluants (métaux lourds dont plomb, cadmium et mercure, mais aussi radionucléides, qui peuvent ensuite être concentrés par la chaîne alimentaire).
La forêt a de tous temps également été un lieu privilégié pour la chasse ; les munitions au plomb (grenaille et balles) y ont été dispersées par de milliers de tonnes chaque année, souvent tirées aux mêmes endroits ; près des points d'eau, des berges de fleuves, sur les lieux d'agrainage, sur les layons ou cloisonnements ou à partir de postes de tir aménagés. Les sols forestiers sont souvent naturellement légèrement acides à très acides en zones tropicale ou boréales, ce qui facilite la dispersion et biodisponibilité de ce plomb enrichi d'arsenic et d'antimoine, ainsi que du mercure qui a longtemps été utilisé par les amorces.
Dans certains pays, des boues de station d'épuration sont régulièrement dispersées en forêts, parfois sous forme de pulvérisation, ce qui peut contribuer à la dispersion de certains contaminants.
Avec les premières expérimentations d'arbres OGM (peupliers essentiellement, testés par exemple en France et au Canada en milieu non-confinés), certains craignent une pollution génétique en cas de transmission du gène, ou un impact sur la faune et le sol forestier via la toxine BT émise par ces arbres.
Les séquelles de guerre
De tous temps, les forêts ont été stratégiques du point de vue militaire. Elles ont servi de réserve de bois de marine et charpente, mais surtout d'abri ou de cible à toutes les armées, maquis et résistances, des millions de réfugiés s'y protégeant encore aujourd'hui dans les pays en conflits. Parfois on les a pillées ou détruites dans le cadre de la stratégie de la « terre brûlée ». Au Viêt Nam et Laos, le défoliant, le napalm et les munitions à sous-munitions ont laissé des traces encore persistantes (dioxines, métaux lourds, sols dégradés, mines actives, etc.). Le bois mitraillé des forêts françaises a perdu de sa valeur technique et financière, mais il peut aussi avoir été pollué par le plomb ou d'autres métaux lourds.
Au XXe siècle, notamment en France dans la zone rouge, de vastes forêts dites « de guerre » ont été artificiellement plantées sur des sites agricoles rendus incultivables par les séquelles de guerre et localement en Allemagne ou en France sur des sites gravement pollués par des accidents liés à la production d'usines d'armement ou d'usine produisant en amont les toxiques chimiques ou les métaux utilisés dans les munitions (plomb, cadmium, zinc, cuivre, mercure, etc.). Des forêts comme celle de Verdun contiennent encore des quantités considérables de munitions non explosées, dont certaines chimiques (chargées de « gaz de combat »).
Feux de forêt

Ils sont le plus souvent allumés par l'homme, volontairement (pyromanes, bergers…) ou involontairement (négligence). Le fire-stick farming, souvent employé par les aborigènes australien, a profondément[101] modifié la faune et flore d'Australie. Cette pratique consistait à brûler de vastes terres pour faciliter la chasse a entraîné la disparition de sa mégafaune… Malgré des moyens de surveillance et de lutte de plus en plus performant, leur nombre et leur gravité ne cesse de croître en zone tropicale (Indonésie, Brésil..) mais aussi en Europe et en Amérique du Nord ou Australie.
Prenant des proportions catastrophiques dans certaines régions (notamment autour de la Méditerranée), ils conduisent à la mise en place de moyens de lutte très importants, dont l'efficacité est variable. Toutes les essences forestières sont combustibles, mais certaines riches en produits volatils favorisent la combustion et l'extension de l'incendie, d'autres résistent mieux (grâce à des phénomènes de protection comme la création de liège), ou se régénèrent plus vite.
Il est difficile de tirer un bilan de l'action de l'homme sur les forêts : il ne se résume pas à des actions néfastes, car si les États n'ont pas enrayé la déforestation ni pu s'accorder pour rédiger et signer une convention internationale pour la protection des forêts à Rio en 1992 ou à Johannesburg en 2003, de nombreux programmes locaux d'études et de restauration de forêts existent dans le monde, dont les forêts modèles canadiennes.
En Europe de l'Ouest, la forme et la superficie des forêts européennes contemporaines résultent essentiellement de l'action de l'homme, et il est couramment admis chez les forestiers qu'elles sont gérées de manière durable. Contrairement à une idée répandue, la surface de la forêt française, après avoir fortement diminué jusqu'à la fin du Moyen Âge a réaugmenté, y compris depuis les années 1900 (d'environ + 30 %), mais souvent grâce à des plantations commerciales de résineux et peupliers, moins riches au niveau de la biodiversité et avec un recul des zones humides. Le gain en superficie n'a pas freiné ou compensé le recul des oiseaux, insectes, lichens et fleurs typiquement forestières, ni le recul massif du bocage et des arbres épars depuis les années 1950. Les arbres tendent par ailleurs à être exploités de plus en plus jeunes et les plantations sont génétiquement peu variées. Hormis localement, à la suite des tempêtes, le gros bois mort reste trop rare pour permettre la survie de nombreuses espèces d'invertébrés saproxylophages.
L'action de l'Homme
Gestion administrative, protection et conservation

Selon les époques, les lois et les lieux, la gestion est communautaire, nationale, régionale, communale ou privée. Elle relève parfois comme en France d'un ministère qui est chargé de l'Agriculture ou comme en Belgique des Régions.
Une très petite part des forêts non primaires ne sont pas gérées pour la production de bois (ex : réserves naturelles, réserve biologique intégrale, Parcs nationaux, forêts de protection, forêts urbaines, ou font l'objet d'une gestion restauratoire à fin de protection de la ressource en eau ou des sols). L'écologue japonais Akira Miyawaki a été pionnier en matière de Forêt de protection restaurée à partir d'essences locales.
Les habitats forestiers comptent parmi les habitats les mieux représentés dans les parcs nationaux, régionaux et les 25 000 sites Natura 2000 (couvrant fin 2009 environ 17 % du territoire européen et constituant le premier réseau d'aires protégées au monde), mais la commission européenne reconnait que Natura 2000 préserve à ce jour surtout des espèces remarquables et pas assez de réseaux de corridors biologiques boisés ni la biodiversité dite ordinaire, dont dépend l'essentiel des services « gratuitement » rendus par les écosystèmes. De 40 % à 70 % des espèces d'oiseaux et de 50 % à 85 % des habitats dans lesquels se déploient la faune et la flore européennes se trouvent ainsi dans « une situation de conservation critique »[102]. Diverses espèces forestières, invertébrés du bois mort notamment sont en péril, et font localement l'objet de plans de restauration ou de réintroduction (dont dans le cadre du Grenelle de l'environnement en France).
Les forêts primaires continuent à reculer, et à Rio, comme à Johannesburg ou à Nagoya, les élus et États présents n'ont pas réussi à valider le projet d'une Convention mondiale pour la forêt, qui n'est restée qu'une déclaration d'intention, dont la valeur morale et la portée juridique sont bien plus faibles que celles des conventions sur la biodiversité ou sur le climat (deux thèmes d'ailleurs liés à la Forêt qui héberge un grand nombre d'espèces et de gènes et qui est un puits de carbone majeur).
À l'initiative de l'ONU, 2011 a été l'année mondiale de la forêt.
L'Europe qui dispose en 2010 d'environ 176 millions d'hectares dans (42 % du territoire de l'UE, sans compter l'Outre-mer) a publié en 2010 un « livre vert sur la protection des forêts »[103], qui présente les systèmes d'information existants sur les forêts et les instruments disponibles pour leur protection des forêts (dont face au dérèglement climatique, et pose des questions pour des solutions stratégiques futures. Sur cette base, l'Union européenne, devrait revoir sa stratégie pour une gestion forestière plus intégrée, mais en laissant subsidiairement les états libres de leurs actions. Le Conseil de l'Europe a en 2010 lancé un débat et une consultation[104] sur l’impact prévisible du changement climatique sur les forêts européennes et le rôle que l’UE devrait tenir pour les protéger
En France, de nombreuses ONG s'inquiètent d'une volonté administrative et privée d’accroître la pression d'exploitation et la mécanisation des récoltes, ainsi que la fragmentation forestière par les routes et pistes.
Suivi de l'état et de la surface des forêts
Le suivi satellital et aérien des forêts tropicales montre d'importantes régressions dans de nombreux pays (surtout en Amazonie et en Indonésie). Dans les pays riches, les surfaces augmentent souvent légèrement, mais la santé des forêts s'est localement dégradée. Les forêts sont dans ces pays le plus souvent suivies par un réseau de placettes permanentes où les inventaires forestiers sont régulièrement effectués tous les dix ou vingt ans. En France, il existe une direction de la santé des forêts.
En Europe, il faut attendre 1986 pour que naisse un premier programme coopératif[105] de suivi des forêts.
Après le constat dans les années 1980 d'une tendance régulière à la dégradation de la santé des forêts en Europe (mortalité, maladies émergentes, défoliation précoce, décoloration…)[106], un projet Life + dit FutMon a été mis en place - avec 38 partenaires (dont l'IFN pour la France), dans 23 États membres, pour mettre à jour l'information sur la forêt européenne (du cercle polaire arctique en Laponie au sud de la Sicile). Le programme est coordonné par l'Institute for World Forestry de Hambourg et disposait de 16 millions d'euros de cofinancement européen. Il visait aussi à repenser et harmoniser le système de surveillance forestière en Europe[107].
Il s'est fondé sur les résultats du suivi fin de 300 placettes et de 5 500 parcelles à grande échelle. Après plus de deux ans et demi d'analyse des effets du climat, des retombées d'azote (eutrophisation), en ayant étudié le cycle du carbone, la croissance des forêts et les marchés de la bioénergie, ainsi que les opérations de conservation de la biodiversité… les chercheurs ont constaté que si les pluies acides dues aux émissions d'acide sulfurique ont diminué grâce à une convention[108] sur la pollution transfrontière qui a permis une diminution de 70 % des sulfates dans l'air et les pluies), les arbres forestiers doivent dans une partie importante des forêts d'Europe maintenant répondre à une fréquence accrue de canicules et sécheresse (observée de 2000 à 2010 en Europe centrale[107]). Les observations montrent que durant 10 ans (2000-2010), la vitalité des arbres s'est dégradée sur un tiers des parcelles, et est restée stable sur les deux autres tiers des parcelles[107]. Parmi les causes fréquentes, un approvisionnement des sols forestiers asymétrique (excès d'azote par rapport aux autres nutriments fondamentaux) est très répandu, avec des taux d'azote critiques dépassée sur environ 50 % des placettes de suivi. Le lessivage des nitrates vers l'eau du sol, ses impacts sur la flore et la diversité lichénique sont maintenant bien documentés[107].
Une tendance régulière à l'augmentation des taux d'ozone troposphérique, et au déclin de la biodiversité préoccupe les experts. Les sécheresses plus fréquentes affectent les espèces plus vulnérables et l'écosystème dans son ensemble[106]. Les canicules comme celle de 2003 peuvent entraîner des déclins de croissance, des taux élevés de mortalité avec des effets (maladies, mortalités, parasitoses) retardés de plusieurs années. Les modifications du cycle de l'eau sont donc considérés comme la plus sérieuse menace pour les forêts du monde entier[106]. « Nous pouvons déjà faire des prédictions assez précises comment le climat va développer en utilisant la modélisation du climat. Cependant, il est largement admis qu'une grande biodiversité dans les forêts sont le meilleur moyen de garantir que les forêts seront capables de s'adapter aux changements actuels et futurs »[106].
Le système de surveillance européen va intégrer dès 2011 une surveillance de l'état des houppiers sur environ 4300 parcelles en liaison avec les inventaires forestiers nationaux. Une surveillance intensive concernera 250 parcelles et d'ailleurs état de la couronne et de la croissance des forêts avec suivi couplé météorologique, de la qualité de l'air, des dépositions, de l'état des sols, de la strate herbacée, et la chimie foliaire. Des paramètres supplémentaires sont évaluées via des actions de démonstration (D1 - D3). Un projet de suivi « Les forêts dans l'Union européenne - Fourniture d'informations pertinentes pour les politiques forestières » (ForEU[109]) est prévu.
On espère que la forêt européenne, si sa santé se stabilise ou s'améliore, contribuera à atténuer le changement climatique et à l'adaptation au changement climatique. Elle absorbe en 2011 environ 10 % des émissions européennes de CO2 et l'augmentation des dépôts d'azote a dopé la croissance des arbres et le piégeage, au moins provisoire du carbone. Cette atténuation du changement climatique pourrait cependant diminuer, à un terme que les modèles de croissance forestière en Europe doivent encore préciser[107]. En 2013, l'Ademe encourage la recherche sur l'atténuation du Changement climatique par l'agriculture et la Forêt[110].
Gestion et exploitation des forêts




Selon le traitement utilisé, et selon les essences, le temps de « révolution », c'est-à-dire le délai écoulé entre le semis et la coupe, est variable mais généralement long, de 60 à 100 ans pour les résineux (le sapin grandis peut être coupé à partir de 40 ans), de 150 ans et plus pour les feuillus (80-100 ans pour le chêne rouge d'Amérique). La sylviculture est une affaire de plusieurs générations ; seule la populiculture (peupliers) avec une durée de révolution d'environ 20 ans se rapproche de l'agriculture.
Historique
L'homme n'a eu d'impact sur la forêt que depuis qu'il s'est sédentarisé, au Néolithique ; tant qu'il fut un chasseur cueilleur il en a utilisé les ressources végétales ou animales sans la modifier profondément. Il n'en fut pas de même quand il a utilisé le bois pour son habitat pour lequel les prélèvements de troncs furent abondants, sélectifs et répétés. Les connaissances forestières des dix derniers millénaires sont très rares car le végétal ne conserve pas longtemps et les fouilles n'en n'offrent pratiquement jamais : seuls les pollens permettent de tracer les grandes lignes de l'environnement. Les gisements immergés en mer, lac ou rivière les ont gardés en bon état et là encore faut-il employer des méthodes particulières pour en recueillir les restes. Ce fut le cas lors de l'exploitation du site néolithique de Charavines, Isère[111] où cet aspect du passé fut très étudié par la dendrologie, la botanique, la palynologie et la dendrochronologie des troncs et des sédiments. On a pu y suivre les conséquences significatives des coupes sur l'évolution des peuplements, indépendamment des évolutions climatiques, ainsi que la spécificité de l'utilisation des différentes essences pour les diverses parties de l'habitat, pour les ustensiles et les outils en bois. L'importance majeure de la forêt sur la vie des hommes a pu permettre de dire que le Néolithique fut l’âge du Bois .
Aux temps historiques, la forêt était exploitée pour le bois, le charbon de bois, la cueillette, le pâturage et la chasse. Le bois était généralement débardé à l'aide de chevaux, de bœufs, buffles ou d'éléphants en Asie. En Europe centrale, sur les pentes, il était parfois descendu coupé sur des traîneaux (schlitte). Le plus souvent, ce sont les torrents et cours d'eau qui transportaient les troncs jusqu'aux fleuves en radeaux ou par simple flottage. Autrefois, les troncs étaient coupés par les bûcherons, puis débités par des scieurs de long, avant d'être portés à dos d'homme ou par des chevaux jusqu'aux chemins. Aux époques récentes, ce sont des scieries actionnées par la force de l'eau qui ont permis la coupe de planches dans la forêt ou à proximité, avant que les camions ne transportent les arbres jusqu'à des scieries plus éloignées à partir de la seconde moitié du XXe siècle. De manière générale le nombre de bûcherons et de scieurs n'a cessé de se réduire en raison de la mécanisation.
La sylviculture moderne vise à maintenir ou augmenter le potentiel de production d'une forêt, tout en conservant un équilibre sylvo-cynégétique quand le gibier est une ressource économique majeure et que les animaux sont nombreux (en France, il est fréquent que 50 % au moins du revenu d'un propriétaire forestier vienne des produits de la chasse au grand gibier).
La régénération
La régénération forestière, c'est-à-dire la reproduction des arbres se fait selon deux approches :
- par rejets (ou drageons) ; cette méthode exploite la capacité de nombreuses essences de feuillus à rejeter à partir d'une souche. Elle est surtout utilisée pour les taillis.
- par semences ; cette méthode nécessite, au moins pour certaines essences un niveau d'éclairement suffisant du sol, ce qui justifie des coupes d'éclaircies pour les uns et de larges coupes pour d'autres.
On parle de régénération naturelle quand le forestier sélectionne et conserve des arbres « semenciers » lors des coupes, afin que les graines présentes dans le sol et tombées des semenciers puissent germer et régénérer la forêt. C'est une solution efficace et peu coûteuse lorsque les essences présentes sont bien adaptées au contexte biogéographique et que les herbivores ne sont pas trop nombreux. Pour certaines essences (Chêne par ex), dont les fructification ne sont pas régulières, les délais de régénération peuvent être allongés. Il y a régénération naturelle et continue avec les approches de type Prosilva, promouvant la gestion pied à pied ou en bouquets, sans coupe rase.
La régénération artificielle correspond à la situation où des plants proviennent de semis élevés en pépinière, ou de drageonnages extérieurs à la parcelle, à partir de graines ou arbres sélectionnés (provenance certifiée), au risque de perte de résilience et de biodiversité, voire d'introduction de pathogènes non présents dans la forêt. C'est un mode de régénération adapté à la mécanisation de la gestion forestière, qui a été fortement développé au XXe siècle dans les pays du nord, mais aussi en Australie et dans certaines forêts tropicales. Les bénéfices à long terme de cette méthode sont discutés, notamment pour d'éventuelles conséquences sanitaires, paysagères et environnementales sur la forêt.
Les animaux contribuent également à la régénération forestière. Les gorilles en sont un exemple. En passant la majorité de leur temps dans les trouées forestières, ils y déposent de nombreuses graines ingérées quelques heures auparavant. L'abondance de lumière dans ces trouées stimule la germination des graines et le développement de jeunes plantes[112].
L'exploitation
Les méthodes d'exploitation traditionnelles en forêts tempérées sont les suivantes :
- Taillis simple : on coupe les rejets régulièrement (l'ensemble des rejets issus d'une souche s'appelle une cépée), ce qui produit des arbres de petites dimensions, utilisable comme bois de feu (ou piquets pour le Châtaignier et le Robinier, utilisé principalement aujourd'hui pour le chauffage, mais qui alimentait autrefois des industries comme la verrerie, la porcelaine et la sidérurgie.
- Taillis sous futaie : c'est une forêt exploitée principalement en taillis, mais pour fournir aussi du bois d'œuvre, on laisse venir des arbres de franc-pied, c'est-à-dire issus de semis, d'âges divers.
- Futaie régulière : dans ce type de forêt tous les arbres sont issus de semis et ont le même âge, ce qui donne à l'âge adulte des Futaies « cathédrales ». Ce type de traitement est relativement moderne, et date en France de l'époque de Colbert qui voulut développer la production de bois pour la charpente de marine et notamment les mâts. Un exemple célèbre est la futaie de chênes de Tronçais dans l'Allier.
- Futaie jardinée : c'est une futaie dans laquelle on trouve des arbres à tous les stades de développement. On l'exploite en prélevant régulièrement une partie des arbres considérés comme mûrs, mais en conservant en permanence la protection du couvert forestier. C'est la méthode traditionnelle, qui a été le mieux conservée en montagne parce qu'elle protège les sols, le micro-climat forestier et limite au mieux l'érosion et les glissements de terrain. C'est aussi le principe sylvicole de Prosilva qui lui adjoint une dimension biodiversité (la futaie est hétérogène et mélangée, en essences et en classes d'âge, en conservant des arbres morts et sénescents, considérés nécessaires à l'équilibre écologique forestier).
Galerie

 Forêt à Fontainebleu en automne
Forêt à Fontainebleu en automne Forêt à Langaa
Forêt à Langaa Dollerbaechlein dans le Nonnenbruch
Dollerbaechlein dans le Nonnenbruch
Voir aussi
Généralités
- Arnould P., Corvol A., Hotyat M., La Forêt. Perception et représentation, Paris, l’Harmattan, 1997, 401 p.
- Defontaines P., L’Homme et la forêt, Paris, Gallimard, 1969, 186 p.
- Plaisance G., Dictionnaire des forêts, Paris, La Maison rustique, 1968, 314 p.
- Giry P., Paysages lointains, Paris, Lulu, 2010, 110 p.
- M. Cabarrus[113] Animaux des forêts, Ed Rothschild (manuel de zootechnie forestière élémentaire, principalement à l'intention des gardes forestiers, avec des notions de la chasse conservatrice et prévoyante).
- M. Cabarrus[113] Les animaux des forêts, mammifères - oiseaux, zoologie pratique au point du vue de la chasse et de la silviculture ; 1872 - 280 pages
- Office fédéral de l'environnement des forêts et du paysage (OFEFP) La forêt suisse en équilibre; Direction fédérale des forêts; Berne; 1995; 33 p.
- Agence européenne de l'environnement European forests — ecosystem conditions and sustainable use ; EEA Report No 3/2008 ; Luxembourg: Office for Official Publications of the European Communities, 2008 ; (ISBN 978-92-9167-354-4) ; ISS: 1725-9177 ; DOI:10.2800/3601, PDF, 110 pages,
- Raphaël Larrère, article « Forêt » in Dominique Bourg et Alain Papaux, Dictionnaire de la pensée écologique, Presses universitaires de France, 2015 (ISBN 978-2-13-058696-8).
Histoire
- Arnould P., Forêts, nouvelles forêts et vieilles forêts, Actes du 113e Congrès des Sociétés savantes, Strasbourg, 5-9 avril 1988, textes réunis et présentés par Andrée Corvol, publiés dans La Forêt, Comité des travaux historiques et scientifiques, 1991, p. 13-30.
- Arnould P., La forêt qui cache la forêt, Historiens & géographes no 370, 2000, p. 263-273.
- Badre L., Histoire de la forêt française, Paris, Arthaud, 1983, 312 p.
- Bechmann R., Des arbres et des hommes, la forêt au Moyen Âge, Paris, Flammarion, 1984, 384 p.
- Clement V., De la marche frontière aux pays de bois, forêts, sociétés paysannes et territoires en Vieille-Castille, Madrid, Casa de Velázquez, 2002, 374p.
- Martine Chalvet, Une Histoire de la forêt, Paris, Seuil, coll. « L'Univers historique », , 351 p. (ISBN 9782021042184, écouter en ligne)
- Cheddadi R., Philipon P., Des forêts venues du froid, La Recherche, no 385 – avril 2005, Paris, Société d’éditions scientifiques, 2005.
- Andrée Corvol, L'Homme au bois, Histoire des relations de l'homme et de la forêt, XVIIe – XXe siècle, Paris, Fayard, coll. « Nouvelles Etudes Historiques », (1re éd. 1987), 588 p. (ISBN 9782213649818, présentation en ligne)
- Corvol A., Enseigner et apprendre la forêt XIXe – XXe siècles, Paris, L’Hamattan, 1992, 240 p.
- Corvol A., Amat J.-P. (dir.), Forêt et guerre, Paris, L’Harmattan, 1994, 326 p.
- Degron R., Husson J.-P., Les forêts d’Alsace-Lorraine (1871-1918) : les contrastes de l’héritage allemand, reflets de l’annexion, revue Histoire, économie et société, no 3, 1999, p. 593-611.
- Deveze M., La Vie de la forêt française au XVIe siècle, thèse, Paris, Imprimerie nationale, 1961, 2 volumes, 325 et 473 p.
- Deveze M., Histoire des forêts, Que sais-je ? Paris, PUF, 1973, 125 p.
- Galochet M., (dir), La Forêt, ressource et patrimoine, Paris, Ellipses, Coll. Carrefour, 2006, 272 p
- Groupe d'Histoire des Forêts Françaises, La Forêt, perceptions et représentations, Paris, l’Harmattan, 1997, 401 p.
- Noël M. et Bocquet A. Les hommes et le bois. Histoire et technologie du bois de la préhistoire à nos jours. Hachette, la mémoire du temps. 1987, 347 p.
- Reitel F., Le rôle de l’Armée dans la conservation des forêts de France, Bulletin de l’Association des géographes français, no 502, Paris, Armand Colin, 1984, p. 153-154.
- Van Der Linden H., La forêt charbonnière, Revue belge de philologie et d’histoire no 2 avril 1923, Bruxelles, Éditions de l’Université, 1923, p. 203-204.
- Protoindustries et histoire des forêts, Actes du Colloque international tenu à la Maison de la Forêt (Loubières, Ariège), 10-13 octobre 1990 (= Les Cahiers de l'Isard, 3), Toulouse, GDR-Isard 8881-CNRS, 1992, 343 p. ill.
- Sylvie Bépoix et Hervé Richard,(dir); La forêt au Moyen Âge, éditions Les Belles Lettres, 424 p., 2019, [(en) présentation par l'éditeur (dont sommaire)], (ISBN 9782251449883)
Géographie
- Arnould P., Hotyat M., Simon L., Les Forêts d’Europe, Paris, Nathan, 1997, 413 p.
- Arnould P., Les nouvelles forêts françaises, L’Information géographique, 1996, vol. 60-4, Paris, Armand Colin, 1996, p. 141-156.
- Arnould P., Le recherche française en biogéographie, Bulletin de l’Association des Géographes français no 4, 1994, p. 404-413.
- Bomer B., Progrès dans la connaissance géographique de la forêt française, Annales de géographie, Paris, Armand Colin, 1984, no 516 (93e année), p. 260-263.
- Dubois J.-J. (coord.), Les Milieux forestiers, aspects géographiques, Paris, Sedes, 1999, 336 p.
- Gadant Jean, L’Atlas des forêts de France, Paris, Éditions de Monza, 1998, 240 p.
- Husson J.-P., Les Forêts françaises, Nancy, Presses universitaires de Nancy, 1995, 258 p.
- Verdeaux F., La Forêt-monde en question, Paris, Institut de recherche pour le développement (IRD), coll. « Autrepart », 1999, 182 – [16] p.
- Viers G., Géographie des forêts, Paris, PUF, 1970, 222 p.
Monographies locales
- Defontaines P., « Le "Pays-des-Bois" de Belvès, étude de géographie humaine », Annales de géographie, Paris, Armand Colin, 1930.
- Defontaines P., La vie forestière en Slovaquie, Paris, Travaux publiés par l’institut d’études slaves, Librairie ancienne Honoré Champion, 1932, 94 p.
- Département de l'Intérieur et de l'Agriculture, Genève, Inventaire des forêts genevoises, observations sur leur état sanitaire, 1987
- Dubois K.-J., La forêt de Bialowieza (Pologne), Hommes et Terres du Nord, Lille, Institut de géographie, Faculté des lettres de Lille, 1987-2, p. 125-128.
- Dubois J.-J., Espaces et milieux forestiers dans le Nord de la France – Étude de biogéographie historique, thèse d’État, Paris, Université de Paris I, 1989, 2 volumes, 1024 p
- George P. La Forêt de Bercé, étude de géographie physique, thèse complémentaire, Paris, JB Baillière et fils, 1936, XVIII – 113 p.
- Houzard G., Les Massifs forestiers de Basse-Normandie, Brix, Andaines, Écouves, thèse de doctorat d’État, Caen, université de Caen, 1980.
- Jahan Sébastien (avec Emmanuel Dion), Le peuple de la forêt. Nomadisme ouvrier et identités dans la France du Centre-Ouest (XVIIe – XVIIIe siècles), Rennes, Presses Universitaires de Rennes, 2003, 240 p. (ISBN 9782868477286)
- Noirfalize A., Forêts et stations forestières de Belgique, Gembloux, Presses universitaires de Gembloux, 1984, 234 p.
- Plaisance G., Les Forêts de Bourgogne, leur histoire, leur utilité, leur place dans la vie de tous les jours. Roanne, Ed. Horvath, 1988, 233 p.
- Somme M. La forêt de Nieppe et son exploitation au XVe siècle, Hommes et terres du Nord no 2-3, Lille, Institut de géographie, Faculté des lettres de Lille, 1986, p. 177-181.
Science
- Galochet M., Hotyat M., 2001 - L’Homme, facteur de diversité en milieu forestier. Bulletin de l’Association des Géographes français 2, 151-163.
- Otto H.-J., Écologie forestière, Paris, IDF, 1998, 397 p.
- Simon L., Les Paysages végétaux, Paris, Armand Colin, 1998, 95 p.
- Tome I, Habitats forestiers ; Connaissance et gestion des habitats et des espèces d’intérêt communautaire ; Cahiers d’habitats Natura 2000 (Synthèse des connaissances scientifique et concernant la gestion des habitats naturels et de chaque espèce figurant aux annexes I et II de la directive « Habitats » pour lesquels la France est concernée); La documentation française, 761 pages]
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressource relative à la santé :
- Les forêts tropicales, site du Centre de coopération internationale en recherche agronomique pour le développement (Cirad) à l'occasion de l'Année internationale des forêts 2011
- Des Forêts et des Hommes Site de la fondation GoodPlanet pour l'année internationale des forêts. Actualités, affiches pédagogiques, photos. (fr)
- Article / Indicateurs de la biodiversité dans les inventaires forestiers (Unasylva, FAO) (fr)
- « septième édition de la Situation des forêts du monde », FAO
- FAO Forêts (fr)
- Revue Unasylva (portail FAO de téléchargement) (fr)
- Rapport sur la forêt européenne (ONU/UNEP World Conservation Monitoring Centre Cambridge, Royaume-Uni, 2000, en collaboration avec WWF)(en)
- Inforets, Information et actualités sur la forêt(fr)
- Types de forêts et de gestions en Europe (Rapport European forest types 2006, avec cartes, 8826 KB). (en)
- [PDF] « Cahiers d’habitats, Tome 1 », sur l’INPN
- CNBD - Comité national pour le développement du bois - La Forêt française
- [vidéo] Un monde de forêts - Le Dessous des cartes / ARTE sur YouTube, chaine Le Dessous des cartes.
Notes et références
- « L’évaluation de la dégradation des forêts reste difficile en raison de la grande variabilité des formes, des facteurs et des degrés d’anthropisation ».
- Potapov P., Yaroshenko A., Turubanova S., Dubinin M., Laestadius L., Thies C., Aksenov D., Egorov A., Yesipova Y., Glushkov I., Karpachevskiy M., Kostikova A., Manisha A., Tsybikova E., Zhuravleva I. (2008) [Mapping the World’s Intact Forest Landscapes by Remote Sensing]. Ecology and Society 13 (2):51
- (en) Khan Towhid Osman, Forest Soils, Springer Science & Business Media, , p. 133
- FAO, Evaluation des ressources forestières mondiales 2010. Rapport Principal, FAO Éditions, , p. 13
- (en) Carreiro Margaret M. et Tripler Christopher E., « Forest remnants along urban-rural gradients: Examining their potential for global change research » [« Les restes forestiers le long des gradients urbains-ruraux : examen de leur potentiel pour la recherche sur le changement global »], Ecosystems, vol. 8, no 5, , p. 568–582 (résumé)
- OPECST, « La biodiversité : l'autre choc ? l'autre chance ? », sur senat.fr, (consulté le )
- « L'arbre, allié de taille » ((au sujet des enquêtes de l'ONU et du REDD)), Le Monde, (lire en ligne, consulté le )
- Site du cnrtl : origine du mot forêt.
- T.F. Hoad, English Etymology, Oxford University Press 1993. p. 179a.
- Harper, Douglas. "etymology". Online Etymology Dictionary.
- Origine du mot Forst (allemand).
- Baudrillart Jacques-Joseph, Dictionnaire général des Eaux et Forêt, Paris, 1825.
- Site du cnrtl : origine du mot forêt.
- Alain Rey, Dictionnaire historique de la langue française, Le Robert, 2011.
- Félix Gaffiot, Dictionnaire latin français, Hachette, 1934.
- « Remarque linguistique relative au mot « forêt » », (in « Unité du monde vivant et développement durable : Glossaire » de Pierre Dutuit et Robert Gorenflot, éditions Educagri, 2016), sur /books.google.fr (consulté le )
- Bart Buyck, Guide des champignons de la montagne, Belin, , p. 15
- Chalvet 2011
- Termes et Définitions : ’Évaluation des ressources forestières mondiales, Rome, FAO, , 33 p. (lire en ligne), p. 4
- « L'Europe et la forêt - L'enjeu statistique (suite) », sur europarl.europa.eu, (consulté le )
- Arnould P., 1991 - Forêts, nouvelles forêts et vieilles forêts. A. Corvol (dir.), La Forêt, actes du 113e Congrès des Sociétés savantes, Strasbourg (5-9 avril 1988), Paris, CTHS, 13-30
- Marc Galochet, « Le massif forestier du dehors et du dedans : limites, marges et discontinuités de l’espace forestier », Revue Géographique de l'Est, vol. 49, nos 2-3, (2 juin 2012, consulté le )
- Données du TREES
- Le seuil de largeur de 20 m permet de distinguer les haies arborées et les ripisylves.
- La forêt pour métier, Educagri Éditions, (lire en ligne), p. 13.
- (en) C. Jill Harrison,, « Development and genetics in the evolution of land plant body plans », Philos Trans R Soc Lond B Biol Sci., vol. 372, no 1713, (DOI 10.1098/rstb.2015.0490).
- Le milieu terrestre étant beaucoup moins tamponné thermiquement que la mer (écarts de température rapides et de grande amplitude), il impose des contraintes hydriques et thermiques supplémentaires.
- Les Trachéophytes sont des plantes homéohydres grâce à la présence de racines et de vaisseaux conducteurs. Les Bryophytes ne possèdent pas ces caractères et adoptent une autre stratégie de résistance au stress hydrique, la poïkilohydrie : comme les lichens, leur teneur en eau varie suivant les variations d'hygrométrie de l'environnement extérieur, de 10 à 90 % de leur poids frais, car ces végétaux sont incapables de contrôler la perte en eau de leurs cellules et se déshydratent facilement par toute leur surface. Elles restent pour beaucoup inféodées aux milieux humides, mais de nombreuses espèces sont aussi pionnières des milieux secs grâce à une stratégie d'évitement, l'anhydrobiose. Robert Gorenflot, Biologie végétale, Masson, , p. 213
- (en) Zoe Popper et al., « Evolution and diversity of plant cell walls: from algae to flowering plants », Annual Review of Plant Biology, vol. 62, no 1, , p. 567-590 (DOI 10.1146/annurev-arplant-042110-103809)
- Les recherches actuelles suggèrent la possibilité d'une voie de pré-lignine apparaissant dans les plantes non vasculaires de type mousses pendant les premiers stades de la transition de l'eau vers la terre.
- (en) Weng JK, Chapple C., « The origin and evolution of lignin biosynthesis », New Phytol., vol. 187, no 2, , p. 273-285 (DOI 10.1111/j.1469-8137.2010.03327.x)
- (en) W. Goldring, « The oldest known petrified forest », Sci. Mthly, no 24, , p. 514–529.
- (en) W. E.Stein & F.M Hueber, « The anatomy of Pseudosporochnus: P.hueberi from the Devonian of New York », Rev Palaeobot Palynol, vol. 60, nos 3-4, , p. 311–359.
- Jean-Claude Roland, Hayat El Maarouf Bouteau, François Bouteau, Atlas de biologie végétale, Dunod, , p. 68-85
- Sans cette lignine, la croissance des plantes ne dépasserait pas quelques centimètres en hauteur. Cf (en) Peter Scott, Physiology and Behaviour of Plants, John Wiley & Sons, (lire en ligne), p. 27
- Selon le principe de l'allocation des ressources, l'arbre investit une grande partie de son énergie au développement en hauteur. Il réduit celle allouée à la reproduction, ce qui a la conséquence suivante : alors qu'un seul chêne pourrait potentiellement produire en moyenne 100 millions de glands par an, il n'en produit que de 5 à 10 000 /an, qu'à partir de 30 et que les bonnes années. Cf (en) Ethelyn Gay Orso, Louisiana Live Oak Lore, Center for Louisiana Studies, University of Southwestern Louisiana, , p. 8
- Annette Millet, « L'invention des arbres », La Recherche, no 296, , p. 57
- (en) Rémy J. Petit, Itziar Aguinagalde, Jacques-Louis de Beaulieu, Christiane Bittkau, Simon Brewer, Rachid Cheddadi, « Glacial refugia: hotspots but not melting pots of genetic diversity », Science, vol. 300, no 5625, , p. 1563-1565 (DOI 10.1126/science.1083264).
- Martine Chalvet, Une histoire de la forêt, Le Seuil (lire en ligne), n. p..
- Simon Pomel, Jean-Noël Salomon, La déforestation dans le monde tropical, Presses Universitaires de Bordeaux, (lire en ligne), p. 62.
- Paul Arnould, Micheline Hotyat, Laurent Simon, Les forêts européennes, Nathan Université, , p. 40
- « Ainsi en va-t-il de la Grèce où, par la force des choses, la pierre se substitue au bois dans l'architecture ». Cf « Europe. La forêt, conquête des hommes », sur herodote.net,
- Éléments d'histoire forestière, École nationale du génie rural, des eaux et des forêts, , p. 36
- « Europe. La forêt, conquête des hommes », sur herodote.net,
- (Communiqué intitulé « La déforestation se poursuit à un rythme alarmant - Nouveaux chiffres de la FAO sur les forêts mondiales » Rome, 14 novembre 2005 ; basé sur les conclusions de l’Évaluation des ressources forestières mondiales 2005, étude la plus complète à cette date, portant sur l'usage et la valeur des forêts dans 229 pays et territoires, de 1990 à 2005)
- Francis Hallé, « Il y a urgence à reconstruire de grandes forêts primaires », Le Monde, (ISSN 1950-6244, lire en ligne)
- (en) Donald W. Floyd, Forest Sustainability. The History, the Challenge, the Promise, Forest History Society, , p. 66.
- Microreserves for protected forest habitats - experience in Latvia. Par Sandra Ikauniece, du State Forest Service (Lettonie). Document établi en 2011.
- MCPFE Ministerial Conference on the Protection of Forests in Europe ou Conférence ministérielle sur la Protection des Forêts en Europe, parfois dite « Forest Eutope »
- Gilbert, J.M., & Franc, A. 1997. Typologie et cartographie du climat dans la moitié nord de la France. Perspectives d’utilisation en relations milieu-production forestière. Ingénieries, 12, 35–47.
- MACIEJEWSKI L. (2010), Méthodologie d'élaboration des listes d' "espèces typiques" pour des habitats forestiers d'intérêt communautaire en vue de l'évaluation de leur état de conservation. Méthodologie d'élaboration des listes d'"espèces typiques" pour des habitats forestiers d'intérêt communautaire en vue de l'évaluation de leur état de conservation ; Service du patrimoine naturel, Muséum national d'histoire naturelle, Paris, 48 p. consulté le 2013-01-12
- Christine Estreguil & Coralie Mouton, Measuring and reporting on forest landscape pattern, fragmentation and connectivity in Europe: methods and indicators ; European Commission Joint Research Centre Institute for Environment and Sustainability
- J. Römbke, S. Jänsch, W. DiddenThe use of earthworms in ecological soil classification and assessment concepts ; Ecotoxicology and Environmental Safety, Volume 62, Issue 2, octobre 2005, Pages 249-265
- Juliet C. Frankland, J. Dighton, Lynne Boddy, 11 Methods for Studying Fungi in Soil and Forest Litter ; Methods in Microbiology, volume 22, 1990, pages 343-404 (Résumé)
- [PDF] UICN (2014), Panorama des services écologiques fournis par les milieux naturels en France - volume 2.1 : Écosystèmes forestiers
- Source FAO (Extrait du résumé des conclusions de l’Évaluation des ressources forestières mondiales 2005, étude la plus complète à cette date, portant sur l'usage et la valeur des forêts dans 229 pays et territoires, de 1990 à 2005)
- Rautiainen A, Wernick I, Waggoner PE, Ausubel JH, Kauppi PE (2011); A National and International Analysis of Changing Forest Density. PLoS ONE 6(5): e19577. doi:10.1371/journal.pone.0019577
- Écosystème forestier exceptionnel, ministère des Ressources naturelles et de la Faune, consulté le
- Registre des aires protégées du Québec, Ministère du Développement durable, de l'Environnement et des Parcs, consulté le
- Registre des aires protégées du Québec, ministère du Développement durable, de l'Environnement et des Parcs, consulté le
- Registre des aires protégées du Québec, ministère du Développement durable, de l'Environnement et des Parcs, consulté le
- « Dernier alinéa de l'article L. 121-1 du code forestier », sur legifrance.gouv.fr, (consulté le )
- Christian Barthod, « La multifonctionnalité des forêts entre discours et pratiques : illusion ou réalité à assumer ? », Revue forestière française, , p. 293-319 (lire en ligne)
- Jean-Michel Le Bot, « Contribution à l’histoire d’un lieu commun : l’attribution à Chateaubriand de la phrase "les forêts précèdent les peuples, les déserts les suivent" : Un exemple d’utilisation du logiciel Google Books Ngram Viewer », 2011, p. 9
- « IFN - Dictionnaire/glossaire », sur lfi.ch (consulté le )
- « Le Barrage vert, un rempart unique contre la désertification », sur elwatan.com (consulté le )
- Eidgenössisches Departement für Umwelt, Verkehr, Energie und Kommunikation UVEK, « Puits de carbone : Rapport à l’intention de la CEATE-N 17.071 n Révision totale de la loi sur le CO 2 pour la période postérieure à 2020 », sur bafu.admin.ch, (consulté le )
- « Le poumon vert de la planète, c'est quoi ? », sur futura-sciences.com (consulté le ).
- François Ramade, Éléments d'écologie, Dunod, , p. 415.
- (en) Tropical forests losing their ability to absorb carbon, study finds sur theguardian.com
- (en) Deborah Lawrence et al, The Unseen Effects of Deforestation: Biophysical Effects on Climate, Frontiers in Forests and Global Change, 24 mars 2022.
- Isabelle Bellin, Les forêts sont bien plus que des puits de carbone, Pour la science, 17 mai 2022.
- Dominique Louppe, Gilles Mille, Mémento du forestier tropical, Quae, , p. 359
- C'est le cas par exemple en France pour le Nord-Pas-de-Calais (entre 7,5 % et 9 % de forêts) et Île-de-France (où hors forêts, il ne reste qu'environ 4 % du territoire régional classé en milieux naturels. Cf NatureParif, "Fragmentation forestière par les infrastructures de transport", Colloque 2011
- L’environnement en France - Édition 2010 - COll. Références Commissariat général au développement durable, juin 2010 par le service de l'observation et des statistiques
- Jérôme Duval, « Alerte sur le climat », sur Politis.fr,
- Source : Rapport ONU/FAO FRA 2005
- Eric de La chesnais, « La forêt française largement sous-exploitée » (consulté le ) : « Le potentiel de la filière bois est d'autant plus important qu'il s'agit d'un secteur économique de poids. La forêt emploie 400.000 personnes en France et génère toutes activités confondues un chiffre d'affaires de 60 milliards d'euros, dont un tiers (19 milliards d'euros) pour le seul «papier-carton». »
- Source : FAO, Rapport FRA 2005 (
- « L'industrie des produits forestiers au Québec », sur mffp.gouv.qc.ca, (consulté le )
- Source : Rapport WWF (J. Hewitt) Failing the forests – Europe’s illegal timber trade (en)
- page d'accueil francophone du réseau TRAFFIC
- Étude de Chatham House (ex-Royal Institute for International Affairs/Institut royal des affaires internationales) montrait fin janvier 2006 que les lois de quatre pays de l’UE suffiraient - si elles étaient appliquées - à maîtriser l'importation de bois illégaux. Une législation européenne contre le blanchiment d’argent et la vente de bois sans licence est aussi proposée.
- Synthèse du travail collectif intitulé Derrière le label (FERN, 2001)
- Voir graphique FAO sur la part des forêts dites affectées à la conservation de la biodiversité
- Site de la FAO
- Bernard Kalaora, Le musée vert Radiographie du loisir en forêt, (ISBN 2-7384-1987-9) ; 304 p.
- Robert Harrison (trad. de l'anglais par Florence Naugrette), Forêts, essai sur l'imaginaire occidental, France, Flammarion, , 398 p. (ISBN 2-08-035201-6)
- Jean-Baptiste Vidalou, « Dossier d'accompagnement du documentaire Le Temps des forêts », (30 p.), (consulté le )
- Rapport ONF Développement durable / Gestion 2006
- Baumgartner, 1969
- Forêt et santé, Guide pratique de sylvothérapie, éditions Dangles, 506p, 1985
- Par exemple (de) Inhumation en forêt à Rheinau au Bade-Wurtemberg à Rheinau (quartier de Memprechtshofen).
- La première forêt cinéraire de France se trouve en Occitanie
- Une sécheresse sévère, associée à la chaleur, comme celle de l'été 2003, ne provoque pas seulement la perte précoce des feuilles des arbres. Elle a des conséquences sur la capacité de l'arbre à résister au froid pendant l'hiver suivant. C'est ce qu'étudient les chercheurs de l'INRA de Clermont-Ferrand, article de Futura Science, consulté le 17 octobre 2017
- Antoine Kremer, Rémy-J. Petit et Alexis Ducousso, « Biologie évolutive et diversité génétique des chênes sessile et pédonculé », Revue forestière française, vol. 54, no 2, , p. 111.
- Rapport 2010, Vulnerability of Tasmania’s Natural Environment to Climate Change: An Overview ; Resource Management and Conservation ; Department of Primary Industries, Parks, Water and Environment, 2010 ; Hobart, Tasmanie ; ISBN (Book):978-0-7246-6532-7 ; ISBN (Web):978-0-7246-6533-4
- ONU (1992) «Déclaration de principes, non juridiquement contraignante mais faisant autorité, pour un consensus mondial sur la gestion, la conservation et l'exploitation écologiquement viable de tous les types de forêts» (Principes forestiers) ; ref : A/CONF.151/26 (Vol. III), Rio, le 14 août 1992
- Carnino (2009), État de conservation des habitats forestiers d'intérêt communautaire à l'échelle du site - Méthode d'évaluation et Guide d'application; État de conservation des habitats forestiers d'intérêt communautaire à l'échelle du site - Méthode d'évaluation et Guide d'application. Service du patrimoine naturel, Muséum national d'histoire naturelle, Paris, 113 p. ; consulté le 2013-01-12
- Prideaux, G.J. et al. 2007. An arid-adapted middle Pleistocene vertebrate fauna from south-central Australia. Nature 445:422-425
- Stavros Dimas, commissaire européen à l'environnement, Conférence d'Athènes, les 27 et 28 avril 2009
- « livre vert sur la protection des forêts » (25 pages, publié 1er mars 2010, avec un Document de travail, en anglais uniquement), avant une consultation publique (faite du 1er mars au 31 juillet 2010, sur le site web Your Voice in Europe), avant un atelier (2010/06/03, Bruxelles, lors de la Green Week) et une discussion lors d'une conférence sur la protection des forêts (sous présidence espagnole, à Valsain, Espagne, les 6 et 7 avril 2010).
- Consultation en ligne jusqu'au 31 juillet 2010
- Co-operative Programme on Assessment and Monitoring of Air Pollution Effects on Forests (Portail de l'ICP Forest)
- FutMon, Présentation du cadre du projet Life + FutMon (2011) ; FutMon associe 38 bénéficiaires de presque tous les États membres de l'UE. Son budget total est de 34,44 millions d'€ (Au titre du financement de LIFE +, avec 16,14 millions d'€ supplémentaires, le reste du budget provenant des autorités nationales. (Publications scientifiques de FutMon et l'ICP Forest)
- Projet FutMon Communiqué On June 21st, in the International Auditorium in Brussels, FutMon, the EU’s largest LIFE+ project, presented a comprehensive update on forest information in Europe today, consulté 2011-06-26
- Convention on Long-range Transboundary Air Pollution (CLRTAP)
- "Forests in the European Union - Provision of Policy relevant information" (ForEU).
- Ademe présentation de l'Appel à projets R&D REACCTIF - REcherche sur l'Atténuation du Changement ClimaTique par l'agrIculture et la Forêt 2013, et Appel à projet téléchargeable, ouvert jusqu'au 26/06/2013
- Aimé Bocquet (préf. par Yves Coppens, professeur au Collège de France), Les oubliés du lac de Paladru. Ils vivaient il y a 5000 ans à Charavines en Dauphiné, Montmélian, Fontaine de Siloé Montmélian, , 200 p. (ISBN 978-2-84206-550-8)Avec un DVD contenant les résultats archéologiques et scientifiques par 60 spécialistes
- « Régénérer les forêts africaines grâce aux gorilles », sur Université de Liège
- Sous-inspecteur des forêts de la Couronne, attaché à la vénerie de l'Empereur.