Mycorhize
Une mycorhize (du grec ancien : μύκης / múkēs, « champignon » et rhiza, « racine », terme introduit en 1885 par le botaniste Albert Bernhard Frank) est le résultat de l'association symbiotique, appelée mycorhization, entre des champignons et les racines des plantes. La mycorhize est une composante majeure de l'édaphon et de la rhizosphère.
.jpg.webp)

Dans cette association généralement non spécifique, les spores d'un champignon mycorhizien ou mycorhizogène (du grec myco, rhiza et génos, « engendrer », littéralement qui donne naissance à une mycorhize) sont disséminées par le vent (anémochorie), par la pluie (hydrochorie), ou par les déjections d'animaux (endozoochorie), germent, et donnent les hyphes du mycélium qui colonisent les racines d’une plante. Ces hyphes radiculaires se distinguent des hyphes extraradiculaires[2] qui se développent également à l'extérieur de la racine sur plusieurs centimètres, explorant le sol alentour du système racinaire de la plante hôte. Ce que l'on appelle couramment champignon, que l'on cueille avec son pied et chapeau, n'est que la « fructification » du mycélium, le sporophore, où se déroule la reproduction sexuée. Les hyphes se présentent comme de fins filaments, capables d'explorer un très grand volume de sol (mille mètres de filaments mycéliens pour un mètre de racine).
La relation mycorhizienne est de type symbiotique, mais un déséquilibre dans la relation peut être induit par une faiblesse de l'un des deux partenaires, l'association pouvant alors glisser le long du continuum mutualisme-parasitisme[3] - [4]. Le champignon peut alors aussi contribuer à recycler la nécromasse de son hôte, au profit de leurs deux descendances.
Alors que la surface d'exploration exploitée par la plante n'est multipliée que par 10 par les poils absorbants, actifs seulement en période de germination[5], elle est multipliée par 10 000 grâce aux mycorhizes (filaments d'un diamètre d'un centième de millimètre) qui ont un coût énergétique de mise en place cent fois moindre que les racines[6]. Les poils absorbants restent fonctionnels dans quelques groupes de plantes adultes (moins de 10 %) non mycorhizées qui ont perdu secondairement l'association fongique, plus de 90 % étant colonisées par ces hyphes du champignon symbiote qui assurent l'essentiel de l'absorption d'eau et des nutriments, et multiplient par dix la croissance de la plante[7]. Les estimations suggèrent qu'il y a près de 50 000 espèces fongiques qui forment des associations mycorhiziennes avec 250 000 espèces végétales, 80 % de ces associations correspondant à des endomycorhizes arbusculaires[8]. Il semble que les plantes non mycorhizées de milieux pionniers (absence de champignons), humides et/ou riches, dans lesquels l'approvisionnement hydrominéral ne nécessite pas de mycorhize, « aient eu besoin de compenser l'absence de l'auxiliaire fongique en développant des structures racinaires qui imitent les filaments mycéliens et leur grande efficacité pour coloniser un grand volume de sol[9] ».
Les recherches actuelles montrent une association plus large au niveau des mycorhizes, avec le concept de microbiome mycorhizien, appelé rhizomicrobiome, qui fait également intervenir des bactéries[10] - [11].
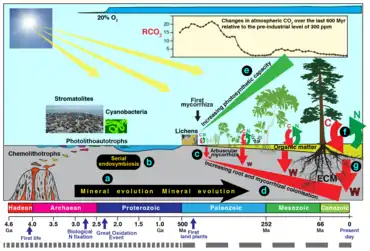
Histoire évolutive des mycorhizes


Le symbiote originel (un gloméromycète semble-t-il), serait apparu il y a environ 500 millions d'années[13] au Paléozoïque, probablement au même moment que les premières plantes terrestres. Des fossiles de la flore de Rhynie (e.g. Aglaophyton (en), Rhynia (en)), âgés d'environ 400 millions d'années, comportent des mycorhizes morphologiquement identiques aux Glomales, associées aux rhizomes[14]. Ceci laisse penser que les mycorhizes ont été l’instrument d'une colonisation accélérée des terres émergées, par leur capacité à extraire l’eau et les minéraux du sol, assurant aux premières plantes leur nutrition minérale quand elles n'avaient pas encore de racines (lichens, bryophytes[15] dans les estuaires de cours d'eau, fougères terrestres à proximité de la limite eau/terre ferme, comme les bords des eaux douces ou saumâtres)[16].


Ces premières associations ont aussi pu permettre la constitution d'un sol résistant mieux aux intempéries, stockant mieux l'eau, tout en améliorant la résistance des plantes au stress hydrique et au froid[18] - [19] ou au manque d'azote (chez l'épinette par exemple[20]), leur tenue au vent et au ruissellement, ainsi peut-être que leur résistance aux trop fortes intensités lumineuses, comme c'est le cas des mycophycobiontes de certaines algues de l'estran (ces symbioses, avec des ascomycètes principalement, semblent être apparues secondairement).
Les associations mycorhiziennes (arbusculaires et ectomycorhiziennes) existent aussi dans les écosystèmes froids (température moyenne inférieure à 15 °C), où elles sont actives tout ou partie de l'année (selon la température du sol), impliquées dans certaines adaptations de résistance au gel et favorisent l'acquisition des nutriments à basse température chez les champignons mycorhiziens[21]. Elles contribuent sans doute à une meilleure survie du champignon dans les sols gelés en hiver[22] où les microchampignons subissent ce facteur de sélection supplémentaire[23]. Ces symbioses froides profitent aussi à des graminées telles que l'orge (Hordeum) qui améliore ainsi son accès au phosphore du sol[24]
Ces symbioses correspondent à un « saut macroévolutif » (bond de l'évolution) puisque les fonctions d’un des partenaires s’associent aux fonctions de l’autre, avec des effets fonctionnels multipliés[25]. En effet on passe de l’état algue et champignon à celui de plante mycorhizée terrestre (ce qui va à l'encontre du gradualisme darwinien).
À l’heure actuelle, 85 % des Archégoniates, ainsi que des Hépatiques, sont endomycorhizés par des Glomales. Cela suppose que la symbiose avec les Glomales est la plus ancienne chez les Archégoniates et qu’elle aurait permis l’impressionnante radiation de ces derniers (diversité, lignification…). 80 % des plantes vasculaires sont colonisées par des champignons endomycorhiziens alors que les ectomycorhizes sont souvent associés aux ligneux forestiers[26].
Les autres familles de Gloméromycètes (Acaulosporaceae et Gigaspora) sont apparues plus tard vers -250/-230 millions d’années. Elles possèdent des capacités supérieures pour l’exploitation des ressources minérales des sols.
Les ectomycorhizes, quant à elles, seraient peut-être apparues au Crétacé mais les plus vieux fossiles connus ne datent que de l’Éocène. Elles ont permis la colonisation de sols antérieurement défavorables. C’est également à cette époque que des symbioses fixatrices d’azote sont apparues[27]. La symbiose ectomycorhiziennes est apparue de nombreuses fois indépendamment dans différents clades des champignons (80 fois chez les Gloméromycètes, Ascomycètes et Basidiomycètes) et de Spermaphytes (12 fois chez les Gymnospermes et les Angiospermes)[28]. Cette fréquence montre le succès évolutif de ces associations à partir des ancêtres des champignons ectomycorhiziens qui vivaient à partir de matière organique morte du sol en un mode de vie saprophyte[29]. L'étude comparative des génomes des champignons ectomycorhiziens et saprophytes actuels montre que les mycorhiziens ont perdu de nombreuses exoenzymes qui assurent la nutrition carbonée autonome des saprophytes, car ils sont nourris en sucres par la plante hôte, mais ont gardé les enzymes (peroxydases, laccases, phénol-oxydases fongiques telles les tyrosinases) exploitant les ressources azotées et phosphatées des résidus organiques (lignine, composés phénoliques, cellulose) nécessaires au bon fonctionnement de la plante[30].
Certaines plantes à symbioses mycorhiziennes plus récentes (d'un point de vue évolutif), peuvent aussi contracter une association à mycorhizes à arbuscules. Il semble donc qu’il y ait eu des innovations évolutives dans ce type de symbiose. Ces innovations expliquent sans doute le nombre limité de plantes capables de les contracter.
L'apparition d'ectomycorhizes a été corrélée deux fois à des radiations évolutives des plantes :
- au Crétacé (apparition des pinacées et des rosidées) ;
- lors de la transition Éocène-Oligocène (apparition des forêts « actuelles » de l'hémisphère Nord). Cette apparition serait une adaptation aux régions tempérées où, pendant la saison froide ou sèche, la minéralisation de la matière organique et l'altération des roches sont ralenties. Or, certaines espèces ectomycorhiziennes ont de plus grandes capacités à altérer les roches par leurs hyphes et d'autres ont un équipement enzymatique leur permettant d'extraire des résidus azotés ou phosphatés de la matière organique du sol.
Plus récemment encore d’autres formes d’endomycorhizes et d’ectomycorhizes à pelotons sont apparues, notamment chez les Ericales, avec le phénomène de mycohétérotrophie : leurs symbiotes fongiques ont des capacités saprophytes encore plus fortes permettant à la plante de réingérer directement le carbone organique par le biais du champignon, dans les sols où l’activité de minéralisation est très faible (landes, haute montagne, écosystèmes froids…) : la symbiose permet un couplage de niveaux trophiques.
Plusieurs groupes de plantes (moins de 10 %) ne sont pas mycorhizés. Ils ont perdu secondairement l'association et illustrent le phénomène de néoténie. Ce sont essentiellement des plantes de milieux pionniers (absence de champignons) ou riches. Par exemple des bryophytes adaptées à des milieux hostiles, où elles peuvent se dessécher et où un champignon survivrait mal. Elles ont acquis des structures anatomiques leur permettant de résister à la dessication mais, corrélativement, leur taille reste petite. Ce sont également des angiospermes (Brassicacées, Chénopodiacées, Polygonacées, Protéacées, Caricacée…) qui se sont adaptées le plus souvent à milieux riches, dans lesquels l'approvisionnement hydrominéral ne nécessite pas de mycorhize[7].
Importance écologique de la mycorhization

Les mycorhizes sont à l'origine des écosystèmes les plus complexes, et en particulier dans les forêts et notamment les forêts tropicales qui vivent et évoluent souvent sur des sols ingrats et parfois peu fertiles. Leurs mycéliums forment des réseaux mycéliens interconnectés qui influencent le fonctionnement des écosystèmes (cycles biogéochimiques, composition des communautés végétales, alimentation carbonée des plantules pendant leur développement, modification de la compétition…) en permettant ou augmentant des flux importants de carbone organique et de minéraux (azote, phosphore, eau…) via le sol (en moyenne 30 à 40 % des minéraux captés par les marges du réseau mycélien sont rétrocédés à la racine, cette dernière apportant 4 à 40 % des glucides photosynthétisés au champignon[31] - [32] - [33]). Ils constituent un des éléments les plus dynamiques de la symbiose mycorhizienne et jouent un rôle essentiel dans le fonctionnement et la structuration des communautés végétales. Ces transferts sont si efficaces, qu'ils remettent en cause le concept de spéciation par compétition pour les nutriments entre les plantes d'un écosystème, en particulier pour la capture des phosphates par les racines (ils permettent de se passer des fertilisants phosphatés), pour la résistance au calcium toxique[34] (certaines plantes calcicoles tolèrent le calcium grâce aux hyphes mycéliens rejetant activement vers l'extérieur les ions Ca2+ ou en les immobilisant sous forme de cristaux d'oxalate de calcium qui précipitent dans les vacuoles, les idioblastes, ou sur les parois des hyphes)[35] ou pour la résistance à la sécheresse. Ils sont pourtant encore peu exploités en horticulture, agriculture et foresterie, ou pour la dépollution de certains sols pollués.
Certains groupes de champignons sont probablement des espèces-clés voire des « espèces ingénieur » qui influent sur les principaux processus écologiques du sol. Ils sont considérés par les pédologues comme des éléments essentiels de la diversité des communautés, laquelle est un facteur de stabilité et d'équilibre écologique[36]. Beaucoup de groupes-clés trouvés dans les sol (bactériens et de champignons mycorhiziens notamment) peuvent se connecter aux plantes (au moins 90 % des familles de plantes terrestres sont concernées) via des associations mycorhiziennes à arbuscules et jouer des synergies essentielles pour la survie et la productivité des plantes, contribuant à former un réseau écologique essentiellement souterrain, que certains biologistes ont nommé le wood-wide web (en référence au « World wide web[36] »). C'est la chercheuse canadienne Suzanne Simard qui est la première à mettre en évidence en 1997 ce réseau avec le transfert mycorhizien du carbone entre des arbres en conditions naturelles[37].
La plupart des champignons mycorhiziens sont soupçonnées d'avoir plusieurs hôtes voire une large gamme d'hôtes (chaque plante étant couramment associée à plusieurs dizaines de champignons mycorhiziens différents)[31], ce qui semble se confirmer dans les milieux naturels, mais les études faite sur les sols arables cultivés montrent cependant que la diversité en champignons mycorhiziens y est « extrêmement faible par rapport aux sols forestiers »[36].
La colonisation des systèmes racinaires, le potentiel « mycorhizogène » du sol et la « dépendance mycorhizienne » des plantes sont inversement corrélés avec la teneur de la solution du sol en ions phosphates ; de plus, ce résultat n'est pas lié à une forme d'engrais phosphaté, qu'il soit organique ou minéral, puisque les plantes n'absorbent que des ions en solution. L'enrichissement de cette solution devient directement responsable du fait que la plante bien nourrie ne favorise plus le développement des mycorhizes. Dans certaines situations, les niveaux de phosphore atteints deviennent incompatibles avec l'installation des mycorhizes[38].
Les mycorhizes interagissent aussi avec diverses bactéries du sol (dont Pseudomonas) qui peuvent être pathogènes (la mycorhize protège la plante contre ses pathogènes, par exemple en émettant des antibiotiques[39]), mais qui sont aussi appelées « bactéries auxiliaires à la mycorhization » (en anglais MHB: Mycorrhizal Helper Bacteria) tant elles jouent un rôle important.
Les mycorhizes interagissent aussi avec les autres mycorhizes et les autres champignons et avec certains prédateurs et parasites aériens des plantes :
- l'attaque des plantes par des herbivores provoque une modification rapide des communautés mycorhiziennes (les espèces demandant le moins de carbone sont favorisées) mais la nature de la population mycorhizienne modifie également (positivement ou négativement) les capacités de défense des plantes ;
- les communautés mycorhiziennes répondent (par modification des abondances spécifiques relatives) aux modifications de l'environnement suivant qu'elles soient plus ou moins favorable à l'hôte ou au symbiote et les communautés bactériennes sont modifiées par la variation des exsudats entre racines mycorhizées et non mycorhizées ;
- la diversité des champignons mycorhiziens à arbuscules du sol contrôle la composition des communautés végétales par un effet direct du champignon sur la valeur sélective des individus qu’ils colonisent (effet bénéfique, neutre, négatif ou même suppressif). Ce phénomène est lié à la préférence d’hôte existant pour chaque champignon. Cette préférence résiderait dans l’adéquation entre fonctions écologiques exercées par le champignon et besoins de la plante hôte.
Mycorhization contrôlée
De nombreuses expériences de mycorhization contrôlée ont montré que la régénération naturelle ou artificielle bénéficiait de la présence ou inoculation de champignons symbiotes adaptés aux plantes et au contexte (produits de champignons et micro-organismes efficaces contenant des cocktails de souches). Inversement la trufficulture n'a pu s'exporter en Nouvelle-Zélande qu'avec les plantes hôtes mycorhizées. De même les sapins de Noël européens n'y ont poussé qu'avec leurs symbiotes. Certains symbiotes sont d’une efficacité spectaculaire : c'est un accroissement de 60 % du volume total de Pseudotsuga menziesii qui a été permis en 10 ans sur les boisements issus de plants ectomycorhizés en pépinière avec une souche Laccaria bicolor dite S238N, par rapport aux arbres non inoculés[40].
Précautions : Le risque existe de concurrence avec des espèces locales, voire de pollution génétique. Plusieurs suivis ont montré que des plants inoculés en pépinières avaient en général perdu ce symbiote au profit d'autres issus du sol local, mais ce pourrait ne pas toujours être le cas[41].
Symbiose
Contrairement à une idée répandue, la relation mycorhizienne n'est pas exclusivement symbiotique car les transferts de substances du champignon à la plante n'augmentent pas toujours la valeur sélective (qui est le critère de définition de la symbiose). Les bénéfices, qui varient hautement en fonction du génotype des partenaires et de l'environnement sont difficiles à évaluer, particulièrement pour les plantes pérennes. Elles pourraient bénéficier de la symbiose uniquement pour de courtes périodes à différents moments de leur vie. Il existe en fait un continuum de relations entre les partenaires, de la symbiose au parasitisme en passant par la saprotrophie (la nature de la relation est descriptible en fonction du rapport coût/bénéfice).
Par exemple, Tricholoma matsutake est symbiotique, parasite ou saprophyte suivant son stade de développement et les conditions du milieu ; les mycorhizes des orchidées sont parasites de ligneuses et les néottie nid d'oiseau sont parasites de leurs mycorhizes.
En fait, la mycorhization est continuellement instable en raison des conflits d'intérêts entre les partenaires et de la pression de sélection qui pousse chaque partenaire à être le plus parasitique possible, ce qui explique les nombreuses interactions possibles : échanges de nutriments (la plante fournit des sucres et des lipides, les mycéliums fongiques fournissent de l'eau et des sels minéraux qu'il puisent dans le sol, parfois jusqu'à plusieurs dizaines de centimètres de la racine[42]), des facteurs de croissance (hormones, vitamines), des allomones fournissant une protection[43]. Un parasitisme trop important peut conduire à la rupture de l'association. Au cours du temps, la « symbiose » serait apparue et aurait été rompue plusieurs fois : l'association est réversible. Les champignons saprophytes pourraient ainsi être des symbiotes ayant perdu leur hôte. Ainsi, dans certaines associations mycorhiziennes, l’un des partenaires semble exploiter l'autre (soit par nature, soit en fonction des conditions). On entend ici par « exploiteur » un individu qui obtient un bénéfice (augmentation de la valeur sélective) sans réciprocité. On peut citer comme exemple les plantes mycohétérotrophes (plus de 200 espèces connues chez les orchidacées, les gentianacées, les burmanniacées…), des plantes aux capacités photosynthétiques nulles ou réduites qui obtiennent leur carbone de leur partenaire mycorhizien, lui-même l'obtenant d’un partenaire chlorophyllien au-travers du réseau mycélien.
L'exploitation d'un des partenaires de la symbiose par l'autre suppose des compensations pour l'individu exploité :
- uniformité génétique : la symbiose permet de maintenir l'uniformité génétique de l'espèce qui est parfois plus intéressante évolutivement que la variabilité (c'est le cas des mycorhizhes à vésicules et arbuscules et des éricoïdes) ;
- transmission verticale : la valeur sélective de l'exploité est liée à celle de son partenaire. C'est par exemple le cas pour les Glomales qui ont perdu toute reproduction sexuée depuis 400 millions d'années et sont dépendant de l'hôte pour leur survie ;
- interaction de voisinage : lorsque la densité d'exploiteur est grande, l'exploité peut se réfugier sur les hôtes les moins exploitants et diminuer la valeur sélective des hôtes plus exigeants.
- commensalisme ;
- promiscuité : capacité à s'associer à plusieurs partenaires (cas des mycohétérotrophes).
Les mécanismes de compensation pourraient être important dans la stabilisation de la symbiose. De manière générale les symbioses se caractérisent par une diminution de la dérive génétique et du taux de spéciation (Cf.effet "Roi rouge"[44]) mais ce n’est pas toujours le cas dans la mycorhization : plus l'association est exploiteuse plus elle est spécifique car l'exploité développe des résistances qui doivent être contournées par l'exploiteur (Théorie de la reine rouge). Dans le cas présent, la pression sélective sur l'hôte aurait conduit à l'apparition de la lignine et favorisé la croissance des tissus vasculaires.
Enfin, la logique et de nombreux indices laissent soupçonner une origine parasitique des mycorhizes :
- près de la moitié des gènes dont l'expression est modifiée par la mycorhization le sont de la même manière lors d'une attaque de parasites fongiques (à titre d'exemple, l’élicitation des chitinases) ;
- au cours de l'évolution, il y a eu contre-sélection des gènes de défense et augmentation des gènes de symbiose. La stimulation des défenses basales (non spécifiques) de la plante par les mycorhizes serait donc un vestige de l'ancienne relation parasitaire entre les partenaires.
- Bien d'autres exemples de symbiose ou d'interactions durables semblent avoir pour origine le parasitisme.
Types de mycorhization

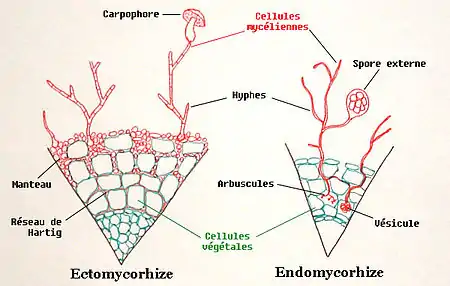
On distingue deux types principaux de mycorhizes, définis par les relations physioanatomiques entre les deux partenaires[27] : les endomycorhizes et les ectomycorhizes. Les mycorhizes éricoïdes et celles associées aux orchidées sont également étudiés pour leurs services écologiques, mais ont un intérêt économique plus limité.
Une cartographie mondiale des symbioses forestières[45] montre le succès évolutif des arbres ectomycorhizés. Sur les trois types de symbioses les plus courantes (endomycorhizes à arbuscules abondantes dans les climats tropicaux chauds et humides, ectomycorhizes dans les climats froids, et bactéries fixatrices d’azote dans les climats arides et chauds), les ectomycorhizes ne représentent que 2 % des espèces végétales, mais constituent 60 % de tous les arbres de la planète[46] - [47].
Endomycorhizes
Les endomycorhizes (ou mycorhizes internes) sont la forme la plus répandue. Ce sont des mycorhizes qui pénètrent à l'intérieur des racines pour mieux s'y associer. Il existe plusieurs types d'endomycorhizes :
Endomycorhizes à arbuscules


Les endomycorhizes à arbuscules ou arbusculaires (AM) sont le cas le plus répandu. Ces champignons mycorhiziens colonisent environ 80 % des plantes vasculaires terrestres, c'est-à-dire plus de 400 000 espèces. Il existe cependant moins de 200 espèces de champignons endomycorhiziens. Ces champignons ne sont donc pas très spécifiques dans leurs relations de symbiose. Étant peu spécifique, chaque espèce doit posséder un grand potentiel d'adaptabilité et une large diversité génétique afin de lui permettre de s’adapter aux différentes conditions environnementales auxquelles elle doit faire face.
Ils sont associés avec les plantes herbacées et ligneuses. Ces endomycorhizes arbusculaires, aussi appelés mycorhizes à vésicules et arbuscules (ou mycorhizes vésiculo-arbusculaires), tirent leur nom des vésicules intercellulaires (souvent des gouttes d'huile, stockage de réserve pour le champignon) et des structures « intracellulaires » rappelant un petit arbre. S'ils traversent bien la paroi, ils ne pénètrent cependant pas la membrane plasmique de la cellule végétale, se contentant de provoquer une invagination de la membrane de celle-ci. Cela a pour effet d’accroître la surface de contact entre l'hyphe et la cellule de la plante et ainsi faciliter l’échange de métabolites entre les deux partenaires.
Les endomycorhizes arbusculaires sont formées uniquement par des champignons de la division des Gloméromycètes ayant perdu la reproduction sexuée. Les hyphes s’étendent dans le parenchyme cortical de la racine, formant des vésicules contenant des réserves, et des structures ramifiées, les arbuscules. Ils se reproduisent donc uniquement asexuellement. Cependant les hyphes d'individus différents peuvent fusionner, ce qui rend possible un échange génétique et une forme de parasexualité
Ils sont aussi uniques au point de vue génétique puisque leurs spores possèdent plusieurs noyaux génétiquement différents[48].
Endomycorhizes à pelotons intracellulaires
Chez les endomycorhizes à pelotons intracellulaires, les hyphes forment des amas dans les cellules corticales. Elles impliquent des basidiomycètes, en association avec les Orchidacées qui ont accru leur dépendance à la symbiose, en devenant des mycohétérotrophes qui exploitent leurs champignons mycorhiziens comme source de carbone[49]. Les hyphes pénètrent à travers la paroi des cellules à l'intérieur des cellules du cortex racinaire en repoussant la membrane plasmique. La paroi des hyphes est donc en contact avec la membrane plasmique de la cellule racinaire, sans la traverser. La surface de contact peut être augmentée par la formation de ramifications (ou arbuscules). Les racines ne sont pas déformées.
Endomycorhizes éricoïdes
Chez les endomycorhizes éricoïdes : les hyphes forment des pelotons dans des racines transitoires de faible diamètre. Elles impliquent des Ascomycètes ou Basidomycètes (en symbiose avec les Ericales).
Ectendomycorhizes
Chez les ectendomycorhizes, appelées aussi mycorhizes ectendotrophes ou mycorhizes de type arbutoïde : le champignon forme des pelotons intracellulaires comme les endomycorhizes, et un manteau autour de la racine comme les ectomycorhizes. C’est le cas chez les Pyroles qui exploitent, comme les Orchidacées, leurs champignons mycorhiziens comme source de carbone[50]. On trouve également des ectendomycorhizes monotropoïdes, chez les Ericales non chlorophylliennes. Les hyphes forment des pelotons dans les cellules superficielles de la racine.
Dans cette symbiose, le réseau dense et étendu des hyphes des champignons mycorhiziens aide la plante à explorer un volume accru de sol et à accéder à des endroits inaccessibles pour les racines. Le champignon permet à la plante d'améliorer sa nutrition en apportant principalement de l'eau, du phosphore et de l'azote. Accessoirement, la colonisation des racines par des champignons mycorhiziens permet de protéger celles-ci contre les attaques d’organismes pathogènes. Plusieurs études ont démontré que sans association avec un champignon symbiotique, la plante poussera plus lentement (voire pas du tout, comme dans le cas du Pin noir sur sol calcaire) et sera beaucoup plus susceptible d’être la victime d’une infection. En retour, le champignon bénéficie de la photosynthèse de la plante sous forme de matière organique riche en énergie (sucres) essentielle à sa survie. La qualité de l'humus en est améliorée, au bénéfice d'autres espèces et du maintien ou de la constitution et amélioration du sol.
Quelques plantes de la famille des Gymnospermes comme les Podocarpaceae, les Araucariaceae et les Phyllocladaceae, sont connues pour présenter des renflements racinaires envahis par des champignons endomycorhiziens, appelées myconodules ou pseudonodules.
Ectomycorhizes
Les ectomycorhizes (ou mycorhizes externes) concernent seulement 5 % des plantes vasculaires, en majorité des arbres des forêts tempérées et boréales (comme les Fagacées, les Pinacées ou les Bétulacées) et des champignons de la division des Ascomycètes, des Basidiomycètes ou des Zygomycètes. Ces mycorhizes ne pénètrent pas à travers des parois cellulaires à l'intérieur des cellules de la plante, mais entourent simplement les racines, formant un manteau de mycélium et un réseau entre les parois des cellules de la racine.
Le champignon s’associe d’abord aux racines fines à croissance déterminée, dépourvues de poils absorbants. Puis, il enveloppe la racine d’un manteau d’hyphes, le manchon mycorhizien. D'autres hyphes croissent entre les cellules dans la partie externe du parenchyme cortical, formant ainsi l'interface symbiotique ou « réseau de Hartig ». La symbiose modifie la physionomie de la racine mycorhizée : elle se renfle, cesse de croître et peut se ramifier de façon abondante. La coiffe et le méristème apical sont alors réduits.
Dialogue plante-hôte champignons
Des centaines de champignons différents peuvent être associés à une même espèce. Le hêtre, par exemple, détient un « record » avec plus de 200 associations mychoriziennes.


Inducteurs de la plante-hôte
La croissance du mycélium fongique en direction des racines de la plante-hôte est déclenchée par la perception d'un signal émis en permanence par les racines sous la forme de molécules spécifiques à la plante comme des strigolactones, et surtout des flavonoïdes[51].
Voie de signalisation Myc
Les signaux émis par le champignon qui lui permettent d'être reconnus par la plante sont mal connus. Par analogie avec les facteurs Nod, on appelle ces facteurs « facteurs Myc ». Des molécules de type facteur Nod produites par les champignons arbusculaires et ayant un effet sur la plante hôte ont récemment été mises en évidence[52], mais leur rôle dans la signalisation symbiotique reste à déterminer.
La voie de signalisation activée par les facteurs myc présente des étapes communes avec la voie Nod présente chez les légumineuses nodulées par des rhizobia[53] et chez les plantes actinorhiziennes[54]. Les récepteurs des facteurs Myc ne sont pas connus, mais les protéines intervenant après telles que SYMRK, CASTOR, POLLUX, NUP, CYCLOPS sont nécessaires aux symbioses rhizobiennes et mycorhiziennes arbusculaires. Comme pour la symbiose rhizobienne, le contact avec un champignon arbusculaire induit des oscillations calciques. Les endomycorhizes arbusculaires étant apparues avant les endosymbioses fixatrices d’azote, les chercheurs émettent l’hypothèse que la voie de transduction du signal mycorhizien a été recrutée par les bactéries fixatrices d’azote.
Applications
Un cortège mycorhizien optimal agirait comme un « engrais » sans ses inconvénients, et gratuitement, en se passant de pesticides, fongicides et amendements. Après de premiers essais en Australie dès les années 1920, des entreprises ont développé des souches d'inoculation adaptées à plusieurs espèces commerciales (inoculums monosouches ou plurisouches), mais il faudrait qu'elles soient aussi adaptées au contexte du lieu d'implantation. Plusieurs chercheurs estiment que les souches de champignons symbiotes génétiquement les mieux adaptées au terrain, sont celles qui sont indigènes[55]. Des sociétés privées dans le monde entier ont ainsi développé la production et la vente d'inoculants mycorhiziens destinés à un usage agricole (biofertilisant, biostimulant) mais aussi écologique (revégétalisation des sols érodés, phytoremédiation)[56].
Prise en compte dans la gestion des forêts et des cultures
En agriculture l’utilisation de champignons mycorhiziens éviterait bien des problèmes de dénaturation des sols biologiques. En effet, l’ajout de pesticides et notamment de fongicides peut avoir des effets néfastes sur la qualité des sols. Les champignons ont des rôles importants dans le maintien d’un sol fertile. L’ajout de composés chimiques hautement phosphorés induirait un appauvrissement en quantité et qualité de champignons endomycorhiziens, réduisant l’apport en nutriment aux plantes cultivées. De plus, une trop grande quantité de phosphore a un impact néfaste sur les cours d’eau (eutrophisation)[57]. Il est primordial alors de réduire la quantité de produits chimiques néfastes et d’opter plutôt sur l’inoculation de champignons naturels qui auraient les mêmes avantages de croissance rapide, sans les inconvénients sur l’environnement.
Une étude sur le jujubier a démontré que la mycorhization contrôlée était bénéfique à sa croissance et à sa nutrition phosphatée. Effectivement, l’arbre fruitier absorbait avec beaucoup plus de facilité le phosphore naturel ajouté dans un sol pauvre. Il en était même dépendant pour une croissance normale[58]. Il ne suffit donc pas, en agriculture, de simplement rajouter du phosphore en très grande quantité pour que la plante pousse plus rapidement, il s'agit également de prendre en compte le réseau mycorhizien[59]. Celle-ci doit d’abord et avant tout être capable d’absorber efficacement. Une surdose de nutriments n’y changerait rien et cela ne provoquerait que le lessivage du phosphore et la pollution des eaux de surface.
L’action des mycorhizes ne s’arrête pas à une meilleure nutrition : elles permettent aussi à la plante de mieux se protéger des facteurs biotiques et abiotiques nuisibles. Bien sûr, une meilleure nutrition implique une meilleure santé aux végétaux qui peuvent alors mieux tolérer les stress environnementaux, notamment les agents pathogènes. Les mycorhizes peuvent libérer dans la rhizosphère des antibiotiques, provoquant l'élimination de tous les microorganismes, pathogènes ou non, qui pourraient venir détourner à leur profit une partie des échanges[60]. De plus, la symbiose mycorhizienne induit aussi l’établissement de mécanismes de défense de la plante elle-même (prémunition et stimulation immunitaire). C’est une protection indirecte qui se situe au niveau cellulaire. Chez les plants ectomycorhizés, les cellules du rhizoderme synthétisent des tannins stockés dans des vacuoles qui constituent une prémunition face à d'autres attaques de microbes et autres agents pathogènes. La plante produit aussi davantage de lignine dans les parois cellulaires de l’endoderme et des tissus vasculaires. Elle peut également induire ou supprimer divers défenses liées aux phytoalexines, peroxydases, chitinases et plusieurs autres. En bref, le champignon entraîne des changements considérables dans les mécanismes de défense chez la plante contre divers parasites, et ce avant les infections[61].
Parfois, l’association avec un champignon provoque un remodelage du système racinaire. Par exemple, chez le fraisier, la mycorhization provoque une protection accrue contre la pourriture racinaire causée par Phytophthora fragariae. La ramification intense des racines induite par le champignon mycorhizien est accompagnée d’exsudats racinaires, et cela aurait comme effet de modifier la microflore et les interactions directes avec les parasites[62].
Concernant les mycètes parasitaires, une plante associée à un mycorhize est aussi mieux protégée. Les hyphes du champignon symbiotique colonisent les racines de la plante et « bloquent » des sites d’accès au mycète parasite. Ils entrent aussi en compétition avec les nutriments disponibles. Un mycorhize reçoit lui aussi des avantages à se lier à une plante : il reçoit des composés carbonés en échange de minéraux. Le carbone étant très convoité, un mycorhize est plus avantagé qu’un champignon parasitaire libre dans le sol. De plus, les mycorhizes peuvent représenter jusqu’à 80 % de la masse microbienne du sol[63]. Ils influencent alors grandement les propriétés physiques et chimiques de l’environnement et peuvent donc contrôler plusieurs interactions microbiennes du sol. Parfois c’est en accord avec la plante mycorhizée en apportant protection et croissance, mais parfois les effets sont plutôt négatifs[64].
Les mycorhizes peuvent donc aider à protéger la plante aux stress abiotiques (par exemple la sécheresse) et biotiques de plusieurs façons : une meilleure nutrition et santé, une transformation morphologique des racines, l’induction ou la suppression de mécanismes de défense et en agissant sur le parasite lui-même, soit par compétition pour les ressources et les sites d’infection, soit par la modification de la microflore et de l’augmentation du taux de matière organique[61].
Il faut noter toutefois que ces interactions sont étudiées en serre et en milieux contrôlés et qu’elles ne reflètent donc pas entièrement toute la complexité d’un milieu naturel variable dans le temps et en composition[61].
Avec tous les avantages énoncés des mycorhizes, il est donc juste de dire que leur bonne utilisation éviterait bien des soucis environnementaux, car elles agiraient comme engrais et agents protecteurs. L’utilisation d’engrais chimiques, de fongicides et de pesticides ne seraient alors plus autant nécessaire. En effet, les engrais diminuent le taux de mycorhization, ce qui a pour effet une dépendance accrue des plantes à ces intrants. De même, l'emploi de pesticides diminue le pouvoir inoculant du sol, d'où une diminution de l'effet protecteur des mycorhizes et une demande accrue des plantes en pesticides. L'ajout de tels intrants installe une forme de cercle vicieux[65].
L'activité sylvicole et agricole peut perturber ou modifier (négativement ou positivement) la microflore fongique et sa capacité à mycorhizer ;
- Le retournement du sol (labour), le tassement par les engins endommagent la communauté ectomycorhizienne
- Les programmes de sélection et d'amélioration génétique des plantes adaptés à des systèmes de cultures à haut niveau d'intrants (engrais azotés, phosphatés, potassiques), minimisent ou annulent la formation des mycorhizes. Il est possible que ce processus soit renforcé par les sélections variétales qui portent sur la résistance aux maladies fongiques[66] - [67].
- La fertilisation azotée (qui se fait de plus en plus en sylviculture aussi) diminue le nombre de carpophores et altère la composition en espèces (mesuré sur Picea abies par Peter et al.[68], en réduisant le nombre de mycorhizes[69], et en changeant les types mycorhiziens (Brandbrud, 1995 ; Karen, 1997).
- Les coupes rases endommagent la communauté mycorhizienne[70]. Jones estime que le changement de composition des communautés ectomycorhiziennes est plus en cause qu'une diminution du taux de colonisation des racines. Le tassement du sol pourrait être en jeu aussi, de même à long terme que l'exportation de presque toute la biomasse ligneuse.
- Les coupes forestières d’éclaircie[71] - [72], ainsi que l’irrigation[73] augmentent le nombre de carpophores produits avec des effets encore mal compris sur la composition et biodiversité de la communauté fongique.
- Bien entendu l'utilisation de fongicide affecte cette communauté. La présence de fongicides dans les eaux météoriques (pluies, brumes, rosées, neige, etc.) est avérée, mais ses impacts sur les champignons restent mal compris.
Les changements biochimiques et biologiques, ainsi que microclimatique induit par les grandes coupes rases, (ou même par les moissons dans le cas de l'agriculture) pourraient avoir des impacts sous-estimés, liés aux impacts directs sur le sol, sur l'eau, mais aussi à la perte d’inoculum fongique (même si les racines restent dans le sol, les « gros-bois » et gros « bois mort » deviennent rares ou absents, et les rémanents sont souvent rassemblés).
Recherche
Le terme de mycorhize (du grec myco, « champignon » et rhiza, « racine ») est introduit en 1885 par le botaniste Albert Bernhard Frank[74]. Engagé par le roi de Prusse Guillaume Ier pour développer des méthodes de production de truffes en étudiant leur mode de propagation, A.B.Frank observe que ces champignons s'associent aux radicelles des arbres et propose que cette association est une relation symbiotique et non parasitique. La théorie d'écologie évolutive de Frank, contredisant la croyance que les truffes et les autres champignons entraînent maladies et pourritures végétales, est vivement contestée par ses collègues[75]. Cette théorie revient sur le devant de la scène avec les travaux[76] de Jack Harley[77] - [78] considéré comme le « pape des mycorhizes » pour ses études depuis les années 1950[79], Barbara Mosse en 1962[80], J.M. Phillips et D.S. Hayman en 1970[81], M. Gardes et T.D. Bruns en 1993[82].
La recherche est en plein développement au début du XXIe siècle grâce aux moyens nouveaux de la biologie moléculaire et de la génétique, au point de donner le nom à une discipline scientifique, la mycorhizologie, étudiée par les mycorhizologues[83]. De 2008 à 2016, plus de 10 000 nouvelles contributions scientifiques ont concerné les mycorhizes[38].
Notes et références
- Légende : A=cortex racinaire, B=épiderme racinaire, C=arbuscle, D=vésicule, E=hyphe, F=poil absorbant, G=noyaux cellulaires.
- Dits aussi hyphes extramatriciels.
- Margaret L. Ronsheim, The Effect of Mycorrhizae on Plant Growth and Reproduction Varies with Soil Phosphorus and Developmental Stage ; The American Midland Naturalist (édité par la "University of Notre Dame") 167(1) ; pages 28 à 39. Jan 2012 doi:https://dx.doi.org/10.1674/0003-0031-167.1.28 (Résumé)
- Certains champignons mycorhiziens deviennent parasites quand leur coût en carbone surpasse leur apport hydro-minéral. Cf (en) Melanie D. Jones, Sally E. Smith, « Exploring functional definitions of mycorrhizas: Are mycorrhizas always mutualisms? », Canadian Journal of Botany, vol. 82, no 8, , p. 1089-1109 (DOI 10.1139/b04-110).
- Les enseignements s'appuient souvent sur des observations de plantes en germination, ce qui masque le fait que la plupart des poils absorbants des plantes adultes ne sont pas fonctionnels. Cette vision a longtemps prévalu chez les chercheurs en biologie végétale qui ont utilisé comme modèle expérimental des espèces exceptionnellement non mycorhiziennes, comme l'arabette (Arabidopsis thaliana, de la famille du chou).
- Comme un hyphe de champignon a un rayon dix fois plus petit qu'un poil racinaire, son rapport surface/volume est cent fois plus grand, d'où le rapport 1 000/10. « Dans une prairie, chaque mètre de racine correspond à 10 kilomètres d'hyphes. Chaque cm3 de sol contient entre 100 et 1 000 m d'hyphes, dont la surface est, par procuration, le contact indirect entre la plante et le sol. Sous 1 m2 de sol, la surface des hyphes représente environ 100 m2 ». Cf Marc-André Selosse, Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, Actes Sud Nature, , p. 58.
- Marc-André Selosse, Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, Éditions Actes Sud, , p. 171
- (en) van der Heijden MG1, Martin FM, Selosse MA, Sanders IR, « Mycorrhizal ecology and evolution: the past, the present, and the future », New Phytol, vol. 205, no 4, , p. 1406-1423 (DOI 10.1111/nph.13288).
- Jean Garbaye, La symbiose mycorhizienne, Editions Quae, , p. 121.
- (en) Jacqueline M. Chaparro, Dayakar V. Badri, Matthew G. Bakker, Akifumi Sugiyama, Daniel K. Manter, Jorge M. Vivanco, « Root Exudation of Phytochemicals in Arabidopsis Follows Specific Patterns That Are Developmentally Programmed and Correlate with Soil Microbial Functions », PLOS ONE, vol. 8, no 2, (DOI 10.1371/journal.pone.0055731).
- (en) Alessandro Desirò, Alessandra Salvioli, Eddy L Ngonkeu, Stephen J Mondo, Sara Epis, Antonella Faccio, Andres Kaech, Teresa E Pawlowska & Paola Bonfante, « Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi », The ISME Journal, vol. 8, , p. 257–270 (DOI 10.1038/ismej.2013.151).
- (en) Frida A. A. Feijen, Rutger A. Vos, Jorinde Nuytinck & Vincent S. F. T. Merckx, « Evolutionary dynamics of mycorrhizal symbiosis in land plant diversification », Scientific Reports, vol. 8, no 1, (DOI 10.1038/s41598-018-28920-x).
- La mycorhize, la symbiose qui a fait la vie terrestre, Pour la Science no 494, décembre 2018.
- Bernard Boullard et Y. Lemoigne, « Les champignons endophytes du "Rhynia gwynne-vaughanii" K. et L. Étude morphologique et déductions sur leur biologie », Botaniste, vol. 54, nos 1-6, , p. 49-89.
- Hépatiques et anthocérotes mais pas les Bryophytes s.s. (mousses, sphaignes). Cf (en) B. Wang & Y.-L. Qiu, « Phylogenetic distribution and evolution of mycorrhizas in land plants », Mycorrhiza, vol. 16, no 5, , p. 299–363 (DOI 10.1007/s00572-005-0033-6).
- Jean-Christophe Guéguen, David Garon, Biodiversité et évolution du monde fongique, EDP Sciences, , p. 96
- « La forme générale et la couleur des ectomycorhizes varient selon l'espèce du champignon infectant et pour un même champignon la forme peut varier selon l'arbre infesté ». Cf Jacques Delmas, Les champignons et leur culture, Flammarion, , p. 51.
- Addy HD, Miller MH, Peterson RL. 1997. Infectivity of the propagules associated with extraradical mycelia of two AM fungi following winter freezing. New Phytol. 135: 745-753
- Addy HD, Boswell EP, Koide RT. 1998. Low temperature acclimation and freezing resistance of extraradical VA mycorrhizal hyphae. Mycol. Res. 102: 582-586
- Alexander IJ, Fairley RI. 1983. Effects of N fertilization on populations of fine roots and mycorrhizas in spruce humus. Plant Soil 71: 49-53
- Mark Tibbett, John W.G. Cairney, The cooler side of mycorrhizas: their occurrence and functioning at low temperatures ; Revue canadienne de botanique, 2007, 85(1): 51-62, 10.1139/b06-152 ; En ligne:2007-04-05 ; (Résumé, en français)
- Addy HD, Schaffer GF, Miller MH, Peterson RL. 1994. Survival of the external mycelium of a VAM fungus in frozen soil over winter. Mycorrhiza 5: 1-5
- Antal Z, Manczinger L, Szakacs G, Tengerdy RP, Ferenczy L. 2000. Colony growth, in vitro antangonism and secretion of extracellular enzymes in cold-tolerant strains of Trichoderma species. Mycol. Res. 104: 545-549
- Baon JB, Smith SE, Alston AM. 1994. Phosphours uptake and growth of Barley as affected by soil temperature and mycorrhizal infection. J. Plant Nutr. 17: 547-552
- Marc-André Selosse, François Le Tacon, « Les stratégies symbiotiques de conquête du milieu terrestre par les végétaux », Année Biol., vol. 40, , p. 15-16 (lire en ligne)
- Jean Pelmont, Biodégradations et métabolismes, EDP Sciences, , p. 741
- Francis Martin, « Plantes et champignons, des associations à bénéfice réciproque », Conférence à la Cité des Sciences et de l'Industrie, 26 octobre 2010
- Marc-André Selosse, Jamais seul. Ces microbes qui construisent les plantes, les animaux et les civilisations, Éditions Actes Sud, (lire en ligne), p. 145
- (en) D.S. Hibbett, L.B. Gilbert, M.J. Donoghue, « Evolutionary instability of ectomycorrhizal symbioses in basidiomycetes », Nature, vol. 407, , p. 506-508 (lire en ligne)
- (en) Gary D. Bending, David J. Read, « Lignin and soluble phenolic degradation by ectomycorrhizal and ericoid mycorrhizal fungi », Mycological Reseach, vol. 101, no 11, , p. 1348-1354 (DOI 10.1017/S0953756297004140)
- Marc-André Selosse, Franck Richard, Pierre-Emmanuel Courty, « Plantes et champignons : l'alliance vitale », La Recherche, no 411, , p. 59.
- (en) P. G. Kennedy, A. D. Izzo, T. D. Bruns, « There is high potential for the formation of common mycorrhizal networks between understorey and canopy trees in a mixed evergreen forest », Journal of Ecology, vol. 91, no 6, , p. 1071-1080 (DOI 10.1046/j.1365-2745.2003.00829.x).
- (en) H. Bücking, E. Liepold, P. Ambilwade, « The role of the mycorrhizal symbiosis in nutrient uptake of plants and the regulatory mechanisms underlying these transport processes », dans Dhal NK, Sahu SC, Plant Science, Intech, (DOI 10.5772/52570), p. 108-132
- L'excès de calcium perturbe le fonctionnement et la disposition des molécules des membranes cellulaires.
- (en) Kermit Cromack et al., « The role of oxalic acid and bicarbonate in calcium cycling by fungi and bacteria : some possible implications for soil animals », Ecological Bulletins, no 25, , p. 246-252
- T. Helgason, T. J. Daniell, R. Husband, A. H. Fitter & J. P. W. Young, Ploughing up the wood-wide web ?, Nature, Scientific Correspondence Nature 394, 431 (30 July 1998) ; Doi:10.1038/28764 (Résumé)
- (en) Suzanne Simard, David A Perry, Melanie D. Jones, David D. Myrold, « Net transfer of C between ectomycorrhizal tree species in the field », Nature, vol. 388, no 6642, , p. 579-582 (DOI 10.1038/41557).
- Fortin, Plenchette et Piché - "Les mycorhizes, la nouvelle révolution verte", quae, 2008, p.96, réédité et augmenté en 2016 :
- Francis Hallé, « Des feuilles souterraines ? », Alliage, no 64, , p. 93
- Selosse M.A., Bouchard D., Martin F. & Le Tacon F. 2000. Effect of Laccaria bicolor strains inoculated on Douglas-fir (Pseudotsuga menziesii) several years after nursery inoculation. Canadian Journal of Forest Research 30: 360-371.
- Thèse d'André Gagné, Étude moléculaire du cortège ectomycorhizien de plantations de conifères sur des sites forestiers après coupes à blanc, Université Laval, 2005
- Marc-André Selosse, Franck Richard, Pierre-Emmanuel Courty, « Plantes et champignons : l'alliance vitale », La Recherche, no 411, , p. 58.
- (en) M-A. Selosse, F. Richard, X. He & S. W. Simard, « Mycorrhizal networks : des liaisons dangereuses ? », Trends in Ecology and Evolution, vol. 21, no 11, , p. 621-628.
- The Red King effect: When the slowest runner wins the coevolutionary race, Carl T. Bergstrom and Michael Lachmann, Proceedings of the National Academy of Sciences
- Carte mondiale des symbioses forestières : arbres ectomycorhizés (a), arbres à endomycorhizes à arbuscules (b), et arbres à bactéries fixatrices d’azote (c), tiré de B. S. Steidinger et al., 2019
- (en) B. S. Steidinger, T. W. Crowther, J. Liang, M. E. Van Nuland, G. D. A. Werner, P. B. Reich, G. Nabuurs, S. de-Miguel, M. Zhou, N. Picard, B. Herault, X. Zhao, C. Zhang, D. Routh, K. G. Peay & GFBI consortium, « Climatic controls of decomposition drive the global biogeography of forest-tree symbioses », Nature, vol. 569, , p. 404–408 (DOI 10.1038/s41586-019-1128-0).
- « Une cartographie mondiale des symbioses microbiennes des arbres révèle leur rôle clé dans la régulation du climat », sur cirad.fr, .
- Marc-André Selosse, Jean Jacques Guillaumin (2005), De la germination à l’âge adulte : les champignons symbiotiques des orchidées, in M. Bournérias & D. Prat (ed.), Orchidées de France, Belgique et Luxembourg, p. 34-44. Parthénope
- Marc-André Selosse, « Existe-t-il des plantes sans symbiose ? », Les Amis du Muséum National d'Histoire Naturelle, Publication trimestrielle, Les Amis du Muséum, no 266, , p. 24.
- Jean Garbaye, La symbiose mycorhizienne, Editions Quae, , p. 66.
- http://www.wipo.int/pctdb/en/wo.jsp?WO=2010049751
- http://linkinghub.elsevier.com/retrieve/pii/S1937644810810019
- http://www.pnas.org/content/105/12/4928.full
- Trappe J.M. 1977. Selection of fungi for ectomycorrhizal inoculation nurseries. Annual Review of Phytopathology 15: 203-222. ;
Navratil S. 1988. The state of the art in mycorrhizal research in Alberta and Saskatchewan. In Proceedings of the Canadian Workshop on Mycorrhizae in Forestry, May 1-4, 1988. M. Lalonde & Y. Piché (Ed). Centre de recherche en biologie forestière, Faculté de foresterie et géodésie, Université Laval, Ste-Foy, Qc. ;
Perry P.D., Molina R. & Amaranthus M.P. 1987. Mycorrhizae, mycorrhirospheres and reforestation. Canadian Journal of Forest Research 17: 929-940. - (en) Gianinazzi G, Gollotte A, Binet M-N, Van Tuinen D, ReD WD, « Agroecology: the key role of arbuscular mycorrhizas in ecosystem services », Mycorrhiza, vol. 20, no 8, , p. 519–530 (DOI 10.1007/s00572-010-0333-3).
- R. Chaussod, « La qualité biologique des sols, Évaluations et implications » (consulté le ).
- Amadou Bâ, Tiby Guissou, Robin Duponnois, Christian Plenchette, Ousmane Sacko, Daouda Sidibé, Kondé Sylla et Baba Windou, « Mycorhization contrôlée et fertilisation phosphatée : applications à la domestication du jujubier », Fruits, vol. 56, no 04, , p. 261-269 (lire en ligne)
- « Réseaux mycorhiziens, sols et agriculture : une histoire à inventer ! », sur blog.defi-ecologique.com, (consulté le )
- Azcon-Aguilar, C. et J.M. Barea, « Arbuscular mycorrhizas and biological control of soil-borne plant pathogens – an overview of the mechanisms involved », Mycorrhiza, vol. 6, no 6, , p. 457-464 (lire en ligne)
- Yolande Dalpé, « Les mycorhizes : un outil de protection des plantes mais non une panacée », Phytoprotection, vol. 86, no 1, , p. 53-59 (lire en ligne)
- Norman, J.R. et Hooker, J.E., « Sporulation of Phytophthora fragariae shows greater stimulation by exudates of non-mycorrhizal than by mycorrhizal strawberry roots », Mycologia, no 104 : 1069-1073.DOI:10.1017/S0953756299002191,
- Z.Kabir, I. P. O'Halloran, J.W. Fyles et C. Hamel, « Seasonal changes of arbuscular mycorrhizal fungi as affected by tillage practices and fertilization : Hyphal density and mycorrhizal root colonization », Plant and Soil, vol. 192 !numéro= 2, , p. 285-293
- Borowicz, V.A., « Do arbuscular mycorrhizal fungi alter plant–pathogen relations? », Ecology, vol. 82, no 11, , p. 3057-3068
- Jean Garbaye, La symbiose mycorhizienne, Editions Quae, , p. 133-140.
- (en) B. A. D. Hetrick, G. W. T. Wilson & T. S. Cox, « Mycorrhizal dependence of modern wheat varieties, landraces, and ancestors », Canadian Journal of Botany, vol. 70, no 10, , p. 2032– 2040 (DOI 10.1139/b92-253).
- Jean Garbaye, La symbiose mycorhizienne. Une association entre les plantes et les champignons, Quæ, , p. 97
- Peter M., Ayer F. & Egli S. 2001. Nitrogen addition in a Norway spruce stand altered macromycete sporocarp production and below-ground ectomycorrhizal species composition. New Phytologist 149: 311-325
- (Newton et Pigott, 1991)
- Perry P.D. 1995. Self-organizing systems across scales. Trends in Ecology and Evolution 10: 241-244,
Kranabetter, J.M., & Wylie, T. 1998. Ectomycorrhizal community structure across forest openings on naturally regenerated western hemlock seedlings. Canadian Journal of Botany 76: 189-196.,
Jones M.D., Durall D.M. & Cairney W.G. 2003. Ectomycorrhizal fungal communities in young forest stands regenerating after clearcut logging. Tansley review. New Phytologist 157: 399-422.,
Lazaruk l., Kernaghan G., Macdonald S.E. & Khasa D.P. 2005. The impact of partial forest harvesting on the ectomycorrhizae of Picea glauca in northwestern Alberta. Canadian Journal of Forest Research, 35: 1-13 - Waters J.R., McKelvey K.S., Zabel C.J. & Oliver W.W. 1994. The effects of thinning and broadcast burning on sporocarp production of hypogeous fungi. Canadian Journal of Forest Research 24: 1516-1522, McKelvey K.S., Zabel C.J. & Oliver W.W. 1994. The effects of thinning and broadcast burning on sporocarp production of hypogeous fungi. Canadian Journal of Forest Research 24: 1516-1522
- Egli S. & Ayer F. 1997. Est-il possible d’améliorer la production de champignons comestibles en forêt ? L’exemple de la réserve mycologique de La Chenéaz en Suisse. Revue Forestière Française 49: 235-243)
- Le Tacon F., Delmas J., Gleyze R. & Bouchard D. 1982b. Influence du régime hydrique du sol et de la fertilisation sur la fructification de la truffe noire du Périgord (Tuber melanosporum Vitt.) dans le Sud-Est de la France. Acta Oecologica 3-4 : 291-306.
Wiklund K., Nilsson L.O. & Jacobson S. 1995. Effect of irriguation, fertilization and artificial drought on basidioma production in a Norway spruce stand. Canadian Journal of Botany 73: 200-208. - (de) Frank A.B., 1885, « Über die auf Wurzelsymbiose beruhende Ernährung gewisser Bäume durch unterirdische Pilze » (Sur la nutrition de certains arbres par l'intermédiaire de la symbiose entre les racines et des champignons souterrains), Berichte der Deutschen Botanischen Gesellschaft, 3, p. 128–145
- (en) James M. Trappe,, « A.B. Frank and mycorrhizae: the challenge to evolutionary and ecologic theory », Mycorrhiza, vol. 15, no 4, , p. 277–281 (DOI 10.1007/s00572-004-0330-5).
- (en) Marcel G. A. van der Heijden, Francis M. Martin, Marc‐André Selosse, Ian R. Sanders, « Mycorrhizal ecology and evolution: the past, the present, and the future », New Phytologist, vol. 205, no 4, , p. 1406-1423 (DOI 10.1111/nph.13288).
- « Harley, J. L. 1948. Mycorrhiza and soil ecology », Biological Review, vol. 23, no 2, , p. 127-158 (DOI 10.1111/j.1469-185X.1948.tb00460.x).
- (en) J.L. Harley, S.E. Smith, Mycorrhizal symbiosis, Academic Press, , 483 p..
- Francis Martin, Sous la forêt. Pour survivre il faut des alliés, Humensis, , p. 121.
- (en) Barbara Mosse, « The establishment of vesicular-arbusacular mycorrhiza under aseptic conditions », Journal of general microbiology, vol. 27, no 3, , p. 509-520.
- (en) J.M. Phillips, D.S. Hayman, « Improved procedures for clearing roots and staining parasitic and vesicular–arbuscular mycorrhizal fungi for rapid assessment of infection », Transactions of the British Mycological Society, vol. 55, no 1, , p. 158-161 (DOI 10.1016/S0007-1536(70)80110-3).
- (en) M. Gardes, T.D. Bruns, « ITS primers with enhanced specificity for basidiomycetes – application to the identification of mycorrhizae and rusts », Molecular Ecology, vol. 2, no 2, , p. 113–118.
- (en) Sumei Li, Yinglong Chen, Xiangui Lin, Runjin Liu, « Mycorrhizology in the 21st Century », Journal of Fungal Research, vol. 10, , p. 182-189
Voir aussi
Bibliographie
- Jean-André Fortin, Christian Plenchette, Yves Piché, Les mycorhizes - La nouvelle révolution verte Éditions Quæ et Multimondes, Québec, 2008, 148 p.
- Victoria GOMEZ ROLDAN, "Rôle des strigolactones dans la symbiose mycorhizienne à arbuscule.", PhD, Université Paul-Sabatier, Toulouse, France, 2009.
- Garbaye J (2013) Une association entre les plantes et les champignons, Éditions QUAE, publié 28/10/2013, (ISBN 9782759219636), 280 pages.
Articles connexes
- Bactéries auxiliaires de la mycorhization (en)
- Champignon
- Lichen
- Mycélium
- Anastomose racinaire
- Liste de genres de plantes mycohétérotrophes
- Réseau mycorhizien
- Symbiose
- Symbiose entre champignon et racines d'une plante (fabacée) pour l'absorption de l'azote
- Interactions durables
- Glomaline
- Mycorhizes et changement climatique
- Nodosité
- Rhizomorphe
- Actinorhize
Liens externes
- [vidéo] Sur l'importance des mycorhizes
- Site dédié aux Interactions Arbres-Microorganismes (en anglais), INRA de Nancy
- International Mycorrhiza Society
- Marc-André Selosse, recherches sur l’interaction mycorhizienne (Université de Montpellier II)
- Silvio Gianinazzi et Janie Bouvet, « Les mycorhizes : Une union harmonieuse pour la production végétale », jardins de France, no 622, (lire en ligne).