Maladie débilitante chronique
La maladie débilitante chronique (MDC) ou encéphalopathie des cervidés (EC), appelée CWD ou chronic wasting disease en anglais, est une « encéphalopathie spongiforme transmissible », émergente (voire ré-émergente[1]), la seule connue au sein de la faune sauvage[2] qui s'est, en quelques décennies, étendue à trois continents, uniquement chez les cervidés. Fatale (sans remède connu), elle est proche de la maladie de la vache folle (ou ESB) et de la maladie de Creutzfeldt-Jakob chez l'Homme, et plus encore de la tremblante du mouton[3], mais qui n'affecte que les cervidés (cerfs, wapitis et élans…)[3]. Le risque d'une transmission à l'Homme ne peut être exclu (in vitro, sept expériences ont prouvé que les prions « MDC » peuvent transformer le prion humain en une forme anormale, mal repliée)[4].
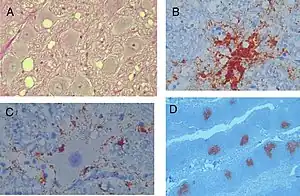
(A) coupe histologique de lésions typiques de l'encéphalopathie des cervidés dans le noyau moteur dorsal du nerf vague, dans le bulbe (medulla oblongata) d'un cerf malade. Noter les modifications spongiformes, les vacuoles intraneuronales, et une gliose modérée (coloration à l'hématoxyline et éosine, grossissement 1.003 x).
(B) dépôt amyloïde PrP coloré par immuno-histochimie (brun) et entourées de vacuoles (grossissement 1803 x).
(C) Dépôts Périneuronaux et extracellulaires de prions anormaux (PrPCWD, analogue à la PrPSc) chez un cerf malade de la MDC (grossissement original de 1803x).
(D) Dépôts de prions dans les centres germinatifs des follicules lymphoïdes dans les amygdales d'un cerf (immunohistochimie, grossissement 503x)


La MDC se transmet d’un animal à l’autre via les fèces, l'urine ou la salive, avec un prion très résistant à des facteurs environnementaux (froid, chaleur, sécheresse...) et physiologiques (biodégradation, digestion par les animaux infectés). Du fait de ces résistances, un pâturage infecté par un animal malade ou un cadavre pourrait rester infectieux durant de nombreuses années. En Amérique du Nord, la maladie semble se propager par les mouvements naturels de cerfs sauvages (connus pour parcourir de grandes distances) mais aussi par le déplacement de cervidés d’élevage ou de matériaux infectés.
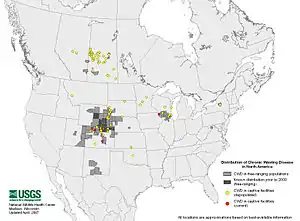
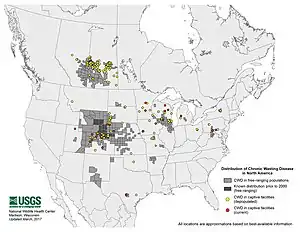
- En Amérique, en 2017 la maladie est présente dans 24 états américains et 2 provinces canadiennes.
- En Europe de premiers cas ont été en 2016 identifiés en Suède et Norvège chez des rennes et caribous[6]. Ceci alarme les écologues et écoépidémiologistes car cette émergence en Europe offre à la MDC le potentiel d’un immense nouveau territoire (l’Eurasie) et la possibilité de contaminer plusieurs nouvelles espèces d'ongulés (l’Eurasie offre dans le monde la plus grande diversité d'espèces de cervidés/ongulés, dont des espèces vulnérables comme les Barasingha en Inde). La maladie pourrait potentiellement fortement réduire les populations de cervidés et générer des impacts cynégétiques, socio-économiques et écologiques majeurs. Bloquer sa propagation en Europe pourrait nécessiter un effort de bonne gestion durant des années ou décennies, et à échelle internationale, car les cerfs sauvages ne connaissent pas les frontières des pays. Certains auteurs se demandent si la bataille pour épargner l’Europe n’est pas déjà perdue[7]. En 2017 le 1er cas au monde ayant touché un cerf élaphe survient dans l’ouest de la Norvège[8].
Histoire
Cette maladie semble récente et apparue en Amérique du Nord, aux États-Unis plus précisément, avant d'être introduite au Canada via des échanges commerciaux ou par contacts directs, et par contagion entre des cervidés sauvages et d'élevages. L'histoire de la MDC est encore mal cernée et incomplètement comprise.
Durant la décennie 1967-1979 des symptômes cliniques inhabituels et alors inexpliqués sont d'abord signalés (et étudiés) chez 53 cervidés (Odocoileus hemionus hemionus) captifs[9], dans le Colorado puis dans le Wyoming[9]. Les premiers cas repérés l'ont été dans 5 établissements de recherche (du Colorado et du Wyoming), chez deux espèces de cervidés détenues par ces établissements[10] (situés près des villes de Wheatland, Fort Collins, Kremmling et Meeker[10]).
Les symptômes étaient une altérations du comportement, avec perte de poids progressive et un état évoluant vers la mort en 2 semaines à 18 mois[9], les autopsies conduites révélant dans tous ces cas une encéphalopathie spongiforme (ES) proche de la scrapie du mouton.
Les analyses de quelques-uns de ces premiers cas n'ont pas révélé d'infections bactériennes ni virales significatives[9], ni d'intoxication par le sélénium, plomb, cuivre, mercure ou molybdène[9].
En 1978, la maladie est formellement identifiée par le Dr. Beth Williams comme encéphalopathie spécifique.
En 1981 la maladie est observée dans la nature dans le Colorado chez 3 espèces différentes (dans les mêmes régions que celles où les premiers cas ont été détectés chez des animaux d'élevage [10]). Elle l'est ensuite (en 1985) chez des cervidés du Wyoming. La MDC est classée parmi les maladies dites « émergentes »[1]. Elle semble alors différer à la fois de la tremblante du mouton, et de l'encéphalopathie spongiforme bovine (ESB), en ce qu'elle est initialement apparue chez des espèces non-domestiques et sauvages.
La MDC apparait cependant peu à peu plus proche de la tremblante du mouton[3] (dont par une distribution généralisée et précoce de protéines prion (PRPD) dans les tissus lymphoïdes (ce n'est pas le cas chez les bovins), et ensuite par la participation du système nerveux central (SNC) et de tissus périphériques à la maladie (y compris des tissus excrétoires chez les cervidés[11]). « Cette distribution contribue probablement à l'apparente efficacité de la transmission horizontale. Et en cela, elle est similaire à la tremblante et diffère de l'ESB[12]. »
La maladie est aussi identifiée comme cause de mortalité de cervidés dans des fermes qui élèvent des espèces-gibier (« game farms »), et dans plusieurs zoos ou jardins zoologiques américains (Williams and Young 1992)[13].
Ce prion pathogène s'est assez rapidement répandu (au milieu des années 1990) au nord (Canada) dans une population sauvage de cerfs de la Saskatchewan, alors que plus au sud la maladie s’étendait à une dizaine d’États des États-Unis. La situation préoccupe d'autant plus les épidémiologues qu'il n’y a pas en Amérique du Nord, comme en Europe de barrières naturelles montagneuses susceptibles de bloquer la diffusion vers le nord ou vers le sud de la MDC.
En 2001 la MDC est détectée au sein de troupeaux sauvages de cervidés du Dakota du Sud et dans un troupeau captif au Nebraska[14].
En 2004, un groupe d’experts canadiens estimait que cette maladie devait devenir une priorité pour les gestionnaires publics et privés des cervidés en liberté en Amérique du Nord, qu’elle justifiait un gros effort de recherche et de suivi.
En 2008, une seule souche de prion de la MDC est scientifiquement décrite, mais au moins 3 études suggèrent la possibilité qu'il existe d'autres variants du prion mis en cause[1], ce qui sera clairement confirmé en 2012 par Matthew R. Perrott & al.[15].
Dans la première décennie du XXIe siècle la maladie s'étend rapidement au Minnesota, au Wisconsin, au Nouveau-Mexique, à l'Utah, à l'Illinois, au Kansas, à la Virginie, au Dakota du Nord, à l'Iowa, à la Pennsylvanie et au Texas (en 2012) puis finalement à l'Ohio en 2014[14].
En 2015, le Michigan confirme son premier cas de MDC chez le cerf sauvage[14]. 21 États américains et 2 provinces canadiennes sont touchés[14], et toutes les espèces de cervidés semblent pouvoir être victime de ce prion.
En 2016, un prion identique ou très semblable est détecté pour la première fois en Europe ; chez des rennes et des élans d'Europe du Nord[6].
Dans les années 2000-2010, des outils et stratégies de détection, de contrôle et de prévention ont été développés, dont dans les zoos et élevages, mais qui semblent encore insuffisants pour éradiquer la maladie[1].
Historique de la prévalence
La maladie semble apparaître aux États-Unis dans les années 1980 (ou avant, mais sans avoir été détectée), puis elle s'est étendue dans une grande partie de l'Amérique du Nord dont chez les animaux d'élevage, devenant l'une des trois EST affectant les ruminants domestiqués d'Amérique du Nord[1].
Au Canada, la MDC a été identifiée dans l'ouest du pays en 1996, d'abord chez les cervidés d'élevage, puis en 2000 chez les cerfs en liberté en Saskatchewan.
Élevage
Un programme américain de surveillance épidémiologique des cervidés d'élevage a suivi les premières preuves d'existence de la maladie. Il a permis d'identifier (de 2000 à 2004) 40 élevages touchés par la maladie en Saskatchewan et 3 en Alberta, mais la MDC pourrait avoir été présente dans les élevages dès la fin des années 1980 en Saskatchewan à la suite de l'importation d'élans infectés du Dakota du Sud.
Tous les animaux malades ont été tués et éliminés dans les élevages, ce qui semble avoir bloqué la contamination dans les élevages, mais la maladie s'est étendue dans la faune sauvage (et si les autorités nord-américaines insistent sur le fait qu’on n'a pas de preuves que ce prion puisse infecter l’Homme, un doute subsiste étant donné une relative proximité de ce prion avec celui de la vache folle.
De plus, des cerfs sauvages malades, ou peut-être des prions stockés dans le sol, pourraient peut-être recontaminer des élevages et menacer leur viabilité à long terme. La MDC ne semblerait pas (facilement ?) transmissible au bétail ou aux bisons (sous réserve de confirmation scientifique à venir).
Faune sauvage
Au Canada, en 2004, la MDC chez les cervidés en liberté semblait limitée à 3 foyers géographiques distincts en Saskatchewan, mais la faiblesse des contrôles ne permettait pas de garantir que le reste du pays était épargné.
Aux États-Unis, on a d'abord cru l'extension de la MDC concentrée géographiquement au Colorado et du Wyoming, mais une surveillance accrue a dévoilé dans les années 2000-2010 plusieurs poches supplémentaires d'encéphalopathie des cervidés infectant des cerfs et wapitis, dans la nature et dans des élevages commerciaux de « wapitis des Rocheuses » (Cervus elaphus nelsoni), puis dans de nombreuses forêts ou élevages des plaines et des montagnes Rocheuses dans l'ouest du piémont en Amérique du Nord[2] et enfin dans 12 états supplémentaires (par rapport aux premières données), et dans 2 provinces canadiennes[1].
En Europe en quelques mois en 2016, trois premiers cas ont été identifiés (un renne et deux élans[16] - [17]).
Puis en 2019, un article a signale le 1er cas mondial de la maladie chez un cerf élaphe[8]. Il s'agit d'une femelle adulte estimée âgée de 16 ans, abattue par un chasseur en octobre 2017 dans la municipalité de Gjemnes (dans l’ouest de la Norvège, près de la mer)[8].
L’animal a été dépecé sur le terrain et la tête et la carcasse ont été livrés à un abattoir de gibier. Cet abattoir a envoyé un échantillon de moelle épinière pour analyse à l'Institut vétérinaire norvégien d’Oslo (Norvège) dans le cadre du programme norvégien de surveillance de la CWD. Un premier test (TeSeE Short Assay Protocol : SAP) a détecté le prion pathogène de la WCD dans l'échantillon. La présence du prion a été confirmée par un dosage immuno-enzymatique (ELISA)[8], des analyses moléculaires devant ensuite préciser s’il s’agit ou non du même prion que celui déjà trouvé dans la population norvégienne d’élans[8] (chez lequel la souche de prion a été en 2018 qualifiée de CWD atypique et baptisée Nor16CWD[18].
Taxons touchés
En 2016, au moins cinq espèces appartenant à trois genres différents étaient touchées[1], en 2019 7 espèces avaient été détectées porteuses de la maladie :
- Odocoileus hemionus (cerf hémione)[12] ;
- Odocoileus virginianus (cerf de Virginie)[12] ;
- Cervus elaphus nelsoni[12] ;
- Cervus elaphus [8] ;
- Alces americanus (orignal) en Amérique du Nord[19],
- Alces alces (élan) en Europe (deux premiers cas en Norvège en )[17] ;
- Rangifer tarandus (renne), en Norvège en [16].
Clinique
Les caractéristiques cliniques de la maladie et celles des lésions induites par cette « encéphalopathie des cervidés » sont qualitativement semblables à des EST touchant d'autres espèces animales.
Après une période d'incubation variable, mais longue, le microscope révèle des lésions « spongiformes » dans le système nerveux central (SNC). Durant l'incubation, le prion ((PrPd)) peuvent maintenant être identifiés dans les tissus par des tests de diagnostic pour les prions des animaux d'élevage. Ces tests basés sur un dosage immunologique dépendant de la conformation des prions, mesurent simultanément la liaison d'anticorps spécifique aux formes dénaturées et native de la protéine prion (PrP)[20]. Grâce à ces tests, les cervidés d'élevages trouvés porteurs de prions pathogènes peuvent être abattus et éliminés de la chaîne alimentaire (cette méthode a fait ses preuves dans le cas de la vache folle au Royaume-Uni).
Contagion
La contagion est « horizontale » (c'est-à-dire d'individus à individus et non verticale ; des parents aux descendants). Elle se fait par un ou des mécanisme(s) encore inconnu(s) ou incertains. Une diffusion rapide chez les animaux sauvage pose un véritable « défi[21] » écoépidémiologique aux chasseurs, aux vétérinaires et à la conservation de la nature notamment car les signes cliniques sont discret durant une grande partie de l'évolution de la maladie, et les outils de diagnostic ante-mortem (avant la mort) sont limités, surtout pour le suivi d'animaux sauvages en liberté. De plus, les écoépidémiologistes manquent souvent d'informations sur les antécédents des animaux et les facteurs de risque auxquels ils ont pu être exposés.
Selon les données disponibles :
- cette encéphalopathie est transmissible par inoculation intracérébrale à des bovins, des moutons et des chèvres, mais aucune étude n'a pu démontrer que les animaux domestiques y seraient vulnérables via l'exposition orale[12]. La voie orale est l'une des voies présumées naturelles d'exposition aux EST, supposée la plus probable chez les cervidés[12] ;
- les prions présents dans les liquides corporels (sang, urine, salive, sperme, lymphe…) sont susceptibles de jouer un rôle dans la contagion (notamment en situation d'élevage favorisant la promiscuité[22] - [23] - [24]). Une expérience a consisté à exposer des cohortes de cervidés non contaminés (naïfs) à de la salive, du sang ou de l'urine et des fèces de cerfs atteint d'encéphalopathie. Les auteurs ont montré que des prions infectieux pouvaient transmettre la MDC dans la salive (par voie orale) et dans le sang (par transfusion) ; données qui aident à expliquer la transmission de la MDC chez les cervidés et qui invitent à être prudent en matière de contacts avec les fluides corporels d'animaux victimes ou potentiellement victimes d'infections à prions[19] - [24]. L'éthologie pourrait aussi éclairer l'étude des risques de contacts entre animaux ou d'animaux avec l'urine d'animaux malades ;
- le polymorphisme génétique des gènes impliqués dans la production de prions pourrait influencer la susceptibilité des individus à la MDC, en particulier au niveau du codon 225 (S/F) chez le cerf et le codon 132 (M/L) chez les wapitis[21]. En Europe, une prédisposition génétique semble également détectée chez les rennes sauvages[25]
- La veille sanitaire concernant la MDC se poursuit chez les cervidés nord-américains, tant en captivité qu'en liberté, de concert avec les suivis et études similaires sur la tremblante et l'ESB[12] pour notamment mieux en comprendre la contagion.
On a montré en 2020 (sur le Cerf de Virginie) que la recherche de prion par tests RT-QuIC (Real-time quaking-induced conversion, mis au point chez l'Homme pour détecter la maladie Creutzfeldt-Jakob) sur des excréments échantillonnés dans un paysage permettent d'évaluer la prévalence de la maladie, même quand aucun cas n'a été détecté[26]
Origine de la MDC
Chez les cerfs et les élans, l'origine du prion reste inconnue.
La maladie préexistait-elle discrètement chez les espèces nord-américaines indigènes de cervidés ? S'agit-il d'une nouvelle manifestation d'un prion présent chez une autre espèce (par exemple la tremblante du mouton) ? Les chercheurs ne peuvent apporter de réponse certaine, mais la distribution localisée et en extension, et la prédominance connue de la MDC au Canada et aux États-Unis suggèrent que la maladie est récente chez les cervidés sauvages et qu'elle ne pré-existait pas dans les écosystèmes indigènes. Elle semble être apparue au centre des États-Unis.
- Divers auteurs et la presse ont montré que des « compléments alimentaires » fabriqués à partir de déchets animaux (dont des déchets à risque), ont été largement distribués en forêt ou dans des élevages aux États-Unis, notamment pour produire de plus beaux trophées de chasse. La maladie semble être apparue à proximité d'un centre d'étude travaillant justement sur l'alimentation des animaux sauvages.
- Huit universitaires américains ont présenté en 2007 une autre hypothèse[27], appuyée sur des indices moléculaires[28] et sérologiques[29] : ces prions (et d'autres) pourraient provenir de petites bactéries parasites encore assez mal connues (Spiroplasmes) pour les encéphalopathies spongiformes transmissibles (EST). Des inclusions de ces bactéries avaient été notées dans les cerveaux malades dès la fin des années 1970[30], confirmées en 1981[31] et considérées en 2005 comme un agent causal possible[32]. Une expérience a conclu que Spiroplasma mirum isolée dans une tique de lapin a induit expérimentalement une encéphalopathie spongiforme chez des rongeurs. Puis, inoculée par voie intracrânienne (IC) chez des ruminants (cerf), la même bactérie semble avoir induit le tableau clinique d'une MDC (après 1,5 à 5,5 mois d'incubation). Des cerfs, mais aussi des moutons et des chèvres, inoculés avec S. mirum ont développé une encéphalopathie spongiforme, et d'une manière dose-dépendante.
Une seconde expérience a utilisé des spiroplasmes étroitement liés à S. mirum, cette fois isolés dans des cerveaux d'animaux victimes d'une encéphalopathie spongiforme (cultivés dans des œufs embryonnés). Les espèces de spiroplasmes provenant de la scrapie du mouton ont induit chez les cervidés (à la suite de leur inoculation dans le cerveau) une encéphalopathie spongiforme ressemblant fortement à celle qui est observée chez ces animaux. Les auteurs notent que des spiroplasmes ont été dans ces cas constamment associés à la maladie et capables expérimentalement de provoquer chez des ruminants une MDC ou l'équivalent d'une MDC dans le modèle animal expérimental, ce qui remet en cause la validité des études qui avaient conclu que le prion était l'unique agent causal de la maladie.
Pour le Canada
La modélisation éco-épidémio-géographique suggère au moins deux événements-sources de contamination des populations sauvages.
- Un élevage infecté a presque certainement été la source pour le premier cas, et semble la source la plus probable pour l'autre.
- Des études rétrospectives et épidémiologiques laissent penser que des cerfs infectés par un prion pathogène ont probablement été importés au Canada à partir des États-Unis, et au moins 2 fois depuis 30 ans.
- D'autres introductions plus tardives sont également plausibles (1re apparition dans un zoo de l'Ontario (années 1970), 2e cas dans les années 1980 (ou plus tôt) dans au moins un élevage de la Saskatchewan avec des élans infectés importés, par diffusion dans l'aire d'élevage).
- Des experts suspectent que les animaux sauvages de la Saskatchewan ont probablement été contaminés par des prions provenant des élevages infectés (animaux échappés, contacts avec cerfs sauvages… ?).
Données écoépidémiologiques
En 2006, 14 états et 2 provinces canadiennes étaient reconnus touchés par la maladie en Amérique du Nord.
À ce jour le prion pathogène n'a pas fait disparaitre de populations entières de cervidés, mais dans les zones de forte prévalence il en diminue significativement la démographie. Ainsi selon l'État du Michigan, dans le « Wyoming’s South Converse Unit » (record de prévalence au sein des animaux sauvages avec environ 50 % environ des animaux sont touchés) la maladie a divisé par deux le nombre d'individus en une décennie (19 % de la population totale mourant chaque année à la suite de l'encéphalopathie induite)[33].
Le risque de mortalité par collision avec véhicule, prédation, action de chasse ou autre maladie est également exacerbé par la maladie, l'animal malade étant de moins en moins vigilant et capable de fuir ou de se défendre[33].
Aucun phénomène d'immunisation contre ce prion n'est apparu en 40 ans alors que la seconde menace sanitaire pour les cervidés (virus EHD) induit une immunisation des troupeaux en quelques années[33]. Aucun cas de guérison n'a jamais été découvert. Certains individus semblent plus résistants, mais ils survivent simplement plus longtemps avant de succomber, ce qui leur permet de disperser des prions plus longtemps que ceux qui meurent plus vite[33].
En 2016, cette maladie est devenue la seconde cause de mortalité du cerf dans le Wyoming, et d'autres sources de mortalités (accident/prédation) pourraient en partie être exacerbées par la maladie qui y prédispose.
Contagion entre animaux
La transmission horizontale (de cerf à cerf) est avérée. Dans les années 2000 on a montré une participation précoce des tissus lymphoïdes du tube digestif durant l'incubation de la MDC ; et divers indices laissaient penser que les selles ou la salive pouvaient participer à la contagion[2]. En 2006, le Dr Edward A. Hoover[34] alerte sur le fait que des cerfs semblent pouvoir assez facilement s'infecter par contact avec du sang ou de la salive d'un cerf infecté, alors que le toilettage, léchage et contact avec le pelage jouent un rôle majeur dans les interactions sociales entre les cerfs, entre les wapitis et chez de nombreuses autres espèces de mammifères. Ces comportements sont accompagnés par des échanges salivaires ;
- un cerf peut se contaminer par ingestion d'un aliment contaminé par des prions pathogènes ;
- chez les animaux infectés, on a confirmé (dès 2006) que le prion pathogène est bien présent dans les excréments et dans la salive[35] (bien avant que les symptômes apparaissent)[26] ;
Même de faibles doses de prions dans la salive peuvent être contaminantes[36] ; - le prion est aussi présent dans le sang du velours qui recouvre les corps des cervidés, ce qui pose la question d'une possible transmission par des insectes suceurs de sang (tiques, taons notamment) ou via les relations sociales entre animaux[35] (combats entre mâles notamment, ou léchage de blessures acquises par balles, ou lors de la fuite devant l'homme en saison de chasse) ;
- les données disponibles en 2006 suggèrent que, contrairement à ce qu'on a souvent affirmé antérieurement, aucun tissu issu d'un animal infecté ne peut être considéré comme indemne de prions pathogènes[35] ;
- des tests ont été faits sur divers organes et le sang, la salive, les selles et l'urine de cerfs infectés pour mieux comprendre comment la maladie se transmet ; ils montrent que des prions infectieux sont présents dans les amygdales des animaux dès trois mois après inoculation via la salive ou le sang d'un cerf infecté[35] ;
- une dentition en mauvais état ou une abrasion (même mineure[37]) des muqueuses nasales ou buccales sont aussi une source d'inoculation et de transmission de la maladie, chez le cerf, et peut-être chez d'autres espèces[37] ;
- les données provenant du suivi des élevages contaminés indiquent que des cerfs peuvent spontanément s'infecter à partir d'un environnement très contaminé ;
- ces données laissent penser que la promiscuité (élevages, hardes denses autour des points d'eau ou de nourrissage…) renforcent le risque de transmission ;
- l'agrainage et le nourrissage causent des concentrations artificielles d'animaux favorisant l'extension de la maladie (ainsi que d'autres maladies ou parasites) ;
- en 2005, une publication confirme la présence de protéines prions résistantes aux protéases dans la muqueuse buccale, les papilles, l'épithélium lingual, l'organe voméronasal, et la muqueuse olfactive de hamsters infectés par l'encéphalopathie transmissible du vison[24], mais aussi chez des furets infectés par le prion de la MDC des cervidés[38] ;
- Au début des années 2000, les études épidémiologiques commencent à permettre de proposer des modèles explicatifs de l'histoire de la MDC ou au moins de sa dispersion[2].
Dose infectieuse minimale
Selon Denkers & al. (2020) « une exposition orale à aussi peu que 300 nanogrammes (ng) de cerveau CWD-positif ou à la salive contenant une activité d'ensemencement équivalente à 300 ng de cerveau CWD-positif, était suffisante pour transmettre la maladie CWD. Ceci a été vrai que l'inoculum soit administré en un seul bolus, ou divisé en trois expositions hebdomadaires de 100 ng. Mais quand la dose totale de 300 ng a été répartie en 10 doses de 30 ng administrées sur 12 semaines, aucune infection ne s'est produite. Alors que les expositions à faible dose aux prions d'origine cérébrale ou salivaire ont prolongé le délai entre l'inoculation et la première détection de l'infection, une fois l'infection établie, nous n'avons observé aucune différence dans la pathogenèse de la maladie »[39].
La dose infectieuse minimale pourrait être d'environ 100 à 300 ng de cerveau positif pour la MDC (ou équivalent salivaire). L'infection semble plutôt dépendre d'un seuil que d'une dose cumulée[39].
Dispersion du prion


Le prion étant très résistant, il persiste dans les sols "infectés" par l'urine, les excréments, la salive ou les cadavres de cervidés malades. On ignore dans quelle mesure des transferts de sol par l'homme ou via l'érosion des sols peuvent contribuer à la dispersion de prions pathogènes dans l'environnement, mais on a montré en 2014/2015 que les plantes pourraient jouer un rôle en captant des prions pouvant ensuite être consommés par des cervidés :
- Les plantes et leurs champignons symbiotes des végétaux pouvant absorber de grandes particules organiques, dont des protéines entières. Des universitaires ont cherché si certaines plantes pouvaient absorber le prion de la MDC, et éventuellement le métaboliser. Une étude publiée en 2014 a conclu que des prions pathogènes de la MDC pouvaient se lier au système racinaire d'une graminée (après 24 h d'exposition), mais le prion n'a pas dans ce cas été détecté dans les feuilles ni d'autres tissus aériens, suggérant « que le blé était incapable de transporter suffisamment de protéine prion des racines à la tige pour être détectable par les méthodes employées (western blot, IDEXX ou kit diagnostic Bio-Rad) ». La plante utilisés pour l'expérience était le blé (Triticum aestivum L.)[42].
- Une autre étude a porté sur de possibles liaison ou phénomènes de rétention de la protéine prion infectieuse (PrP (Sc)) avec des plantes. Elle a montré que de petites quantités de prions présents dans un homogénat de cerveau dilué ou présents dans des excrétats (urines et excréments) peuvent se lier aux racines mais aussi aux feuilles de blé, et que ces prions sont infectieux : Des hamsters de type sauvage ont été expérimentalement efficacement infectés par l'ingestion de plantes ainsi contaminées par des prions[43].
- L'épandage des fumiers et lisiers issus d'élevage sur les champs et prairies ou comme engrais forestier est courant en Amérique du Nord. Des chercheurs ont montré que des feuilles de blé sur lesquelles on a pulvérisé une préparation contenant des prions ont ensuite présenté durant plusieurs semaines des prions à l'intérieur de leurs feuilles vivantes[43]. Les auteurs concluent que leurs résultats « démontrent que les plantes peuvent lier efficacement à des prions infectieux et agir comme relai infectieux, ce qui suggère un rôle possible dans la contamination environnementale par le prion et dans la transmission horizontale de la maladie »[43].
Les mammifères ou oiseaux nécrophages (et insectes ?) qui se nourrissent de cadavres d'animaux porteurs de prions pathogènes peuvent également contribuer à disperser des prions sur des distances significatives (ou importantes dans le cas des d'oiseaux nécrophages (vautours, corvidés[5]).
Il a été montré en 2013 que le corbeau américain (Corvus brachyrhynchos) est un agent possible de translocation des prions infectieux vers des zones non contaminées, via la dispersion par ses fientes[5]. On suspecte que ceci soit vrai aussi pour certains mammifères nécrophages[5].
Risque de contagion ou transmission vers l'Homme
En 2006, le risque de passage de la barrière de l'espèce, et en particulier de transmission à l'Homme a été jugé « extrêmement faible ». À cette date, aucun cas de transmission du cerf à l'Humain n'avait jamais été détecté[35].
De manière générale, l'infectivité des prions humains, bovins ou ovins est encore mal comprise, mais on sait qu'elle dépend de plusieurs facteurs, dont le type de prion, la souche, la voie d'infection et d'autres facteurs spécifiques à l'hôte[44].
Néanmoins, l'OMS (organisation mondiale de la santé) et d'autres agences gouvernementales de santé ont d'abord recommandé que tous les animaux infectés par un prion pathogène ne soient pas consommés par des humains, et il est maintenant recommandé d'éviter tout contact avec des fluides corporels contenant des prions pathogènes (y compris d'autres infections à prions). De plus, selon le Dr Hoover, les données publiées en 2006[35] devraient « faire reconsidérer le rôle potentiel des insectes se nourrissant de sang comme les moustiques et les tiques dans la transmission de l'encéphalopathie des cervidés ou d'autres infections à prions »[35].
Dix ans plus tard, et alors que les aspects moléculaires de la transmission des prions commencent à être mieux compris[45] ; pour mieux évaluer le risque de transmission à l'Homme, une méta-étude publiée en 2017[46] s'est basée sur 23 études retenues (parmi 78 sélectionnées à partir de 800 citations scientifiques) pour leur qualité scientifique. Ces études ont examiné une possible transmission des prions de la MDC à l'Homme humains en utilisant des bases épidémiologique, des expériences in vitro et/ou in vivo.
Cinq études épidémiologiques, deux études sur les macaques (génétiquement plus proche de l'homme que le singe écureuil qui est le singe de laboratoire le plus utilisé) et sept études sur des souris humanisées transgéniques n'ont fourni aucune preuve de possibilité de transmission des prions de la maladie animale à l'homme[47] - [48] - [49] (mais le suivi n'a pas duré plus de 10ans, et le délai d'incubation pourrait être plus long). La surveillance épidémiologique, telle qu'effectuée depuis plus de 10 ans aux États-Unis et au Canada n'a pas non plus documenté une telle transmission (mais la maladie peut chez l'homme facilement être confondue avec la maladie de Creutzfeldt-Jakob).
Deux études en laboratoire, utilisant le singe écureuil (Saïmiri commun) comme modèle animal (infecté par voie orale ou par voie intracérébrale) ont dans les deux cas fourni des preuves de transmission du prion de la MDC au singe. Les auteurs ont noté que l'incubation a été chez le singe-écureuil plus longue avec ce prion MDC que lors d'infections expérimentale par des prions venant du vison, du mouton, de la vache ou de l'humain). Et sept expériences in vitro ont aussi fourni des preuves que les prions « MDC » peuvent convertir la protéine prion humaine en une forme anormale, mal repliée.
Une autre étude (modèle in vitro d'exposition orale) s'est intéressée aux bases moléculaires de l'infection par le prion de la MDC ; en créant un modèle in vitro à partir de lignées de cellules entérocytes de cinq espèces (dont l'humain[50]). On sait que les récepteurs LRP/LR de la laminine sont aussi des récepteurs de protéines prions ; cette étude a montré que la surface cellulaire des entérocytes humains présente des niveaux élevés de récepteurs LRP/LR et il a été montré que expérimentalement les prions MDC s'associent effectivement aux récepteurs LRP/LR sur la surface de la cellule[51]. Ces données laissent penser qu'une transmission orale des prions MDC à l'homme est possible, sauf s'il existe des barrières intestinales non encore découverte.
La transmission de la MDC aux humains ne peut donc pas être entièrement exclue sur la base des études disponibles, en particulier à la lumière des périodes d'incubation possibles (décennies pour les prions de la vache folle chez l'homme). Les auteurs de cette étude recommande de poursuivre la recherche et la surveillance épidémiologique de la MDC, et de faire preuve de prudence en manipulant tout matériel biologique potentiellement contaminé (gibier notamment) et de continuer à explore une gestion de cette maladie chez la faune sauvage et d'élevage (cervidés dont élan et renne).
En 2018 une revue d'études a fait le bilan de l'état des connaissances sur la base de 14 études présentant des critères élevés de sérieux (critères de la Collaboration Cochrane). Les auteurs ont conclu que depuis l'apparition de la zoonose, cinq études épidémiologiques, deux études sur les macaques et sept ayant utilisé des souris transgéniques humanisées n'ont pas apporté de preuve d'une transmission à l'homme du prion de la MDC, pas plus que la surveillance médicale aux États-Unis et au Canada, cependant « deux études (sur des singes écureuils) ont prouvé que la transmission des prions de la MDC entraînant une maladie à prion était possible chez ces singes dans des conditions expérimentales et sept expériences in vitro ont montré que les prions de la MDC peuvent convertir la protéine prion humaine en un état mal replié. Par conséquent, la découverte future de la transmission de la MDC à l'homme ne peut pas être entièrement exclue sur la base des études en cours, en particulier à la lumière d'éventuelles périodes d'incubation longue de prions de la MDC chez l'homme. Il serait prudent de poursuivre la recherche sur la MDC et la surveillance épidémiologique, et de faire preuve de prudence lors de la manipulation de matériel potentiellement contaminé, et d'explorer les possibilités de gestion de la MDC »[4].
En 2020, après la découverte de phénotypes pathologiques différents de prions, selon l'EFSA : les données disponibles ne permettent pas encore de conclure « sur les implications de la diversité des souches sur la transmissibilité, la pathogenèse ou la prévalence. Les données disponibles ne permettent pas de conclure sur le potentiel zoonotique des isolats NA ou européens de CWD. Le risque d'encéphalopathie des cervidés pour l'homme lié à la consommation de viande ne peut pas être directement évalué »[52].
Actions de lutte contre la maladie et de gestion
Recherche
Beaucoup d'inconnues persistent malgré un effort important de recherche entamé dans les années 1990. (le , le moteur de recherche de donnait 21 125 articles pour l'item "Chronic Wasting Disease"). Les tests diagnostiques ont été améliorés, permettant un diagnostic précoce avant l'apparition des symptômes cliniques. Des protocoles de suivi ont été élaborés et mis en place par les agences américaines de gestion de la faune sauvage (pour les cerfs et les wapitis) et par des agences étatiques et fédérales pour l'élevage privé de wapitis. Dans les années 1990, la perception des EST a radicalement évolué, avec comme conséquence un objectif d'éradication mondiale de toutes les maladies à prions en cours de discussion[2].
On n'a néanmoins pas encore répondu à la question Pourquoi et comment cette maladie est apparue et s'est répandue si vite.
Lutte contre la maladie
L'éradication de la maladie en Amérique du Nord est l'objectif de l'État central et de plusieurs États américains, de certains représentants des groupes de chasseurs ou de l'industrie.
Mais selon des experts tels que E. S. Williams (Département des sciences vétérinaires de l'Université du Wyoming) ; « l'éradication de l'encéphalopathie des cervidés en liberté à partir des populations de cervidés est peu probable avec les modes actuels de gestion »[12] notamment parce que le prion est très résistant et qu'il se conserve dans les sols durant des années (voire décennies) faisant que la maladie peut ensuite réapparaitre.
De plus, les densités en deçà desquelles le risque de diffusion du prion serait faible et la largeur des zones tampons nécessaires sont encore largement inconnues. Et, dans des forêts de plus en plus fragmentées, diminuer le « pool génétique » des cervidés en les tuant par dizaines de milliers peut aussi présenter d'autres inconvénients sanitaires et aboutir à un goulot d'étranglement génétique et à la consanguinité.
Certains États ont néanmoins fait le pari qu'en éradiquant les cervidés des zones touchées, le risque de futures épidémies diminuera fortement. Ainsi en 2017 l'État de New York et celui du Minnesota semblent avoir « apparemment supprimé tous les animaux vivants avec MDC, empêchant ainsi toute accumulation supplémentaire de prions dans l'environnement (...) Ces deux États ont eu la chance de détecter la maladie au début et ont apparemment éliminé tous les animaux porteurs du prion du paysage sans détecter aucun cas positif supplémentaire après leurs détections initiales. »[33]. Des experts ont recommandé une chasse intensive et ciblant les cervidés durant 10 ans au moins pour diminuer les densités de cerfs à moins d'1 animal/km² et bloquer l'extension du prion. Certains de ces mêmes experts voulaient éliminer 100 % des cervidés dans les zones contaminées, mais les expériences faites n’ont pas été concluantes (notamment parce que pour des raisons psychologiques, les chasseurs se montrent moins enclins à tuer une grande quantité de cerfs s'ils savent qu'ils sont malades.
Une autre option est de diminuer la promiscuité des cervidés, afin de réduire le risque de transmission de la MDC, notamment et par exemple autour des sites d'agrainage, des tas de foin, des blocs de sel, et sources artificielles d'eau. Dans des secteurs jugés à haut risque c'est l'un des axes de la lutte contre la maladie.
Mobilisation de tireurs d'élite
Dans certaines zones (autour de régions connues pour être infectées) des tireurs d'élite (sharpshooters) ont pour mission de tuer tous les cerfs.
Ce moyen est controversé, notamment car les cervidés sont territoriaux et que chaque territoire libéré par mais jugé nécessaire par certains états (Illinois, puis Michigan) et semble avoir pu ralentir la propagation de la maladie (En 2014-2015, 7 902 cervidés avaient été testés pour MDC, dont seuls 1 393 provenaient de l'effort de dépistage (soit 18 %) alors que 35 % du total des animaux tués étaient positif au test[33]. Dans le Michigan, en , les cerfs tués dans le cadre de l'effort de gestion/dépistage dans la zone de gestion de la MDC ne représentaient qu'environ 17 % de l'échantillon total (769 sur 4 558 animaux) mais ont contribué à 66 % des tests positifs totaux depuis la découverte initiale de la maladie dans cette zone à 2015[33]. Ils n'agissent pas sur l'ensemble de la zone de gestion de MDC mais uniquement dans les propriétés situées dans un rayon de 2 milles autour d'un point où un animal a déjà été découvert atteint de la maladie et avec autorisation signée des propriétaires fonciers, et sans tuer plus de cervidés que le nombre autorisé par le propriétaire[33].
Surveillance, veille et inspections des installations d'élevage
Dans le Wyomming (État parmi les plus touchés), l'Agence environnementale chargée du dossier[53] a construit un dispositif de surveillance de la maladie[54] et note que la propagation de la MDC vers de nouvelles aires se faisait généralement à partir d'aires contaminées proches. En 2015-2016, la propagation semble avoir été un peu plus rapide et touche dans un cas une nouvelle zone éloignée de zones déjà touchées (rivière Shoshone)[55].
Dans le Michigan le DNR avait testé en quelques années plus de 34 000 cerfs, 1,600 élans et 70 orignaux sans aucun cas détecté. Après la découverte des premiers cas, selon le Gouvernement de l'État, chaque élevage privé de cervidés a été inspecté s'il était situé dans un rayon de 15 milles autour d'un des cas positifs identifiés dans la faune sauvage « pour s'assurer que toutes les restrictions et règlements ont été respectés »[33].
Actions réglementaires
La réglementation des États touchés s'est durcie concernant le transport de cervidés vivant ou de cadavres de cervidés[33].
Le Wisconsin interdit aux chasseurs de cervidés de pratiquer la chasse à l'agrainage et à quiconque, d'utiliser les distributeurs automatiques de nourriture pour alimenter les cervidés sauvages. (Interdiction dans le sud du pays, et restrictions/réglementation dans le nord, dans le cadre des lois et mesures d'urgences de lutte contre la propagation de la MDC chez les animaux sauvages.
En fait la loi interdisait déjà d'offrir des aliments dans des récipients de plastique, de métal, de verre ou de bois, mais avant la découverte de la MDC dans le Wisconsin, qui a justifié la Loi 240 du Wisconsin (Wisconsin Act 240) en , il n'y avait pas de loi interdisant l'agrainage pour la vision récréationnelle ou des activités non liées à la chasse. L'agrainage et l'alimentation sont maintenant interdit dans 26 comtés du Wisconsin (presque tout le sud du pays). Dans les autres comtés où cela reste autorisé, on peut au maximum déposer 2 gallons (7,6 litres) de maïs ou aliments par emplacement pour chaque parcelle de 40 acres (16 ha) au moins si l'appât est au moins à 100 yards (91 mètres) d'autres emplacements d'amorce de chasse ou d'une chaussée où l'on roule à 45 mi/h (72 km/h) ou plus.
L'alimentation des cerfs communs n'est permise que lors de la période de chasse et un jour avant l'ouverture. Les spectateurs de la faune et les propriétaires de maisons occupées peuvent placer jusqu'à 2 gallons d'aliments pour attirer des cerfs communs pour le visionnement récréationnel à tout moment de l'année, mais à moins de 50 yards (46 m) d'un logement occupé et à plus de 100 yards (91 m) de n'importe quelle route à plus de 45 mi/h (72 km/h).
Les suppléments alimentaires sont interdits ou réglementés. Des règles générales additionnelles qui s'appliquent à l'utilisation d'amorce (ou aliments pour la chasse) ou non peuvent être trouvées sur le site Web de DNR. (avec un diaporama)
En 2016, en incluant les données récentes concernant les élevages de gibier des comtés de Oneida et Oconto, 43 des 72 comtés de l'État sont considérés comme « MDC-affectés » et tous les efforts faits pour développer un vaccin sont restés vains. Mais la maladie semble un peu mieux comprise, ce qui aidé l'agence à développer un nouveau plan de lutte contre la MDC (signé en )[56], prenant mieux en compte le risque de contamination via les sites d'alimentation du nord-ouest du Wyoming (publié 2016 pour être mis en consultation publique puis adopté). En 2016, la législation continue à imposer notamment un traitement particulier des cadavres et carcasses d'animaux tués à la chasse (et de leur transport, interdit ou assujetti à certaines conditions)[57]. Ce plan vise à réduire le nombre d'aires d'alimentation où les animaux peuvent se transmettre la maladie en partageant la nourriture ou par contact physique[55].
Recherche & prospective
La MDC est considérée comme émergente et en pleine expansion.
Des besoins importants de recherche persistent notamment concernant le domaine de la génétique des cervidés (la maladie semble se développer moins vite chez certains individus[58] et de la biologie moléculaire[59] - [60] ou sur les manières dont la maladie est perçue par divers parties prenantes (agriculteurs, chasseurs...)[61]. La recherche porte aussi sur le temps de survie de ce prion dans le sol ou dans les milieux aquatiques : il reste infectieux des mois ou années dans l'eau, y compris après un long traitement en station d'épuration[62]. Des travaux récents (thèse 2016) ont porté sur un nouveau test[63] (efficace et rapide, applicable aux excréments de cervidés plus facile à collecter et envoyer aux laboratoires que des échantillons de cerveaux, de sang ou d'urine)[63] et sur les risques de transmission aux caribous[63].
La recherche porte notamment sur la maladie, sa modélisation (à partir d'infections expérimentales de certains cervidés ; Odocoileus spp.) dans l'organisme, en particulier concernant le passage de l'infection initiale au stade de l'excrétion via le sang, l'urine, la salive et les fèces[64]. Chez ces espèces les tissus nerveux sont saturés en prion environ 20 mois après l'infection initiale, les fluides excrétés en contiennent de faibles niveaux durant toute l'infection, avec une quantité plus élevée dans la salive et les matières fécales (jusqu'à 10 fois la dose létale, soit 1,34 × 1029 prions) dans les 11 à 15 mois suivant l'infection, ce qui laisse penser que des tests permettraient de détecter ces prions dans les fluides corporels et sécrétions bien avant la mort de l'animal (diagnostic ante mortem)[64].
De même cherche-t-on à mieux comprendre la manière dont les prions restent ou non infectieux dans les écopaysages et si et alors comment des transmissions inter-espèces sont possibles (dont à des primates non humains et à la souris) en étudiant quels sont les déterminants d'une transmission de la MDC à d'autres espèces (un modèle ayant proposé en 2016 l'existence d'une barrière structurelle pour la transmission de la MDC à l'homme[65]).
L'excrétion fécale de prions infectieux commence des mois avant l'apparition des symptômes cliniques et se poursuit tout au long de l'évolution de la maladie. Quelques cycles de gel-dégel répétés diminuent peu à peu et significativement le caractère infectieux de ces prions, mais pas la dessiccation[26].
En 2004, les experts du panel canadien citant en exemple l’efficacité du programme fédéral contre la MDC dans les élevages demandaient un investissement au moins comparable pour la faune sauvage, avec la participation des gouvernements fédéraux et provinciaux, des chasseurs et des propriétaires fonciers car les tentatives de réduire des densités de cerfs en les chassant ont laissé une densité de cerfs suffisante aux États-Unis et dans l'ouest du Canada pour permettre à la MDC de continuer à se développer (en surface et en nombre d'animaux porteurs du prion pathogène).
De plus on ne sait pas encore si d’autres espèces peuvent ou ne peuvent pas jouer un rôle de réservoir et/ou de relais dans la contagion : l'infection des orignaux était confirmée expérimentalement en 2004, et le caribou pourrait y être sensible.
En 2019, une revue d'études scientifiques (review) conclut que « même si la MDC n'est pas connue pour affecter les humains, des incertitudes sur le comportement biologique des prions demeurent. Le risque pour les humains de contracter la MDC est classé comme très faible (très rare, mais ne pouvant être exclu) (…) des mesures pour éviter ou diminuer l'exposition des humains (par exemple, en évitant la consommation de viande provenant d'animaux infectés par la MDC) sont recommandées (VKM 2016). Une meilleure compréhension de l'occurrence et de la propagation de l'encéphalopathie des cervidés en Europe est nécessaire pour concevoir des stratégies de contrôle et de gestion. Par conséquent, la première étape et la plus urgente est une surveillance intensive avec des tests spécifiques pour la MDC »[66].
En Europe (3 premiers cas en avril-juin 2016 chez le renne et l'élan)
À l'apparition de la maladie de la vache folle, l’Europe a encouragé et mis en place un programme de surveillance des maladies à prion dans la faune sauvage (ex : suivi en place en Allemagne depuis 2005 au moins pour les cervidés)[67].
Depuis les années 2010, quelques cas de MDC ont été détectée en Europe chez trois espèces de cervidés, avec des souches norvégiennes de MDC distinctes de celles qui ont causé l'épidémie qui s'est rapidement étendue en Amérique du Nord. Les rennes et les orignaux norvégiens présentent en outre différentes souches de MDC, « révélant une variation sans précédent des souches de prions dans les populations de cervidés sauvages norvégiens. Ces résultats indiquent que les prions nord-américains de la MDC ne sont pas la cause immédiate des nouveaux cas norvégiens de MDC et ont des implications pour les stratégies de contrôle de la MDC en Europe, ainsi que pour la sécurité des humains »[68]. Pour l'EFSA, « les données disponibles n'étayent ni ne réfutent la conclusion selon laquelle la maladie débilitante chronique n'est pas répandue dans l'UE et n'excluent pas la possibilité que la maladie ait été présente en Europe avant la réalisation de l'enquête. Il semble plausible que la maladie débilitante chronique ait pu s'établir en Norvège il y a plus de dix ans »[69]. Selon Nono & al. (2020) il est devenu « nécessaire d'évaluer le potentiel zoonotique des nouvelles souches de MDC détectées en Europe »[68].
Histoire de la CWD en Europe
La Norvège a également un programme de suivi depuis 2005. Il n'avait rien mis en évidence jusqu'en 2015[70], peut-être en partie à cause du faible nombre d'échantillons analysés (ex : 19 mammifères sauvages pour l'année 2015)[70]. En 2015, une ESB atypique est notée dans un élevage de rennes (sur un total de 6780 échantillons analysés, prélevés dans 4323 troupeaux d'élevage[71] - [72].
En , un premier cas est signalé chez un renne sauvage (premier cas pour toute l'Europe chez les cervidés sauvages, et premier cas au monde pour un renne[73].
Un communiqué de l’Institut vétérinaire norvégien (Norwegian Veterinary Institute ou NVI) a confirmé le [74] la présence d’un cas de maladie à prion chez une femelle de renne sauvage (Rangifer tarandus tarandus) trouvé dans le sud du pays à Lærdal[17] lors d’une opération de capture de rennes que l’on voulait équiper de balises pour les suivre par satellite[74]. L'animal capturé était en mauvaise santé et est mort peu après. Ce cas a intéressé les responsables du programme norvégien de surveillance des maladies à prion chez les ongulés sauvages qui l'ont confirmé mi- à la fois par des tests biochimiques (test Elisa, Western Blot) et par des tests immuno-histochimiques réalisé au « Norwegian Veterinary Institute » d’Oslo. C’est le premier cas détecté pour toute l’Europe, mais peut être que le « faible nombre d'animaux dépistés » ne permet pas l'identification de cas rares et sporadiques (en élevages de bovins). Jusqu’ici on pensait que seuls le Wapiti (Cervus canadensis) et l'élan (Alces alces) y étaient sensibles (avec de nombreux cas en Amérique du Nord) et quelques-uns en Corée du Sud chez animaux en captivité dans une population de wapitis importé vivants fin des années 1990 pour être élevés en Corée. Avec le Renne en Norvège, c'est une 3e espèce qui s’y montre potentiellement vulnérable.
En 2016, on ne sait pas encore d’où vient ce prion « norvégien » (saut d’espèce à partir de la scrapie du mouton, mutation, ou bien ingestion de prions de vache folle…) mais selon le communiqué norvégien il est similaire à ceux trouvés au Canada et aux États-Unis [75]. Deux nouveaux cas (portant le total à 5) ont été détectés en octobre, chez des rennes sauvages tués à la chasse d'automne dans la zone Nordfjella (pour 300 rennes sauvages et 1000 cerfs testés) automnale. L'un de ces deux rennes ne présentait pas de symptômes, ce qui invite à aussi tester les animaux apparemment sains, souligne la Direction norvégienne de l'environnement[76].
Peu après, deux autres cas ont été détectés à Elbu, plus au nord, près de la frontière suédoise, respectivement le et le [16], cette fois chez des élans (Alces alces) femelles (toutes deux en situation de grossesse). « Des échantillons ont été envoyés au laboratoire de référence de l’OIE pour le MDC au Canada. La Norvège a bloqué l’exportation de cervidés. La surveillance clinique passive sera étendue ; la surveillance active commencera en automne comme initialement prévu ». Trois pays (Norvège, Suède et Finlande) vont coordonner leur surveillance. Ces trois premiers cas ont tous été trouvés en Norvège, mais au sein de trois populations qui n'ont pas de contact direct entre elles[17]. En 2018, un premier cas est identifié pour la Finlande : un élan de quinze ans mort naturellement dans le centre du pays à 50 kilomètres de la frontière russe. Selon le ministère finlandais de l'agriculture il s'agit de la forme norvégienne de la MDC et non de la forme américaine. Par précaution, le pays stoppe toute exportation de cervidés[77] - [78] - [79].
En France, en 1996, un guépard importé par et pour un zoo s'avère porteur d'un prion pathogène[80]. Ce phénomène attire l'attention d'écoépidémiologistes. Mi-2021, il ne semble toujours pas y avoir eu de programme de recherche systématique de prions sur le terrain au sein la faune sauvage (malgré la dispersion accidentelle de farines animales à risque dans l'environnement (à partir d'entrepôts de stockage en mauvais état). La connaissance théorique des maladies à prion chez l'animal a cependant avancé : elle a été étudiée en laboratoire par l'Inra, qui a répondu a une série d’appels d’offres (INRA en interne, interministériels, GIS Prions, Union Européenne) ; six départements de recherche de l'INRA[81] ont à partir de 2004 initié des projets de recherche relatifs aux maladies à prions, mais sans création de poste (« cet intense effort de mobilisation s’est accompli essentiellement par mobilité thématique (et non pas à la faveur de recrutements nouveaux), ce qui a représenté pour chacun des chercheurs engagés un effort personnel de remise en cause l’obligeant à repartir de zéro dans un domaine totalement nouveau, en abandonnant des recherches où chacun avait acquis un positionnement national et international »[82]. Ces études ont porté sur l'ESB bovine et la tremblante du mouton, avec des séminaires INRA organisés en 1998, 2000 et 2003, des publications, des applications zootechniques (tests de diagnostic rapide, amélioration des protocoles de biosécurité du retraitement des farines animales ; brevet déposé en mars 2004). Les résultats de ces huit ans de recherches ont été publiés dans un numéro spécial de la revue Productions animales en 2004[82]. En forêt domaniale, l'ONF a - dans le cadre de certains baux de « lots de chasse », pour d'autres raisons (limiter les surpopulation de cervidés et/ou sangliers) - à partir de 2004, commencé à interdire l'agrainage intensif et/ou à le réglementer (clauses imposées aux chasseurs dans ces baux).
Notes et références
- (en) Michael W. Miller « Chapter 53 – Chronic Wasting Disease of Cervid Species » Zoo and Wild Animal Medicine (Sixth Edition) — Current Therapy 2008, p. 430–437. résumé/1re page
- (en) Williams ES, Miller MW « Chronic wasting disease in deer and elk in North America » International Office of Epizootics 2002, 21(2):305-316 (Résumé)
- (en) Elizabeth S Williams « Scrapie and chronic wasting disease » (Review article) ; Clinics in Laboratory Medicine ; 2003;23(1):139–159. (résumé)
- Waddell L, Greig J, Mascarenhas M, Otten A, Corrin T & Hierlihy K (2018) Current evidence on the transmissibility of chronic wasting disease prions to humans—a systematic review. Transboundary and emerging diseases, 65(1), 37-49|https://doi.org/10.1111/tbed.12612
- (en) J.W. Fischer, G.E. Phillips, T.A. Nichols et K.C. VerCauteren, « Could avian scavengers translocate infectious prions to disease-free areas initiating new foci of chronic wasting disease ? », Prion, Taylor & Francis, vol. 7, no 4, , p. 263-266 (PMID 23822910, DOI 10.4161/pri.25621)
- Benestad, S. L., Mitchell, G., Simmons, M., Ytrehus, B., & Vikøren, T. (2016). First case of chronic wasting disease in Europe in a Norwegian free-ranging reindeer. Veterinary Research, 47(1), 88).
- Dagleish M.P (2016) « Chronic wasting disease of deer–is the battle to keep Europe free already lost ? ». Veterinary Record, 179(5), 121-123 (résumé).
- (en) Turid Vikøren, Jørn Våge, Knut I Madslien, Knut H Røed, Sylvie L Benestad et al., « First Detection of Chronic Wasting Disease in a Wild Red Deer (Cervus elaphus) in Europe », J Wildl Dis, vol. 55, no 4, , p. 970-2. (PMID 30920905, DOI 10.7589/2018-10-262)
- (en) ES Williams et S Young (1980), « Chronic wasting disease of captive mule deer: a spongiform encephalopathy » ; Journal of Wildlife Diseases ;16(1):89-98. (Résumé)
- Bollinger (2004), The History of Chronic Wasting Disease - One World One Health PPT ; oneworldonehealth.org sept 2004, consulté 5 mai 2017
- Haley, N., Siepker, C., Greenlee, J., & Richt, J. (2016). Limited amplification of chronic wasting disease prions in the peripheral tissues of intracerebrally inoculated cattle. Journal of General Virology. (résumé)
- (en) E. S. Williams « Chronic Wasting Disease » Veterinary Pathology 2005;42(5):530-549. DOI 10.1354/vp.42-5-530 ()
- USGS : Frequently asked questions concerning Chronic Wasting Disease (CWD) ; U.S. Department of the Interior | U.S. Geological Survey URL: http://www.nwhc.usgs.gov, mis à jour le 19 mai 2016, consulté 7 mai 2017
- History of Chronic Wasting Disease (Origins) ; AgriLife Extension Wildlife & Fisheries ; Chronic Wasting Disease Alliance
- Matthew R. Perrott, Christina J. Sigurdson, Gary L. Mason & Edward A. Hoover (2012) Evidence for distinct chronic wasting disease (CWD) strains in experimental CWD in ferrets ; J Gen Virol. 2012 Jan; 93(Pt 1): 212–221. doi: 10.1099/vir.0.035006-0 PMCID: PMC3352335
- carte, et situation géographique des premiers cas en Norvège
- Bulletin Radar de juin 2016 ; Office fédéral de la sécurité alimentaire et des affaires vétérinaires OSAV - couvre la période du 21 mai au 24 juin 2016.
- (en) Laura Pirisinu, Linh Tran, Barbara Chiappini, Ilaria Vanni, Sylvie L Benestad et al., « Novel Type of Chronic Wasting Disease Detected in Moose (Alces alces), Norway », Emerg Infect Dis, vol. 24, no 12, , p. 2210-8. (PMID 30457526, PMCID PMC6256397, DOI 10.3201/eid2412.180702)
- (en) Candace K. Mathiason et al. « Infectious Prions in the Saliva and Blood of Deer with Chronic Wasting Disease » Science 2006;314(5796):133-136. DOI 10.1126/science.1132661 (résumé)
- (en) Safar JG, Scott M, Monaghan J, Deering C, Didorenko S, Vergara J, Ball H, Legname G, Leclerc E, Solforosi L, Serban H, Groth D, Burton DR, Prusiner SB, Williamson RA « Measuring prions causing bovine spongiform encephalopathy or chronic wasting disease by immunoassays and transgenic mice » Nat Biotechnol. 2002;20(11):1147-50. DOI 10.1038/nbt748 (Résumé)
- (en) Christina J. Sigurdson et Adriano Aguzzi « Chronic wasting disease » Biochim Biophys Acta. 2007 Jun;1772(6):610-8.
- W. J. Hadlow et al., J. Infect. Dis. 129, 559 (1974).
- M. W. Miller, E. S. Williams, Curr. Top. Microbiol. Immunol. 284, 193 (2004).
- (en) DeJoia C, Moreaux B, O'Connell K, Bessen RA, « Prion infection of oral and nasal mucosa », J Virol, vol. 80, no 9, , p. 4546-56. (PMID 16611915, PMCID PMC1472028, DOI 10.1128/JVI.80.9.4546-4556.2006, lire en ligne [html])
- (en) Mariella E. Güere, Jørn Våge, Helene Tharaldsen et Sylvie L. Benestad, « Chronic wasting disease associated with prion protein gene ( PRNP ) variation in Norwegian wild reindeer ( Rangifer tarandus ) », Prion, vol. 14, no 1, , p. 1–10 (ISSN 1933-6896 et 1933-690X, PMID 31852336, PMCID PMC6959294, DOI 10.1080/19336896.2019.1702446, lire en ligne, consulté le )
- (en) Joanne M. Tennant, Manci Li, Davin M. Henderson et Margaret L. Tyer, « Shedding and stability of CWD prion seeding activity in cervid feces », PLOS ONE, vol. 15, no 3, , e0227094 (ISSN 1932-6203, PMID 32126066, PMCID PMC7053746, DOI 10.1371/journal.pone.0227094, lire en ligne, consulté le )
- Bastian & al (2007) "[Spiroplasma spp. from transmissible spongiform encephalopathy brains or ticks induce spongiform encephalopathy in ruminants]". Journal of Medical Microbiology. 1235–1242 DOI 10.1099/jmm.0.47159-0
- Bastian, F. O., Dash, S. & Garry, R. (2004). Linking chronic wasting disease to scrapie by comparison of Spiroplasma mirum ribosomal DNA sequences. Exp Mol Pathol 77, 49–56.
- Bastian, F. O., Jennings, R. A. & Gardner, W. A. (1987a). Antiserum to scrapie-associated fibril protein cross-reacts with Spiroplasma mirum fibril protein. J Clin Microbiol 25, 2430–2431.
- Bastian, F. O. (1979). Spiroplasma-like inclusions in Creutzfeldt- Jakob disease. Arch Pathol Lab Med 103, 665–669
- Bastian, F. O., Hart, M. N. & Cancila, P. A. (1981). Additional evidence of spiroplasma in Creutzfeldt-Jakob disease. Lancet 1, 660.
- Bastian, F. O. (2005). Spiroplasma as a candidate causal agent of transmissible spongiform encephalopathies. J Neuropathol Exp Neurol 64, 833–838.
- CWD Myth Busting, Page mise en ligne par l'État du Michigan, consulté le 8 mai 2017
- Professeur émérite au département de microbiologie de l'Université du Colorado et spécialiste de la MDC
- (en) Candace K. Mathiason, Jenny G. Powers, Sallie J. Dahmes, David A. Osborn, Karl V. Miller, Robert J. Warren, Gary L. Mason, Sheila A. Hays, Jeanette Hayes-Klug, Davis M. Seelig, Margaret A. Wild, Lisa L. Wolfe, Terry R. Spraker, Michael W. Miller, Christina J. Sigurdson, Glenn C. Telling et Edward A. Hoover, « Report Infectious Prions in the Saliva and Blood of Deer with Chronic Wasting Disease » Science 2006;314(5796):133-136. DOI 10.1126/science.1132661 (Résumé, en anglais)
- (en) The PLOS ONE Staff, « Correction: Very low oral exposure to prions of brain or saliva origin can transmit chronic wasting disease », PLOS ONE, vol. 16, no 6, , e0253356 (ISSN 1932-6203, PMID 34111230, PMCID PMC8191958, DOI 10.1371/journal.pone.0253356, lire en ligne, consulté le )
- (en) Nathaniel D. Denkers, Glenn C. Telling, and Edward A. Hoover, « Minor Oral Lesions Facilitate Transmission of Chronic Wasting Disease » Journal of Virology 2011;85(3):1396-1399 ; 0022-538X/11/$012.00+0 ; DOI 10.1128/JVI.01655-10 (Résumé, en anglais)
- (en) M. P. Perrott, paper presented at the Molecular Mechanisms of Transmissible Spongiform Encephalopathies (Prion Diseases) ; Keystone Meeting, Snowbird, UT, 11 to 15 January 2005.
- (en) Nathaniel D. Denkers, Clare E. Hoover, Kristen A. Davenport et Davin M. Henderson, « Very low oral exposure to prions of brain or saliva origin can transmit chronic wasting disease », PLOS ONE, vol. 15, no 8, , e0237410 (ISSN 1932-6203, PMID 32817706, PMCID PMC7446902, DOI 10.1371/journal.pone.0237410, lire en ligne, consulté le )
- VerCauteren KC, Pilon JL, Nash PB, Phillips GE, Fischer JW. (2012), Prion remains infectious after passage through digestive system of American crows (Corvus brachyrhynchos) ; PLoS One. 2012; 7(10):e45774. Epub 2012 Oct 17
- Nichols TA, Fischer JW, Spraker TR, Kong Q, VerCauteren KC (2015), CWD prions remain infectious after passage through the digestive system of coyotes (Canis latrans) ; Prion; 9(5):367-75 (résumé).
- Rasmussen J, Gilroyed BH, Reuter T, Dudas S, Neumann NF, Balachandran A, Kav NN, Graham C, Czub S, McAllister TA. (2014), Can plants serve as a vector for prions causing chronic wasting disease ? ; Prion. 2014 Jan-Feb;8(1):136-42. (résumé)
- Pritzkow S, Morales R, Moda F, Khan U, Telling GC, Hoover E, Soto C. (2015), Grass plants bind, retain, uptake, and transport infectious prions ; Cell Rep. 2015 May 26 ; 11(8):1168-75. Epub 14 mai 2015 (résumé).
- Raymond G.J, Bossers A, Raymond L.D, O'Rourke K.I, McHolland L.E, Bryant, P.K 3rd, … & Caughey B (2000). Evidence of a molecular barrier limiting susceptibility of humans, cattle and sheep to chronic wasting disease. EMBO Journal, 19, 4425–4430.
- Moreno, J. A., & Telling, G. C. (2017). Molecular Mechanisms of Chronic Wasting Disease Prion Propagation. Cold Spring Harbor Perspectives in Medicine, a024448 (résumé).
- Waddell L, Greig J, Mascarenhas M, Otten A, Corrin T & Hierlihy K (2017) Current evidence on the transmissibility of chronic wasting disease prions to humans—A systematic review. Transboundary and Emerging Diseases. publication sous licence CC-BY-SA 4.0
- Race, B., Meade-White, K. D., Miller, M. W., Barbian, K. D., Rubenstein, R., LaFauci, G., … Chesebro, B. (2009). Susceptibilities of nonhuman primates to chronic wasting disease. Emerging Infectious Diseases, 15, 1366–1376.
- Race, B., Meade-White, K. D., Phillips, K., Striebel, J., Race, R., & Chesebro, B. (2014). Chronic wasting disease agents in nonhuman primates. Emerging Infectious Diseases, 20, 833–837.
- Schmaedicke N.C (2012) Estimating the risk of CWD transmission to humans – An interim report of a comprehensive study in non-human primates. Prion, 6, 67–68.
- Kolodziejczak, D., Da Costa Dias, B., Zuber, C., Jovanovic, K., Omar, A., Beck, J., … Weiss, S. F. (2010). Prion interaction with the 37-kDa/67-kDa laminin receptor on enterocytes as a cellular model for intestinal uptake of prions. Journal of Molecular Biology, 402, 293–300.
- Kolodziejczak, D., Da Costa Dias, B., Zuber, C., Jovanovic, K., Omar, A., Beck, J., … Weiss, S. F. (2010). Prion interaction with the 37-kDa/67-kDa laminin receptor on enterocytes as a cellular model for intestinal uptake of prions. Journal of Molecular Biology, 402, 293–300
- EFSA Panel on Biological Hazards (BIOHAZ), Kostas Koutsoumanis, Ana Allende et Avelino Alvarez‐Ordoňez, « Update on chronic wasting disease (CWD) III », EFSA Journal, vol. 17, no 11, (PMID 32626163, PMCID PMC7008890, DOI 10.2903/j.efsa.2019.5863, lire en ligne, consulté le )
- Wyoming Game & Fish Department
- CWD dans le Wyoming
- Melodie Edwards (2015)Chronic Wasting Disease Spreads To More Elk And Deer Hunting Areas Than Usual Wyoming Public Media Statewide Network Nov 30, 2015
- CWD Management Plan WGFD Chronic Wasting Disease Management Plan, PDF, 10 pp, (en)
- Carcass Disposal and Precautions in CWD Areas
- Stacie J. Robinson (2012)The role of genetics in chronic wasting disease of North American cervids ; Pages 153-162, mis en ligne le 01 avril 2012
- Davenport, K. A., Henderson, D. M., Mathiason, C. K., & Hoover, E. A. (2016). Assessment of the PrPc amino-terminal domain in prion species barriers. Journal of Virology, JVI-01121.
- Kurt, T., Jiang, L., Alderson, N., Liu, J., Eisenberg, D., & Sigurdson, C. (2016). The molecular basis for cross-species prion transmission. The FASEB Journal, 30(1 Supplement), 814-7.
- Schuler, K. L., Wetterau, A. M., Bunting, E. M., & Mohammed, H. O. (2016). Exploring perceptions about chronic wasting disease risks among wildlife and agriculture professionals and stakeholders. Wildlife Society Bulletin, 40(1), 32-40 (résumé).
- Marín-Moreno, A., Espinosa, J. C., Fernández-Borges, N., Píquer, J., Girones, R., Andreoletti, O., & Torres, J. M. (2016). An assessment of the long-term persistence of prion infectivity in aquatic environments. Environmental Research, 151, 587-594.
- Cheng, Y. C. (2016). Chronic Wasting Disease: Investigations on Prion Shedding and Risk of Transmission to Caribou (Doctoral dissertation, University of Calgary) (résumé).
- Holcomb, K. M., Galloway, N. L., Mathiason, C. K., & Antolin, M. F. (2016). Intra-host mathematical model of chronic wasting disease dynamics in deer (Odocoileus). Prion, 1-14 (résumé).
- Timothy D. Kurt et al. (2016) Cross-species transmission of CWD prions ; Prion, 25 janvier 2016 (résumé)
- Yon, L., Duff, J. P., Ågren, E. O., Erdélyi, K., Ferroglio, E., Godfroid, J., ... & Gavier-Widén, D. (2019). Recent changes in infectious diseases in European wildlife. Journal of wildlife diseases, 55(1), 3-43 | Lire en ligne : https://discovery.ucl.ac.uk/id/eprint/10063586/1/Yon%202018_recent%20changes%20european%20wildlife%20disease.pdf
- Schettler, E., Steinbach, F., Eschenbacher-Kaps, I., Gerst, K., Meussdoerffer, F., Risch, K., ... & Frölich, K. (2006). Surveillance for prion disease in cervids, Germany. Emerging Infectious Diseases, 12(2), 319.
- (en) Romolo Nonno, Michele A. Di Bari, Laura Pirisinu et Claudia D’Agostino, « Studies in bank voles reveal strain differences between chronic wasting disease prions from Norway and North America », Proceedings of the National Academy of Sciences, vol. 117, no 49, , p. 31417–31426 (ISSN 0027-8424 et 1091-6490, PMID 33229531, PMCID PMC7733848, DOI 10.1073/pnas.2013237117, lire en ligne, consulté le )
- EFSA Panel on Biological Hazards (BIOHAZ), Antonia Ricci, Ana Allende et Declan Bolton, « Scientific opinion on chronic wasting disease (II) », EFSA Journal, vol. 16, no 1, (PMID 32625679, PMCID PMC7328883, DOI 10.2903/j.efsa.2018.5132, lire en ligne, consulté le )
- Chronic Wasting Disease hos vilt ; Chronic Wasting Disease (CWD) ble påvist i Norge for første gang i 2016, på norsk villrein. Sjukdommen er nå også påvist på to elger i Norge (liste des rapports et liens ; en norvégien).
- BSE hos storfe ; Klassisk BSE (bovin spongiform encefalopati) har ikke blitt påvist hos storfe i Norge, men ett atypisk tilfelle av BSE (H-variant) ble påvist i 2015.
- ESA (5 avril 2016) : « Premier cas européen de maladie à prion chez un renne en Norvège » .
- D. Calavas (1), T. Baron (2) (2016) [Premier cas européen de maladie à prion chez un renne en Norvège] le 5. avril 2016 – Cervidés (1) Anses, Laboratoire de Lyon, Unité Epidémiologie, Lyon, France ; (2) Anses, Laboratoire de Lyon, Unité Maladies neuro-dégénératives, Laboratoire national de référence pour les encéphalopathies spongiformes transmissibles animales, Lyon, France.
- The first detection of Chronic Wasting Disease (CWD) in Europe ; CWD-Info, 5 avril 2016.
- Becker, Rachel (2016) Deadly animal prion disease appears in Europe ; How brain disorder related to mad-cow disease spread to Norway is a mystery ; Nature , 18 avril 2016 doi: 10.1038 / nature.2016.19759
- Sönnergren, Lars (2016), Deux nouveaux cas de CWD en Norvège, publié le 5 oct 2016.
- Communiqué de presse, ministère de l’agriculture et de la pêche finlandais - 8 mars 2018.
- ESA Finlande : Déclaration d’un premier cas de maladie du dépérissement chronique des cervidés, 15 mars 2018.
- ESA du 1er juin 2016 : « deuxième cas de CWD dans la faune sauvage en Norvège - point de situation 2016-02 du 31 mai 2016.
- (en) Baron, T., Belli, P., Madec, J. Y., Moutou, F., Vitaud, C. et Savey, M, « Spongiform encephalopathy in an imported cheetah in France », The Veterinary Record, no 141(11), , p. 270-271 (lire en ligne, consulté le )
- Ces six départements de recherche de l'INRA sont : Départements de génétique animale, de santé animale, physiologie animale, de transformation des produits animaux, d'hydrobiologie et faune sauvage, d'économie et sociologie rurale)
- J. M. ELSEN et J. M. AYNAUD, « Introduction au numéro hors série Encéphalopathies spongiformes transmissibles animales », sur INRAE Productions Animales, (ISSN 2273-7766, DOI 10.20870/productions-animales.2004.17.HS.3613, consulté le ), p. 5–6
Voir aussi
Articles connexes
Généralités sur les prions et ES
- (en) Hans A. Kretzschmar « Prion Diseases » Encyclopedia of the Human Brain, pages 47–60
- (en) J.D.F. Wadsworth et J. Collinge « Prions of Vertebrates » Encyclopedia of Virology (Third Edition), pages 330–336
- (en) E.D. Belay, L.B. Schonberger « Transmissible Spongiform Encephalopathies » Encyclopedia of Virology (Third Edition) pages 186–193.
Articles spécialisés
- (en) Barria M.A, Libori A, Mitchell G & Head M.W (2018) Susceptibility of Human Prion Protein to Conversion by Chronic Wasting Disease Prions ; Emerging infectious diseases, 24(8), 1482 (résumé).
- (en) Haley N.J, Candace K. Mathiason, Scott Carver, Mark Zabel, Glenn C. Telling et Edward A. Hoover « Detection of Chronic Wasting Disease Prions in Salivary, Urinary, and Intestinal Tissues of Deer: Potential Mechanisms of Prion Shedding and Transmission » The Journal of Virology, July 2011, p. 6309-6318 (Résumé)
- Gavin, C., Henderson, D., Benestad, S. L., Simmons, M., & Adkin, A. (2019). Estimating the amount of Chronic Wasting Disease infectivity passing through abattoirs and field slaughter. Preventive veterinary medicine, 166, 28-38 (résumé).
- Hannaoui, S., Arifin, M. I., Chang, S. C., Yu, J., Gopalakrishnan, P., Doh‐ura, K., etc. & Gilch, S. (2019). Cellulose ether treatment in vivo generates chronic wasting disease prions with reduced protease resistance and delayed disease progression. Journal of neurochemistry (résumé).
- (en) McNulty, E., Nalls, A. V., Mellentine, S., Hughes, E., Pulscher, L., Hoover, E. A., & Mathiason, C. K. (2019). Comparison of conventional, amplification and bio-assay detection methods for a chronic wasting disease inoculum pool. PloS one, 14(5), e0216621.
- (en) Miller MW, Wild MA. et Williams ES « Epidemiology of chronic wasting disease in captive Rocky Mountain elk » Journal of Wildlife Diseases 1998;34:532-538. (résumé)
- Osterholm, M. T., Anderson, C. J., Zabel, M. D., Scheftel, J. M., Moore, K. A., & Appleby, B. S. (2019). Chronic Wasting Disease in Cervids: Implications for Prion Transmission to Humans and Other Animal Species. mBio, 10(4), e01091-19.
- (en) Race, B., Williams, K., & Chesebro, B. (2019). Transmission studies of chronic wasting disease to transgenic mice overexpressing human prion protein using the RT-QuIC assay. Veterinary research, 501), 6.
- Requena J.R, Kristensson K, Korth C, Zurzolo C, Simmons M, Aguilar-Calvo P, etc. & Brown K (2016) The Priority position paper: protecting Europe´ s food chain from prions. Prion, (just-accepted oct 2016), 00-00.
- (en) Sigurdson CJ. et al. « Oral transmission and early lymphoid tropism of chronic wasting disease PrPres in mule deer fawns (Odocoileus hemionus) » J Gen Virol. 1999;80(10);2757-2764. (Résumé)
- Williams, K., Hughson, A. G., Chesebro, B., & Race, B. (2019). Inactivation of chronic wasting disease prions using sodium hypochlorite. PloS one, 14(10), e0223659.
- (en) Miller, W. L., & Walter, W. D. (2019). Spatial heterogeneity of prion gene polymorphisms in an area recently infected by chronic wasting disease. Prion, 13(1), 65-76.
- (en) Viljugrein, H., Hopp, P., Benestad, S. L., Nilsen, E. B., Våge, J., Tavornpanich, S., etc. & Mysterud, A. (2019). A method that accounts for differential detectability in mixed samples of long‐term infections with applications to the case of chronic wasting disease in cervids. Methods in Ecology and Evolution, 10(1), 134-145.
- (en) Waddell L, Greig J, Mascarenhas M, Otten A, Corrin T & Hierlihy K (2018) Current evidence on the transmissibility of chronic wasting disease prions to humans—a systematic review. Transboundary and emerging diseases, 65(1), 37-49.
- (en) Williams ES. et Young S. « Chronic wasting disease of captive mule deer: a spongiform encephalopathy » Journal of Wildlife Diseases 1980;16:89-98. (Résumé)
