Rangifer tarandus
Caribou, Renne

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Sous-classe | Theria |
| Infra-classe | Eutheria |
| Ordre | Artiodactyla |
| Famille | Cervidae |
| Sous-famille | Capreolinae |
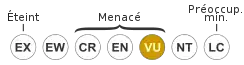
VU A2a : Vulnérable
Le renne (Rangifer tarandus), appelé caribou au Canada, est un cervidé originaire des régions arctiques et subarctiques de l'Europe, de l'Asie et de l'Amérique du Nord. Il a également été introduit dans l'archipel antarctique français des îles Kerguelen où il s'est naturalisé et vit désormais à l'état sauvage.
Les plus grandes hardes de caribous sauvages se trouvent en Alaska et dans le nord du Québec et du Labrador. Le renne a été domestiqué, notamment dans le Nord de l'Europe et en Sibérie où il sert d'animal de trait, de bât et de course.
Origine du nom
Le mot caribou, utilisé pour décrire l’espèce par les premiers explorateurs français, tire son origine du mot micmac « xalibu », qui veut dire « celui qui gratte le sol avec sa patte » ou « qui creuse avec une pelle ». Les explorateurs anglais de l’Arctique n’ont jamais adopté le terme inuktitut « tuktu » pour désigner le caribou. Dans leur journal, ils utilisaient plutôt le terme anglais « deer », comme raccourci de « reindeer ».
Le terme renne vient de la langue same, dans laquelle le mot « reino » signifie jeune renne. D’autres termes français, comme « rangier » et « rangifère », remontent à l’an 1500 apr. J.-C.[1]
Description de l'espèce
Le renne, ou caribou, est un animal robuste pouvant peser jusqu’à 180 kg pour un mâle adulte pour une taille moyenne de 1,30 m au garrot, les femelles font un poids moyen d'environ 100 kg pour une taille au garrot de 1,10 m environ. Son pelage peut être brun ou gris, sa queue est courte. Les poils sont creux comme un tube et l'aident à nager en plus de l'isoler du froid. Adaptation à la variation saisonnière de la luminosité dans les régions polaires, la couleur des yeux du renne passe du marron doré en été au bleu profond en hiver[2].
Mâles et femelles portent des bois (panache en québécois) recouverts d'un velours[3] l'été. Les bois prennent alors une teinte rouge, puis brun foncé. Les vaisseaux sanguins des bois, qui assurent leur croissance, contribuent à cette coloration. Le panache des mâles tombe au début de l'hiver et celui des femelles plus tard au printemps[4]. Les rennes du père Noël sont ainsi des femelles. Les sabots sont larges, adaptés à la marche dans la neige ou la boue des sols qui dégèlent, ainsi qu'à la nage et au pelletage de la neige pour atteindre la nourriture.

Le renne se nourrit d'herbe, de buissons, d'écorces et de lichen, qu'il doit parfois chercher sous la neige. En fonction des saisons, il doit effectuer de longues migrations dans la toundra pour survivre, n'hésitant pas à traverser fleuves et bras de mer.
C'est un animal doué d'une adaptation au fil du temps qui a su survivre aux différents changements climatiques car le renne a côtoyé le mammouth et le rhinocéros laineux. Ceci grâce à ses faibles exigences alimentaires, et à ses multiples adaptations pour pouvoir survivre en fonction du climat, comme l'absence d'horloge circadienne[5]. Sa dépendance vis-à-vis du lichen n'est pas un problème car cette nourriture est présente sur Terre depuis très longtemps. Le lichen est une nourriture riche qui fermente dans le rumen de l'animal, ce qui dégage de la chaleur et réchauffe le renne ; ainsi il n'a pas besoin d'avoir une activité physique pour se réchauffer, ce qui limite ses dépenses énergétiques.

Le principal prédateur est le loup qui suit de près les troupeaux. Les ours noirs, bruns et polaires représentent aussi une menace. Cependant, les rennes en bonne santé sont bien plus rapides à la course que la plupart de leurs prédateurs. Ce sont surtout les individus faibles, malades, jeunes ou âgés qui succombent aux prédateurs. Le renne peut facilement courir à près de 70 km/h en cas de danger. De plus, les bois des grands mâles font une arme redoutable pour affronter les loups ou un ours seul.
Le fait de limiter ses dépenses énergétiques lui permet de survivre l'hiver en grande partie sur les réserves qu'il a accumulées durant l'été. Il s'économise lors de ses déplacements grâce à des raquettes naturelles, ses sabots, qui sont très larges, pourvus d'une touffe de poils entre les doigts sur le dessous et qui s'enfoncent peu. Les femelles en gestation et les jeunes conservent leurs bois durant l'hiver pour avoir plus de facilités pour accéder à la nourriture car ils ont moins constitué de réserves que les mâles.
La période de rut se situe en octobre et occasionne des luttes entre mâles pour obtenir un harem de femelles. La gestation, qui a lieu durant tout l'hiver, va durer entre sept et neuf mois : les mères peuvent stopper le développement du fœtus durant plus ou moins deux mois ; si la nourriture disponible ne permet pas à la fois la survie de la mère et la croissance du fœtus, le développement de ce dernier est mis entre parenthèses et la mise bas sera décalée. Lorsque le petit arrive à maturité, la mère peut encore retarder de quelques jours la mise bas afin d'attendre des conditions climatiques idéales, pas trop de chaleur, ni de pluie, pour augmenter les chances de survie du petit.
Sous-espèces
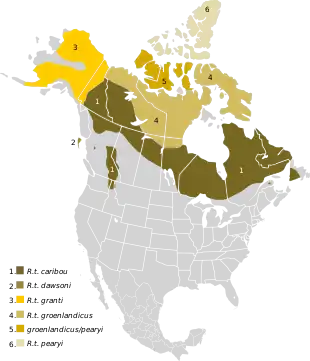
Amérique du Nord
- R. tarandus caribou (caribou des forêts ou caribou des bois). On le trouvait à l'origine dans toutes les forêts boréales de l'Amérique du Nord, depuis l'Alaska et l'État de Washington à l'ouest jusqu'au Labrador et à la Nouvelle-Angleterre à l'est. L'espèce a disparu de la majeure partie de cette aire de répartition originelle, mais des groupes importants subsistent au Québec et au Labrador, au Canada. Des groupes plus restreints sont protégés ailleurs, comme dans l'Alberta. Seule la population de caribous de Terre-Neuve et du Labrador est considérée comme espèce non en péril.
- R. tarandus dawsoni, dans l'île Graham, faisant partie de Haida Gwaii, anciennement îles de la Reine-Charlotte, en Colombie-Britannique, au Canada. Éteinte avant les années 1920[6].
- R. tarandus eogroenlandicus, dans l'est du Groenland. Éteinte vers 1900.
- R. tarandus granti, en Alaska, au Yukon et dans les Territoires du Nord-Ouest du Canada.
- R. tarandus groenlandicus, au Nunavut et dans les Territoires du Nord-Ouest du Canada, ainsi que dans l'est du Groenland.
- R. tarandus pearyi, dans les îles du nord du Nunavut et des Territoires du Nord-Ouest du Canada.
Eurasie
- R. tarandus fennicus, qu'on trouve encore à l'état sauvage dans deux régions, l'une dans la République de Carélie russe, et une plus petite dans le centre de la Finlande.
- R. tarandus platyrhynchus, dans l'archipel du Svalbard, au Nord de la Norvège. C'est la plus petite sous-espèce de Renne.
- R. tarandus tarandus, dans les toundras et les forêts boréales arctiques de l'Eurasie, depuis la péninsule Scandinave jusqu'au Nord de la Sibérie. Ces rennes ont également été introduits dans l'archipel sub-antarctique des îles Kerguelen où ils vivent désormais à l'état sauvage.
Les caribous

En Amérique du Nord, les plus anciens fossiles de caribou (Rangifer tarandus) datent de 50 000 ans[7]. L’espèce semblait alors abondante dans la taïga, à partir de la marge des glaciers jusqu’au Nouveau-Mexique. Les changements climatiques subséquents ont modifié considérablement l’aire de répartition du caribou. À l’arrivée des premiers Européens, on le retrouvait dans toutes les provinces canadiennes ainsi que dans la plupart des États américains limitrophes du Canada. Dans l’est du continent, il était présent dans les états de New York, du Vermont, du New Hampshire et du Maine[8]. Aujourd’hui, il est surtout présent au nord du 49e parallèle. Il subsiste aujourd'hui quatre sous-espèces de caribou en Amérique du Nord : le caribou de Peary (Rangifer tarandus pearyi), le caribou de Grant (Rangifer tarandus granti), le caribou de la toundra (Rangifer tarandus groenlandicus) et le caribou des bois (Rangifer tarandus caribou).
Le caribou des bois vit dans la forêt boréale, de l'Alaska jusqu’à Terre-Neuve. Environ un million de caribous des bois de l'écotype toundrique (migrateur) vivent dans deux grandes populations au Nord du Québec et au Labrador et traversent environ 2 000 kilomètres chaque année pour se nourrir. Leurs passages détériorent la disponibilité alimentaire rapidement et ils doivent se déplacer constamment. La compétition pour la nourriture engendre d'ailleurs d'importants cycles d'abondance. Au sud du fleuve Saint-Laurent, un peu plus d'une centaine de bêtes survivent sur les hauts plateaux du Parc National de la Gaspésie. Cette population (sédentaire) de l'écotype montagnard fut déclarée vulnérable en 2001, puis menacée en 2009, par le gouvernement du Québec. Outre les deux populations toundriques et la population montagnarde, on retrouve au Québec de nombreuses petites populations forestières (sédentaires) disséminées dans la forêt boréale, principalement au nord du 49e parallèle. On retrouve aussi deux populations forestières isolées plus au sud. D'abord, celle de Val-d'Or dans le nord-ouest du Québec (Canada), qui compte à peine une vingtaine de bêtes. La population de caribous la plus méridionale est celle de Charlevoix, localisée à environ 100 km au nord de Québec (ville), Canada. Cette population forestière comprend environ 80 individus. Elle a été réintroduite à la fin des années 1960 et au début des années 1970 à la suite de sa disparition durant les années 1920. L'écotype forestier a été désigné vulnérable par le gouvernement du Québec en 2005.
Au cœur de l'été, près de 400 000 caribous broutent dans les plaines côtières gorgées d'eau qui bordent la mer de Beaufort, tout au nord de l'Amérique. Les femelles s'y rendent sans les mâles. Elles font ainsi leurs petits loin de la plupart des loups qui craignent les sols détrempés. Leur cycle est synchronisé par celui de la toundra.
Sitôt que son petit est né, généralement unique, la mère dévore avidement le placenta qui l'enveloppait. Elle récupère ainsi des éléments nutritifs et des hormones qui vont déclencher sa lactation. Elle passe les premiers jours en tête-à-tête avec le nouveau-né, le léchant et l'allaitant à l'écart du troupeau. Dans la toundra, une escorte de séducteurs accompagne le retour des génitrices.
Au début de l'hiver, des montagnes à l'océan glacial, le troupeau fuit chaque année la faim et les loups par les mêmes sentiers battus.
Les Gwich’in tuent les caribous et en tirent 75 % de leurs protéines.
Répartition géographique
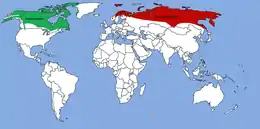
- Renne
- Caribou

De nombreuses sous-espèces sont actuellement réparties d'une manière étendue dans l'hémisphère nord sachant que la variété la plus septentrionale se trouve dans l'archipel du Svalbard. Dans les périodes glaciaires précédentes, elles descendaient beaucoup plus au sud, comme le montrent par exemple des restes de Rangifer sp. trouvés dans des pièges naturels karstiques du Vaucluse en France[9].
On trouve des troupeaux de rennes en Islande. Ceux-ci ont été importés entre 1771 et 1787 du Finnmark. Ils sont répartis entre plusieurs régions : le Vestmannaeyjar, le Suðurland, le Suðvesturland, le Norðausturland et l'Austurland. Plusieurs groupes ont totalement disparu, la cause principale en est le manque de pâturage en hiver. Malgré tout, certains troupeaux ont réussi à s'adapter et ont été déplacés dans le Vopnafjörður en 1787. On essaie aujourd'hui de les garder dans l'est du pays[10].
On trouve aussi des populations de rennes en Asie centrale et orientale (Yakoutie) où il est utilisé comme bête de trait (comme en Laponie) ainsi qu'au Canada dont le climat lui convient parfaitement.
Écologie des populations, menaces
Contrairement aux populations forestières et montagnardes d'Amérique du Nord, le caribou migrateur n'est pas considéré comme menacé, mais plusieurs sources de préoccupations sont citées par la littérature scientifique :
- Les changements climatiques observés dans l'Ouest du Groenland pourraient indirectement l'affecter. En effet, des chercheurs[11] ont constaté en étudiant l'évolution des données de calendrier de mise bas des caribous qu'elles coïncident de moins en moins avec l'apparition et la croissance des végétaux de cette partie du monde[12]. Alors que les plantes à fleurs ont déjà adapté leur cycle annuel à l'élévation de température, les dates de vêlage n'ont pas suivi. Les animaux auraient accès à une nourriture moins riche, ce qui expliquerait un taux anormalement élevé de mortalité chez les jeunes caribous (les chercheurs craignent aussi une réduction d'un facteur 4 du nombre de naissances).
- Les lichens et champignons absorbent fortement le césium radioactif. Les rennes européens ont donc été fortement touchés par les retombées de la catastrophe de Tchernobyl[13]. Le lait des rennes est aussi devenu radioactif, source de risque de mutation délétères de l'ADN pour ses consommateurs humains ou pour les rennes en allaitement. Des milliers d'animaux ont dû être abattus et les éleveurs ont ensuite dû ajouter des produits chimiques (agents complexants[14] - [15] et/ou minéraux (zéolite, bentonite, vermiculite)) à la nourriture des rennes.
- Pour la première fois au monde, un cas de maladie débilitante chronique (CWD ou MDC) a été signalé chez un renne[16] - [17], puis confirmé par un communiqué de l’Institut vétérinaire norvégien le 4 avril 2016[18], chez une femelle dans un groupe de rennes sauvage (Rangifer tarandus tarandus) trouvé dans le sud du pays lors d’une opération de capture de rennes destinés à être équipé de balises satellites. Le renne capturé était en mauvaise santé et est mort peu après. Le programme norvégien de surveillance des maladies à prion chez les ongulés sauvages a été alerté. La maladie semble être la même que l'encéphalopathie spongiforme des cervidés dénommée « Chronic wasting disease » ou CWD en Amérique du Nord, maladie préoccupante car s'étant montrée très contagieuse et inéluctablement mortelle chez les cervidés nord-américains[19]. Mi-mars 2016 ce cas norvégien a été confirmé par des tests biochimiques et immuno-histochimiques réalisé à l'« Institut vétérinaire norvégien » d’Oslo. Une fois malade, l'animal répand des prions infectieux via sa salive, son urine et ses fèces (ainsi que par le « velours » des bois). Peu après, deux autres cas ont été trouvés en Norvège (deux femelles d'élan) : le 12 mai 2016 dans une population qui n'a pas de contact direct avec le premier cas[20] - [21] et le 14 juin 2016 dans le secteur du premier cas[22]. Deux autres rennes sauvages atteints (portant le total à 5) ont été trouvés en octobre 2016, également dans la zone Nordfjella (pour 300 rennes sauvages et 1 000 cerfs testés) à l'occasion de la chasse d'automne. L'un de ces deux rennes ne présentait pas de symptômes, " ce qui invite à aussi tester les animaux apparemment sains, souligne la Direction norvégienne de l'environnement "[23].
Comportement
Les rennes domestiqués ont conservé une grande partie des instincts de leurs ancêtres : ils fuient leurs prédateurs et s'en protègent en groupe, ils se mettent instinctivement en file indienne pour traverser les lacs ou fleuves gelés ou pour nager, ils préfèrent marcher sur la neige plutôt que sur la glace et savent trouver leur nourriture sous la neige.
Ils n'évitent cependant pas toujours les accidents. Ainsi en 2009, alors que 3 000 rennes traversaient un fleuve gelé, les animaux de tête, peut-être en pressentant que la glace était trop fine, firent demi-tour. Sous leur poids, la glace s'est rompue et presque tous les animaux sont tombés à l'eau. Deux cents n'ont pas réussi à regagner la glace ferme et se sont noyés[24].
En septembre 1984, une spectaculaire noyade de 9 604 caribous à la chute du Calcaire sur la rivière Caniapiscau a fait le tour du monde. Une harde du troupeau de la rivière George large d'un kilomètre s'est engagée à la nage juste en amont du rapide de 22 m, alors que la rivière était en crue. Emportés par le courant, ils ont péri par noyade pour s'amonceler en aval de la chute[25].
On a d'abord cru qu'ils avaient été victimes d'une fausse manœuvre d'Hydro-Québec, l'exploitant du complexe La Grande, qui a ouvert les vannes de l'évacuateur de crues Duplanter du réservoir de Caniapiscau, restituant plus de 1 475 m3/s à la rivière Caniapiscau, ce qui porta le débit à 3 145 m3/s, le troisième plus fort débit enregistré en septembre à la chute Pyrite — à 8 km en amont— depuis 1963[26].
Un rapport du ministère québécois du Loisir, de la Chasse et de la Pêche, publié l'année suivante, offre une autre explication :
« Les animaux de tête, poussés par les autres, auraient été forcés de se mettre à l’eau même si leur instinct les incitait à rebrousser chemin face à un danger éventuel. Si les premiers caribous s’engagent dans une traverse dangereuse, l’ensemble du groupe, se trouvant dans une situation de panique et d’agressivité, suivra dans un désordre total les premiers caribous qui se sont mis à l’eau. »
— MLCP 1985, cité dans Hydro-Québec 1993, p. 5.

Le renne et l'homme

Préhistoire
Le renne, répandu alors notamment dans une grande partie de l'Europe, constituait déjà une proie de choix pour l'homme de Néandertal, ainsi que pour Homo sapiens — comme l'homme de Cro-Magnon en Dordogne. Ce dernier consommait évidemment la viande, qu'il pouvait sécher pour la stocker. Les os, dont la moelle était extraite et consommée car riche en graisse, lui servait à fabriquer des pointes de sagaies, des supports d'art mobilier et de parure (colliers, etc.), voire d'instruments de musique (racleurs), ainsi que divers autres outils (aiguilles, etc.). Des bois étaient extrait les bâtons percés (qui servaient sans doute à redresser les sagaies), les harpons et les crochets de propulseurs, souvent magnifiquement sculptés, tandis que les bases des bois pouvaient faire d'excellent percuteurs pour la taille de silex. La graisse était utilisée comme combustible pour les lampes à graisse, avec lesquelles nos ancêtres s'éclairaient dans les profondeurs des grottes qu'ils ornaient. Les tendons ainsi que les boyaux séchés de l'animal fournissaient des fils et ligatures avec lesquels étaient cousus vêtements et couvertures d'habitat, ceux-ci étant obtenus avec les peaux de l'animal, dont l'abondance de poil protégeait effectivement des hivers glaciaires. On peut supposer que les vessies du cervidé, une fois nettoyées, pouvaient constituer d'excellentes outres et gourdes. Enfin, la substance collagène des sabots était extraite pour en faire de la colle. Le renne, on le voit, fournissait tout ce dont nos ancêtres paléolithiques avaient besoin pour vivre dans un climat généralement plus froid qu'aujourd'hui. Ceux-ci dépendaient tellement du renne que le Paléolithique supérieur a souvent été nommé « l'âge du renne », (par l'abbé Breuil, par exemple), et que la disparition définitive de ce cervidé d'Europe lors du réchauffement général à la fin du Paléolithique supérieur a sonné le glas de la culture magdalénienne, il y a 12 000 ans. Malgré cette importance, le renne n'a été comparativement que peu représenté dans l'art pariétal paléolithique. On en trouve toutefois quelques superbes exemplaires, comme ce couple de renne de la grotte de Font-de-Gaume (Dordogne), où l'on assiste à une rare et émouvante scène d'un mâle léchant une femelle.
De nos jours
Aujourd'hui encore, les rennes sont chassés dans de nombreuses régions du monde, notamment pour leur viande et pour leur fourrure. Dans les régions où les gros animaux sauvages, les plantes à fibres et les matériaux de construction font défaut, les hommes ont longtemps utilisé presque toutes les parties du renne, y compris les os comme outils.
On ne sait pas quel peuple a commencé à domestiquer le renne. Ce savoir-faire a été transmis de la Sibérie à la Scandinavie autour de l'an 1 000 avant Jésus-Christ. Ce sont les Sames qui ont pratiqué l'élevage du renne en Scandinavie, et le font d'ailleurs encore aujourd'hui. Pour les Sames, que certains appellent « Lapons », l'élevage du renne est une activité ancestrale fondamentale. En Norvège et en Suède, c'est un privilège des Sames, alors que les Finlandais le font aussi en Finlande. Les rennes peuvent aller et venir librement, ce sont les hommes qui les suivent. Les bêtes sont rassemblées quelquefois au cours de l'année pour marquer les jeunes ou tuer quelques animaux. Le rassemblement des troupeaux est pratiqué aujourd'hui à l'aide d'hélicoptères et de motoneiges. La technique pour les capturer consiste à les attraper au lasso avant de leur tenir par les pattes, pour pouvoir les diriger.
La domestication du renne a été introduite au Groenland, en Alaska et au Canada au cours du XXe siècle seulement. Dans ces régions, les rennes avaient été uniquement chassés jusque-là. La Géorgie du Sud ou les îles Kerguelen abritent aujourd'hui également des populations acclimatées de rennes, retournées à la vie sauvage.
Selon la tradition populaire (assez récente), le traîneau du Père Noël est tiré par des rennes (dont Rudolphe, le renne au nez rouge).
Le caribou apparaît sur une face de la pièce de monnaie canadienne de 25 cents.
Le problème des rennes des îles Kerguelen[27]
Dix rennes de Suède appartenant à la sous-espèce R. tarandus tarandus ont été introduits en 1955–1956 sur l'île Haute dans l'archipel français des îles Kerguelen. Cette première population a été renforcée par les descendants de trois rennes suédois introduits en 1957 sur l'île Haute avec les mouflons.
Comptant une centaine de têtes chacune à la fin des années 1960, les deux populations sont entrées en compétition pour l'espace et la nourriture de cette petite île (6,5 km2). En 1981, les rennes ont fini par gagner l'île principale, la Grande Terre, à la nage, jusqu'à totalement disparaître de l'île Haute.
La population de rennes était estimée à environ 2 000 individus pour l'année 2016, soit trois bêtes par kilomètre carré. Cette densité relativement faible s'explique d'une part par l'alimentation de l'animal presque exclusivement constituée d'acaena et d'autre part par la dureté du climat en période hivernale. L'hypothèse d'une éradication du renne pour maintenir l'équilibre de l'écosystème de l'archipel semble écartée en raison de la stabilité des effectifs, de leur impact relativement limité sur l'environnement ainsi que du coût qu'engendrerait une telle disposition[28].
Notes et références
- Extrait du Guide de l’enseignant pour l’étude des caribous sauvages de l’Amérique du Nord publié par le ministère des ressources naturelles du Québec
- Erwan Lecomte, « Les yeux marron des rennes deviennent bleus en hiver », Sciences et Avenir, (lire en ligne, consulté le )
- Le « velours » est en zoologie, un tissu tégumentaire qui assure la protection, la vascularisation et l'innervation des bois chez la plupart des cervidés
- Pourquoi les rennes perdent-ils leurs bois en hiver ?, Ça m'intéresse, 25 décembre 2020.
- W. Lu et al., A circadian clock is not required in an arctic mammal, Current Biology, 2010.
- (fr) Caribou de la sous-espèce dawsoni sur le site de COSEPAC
- Banfield, A.W.F. 1961. A revision of the reindeer and caribou genus Rangifer. Natl. Mus. Can. Bull. 277. 137 p.
- Moisan, G. 1956. Le caribou de Gaspé I. Histoire et distribution. Naturaliste Can. 83: 225-234.
- Crégut-Bonnoure, E., Argant, J., Bailon, S., Boulbes, N., Bouville, C., Buisson-Catil, J.,... & Frèrebeau, N. (2014). The karst of the Vaucluse, an exceptional record for the Last Glacial Maximum (LGM) and the Late-glacial period palaeoenvironment of southeastern France. Quaternary International, 339, 41-61.
- http://www.na.is/index.php?option=com_content&view=article&id=12&Itemid=112 (site en islandais)
- (en) The New York Times, « Colossal Squid and Parasitic Plants - The New York Times > Science > Slide Show> Slide 3 of 7 », (consulté le )
- « Arctique : les rennes menacés par le réchauffement climatique », sur www.cnews.fr (consulté le )
- (en) Mathiesen S.D., Nordøy L. M. et Blix A.S, « Elimination of radiocesium in contaminated adult female Norwegian reindeer », Rangifer, vol. 49, no 3, (DOI 10.7557/2.10.3.823, lire en ligne [PDF], consulté le )
- (en) Hove K, Staaland H et Pedersen Ole F, « Effects of ammoniumiron-hexacyanoferrate on the accumulation of radiocesium in reindeer », Rangifer, vol. 8, no 2, (DOI 10.7557/2.8.2.747, lire en ligne [PDF], consulté le )
- (en) W.W Giese, « Ammonium-ferric-cyano-ferrate(II) (AFCF) as an effective antidote against radiocaesium burdens in domestic animals and animal derived foods », British Veterinary Journal, vol. 144, no 4, , p. 363-369 (DOI 10.1016/0007-1935(88)90065-6)
- (en) Rachel Becker, « Deadly animal prion disease appears in Europe : Nature News & Comment », sur Nature, (DOI 10.1038/nature.2016.19759, consulté le )
- Julien Cauchard, « Premier cas européen de maladie à prion chez un renne en Norvège » [archive du ], (consulté le )
- (en) CWD-alliance, « The first detection of Chronic Wasting Disease (CWD) in Europe », (consulté le )
- (en) Helen R. Pilcher, « Chronic wasting disease spreads with ease : Nature News », sur Nature, (DOI 10.1038/news030901-5, consulté le )
- Alizé Mercier, « Un deuxième cas de CWD dans la faune sauvage en Norvège - point de situation 2016-02 du 31 mai 2016 », (consulté le )
- (en) SCoPAFF (Animal Nutrition Section of the Standing Committee on Plants, Animals Food and Feed), « Location of two cases of chronic wasting disease in Norway » [« Situation géographique des premiers cas de maladie débilitante chronique en Norvège »] [PDF], (consulté le )
- (en) The British Deer Society, « Chronic Wasting Disease (CWD) » (consulté le )
- Sönnergren, Lars (2016), Deux nouveaux cas de CWD en Norvège, publié le 5 oct 2016
- (fr) Brève de RTL info
- Turgeon 1992, p. 132
- Hydro-Québec 1993, p. 5
- Un problème similaire se posait en Géorgie du Sud.
- https://www.institut-polaire.fr/wp-content/uploads/2017/12/WEB_124004_rapport_activite_2016.pdf
Voir aussi
Articles connexes
- Renniculture (Élevage du renne)
- Rennes du père Noël
- Rodolphe le renne au nez rouge
- Amarok
- Sven, le renne dans La Reine des neiges
- Enjeux du réchauffement climatique
Bibliographie
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Ren » (voir la liste des auteurs). Cela concerne le chapitre consacré au renne et à l'homme.
- Gouvernement du Québec, Considérations relatives à la noyade de caribous du fleuve George sur la rivière Caniapiscau (septembre 1984)., Direction générale de la Faune. Ministère du Loisir, de la chasse et de la pêche, , 100 p.
- Hydro-Québec, La noyade des 9604 caribous, Montréal, Hydro-Québec, coll. « Le complexe hydroélectrique La Grande » (no 16), , 6 p. (lire en ligne).
- Pierre Turgeon, La Radissonie, le pays de la baie James, Montréal, Libre expression, , 191 p. (ISBN 2-89111-502-3).
Liens externes
- (en) Andy Coghlan, « 80,000 reindeer have starved to death as Arctic sea ice retreats », sur New Scientist, (consulté le )
Liens de référence
- (en) Référence Mammal Species of the World (3e éd., 2005) : Rangifer tarandus
- (en) Référence Tree of Life Web Project : Rangifer tarandus
- (en) Référence Catalogue of Life : Rangifer tarandus (Linnaeus, 1758) (consulté le )
- (en) Référence Fauna Europaea : Rangifer tarandus (Linnaeus, 1758) (consulté le )
- (en) Référence Paleobiology Database : Rangifer tarandus (Linnaeus 1758)
- (fr+en) Référence ITIS : Rangifer tarandus (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Rangifer tarandus
- (en) Référence NCBI : Rangifer tarandus (taxons inclus)
- (en) Référence UICN : espèce Rangifer tarandus (Linnaeus, 1758) (consulté le )