Organe voméronasal
L’organe voméronasal (ou « OVN » ou organe de Jacobson) est un organe tubulaire situé chez l'humain sous la surface intérieure du nez.

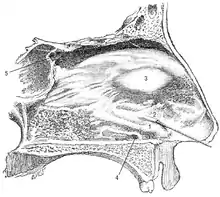
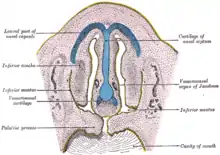
Chez les mammifères, cet organe est spécialisé dans la détection des phéromones, qui sont des molécules véhiculant des signaux innés. Ces signaux permettent de réguler les comportements sociaux (comportements sexuel, parental, d'agression …). Suivant les espèces, il existe des différences anatomiques. Les phéromones arrivent à l'organe voméronasal soit par la bouche (par léchage ou flehmen), soit par le nez, soit par le canal nasopalatin (qui relie la bouche et le nez).
Chez les Catarrhiniens (Macaques, Babouins, et Hominidés), le système voméronasal est vestigial. Chez l'être humain, l'organe voméronasal n'est quasiment plus fonctionnel, le bulbe olfactif accessoire est atrophié, et le canal nasopalatin est généralement obturé[1].
Anatomie
L'organe voméronasal existe chez tous les mammifères. Il doit son nom à un os du nez, le vomer, qui forme la partie postéro-inférieure du septum nasal de la cloison des fosses nasales. Il est également appelé organe de Jacobson, car il a été découvert en 1811 par le Danois Ludvig Jacobson[2]. Il est innervé par le nerf terminal, apparemment non fonctionnel chez l'homme mais jouant un rôle dans les techniques de prédation des reptiles[3].
Le système voméronasal est constitué par le canal nasopalatin, l'organe voméronasal et le bulbe olfactif accessoire[1] (voir les figures ci-contre).
- L'organe voméronasal est situé dans la cloison nasale chez l'homme.
- Le canal nasopalatin permet de relier la bouche et le nez. Il est situé dans le palais derrière les incisives, passe à travers le canal incisive et débouche dans la cavité nasale.
- Le bulbe olfactif accessoire est la structure du cerveau qui reçoit et traite les signaux provenant de l'organe voméronasal.
Chez les mammifères, on trouve trois types de relations anatomiques entre l'organe voméronasal et le canal nasopalatin. L'organe voméronasal débouche soit[1] :
Physiologie
En fonction de l'anatomie des mammifères, les phéromones peuvent arriver à l'organe voméronasal de plusieurs façons[1] :
- si l'ouverture de l'organe voméronasal est dans la cavité orale ou dans le canal nasopalatin, l'animal inspire de l'air par la bouche (c'est le flehmen, chez les ovins, bovins, chevaux, félidés...) ;
- si l'ouverture de l'organe voméronasal est dans la cavité nasale, l'animal inspire de l'air par le nez. Des phéromones solubles peuvent également être recueillies par léchage, puis être transmises de la bouche vers le nez via le canal nasopalatin (cas des rongeurs).
Chez la plupart des mammifères, l'organe voméronasal est spécialisé dans la détection des phéromones. Ces molécules transmettent des signaux innés qui influencent la physiologie ou qui permettent de réguler les comportements sociaux (comportement sexuel, parental, d'agression …).
Comment l'organe voméronasal fonctionne-t-il ?
En contact avec la partie postérieure et inférieure de la cloison des cavités nasales, les organes voméronasaux reposent sur ses deux prolongements antérieurs. Une lamelle osseuse ou cartilagineuse enveloppe le côté latéral de l'organe, l'isolant de la cavité nasale et le maintenant dans une capsule rigide.
En coupe transversale, le canal de l'organe voméronasal est en forme de croissant. Les neurones sensoriels sont exclusivement dans l'épithélium qui forme la face interne, concave du canal. La face latérale convexe n'est pas sensorielle ; elle est couverte de cellules ciliées, analogues à celles du système respiratoire, qui brassent le mucus.
Le canal est un cul-de-sac fermé vers l'arrière et son ouverture antérieure est étroite : comment le mucus externe et les molécules stimulantes qu'il contient sont-ils entraînés à l'intérieur du canal?
En 1949, le physiologiste M. Hamlin a découvert un système de pompage, assuré par une variation de la turgescence du tissu caverneux qui se trouve sous l'épithélium non sensoriel du canal. Ce tissu caverneux est traversé par une grosse veine. Comme l'organe est maintenu rigidement sur sa périphérie, la contraction du tissu caverneux dilate le canal interne et aspire les molécules stimulantes pendant plusieurs secondes. Puis, la vasodilatation du tissu comprime le canal et expulse le liquide analysé. La détection par l'organe voméronasal est donc un mécanisme actif. Selon Michael Meredith, de l'Université de Floride, la pompe s'active, chez des hamsters en captivité, lors de toute situation nouvelle : présence d'un congénère, ouverture de la cage, etc.[4].
Les neurones sensoriels de l'organe voméronasal assurent la double fonction de détection des molécules stimulantes et de transmission de l'information nerveuse au cerveau. Leurs axones très longs, se regroupent en plusieurs rameaux nerveux, qui courent le long de la cloison nasale. Ils passent la lame criblée, qui sépare la cavité nasale du cerveau, et établissent des contacts synaptiques avec les neurones d'une zone du bulbe olfactif, nommé bulbe olfactif accessoire en raison de sa taille (pas de sa fonction!).
Comme les neurones olfactifs, les neurones voméronasaux proviennent de la différenciation du tissu olfactif embryonnaire. Comme les neurones olfactifs, encore, les neurones voméronasaux possèdent une longue dendrite, dont l'extrémité sort dans le canal voméronasal, à la surface de l'épithélium. Cependant cette extrémité porte de nombreuses microvillosités, tandis que les neurones olfactifs, eux, ont des prolongements ciliaires. Les neurones voméronasaux ont également, à la base de leur dendrite, un réticulum endoplasmique très développé, dont la fonction reste mystérieuse (le réticulum endoplasmique est un réseau de citernes intracellulaires chargé, notamment, d'exporter dans la cellule les protéines nouvellement synthétisées).
La physiologie des deux types de neurones diffère également. Selon les études de biologie moléculaire effectuées depuis une dizaine d'années par plusieurs groupes (tels ceux de Catherine Dulac, Richard Axel et Linda Buck, à Harvard, ou de N. Ryba, à l'Université de Bethesda), les neurones voméronasaux comportent, dans leur membrane, des protéines spécifiques qui semblent être les récepteurs des molécules stimulantes.
Ces protéines réceptrices putatives diffèrent des protéines réceptrices des neurones olfactifs. Elles sont codées par des gènes distincts, moins nombreux que les gènes qui codent les protéines réceptrices olfactives. Les neurones voméronasaux et les neurones olfactifs procèdent donc à des lectures différentes du monde chimique environnant.
Le mécanisme de transduction voméronasale, c'est-à-dire la suite des événements moléculaires et électriques qui mènent de la protéine réceptrice activée à l'émission des impulsions nerveuses, diffère également du mécanisme de transduction olfactive.
Le lieu de traitement de l’information est lui aussi différent. En effet des chercheurs suédois ont démontré, par imagerie médicale, que le siège de la perception des phéromones se tenait dans une zone particulière du cerveau, l'hypothalamus, qui n'intervient pas habituellement dans l'odorat , mais joue un rôle important sur le plan des émotions et des comportements sexuels. Contrairement aux odeurs, cette perception ne passe pas par le cerveau conscient - le cortex - elle est reliée au cerveau inconscient.
Effets physiologiques et comportementaux
Les principaux effets physiologiques ou comportementaux actuellement identifiés sont :
- Phéromones émises par le mâle :
- Effet Vandenbergh (Rongeurs) : La puberté de la souris femelle est plus précoce quand celle-ci est exposée aux phéromones présentes dans les urines d'un mâle adulte[5] - [6] - [7].
- Effet Whitten (Rongeurs) : Lorsqu'une femelle adulte est en anœstrus, la présence du mâle peut induire une reprise rapide des cycles ovariens[8].
- Effet Bruce (Rongeurs) : La mise en présence d'un mâle différent de celui avec lequel la femelle s'est accouplée bloque le processus de l'implantation de l'embryon chez la souris[9].
- Phéromones émises par la femelle
L'organe voméronasal est important, si ce n'est essentiel, pour la reproduction de nombreux mammifères. La reproduction est inhibée ou perturbée en cas de destruction de cet organe[12] - [13].
Fonction chez l'être humain
L’être humain possède un organe voméronasal bien visible chez l'embryon et sous forme d'un système apparenté chez le fœtus[14], mais qui s'atrophie au cours de l'embryogenèse[15] - [16] et qui ne semble pas jouer un rôle aussi prépondérant que pour d’autres espèces.
Deux écoles de neuroscientifiques s’affrontent à propos de l'organe voméronasal humain : l'une indique que cet organe est malgré tout fonctionnel et l’autre affirme qu’il ne s’agit que d’un reliquat de l’évolution.
- En effet, le canal nasopalatin, qui permet le passage de la bouche vers l'organe voméronasal des signaux phéromonaux recueilli par le léchage ou le flehmen, est vestigial chez l'être humain[1] - [17]. Mais surtout, l'organe voméronasal est particulièrement altéré : chez l'être humain, les 20 gènes VR2 et 115 gènes VR1 sur 120 sont altérés[18]. De plus, les gènes TRPC2 des protéines réalisant la transduction des signaux phéromonaux sont également altérés[19]. Pour ces raisons, l'organe voméronasal n'est plus fonctionnel. Néanmoins, il reste encore dans l'épithélium olfactif 6 gènes TAAR sur 9 qui sont encore fonctionnels[18]. C'est probablement ces gènes TAAR[20] qui expliquent les effets expérimentaux des éventuelles phéromones humaines[21]. Mais la détection des signaux véhiculés par les bouquets de phéromones est réalisée principalement par l'organe voméronasal[22] et par une interaction entre les deux systèmes olfactifs[23]. La capacité fonctionnelle de détection et de traitement des phéromones est donc grandement altérée, ce qui explique que les effets résiduels des phéromones soient faibles chez l'être humain. Quant aux effets endocriniens et émotionnels obtenus dans des conditions expérimentales, il reste encore à évaluer leur importance réelle en conditions naturelles[24]. Enfin , le bulbe olfactif accessoire est atrophié et le canal nasopalatin est généralement obturé[25]. Pour toutes ces raisons, il n'existe apparemment plus d'effets phéromonaux significatifs chez l'être humain[26] - [27]. La plupart des études confirmant l'activité de détection de phéromones chez l'humain ne sont pas valides, soit parce que l'importance du système HLA / CMH a été surestimé[28], soit parce que l'importance des apprentissages n'a pas été pris en compte dans la conception des études[27], ou en raison de la faible influence des éventuelles phéromones humaines[26]. De plus, des entreprises commerciales et des parfumeurs utilisent à des fins promotionnelles uniquement les publications qui valorisent leurs produits (voir pour exemple les sites commerciaux de James Vaughn Kohl[29] ou du Dr Winnifred Cutler[30]). Pour crédibiliser l'efficacité de leurs produits, les commerciaux omettent généralement de citer dans les références scientifiques présentées sur leurs sites Internet ou dans leurs brochures commerciales les problèmes méthodologiques, les travaux qui invalident leurs résultats[31] - [27] et surtout que 90 % des gènes des récepteurs aux phéromones sont altérés chez l'être humain[18]. « Sur la base des preuves actuelles, la plupart des experts [...] sont sceptiques quant à l’existence d’un organe voméronasal fonctionnel chez les êtres humains adultes[32]. »
- L'école qui soutient que cet organe est fonctionnel (au moins pour la détection d'hormones stéroïdiennes[33]) attache une importance déterminante à son existence (comme à l'odorat et à la vision) pour expliquer l'adaptation aux diverses conditions de vie, en plus de l'instauration d'équilibres psychologiques eux aussi cruciaux. Divers auteurs estiment que l'importance des phéromones dans l'odorat humain a été très ou trop sous-estimée[34]. Des études ont montré que les phéromones, très importants dans le comportement animal (de nombreux mammifères y compris), ont encore un rôle non négligeable chez l’homme, pouvant constituer des signaux non verbaux capables de susciter des émotions ou des interactions sociales, point de vue notamment développé par Kohl et al.[35] dans une revue générale de neuroendocrinologie, puis par d'autres auteurs. Parmi environ un millier de gènes du système olfactif humain, 70 % sont qualifiés chez l’homme de pseudogènes[36] autrefois supposés non fonctionnels, mais ces gènes se sont montrés[37] fonctionnellement liés au complexe majeur d'histocompatibilité[38]. Le système olfactif pourrait ainsi être impliqué dans plusieurs problèmes physiopathologiques en partie au moins neuroendocrinien[39] dont l'anorexie mentale (dont une forme peut être induite chez l'animal de laboratoire, associée à une puberté retardée causée par la perception de phéromones[40]). Une dégradation de l'olfaction est un indicateur précoce de la maladie d'Alzheimer[41] - [42]. Cet organe pourrait être impliqué dans le choix d'une odeur d'un homme par une femme[43] et dans les liens qui unissent une mère et son bébé[44].
Des sécrétions axillaires s'avèrent capables d'influencer le cycle menstruel féminin[45], et le baiser pourrait peut-être être un moyen pour deux individus d'échanger des signaux chimiques par le contact des lèvres avec la peau et l'ingestion de sébum[46].
Évolution et phylogenèse
L'organe voméronasal est aussi présent chez les amphibiens et les reptiles (lézards, et serpents[47]) ; les molécules chimiques de l'environnement sont récupérées par leur langue.
On considère que l'apparition de l'organe voméronasal avec les amphibiens, et sa présence chez tous les serpents et chez les mammifères terrestres, résultent de l'adaptation des organismes à la vie terrestre : les poissons, qui utilisent l'eau comme vecteur de communication chimique, ne possèdent pas d'organe voméronasal, mais leurs cavités nasales assurent une fonction équivalente. De même, il ne semble pas avoir été possible de mettre en évidence un organe voméronasal (ou un organe homologue) chez les oiseaux (ni d'ailleurs chez les dinosaures)[48].
Notes et références
- (en) Jacob S., Zelano B., Gungor A., Abbott D., Naclerio R., McClintock M.K. Location and gross morphology of the nasopalatine duct in human adults. Arch. Otolaryngol. Head Neck Surg., 126(6):741-748, 2000
- Jacobson, L. (1811). Description anatomique d’un organe observé dans les mammifères. Ann. Mus. Hist. Nat. Paris 18, 41 2-424. Johns, M. A., Feder, H. H., Komisaruk
- S. Louryan et N. Vanmuylder, « Apports de l’embryologie et de l’anatomie comparée à l’enseignement des nerfs crâniens », Morphologie, vol. 102, no 337, , p. 111-121 (DOI 10.1016/j.morpho.2018.04.002, lire en ligne, consulté le ).
- Meredith, M. The vomeronasal organ and accessory olfactory system in the hamster. In Muller-Schwarze, D. and Silverstein, R.M. (eds.), Chemical signals. Plenum, New York, PP. 303-326, 1980.
- (en) VANDENBERGH J. G. Male odor accelerates female sexual maturation in mice. Endocrinology, 84(3):658-660, 1969
- (en) N. Kaneko et al., « Puberty acceleration in mice. II. Evidence that the vomeronasal organ is a receptor for the primer pheromone in male mouse urine] » in Biology of …, 1980 voir en ligne
- (en) M.C. Wilson, W.G. Beamer, W.I. Whitten, « Puberty Acceleration in Mice. I. Dose- Response Effects and Lack of Critical Time Following Exposure to Male Mouse Urine », in Biol. Reprod, num. 22, 1980, p. 864-872.
- (en) WHITTEN M. K. Effect of exteroceptive factors on the oestrous cycle of mice. Nature, 180(4599):1436, 1957
- (en) BRUCE H. M. An exteroceptive block to pregnancy in the mouse. Nature, 184:105, 1959
- (en) LEE, S. van der, BOOT, L. M., Acta Physiol. Pharmacol. Neer., 5, 213, 1956
- (en) J. Reynolds, E.B. Keverne, « Accessory olfactory system and its role in the pheromonally mediated suppression of oestrus in mice » in J. Reprod. Fert., vol. 57, num. 3, 1979, p. 1-35.
- M.R. Murphy, « Olfactory impairment, olfactory bulb removal and mammalian reproduction » in Mammalian Olfaction, Reproductive Processes and Behavior (R. L. Doty, ed), Academic Press, New York., 1976, p. 96-117.
- (en) F. Aujard, « Effect of vomeronasal organ removal on male sociosexual responses to female in a prosimian primate (Microcebus murinus) » in Physiol Behav, num. 62, 1997, p. 1003–1008.
- (en) N. Boehm, B. Gasser, « Sensory receptor-like cells in the human foetal vomeronasal organ. » in Neruroreport, num. 4, 1993, p. 867–870.
- Dominique Nazat, « Naissance du nez » in Rev Orthop Dento Faciale, vol. 19, num. 1, janvier 1985, p. 23-32 voir DOI en ligne (en ligne le 30 mars 2010) ; Rev Orthop Dento Faciale, num. 19, 1985, p. 23-32.
- (en) K.P. Bhatnagar, T.D. Smith, W. Winstead, « The human vomeronasal organ: IV, incidence, topography, endoscopy, and ultrastructure of the nasopalatine recess, nasopalatine fossa, and vomeronasal organ » in Am J Rhinol, num. 16, 2002, p. 343–350.
- (en) von Arx T., Bornstein M.M. Canal nasopalatin perméable. Une anomalie développementale rare et un piège diagnostique. Rev Mens Suisse Odontostomatol, 119(4):385-389, 2009
- (en) Nei M., Niimura Y., Nozawa M. The evolution of animal chemosensory receptor gene repertoires: roles of chance and necessity. Nat. Rev. Genet., 9(12):951-963, 2008
- (en) ZHANG J. , WEBB D. M. Evolutionary deterioration of the vomeronasal pheromone transduction pathway in catarrhine primates, Proceedings of the National Academy of Sciences of the United States of America, 100(14):8337-8341, 2003
- (en) Liberles S.D., Buck L.B. A second class of chemosensory receptors in the olfactory epithelium. Nature, 442(7103):645-650, 2006
- (en) Wysocki C.J., Preti G. Facts, fallacies, fears, and frustrations with human pheromones. Anat. Rec. A Discov. Mol. Cell Evol. Biol., 281(1):1201-1211, 2004 (voir résumé en ligne)
- (en) Samuelsen C.L., Meredith M. The vomeronasal organ is required for the male mouse medial amygdala response to chemical-communication signals, as assessed by immediate early gene expression. Neuroscience, 164(4):1468-1476, 2009
- Keller M., Baum M.J., Brock O., Brennan P.A., Bakker J. The main and the accessory olfactory systems interact in the control of mate recognition and sexual behavior. Behavioural Brain Research, 200(2):268-276, 2009
- (en) Havlicek J., Murray A.K., Saxton T.K., Roberts S.C. Current issues in the study of androstenes in human chemosignaling. Vitam. Horm., 83:47-81, 2010
- Jacob S., Zelano B., Gungor A., Abbott D., Naclerio R., McClintock M.K., Location and gross morphology of the nasopalatine duct in human adults, Arch. Otolaryngol. Head Neck Surg., 2000, vol.126(6), pp. 741-748.
- (en) Doty R.L. Human Pheromones: Do They Exist? in Mucignat-Caretta C. (Ed). Neurobiology of Chemical Communication. Boca Raton (FL): CRC Press, (19), 2014
- (en) Doty R.L. "The Great Pheromone Myth". Johns Hopkins Press, 2010
- (en) Hurst J.L., Thom M.D., Nevison C.M., Humphries R.E., Beynon R.J. MHC odours are not required or sufficient for recognition of individual scent owners. Proc. Biol. Sci., 272(1564):715-724, 2005
- « Pheromones by LuvEssentials / Seduction in a bottle », sur PHEROMONES (consulté le ).
- « Athena Institute--Pheromones, Wellness and Science », sur athenainstitute.com (consulté le ).
- (en) Anders Winman, « Do perfume additives termed human pheromones warrant being termed pheromones? », Physiology & Behavior, vol. 82, no 4, , p. 697-701 (PMID 15327919, DOI 10.1016/j.physbeh.2004.06.006)
- (en) Tristram D. Wyatt, Pheromones and Animal Behaviour: Communication by Smell and Taste., Cambridge: Cambridge University Press., (ISBN 0-521-48526-6), p295
- (en) D.L. Berliner, L. Monti Bloch, C. Jennings White, V. Diaz Sanchez, « The functionality of the human vomeronasal organ (VNO): evidence for steroid receptors » in J Steroid Biochem Mol Biol, num. 58, 1996, p. 259–265.
- J. Frey, « Les phéromones : un moyen de communication sous-estimé dans l'espèce humaine » in Annales de Biologie Clinique, 2003 (voir résumé en ligne)
- (en) J.V. Kohl, M. Atzmueller, B. Fink, K. Grammer, « Human pheromones: integrating neuroendocrinology and ethology » in Neuroendocrinol Lett, num. 22, 2001, p. 309-21.
- (en) S. Rouquier, A. Blancher, D. Giorgi, « The olfactory receptor gene repertoire in primates and mouse: evidence for reduction of the functional fraction in primates » in Proc Natl Acad Sci USA, num. 97, 2000, p. 2870-4.
- (en) L. Buck, R. Axel, « A novel multigene family may encode odorant receptors: a molecular basis for odor recognition » in Cell, num. 65, 1991, p. 175-87.
- (en) S. Montag, M. Frank, H. Ulmer, D. Wernet, W. Göpel, H.G. Rammensee, « “Electronic nose” detects major histocompatibility complex-dependent prerenal and postrenal odor components » in Proc Natl Acad Sci USA, num. 98, 2001, p. 9249-54.
- (en) B. Nicholson, « Pheromones cause disease: pheromone-odourant transduction » in Med Hypotheses, num. 57, 2001, p.361-77.
- (en) B. Nicholson, « Pheromones cause disease: the exocrinology of anorexia nervosa » in Med Hypotheses, num. 54, 2000, p. 438-43.
- R. Lange, C.L. Donathan, L.F. Hughes, « Assessing olfactory abilities with the University of Pennsylvania smell identification test: a rasch scaling approach. » in J Alzheimers Dis, num. 4, 2002, p. 77-91.
- (en) Wedekind C, Seebeck T, Bettens F, Paepke AJ. MHC-dependent mate preferences in humans. Proc R Soc Lond B Biol Sci 1995 ; 260 : 245-9.
- (en) S. Jacob, M.K. Mac Clintock, B. Zelano, C. Ober, « Paternally inherited HLA alleles are asociated with women’s choice of male odor » in Nat Genet, num. 30, 2002, p. 175-9.
- (en) M. Kaitz, A. Good, A.M. Rokem, A.I. Eidelman, « Mothers’ recognition of their newborns by olfactory cues » in Dev Psychobiol, num. 20, 1987, p. 587-91.
- (en) W.B. Cutler, G. Preti, A. Krieger, G.R. Huggins, C.R. Garcia, H.J. Lawley, « Human axillary secretions influence women’s menstrual cycles: the role of donor extract from men » in Horm Behav, num. 20, 1986, p. 463-73.
- (en) B. Nicholson, « Does kissing aid human bonding by semiochemical addiction ? » in Br J Dermatol, num. 111, 1984, p. 623-7.
- (en) J.L. Kubie, « Roles of the vomeronassl and olfactory systems in courtship behavior of male garter snakes » in J. Comp. Physiol. Psych., num. 92, 1978, p. 627-641.
- (en) Question posée sur researchgate.net (en 2014)
Voir aussi
Bibliographie
- (en) Doty R.L. Human Pheromones: Do They Exist? in Mucignat-Caretta C. (Ed). Neurobiology of Chemical Communication. Boca Raton (FL): CRC Press, (19), 2014
- (en) Doty R.L. "The Great Pheromone Myth". Johns Hopkins Press, 2010
- (en) L.H. Bannister, « Fine structure of the sensory endings in the vomero-nasal organ of the slow-worm Anguis fragilis » in Nature, 1968 (voir résumé en ligne)
- (en) E.D. Adrian, « Synchronised activity in the Vomero-nasal nerves with a note on the function of the organ of Jacobsen » in Pflügers Archiv European Journal of Physiology, 1955 (voir résumé en ligne)
- (en) M. Dubois-Dauphin et al., « Relations somatotopiques entre la muqueuse olfactive et le bulbe olfactif chez le triton » in Brain Research, 1981 (voir résumé en ligne)
- (en) H. Altner et al., « The ultrastructure of the vomero-nasal organ in reptilia » in Cell and Tissue Research, 1970 (voir résumé en ligne)
- (en) K.B. Døving, D. Trotier, « Structure and function of the vomeronasal organ » in The Journal of Experimental Biology, num. 201 (Pt 21), , p. 2913–25. , (voir texte intégral en ligne).
- (en) L. Silvotti, A. Moiani, R. Gatti, R. Tirindelli, « Combinatorial co-expression of pheromone receptors, V2Rs » in Journal of Neurochemistry, vol. 103, num. 5, , p. 1753–63. DOI : 10.1111/j.1471-4159.2007.04877.x ; .
- (en) E.B. Keverne, « The vomeronasal organ » in Science, vol. 286, num. 5440, , p. 716–20. DOI : 10.1126/science.286.5440.716 ; .
- (en) M. Meredith, « Human vomeronasal organ function: a critical review of best and worst cases » in Chemical Senses, vol. 26, num. 4, , p. 433–45. DOI : 10.1093/chemse/26.4.433 ; .
- (en) C.S. Evans, « Accessory chemosignaling mechanisms in primates » in American Journal of Primatology, vol. 68, num. 6, , p. 525–44. DOI : 10.1002/ajp.20250 ; .
- (en) K.S. Wekesa, R.R. Anholt, « Pheromone regulated production of inositol-(1, 4, 5)-trisphosphate in the mammalian vomeronasal organ » in Endocrinology, vol. 138, num. 8, , p. 3497–504. DOI : 10.1210/en.138.8.3497 ; .
Articles connexes
Liens externes
- (fr) Organe voméro-nasal par Meyer C., ed. sc., 2014, Dictionnaire des Sciences Animales. [en ligne]. Montpellier, France, Cirad. [19/03/2014], in: Dictionnaire des sciences animales .
- (en) Dr. Michael Meredith : The vomeronasal organ dans le site The Florida State University.