Toxicité des munitions
Le problème de la toxicité des munitions (militaires et de chasse) le plus étudié a d'abord été celui qui est induit par le plomb (cause de saturnisme et neurotoxique à très faible dose chez le fœtus et l'embryon), mais depuis quelques années une littérature abondante a porté sur le rôle des munitions militaires, chimiques notamment parmi les séquelles de guerre.

De nombreux composés toxiques ou écotoxiques ont été utilisés pour la fabrication de projectiles depuis trois siècles ; certains ne sont ni dégradables ni biodégradables (ex. : plomb, mercure, arsenic et plus récemment uranium appauvri dans le cas des munitions anti-blindage[1]).
D'autres ne sont que lentement dégradables (ex. : TNT, perchlorates…). Ils sont principalement retrouvés dans le sol et dans les sédiments terrestres et marins où ils peuvent exercer leurs effets toxiques, voire être remobilisés par les invertébrés, les animaux fouisseurs, certains oiseaux[2]…
D'autres composants sont moins toxiques, mais posent problème au-delà de certaines seuils : nitrates, cuivre, zinc, laiton, cadmium…
Les munitions chimiques contiennent des toxiques très stables (tabun, sarin, ypérite, lewisite, arsine, etc.) tout particulièrement dans le cas des munitions immergées[3] en grande quantité après les deux guerres mondiales.
Enjeux




Les enjeux sont ceux de la santé environnementale (dans la perspective de l'approche One Health recommandée par l'OMS), et de la protection de la biodiversité.
En effet, depuis plus de deux siècles, un très grand nombre de munitions ont été fabriquées puis utilisées ou stockées. Beaucoup ont été dispersées ou perdues dans l'environnement. Or nombre de leurs composants sont toxiques et pour certains non-dégradables.
En vieillissant ces munitions ou leur contenu restent dangereux et peuvent libérer des produits toxiques dans l'environnement.
Plusieurs des composés toxiques de munitions (ex. : plomb[4] et autres métaux lourds ou charge explosive ; TNT dans l'environnement marin par exemple[5]) ou mercure sont bioaccumulables. Ces produits posent problème pour l'environnement et la santé.
Les zones de test de nouvelles armes et/ou d'exercice militaire à tir réel (sur terre ou en mer) sont choisies de manière à être éloignées des zones habitées ou cultivées (en forêt parfois). Ces sites sont ainsi souvent d'une naturalité plus élevée et souvent installés sur des milieux pauvres acides (souvent riches en biodiversité car les moins cultivés, ne recevant ni engrais ni pesticides, mais où les métaux lourds sont susceptibles d'être les plus mobiles et les plus bioassimilables quand il s'agit de sites acides et humides). De plus, au XXe siècle (ex. : Première Guerre mondiale, guerre du Vietnam) les forêts, jungles et maquis où se cachent les combattants ou où l'on cache mieux les canons ont été des cibles plus fréquentes et plus lourdement attaquées, non sans impacts écologiques[6] - [7] - [8] - [9]. De même pour les villes (Dresde par exemple).
Hors du plomb et mercure, certains des composés de munitions ont une toxicité qui a précocement été identifiée ; ainsi fin 1916, un communiqué du ministre anglais des Munitions, alertait déjà les usagers du TNT et les médecins quant au fait que cet explosif était aussi un poison[10]. Mais il a fallu plusieurs décennies pour qu'on se rende compte que l'ypérite était également cancérigène. La toxicité de nombreux composés et de leurs produits de dégradation est encore mal connue ou discutée (Acide picrique par exemple, explosif massivement utilisé durant la Première Guerre mondiale).
La connaissance et maîtrise de cette toxicité, une législation (qui semble avoir émergé en Amérique du Nord dans les années 1970[11]) adéquate et adaptée aux risques et dangers pour l'environnement et la santé[12], et des moyens appropriés de remédiation sont des enjeux importants pour le XXIe siècle, y compris concernant la réutilisation[13] de terrains militaires ou d'exercice ou ball-trap et la gestion des stocks de munitions chimiques dont certains ont environ un siècle. Ronald L. Fournier & al. rappelaient en 1990 que « les munitions chimiques contiennent probablement les matériaux les plus toxiques jamais créées par l'homme et représentent un défi unique pour ceux qui sont impliqués dans leur destruction » qui nécessite des procédures hautement sécurisée et des fours spéciaux pour détruire les résidus encore présents sur les parties métalliques des munitions. Les composés organiques peuvent être détruits par la chaleur, mais non les métaux ou métalloïdes tels que l’arsenic qui a abondamment été ajouté aux « gaz de combat » de la Première Guerre mondiale[14].
Temporalité du problème
- Un grand nombre de munitions non explosées ont été perdues, ou leurs sites d'enfouissement ont été oubliés. Pour les munitions chimiques ou stocks de gaz de combat, certains auteurs estiment que leur recherche devrait être poursuivie[15], voire accélérée, car les munitions anciennes non-explosées se corrodent peu et vont perdre leur contenu toxique ; Une meilleure utilisation des archives, photographies aériennes, enquêtes géophysiques, anecdotes, cartes anciennes, connaissance des tirs d'artillerie, analyses de sols ou d'eau, etc. peut y contribuer[16].
- Le dérèglement climatique attendu pourrait exacerber les risques d'inondations de certaines zones de dépôts de munitions enterrées. Il pourrait aussi rendre plus fréquents et plus graves les incendies de forêt (dont « forêts de guerre » où de nombreux obus sont encore présent dans les couches superficielles du sol) ;
- La période récente a vu de nouveaux explosifs ou carburants de missiles et roquettes (carburants gazeux, liquides ou solides) introduits dans l'environnement ; dont l'uranium appauvri qui a été controversé lors de la guerre du Golfe ou des Balkans. Il faut souvent du temps avant que l'on identifie la toxicité d'un nouveau produit. Ainsi, a-t-on utilisé d'autres matériaux lourds pour les munitions perforantes, dont des alliages de tungstène (HMTAs[17]) réputés être des « alternatives non toxiques » à l'uranium[18]. Mais, quand on a injecté des microparticules de composition identique aux HMTAs[19] dans le muscle de Rats, elles ont rapidement induit des cancers avec tumeurs métastatiques agressives (sur le site d'implantation)[18]. Et l'introduction de particules de ce type[20] dans les poumons de rats a aussi induit une toxicité et des lésions pulmonaires[18].
- Le perchlorate (toxique pour la thyroïde[21] - [22]) est un composant pyrotechnique et un carburant de fusées, roquettes ou missiles[23] qui a été très utilisé dès la première guerre mondiale dans certains pays. Il a significativement pollué les sols de terrains militaires d'exercice et les nappes d'eau potable, par exemple en Californie[24] ou dans et autour de zones militaires américaines[25] sur le Massachusetts Military Reservation (MMR) à Cape Cod dans le Massachusetts (États-Unis). En France, des perchlorates ont été trouvés dans plusieurs régions en 2011 dans l'eau du robinet, dont en Aquitaine, dans le Bordelais où 5 captages d'eau potable ont été pollués (jusqu'à 30 µg/L mesurés) par une usine du groupe Safran (fabrication de propulseurs pour missiles)[26]. Des taux dépassant la norme ont été également relevés dans les nappes d'eau potable en Midi-Pyrénées, dans la Garonne, dans la région Toulousaine[26] puis dans le Nord-Pas-de-Calais (Arrageois, région lensoise, Douaisis et région d'Hénin-Beaumont et dans quelques villages alimentés par des forages isolés, avec jusqu'à 4 µg/litre à Douai en 2012) ;
- Nombre des composants de munitions sont rémanents et certains ne sont pas dégradable aux échelles humaines de temps. Par exemple, des années après leur interdiction (là où ils ont été interdits), la grenaille de plomb encore présent dans le sol ou le sédiment continue à empoisonner les oiseaux qui les absorbent[27]
Types de toxicité
Plusieurs types de toxicité sont cités par la littérature scientifique à propos d'une partie des composés libérés par les munitions.
Ils varient bien entendu selon le type de munition, selon la dose et durée d'exposition, sachant également que le composé peut être libéré au moment de la fabrication, de l'explosion ou lentement au cours de la dégradation de munitions ou de leurs composés abandonnés dans l'environnement. L'effet toxique peut être direct (toxicité aiguë pour les organismes présents) ou indirect (ex. : reconcentration par bioconcentration dans le réseau trophique) et/ou différé dans le temps et l'espace (ex. : certains toxiques ne seront libérés dans l'environnement, à partir d'un obus par exemple qu'après plusieurs décennies de corrosion de l'enveloppe de cet obus, ou encore déplétion de la vie du sol et de la matière organique à la suite d'un excès de plomb dans le sol[28]).
Certains composés de munitions sont classés comme :
- cancérigènes (ex. : Ypérite) ;
- neurotoxiques (ex. : plomb, mercure, arsenic même à faible dose pour les deux premiers) ;
- cytotoxiques (ex. : 2,4,6-Trinitrotoluène[29]) ;
- perturbateur endocrinien (ex. : mercure) ;
- génotoxique (ex. : TNT[30]) et/ou mutagènes (ex. : suspecté pour le Trinitrotoluène, le Tétryl ou le RDX[31]). Ces caractéristiques toxicologiques sont d'exploration plus récente. Leur étude bénéficiera de tests et biomarqueurs plus précis qui ont été récemment mis au point (test des comètes ou bioessai sur suspension de salmonelles[32]) ;
- écotoxiques. Les produits toxiques pour l'homme sont écotoxiques pour de nombreuses autres espèces. L'onde de choc et la chaleur libérée par l'explosion d'un obus, d'une roquette, bombe… dans le sol ont aussi des effets écotoxiques immédiats (mais non durables) respectivement en tuant ou blessant les animaux exposés au blast et/ou en les brûlant. Un effet un peu plus durable est la destruction de la matière organique autour du point d'explosion (détruite à 32 à 80 %, selon Kristina Greičiūtė & al. 2007[33]). Outre le plomb et ses additifs (arsenic et antimoine) le cuivre, très utilisé dans les munitions, militaires notamment, n'est toxique pour l'homme qu'à forte dose, mais il l'est à des doses moindres pour d'autres mammifères (mouton par exemple) et à très faibles doses pour certains organismes aquatiques (algues, planctons, invertébrés marins ou leurs propagules). Il a été noté par les chirurgiens en ophtalmologie que les fragments de balle ou chemisage de cuivre ayant pénétré l'oeil y sont moins bien tolérés que le plomb, la poudre de munition ou le verre[34]. Il s'est souvent associé à un effet de souffle traumatisant pour l'œil. De plus comme le plomb, le cuivre et ses alliages ne sont pas aimantables le chirurgien ne peut donc pas s'aider d'un aimant ou électroaimant pour le retirer de l'œil[34]. La toxicité oculaire dépend de l'alliage en cause : « Plus le corps étranger contient de cuivre pur, plus il est toxique. Si le cuivre pur dépasse 85 %, le corps étranger entraîne une chalcose aiguë »[34].
Un même composant de munition (ex. : hexahydro-1,3,5-trinitro-1,3,5-triazine[31]) peut être caractérisé par plusieurs formes de toxicité[31] En outre, certains produits (métaux lourds notamment) peuvent mutuellement renforcer leur toxicité[35] (et écotoxicité) ou exacerber celle d'autres produits (effets dits synergiques et possible effets de potentialisation). Des interactions toxiques, pouvant conduire à la mort, ont aussi été démontrées pour certains composés organiques (charge explosive) de munitions, par des tests faits (1990) sur des rats de laboratoire[36].
Plomb versus « sans plomb »

Ici : munitions de la guerre de Sécession et de la Première Guerre mondiale. Balles de mousquet (ronde) et de fusils.

(A) Balle Impala LS sans plomb (ILS).
(B) Balle Brennecke TAG sans plomb (TAG).
(C) Balle sans plomb Barnes TSX (TSX).
(D) Balle Norma Volcano (NVU) à base de plomb.
Rem : la cavité produite par la balle ILS sans plomb est située la plus « en profondeur » dans le bloc. Il existe des différences considérables entre les balles sans plomb concernant la conversion de l'énergie en volume de cavitation, ainsi que pour le nombre de fragments, leur type de dispersion et la forme de la cavité. La balle TSX sans plomb a des effets remarquablement similaires à ceux de la balle NVU contenant du plomb dans tous les paramètres ici quantifiés, « à l'exception du nombre de fragments »[37] - [38].
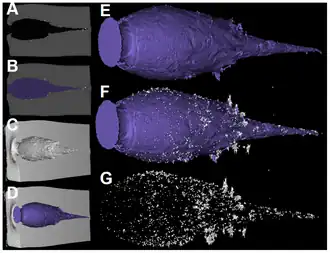
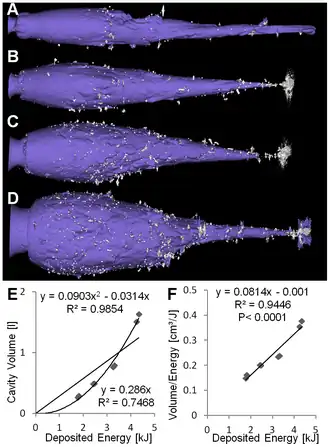
A à D: Cavités à énergies croissantes. De nombreux fragments de plomb toxique sont visibles (gris clair).
E : Cavity volume plotted over deposited energy with higher for the quadratic regression than for linear regression
F: Le ratio volume de la cavité / énergie déposée augmente avec l'énergie déposée. Plus l'énergie cinétique de la balle est important, plus grand est le nombre de fragments de plomb toxique et plus ils sont dispersés.

Depuis l'invention de l'arme à feu, c'est le toxique le plus utilisé dans les munitions, et le plus couramment retrouvé dans les fumées de tir[39]. Durant les guerres, certaines zones ont reçu un grand nombre de balles de plomb provenant des cartouches de fantassins et des obus à balles (ex. : environ un million d'obus tirés le lors de la bataille de Verdun[40] (par 1 407 canons côté allemand[40]).
Les amorces de la presque totalité des milliards de munitions tirées depuis 150 ans par les chasseurs et toutes les armées étaient constituées de fulminate de mercure, puis d'azoture de plomb, contenant deux métaux non biodégradables et susceptibles de durablement polluer l'air, l'eau et les sols et d'affecter les écosystèmes.
En 2004, des analyses réalisées à l'initiative de l'ONF et portant sur 90 échantillons de foies de sangliers provenant de la forêt de Verdun (anciens champs de bataille et polémosylvofacies) ont montré que 11 % des échantillons contenaient une teneur en plomb supérieure à la norme européenne concernant les substances indésirables pour les animaux d'élevage (jusqu'à 12 fois le seuil autorisé…).
Sur ces mêmes zones (les forêts sont des lieux chassés et ont souvent été concernées par les guerres) ou ailleurs, à chaque saison de chasse, et lors de chaque guerre (ou lors d’exercices en extérieur), ce plomb s’est accumulé dans l’environnement.
Le plomb des grenailles de chasse et de ball-trap s'est accumulé sous des formes dangereuses pour les oiseaux d’eau et leurs consommateurs dans les forêts, sur leurs lisières, dans les champs et surtout dans les zones humides, dont le nombre et la surface a par ailleurs beaucoup diminué, forçant les oiseaux à s'y concentrer.
Plusieurs cas sont à différencier concernant leurs causes et impacts :
- Les munitions d’exercice. Elles concernent surtout des sols utilisés pour des activités militaires (stockage, transport[41] - [42]), terrains militaires[33], (champs de tir[43], polygone d'exercice, etc.) qui sont généralement des zones assez bien circonscrites, mais où le taux de plomb peut être localement très élevé. Sur de tels sites, en Europe sur deux terrain militaires (de Gaižiūnai de Kairiai[33]) Kristina Greičiūtė & al (2007) ont par exemple observé une contamination du sol par le plomb s’échelonnant de 5 mg de plomb par kg de sol à plus de 60[33]. Sur ces mêmes sites, la contamination par le plomb et le cuivre était nettement plus dense dans les 20 premiers centimètres puis déclinait jusque environ 1 m de profondeur, alors que celle par le zinc était plus concentrée en surface (20 premiers centimètres) et faibles en dessous[33] ;
- La grenaille de plomb issue du ball-trap (elle est a priori la plus facile à localiser, à inerter et éventuellement à récupérer) ;
- Les munitions de guerre, dispersées, munitions non explosées ; dans cette catégorie figure le cas particulier des munitions chimiques ;
- Les stocks de munitions de guerre non utilisées ou récupérées lors du désobusage ou du déminage. Ce sont souvent des munitions enfouies ou immergées et mélangées. Si elles sont anciennes, en raison de leur corrosion et du risque d'explosion (ou de fuites s'il s'agit d'armes chimiques), elles sont difficiles à identifier, à déplacer et à démanteler, de même que leurs sites d'entreposage[44] et à recycler[45] ;
- Les munitions de chasse à balle ou à grenaille de plomb, de bismuth ou d’autres métaux toxiques très présentes dans toutes les zones humides très chassées[46], assimilables à des déchets toxiques et/ou dangereux en quantités dispersées, difficiles à récupérer, ce qui a justifié que dans les années 1990 l'accord AEWA, en lien avec le PNUE, propose l'interdiction de la chasse à la grenaille de plomb dans les zones humides[47]. Certains oiseaux au bec long peuvent ingérer des billes de plomb qu'ils trouvent en profondeur[48] ;
- Les balles issues de munitions de guerre et autres billes de plomb dispersées par les obus Shrapnel ; ces munitions sont difficiles à récupérer.
L'accumulation de ce plomb peut encore être source de saturnisme chez les animaux sauvages (et potentiellement chez les consommateurs de gibier vivant ou ayant antérieurement vécu sur des zones à risque)[49].
Le plomb mou (pur et non-durci par de l'antimoine ou de l'arsenic) est encore plus propice à se volatiliser, se fragmenter et à causer un saturnisme aggravé et rapide en cas de blessure par balle[50]. À titre d'exemple un homme de 38 ans a été blessé par une munition de plomb mou (30 g) après qu'elle ait traversé une porte (elle était destinée à faire sauter le verrou et/ou les gonds)[50]. Des fragments de cette balle ont été retrouvés dans la partie gauche de son thorax gauche, dans son épaule gauche et dans le plexus brachial gauche. Après un passage en réanimation, le patient s'est vu prescrire une recherche de plomb sanguin (résultat : 1048 μg/L à 7 jours atteignant 1566 μg/L au 11e jour) car il « était en état de fatigue extrême, de constipation et d’atteinte neurologique périphérique cubitale gauche. Un traitement par succimer et de l’EDTA à j14, j21, j44, j61 ainsi que l’extraction chirurgicale de morceaux de plomb à j52 a été réalisé, après amélioration de l’état de santé initial »[50], cependant trois ans après il était encore victime d'un saturnisme chronique (clinique et biologique) nécessitant des chélations successives. Le lieu des résidus de plomb (plèvre et épaule) explique la gravité de ce saturnisme[50]. Les cheveux du patient contiennent encore une dose significative de plomb (qui a la même signature isotopique que la munition qui l'a blessé)[50].
Les problèmes identifiés
L'intoxication saturnine du gibier d'eau a été scientifiquement démontrée dès les années 1950 par Bellrose en Amérique du Nord[51]. Le problème a ensuite été identifié chez de nombreuses autres espèces d'oiseaux, y compris non chassées et de grande taille comme les cygnes[52] - [53]. Chez tous les animaux à sang chaud, le plomb ingéré sous forme moléculaire passe rapidement pour partie dans le sang (le reste est évacué dans les excréments et moindrement dans l'urine)[54]. Il est concentré par les reins et le foie, ou fixé dans le cerveau et les os. Or, les oiseaux d'eau qui n’ont pas de dents recherchent et mangent normalement de petits cailloux arrondis (appelés gritt) qui sont stockés dans le gésier où ils broient les aliments[54] ; à leur place, les oiseaux ingèrent du plomb (ou d’autres métaux lourds toxiques tels que le bismuth). Plus les aliments sont durs, plus ce plomb se solubilise vite[54]. À titre d’exemple, 6 billes de plomb ingérées avec du maïs le matin sont parfois le soir en totalité déjà solubilisées et passées dans le sang du canard qui pourra en mourir. Ce plomb est passé dans son sang 20 fois plus vite que s’il avait été ingéré avec des aliments « mous »[55].
Or le maïs ou le blé dur sont utilisés pour l’égrainage ou recherché par les oies et grues qui s’intoxiquent ainsi dans les champs chassés, ou situés autour des marais chassés ou de ball-trap. Des Bernaches sont ainsi massivement mortes de saturnisme aigu au Canada, dans les champs de maïs et de blé d'automne du Colorado (Szymczak et Adrian, 1978). De même qu’en Grande-Bretagne des oies à bec court et des oies cendrées parfois plus touchées sur des sites de ball-trap en régions agricoles que dans les marais réputés à haut risque (Mudge, 1983). À Oak Hammock (Manitoba), tirer dans les marais était interdit, mais permis dans les champs périphériques. Des Bernaches du Canada qui subsistaient dans les marais mouraient de saturnisme aigu après s'être nourries dans ces champs (Hochbaum, 1993) (la culture sans labour ne favorise pas l’enfouissement des plombs).
Le plomb de chasse contamine la chaîne alimentaire, même dans des régions reculées comme en Alaska[56] et peut affecter l'Homme[57]. Ceci est clairement démontré par le traçage isotopique du plomb, notamment chez les inuits[58]. Les sites de ball-trap sont également très concernés[59].
Des substituts moins toxiques ou réputés non-toxiques existent. La grenaille d’acier semble la solution idéale du point de vue environnemental, testée depuis les années 1970 aux États-Unis après reconnaissance par les autorités gouvernementales de problèmes de saturnismes chez les canards ingérant de la grenaille de plomb sur les lieux de chasse[60]. Le , le conseil national de la chasse et de la faune sauvage a souhaité que la France prenne des mesures concrètes pour tenir ses engagements imminents de l'Accord sur la conservation des oiseaux d'eau migrateurs d'Afrique-Eurasie (interdiction du plomb dans les zones humides pour l’an 2000 au plus tard).
Le plomb n’étant pas biodégradable, la grenaille se délite ou s’oxyde ou est peu à peu érodée ou enfouie, mais reste accessible ou biodisponible des décennies voire des siècles ou des millénaires[54]. Aux États-Unis, une étude a prouvé que la mortalité par saturnisme restait très élevée, même 40 ans après l'interdiction de chasse, sur une zone humide pourtant devenue réserve naturelle[61].
Dans les zones humides très chassées (ex. : Camargue[62] - [63] où dès 1960, Hoffmann identifie le saturnisme comme « fléau de la sauvagine en Camargue »[64], ou Lac de Grand-Lieu selon une publication de chercheurs de l'école nationale vétérinaire de Nantes dans une revue de l'Office national de la chasse et de la faune sauvage[65] par exemple où une étude faite de 1987 à 1990 sur la contamination du milieu par le plomb, sur deux zones chassées, l'une vaseuse et l'autre argileuse, via l'échantillonnage de 2 500 cm3 de sol (« filtrés pour ne retenir que des particules identiques à celles du grit consommé par les canards » ; 70 % des particules étaient des plombs en terrain vaseux (pour 7 prélèvements de sol faits en )[65] et 0,03 à 0,06 % en terrain argileux (pour 20 prélèvements faits en et 16 en [65]) et plus encore dans les zones humides et acides, la biodisponibilité et la bioconcentration peuvent être très aggravées.
Dans les années 1980 on montre que via la prédation, à partir des zones humides chassées, toute la chaîne alimentaire est concernée[66] - [54]. Exceptionnellement, même les plantes pourtant peu sensibles au plomb ne poussent plus ou presque plus…
Enjeux écologiques et sanitaires : Outre que les consommateurs de gibiers à risque (ex. : oiseaux d’eau, bécasse, sanglier) peuvent être victimes d’un saturnisme chronique induit[67], ces intoxications tuent des millions d’oiseaux[54], alors que des alternatives existent depuis longtemps[68] (la grenaille d’acier avait même précédé la grenaille de plomb). Cette forme de saturnisme a aussi des impacts fonctionnels sur les équilibres écologiques, encore mal compris, incluant les aspects prédateurs/proies[54].
Munitions militaires
Le gestionnaire de risque distingue les problèmes posés par les toxiques déjà émis dans l'environnement par le tir de munitions et celui des toxiques encore présent dans des munitions non-explosées ; à titre d'exemple, en France, selon les spécialistes français du déminage interrogé sur le déminage par une commission d'élus présidée par M. Jacques LARCHÉ, Sénateur :
- 1/4 du milliard d'obus tiré pendant la Première guerre mondiale et 1/10e des obus tirés durant la Seconde guerre mondiale n'ont pas explosé pendant ces conflits ;
- depuis 1945 (déminage organisé), plus de 660 000 bombes ont été dégagées, ainsi que 13,5 millions de mines et 24 millions d'obus ou autres explosifs ;
- la dangerosité des munitions ne s'atténue pas avec le temps, au contraire. En 56 ans, 617 démineurs sont morts en service.
De même les démineurs distinguent la toxicité des armes chimiques (intentionnellement hautement toxiques) et celle des munitions dites « conventionnelles » qui contiennent des toxiques fonctionnels, en moindre quantité.
Munitions chimiques
Pour les obus non explosés trouvés après 1918, les démineurs redoutent toujours une fuite des gaz de combat qu'elles peuvent contenir.
Ces produits sont encore actifs dans la plupart des cas, même près de 100 ans après l'armistice de 1918 (fin 1918, 1/3 environ des obus qui sortaient des chaînes de fabrication étaient des munitions chimiques !). Les toxiques présents dans ces obus sont surtout les « Clark I » (chlorure de diphénylarsine) et « Clark II » (cyanure de diphénylarsine) que les démineurs trouvent dans les obus dispersés dans les sols agricoles, urbains et forestiers, notamment dans les obus allemands « à croix bleue ». Les Français ont inventé et utilisé la vincennite (mélange de trichlorure d'arsenic, tétrachlorure d'étain, trichlorométhane (chloroforme) et d’acide cyanhydrique.
Toujours durant la Première Guerre mondiale, des composés organiques halogénés ont été utilisés comme toxiques de combat : ce sont par exemple le bromacétone, le sulfure d'éthyle dichloré (dit ypérite) et le trichloronitrométhane (ou chloropicrine). Des composés chimiques chlorés étaient ajoutés dans les munitions dont le chlorobenzène, tétrachlorure de carbone ; ils sont également toxiques[69] - [70].Hanslian Rudolf, Der chemische Krieg. Berlin, Mittler, 1927, p. 411). La plupart de ces produits sont toxiques à faible, voire à très faible dose[71].
De nombreux autres toxiques (neurotoxiques notamment) ont été développés ensuite, mais ils semblent n'avoir été utilisés que très rarement. Certaines de ces munitions peuvent aussi avoir été jetées dans l'environnement.
Le un rapport d'expertise avait alerté sur l'« état de dégradation extrême » d'un dépôt d'obus chimiques à Vimy avec, malgré les précautions prises, le « danger d'une explosion imminente » et de dispersion de gaz toxique. 12 500 habitants ont été évacués le , pour le transfert sécurisé de 55 t de munitions chimiques vers le camp de Suippes (Marne). 560 habitants du Châtelet-sur-Retourne (Ardennes) ont été déplacés le pour une autre opération de déminage (9 000 obus de 14-18 découverts en janvier 2001 lors de la construction d'un lotissement, transférées vers le dépôt de Laon-Couvron (Aisne).
Ces problèmes ont motivé une proposition de résolution (no 331, 2000-2001), tendant à la création d'une commission d'enquête relative à la présence sur le territoire national de dépôts de munitions datant des deux guerres mondiales, aux conditions de stockage de ces munitions et à leur destruction (présentée par MM. Jacques Machet, Philippe Arnaud, Jacques Baudot et Rémi Herment, sénateurs), et il existe au sénat un groupe d'études sur la sécurité et la défense civile.
Munitions dites conventionnelles
Elles sont également sources de risque de pollution (chronique ou aiguë). À titre d'exemple :
- chaque obus muni de sa douille contient deux amorces contenant chacune deux grammes de fulminate de mercure, soit un gramme de mercure toxique pur) ;
- tous les explosifs nitro-aromatiques (ex. : 2,4,6-trinitrotoluene (TNT), hexahydro-1,3, 5-trinitro-1,3,5-triazine (RDX), octahydro-1,3,5,7-tetranitro-1,3,5-tetrazocine (HMX) ou encore N-methyl-N,2,4,6-tetranitroaniline (tetryl)) présentent une toxicité pour l'homme et/ou l'environnement ; ils laissent des résidus toxiques plus ou moins persistants qui contamineront l'environnement après leur détonation[72] - [73]. (C'est un fait utilisé par les enquêteurs pour identifier les explosifs et leur provenance après un tir ou une explosion). Le nitrotoluène, le nitrobenzène et le nitrophénol, et moindrement le nitroanisol et de nitronaphtaline ont été utilisés dès la Première Guerre mondiale ;
- l'explosif le plus commun en 1914-1918 était l'acide picrique qui est toxique. L'enveloppe (chemise) des munitions et en particulier des obus est très robuste, mais non éternelle. L'oxydation des obus non explosés entraîne la formation de picrates très instables (explosif) qui rendent ces obus de plus en plus dangereux avec le temps ;
- les douilles étaient quant à elles remplies de nitrates (qui sans être toxique lorsque présent à faible dose, pose à des doses plus importantes de graves problèmes environnementaux dont eutrophisation voire dystrophisation des milieux) ;
- le cuivre, le cadmium, le zinc, le plomb, l'arsenic et l'antimoine[35] étaient des composants ou contenus classiques des munitions conventionnelles. Beaucoup d’obus allemands de la période 14-18 contenaient un fumigène à base d’arsenic pour permettre aux artilleurs de mieux repérer le point d’impact de l'obus et régler leur tir. L'arsine a été très utilisée dans les obus chimiques et la destruction d'armes chimiques non utilisées ou non-explosées après les opérations de désobusage a été source de pollutions durables[74]. Ces métalloïdes et métaux sont des polluants majeurs aux doses où ils sont présents dans ces munitions. De plus la toxicité de ces produits est synergiquement exacerbée. Le mercure perdu ou utilisé par les amorces de munitions militaires est surtout lié à la période 14-18 et 39-45 en Europe, dont en Allemagne, Belgique et France (surtout dans la Zone rouge (séquelles de guerre) pour la France) et localement dans les autres pays en conflit, y compris sous la mer en Baltique est un métal volatil qui a pu se diluer plus tôt que les autres dans l'environnement. Sous forme de fulminate dans les amorces, il peut cependant persister plus longtemps.
Divers pays dont le Viêt Nam, le Laos et des pays du Moyen-Orient ont souffert et souffrent encore de graves séquelles de guerre plus récentes, liées aux munitions non explosées, ou aux munitions immergées.
Toxicité des composants d'une munition
Exemples de composés toxiques utilisés dans les armes chimiques
| Nom commun | Nom chimique | Solubilité dans l'eau (en gramme/litre) (+/- selon température, salinité, agitation) | Commentaire |
|---|---|---|---|
| Bertholite Chlore | Chlore (no CAS : ) | ? | Corrosif, irritant pulmonaire, utilisé dès 1915 |
| Bromoacétone | Bromoacétone (no CAS : ) | Assez peu soluble dans l'eau | Gaz lacrymogène, toxique |
| Bromure de xylyle ou T-Stoff | Bromure de xylyle, Bromure de méthylbenzyle (C8H9Br) Cet organobromé a 3 isomères désignées collectivement par le no CAS | ? | Gaz lacrymogène et toxique utilisé dès 1914, il sera l'un des composants des « obus à croix blanche » allemands (Weisskreuz). le T-Stoff et utilisé comme gaz de combat notamment dans des obus sur le front russe, où il fit 9 000 morts[75]. Il sera ensuite aussi un composant de carburant pour avions-fusées. |
| Adamsite (arme chimique) Agent DM, Sternite | Diphenylaminechlorarsine, 10-chloro-5,10-dihydrophenarsazine no CAS : | Presque insoluble | Synthétisé en 1915, utilisé durant la première guerre mondiale |
| CA [BBC] | Bromobenzyl Cyanide (no CAS : ) | Presque insoluble | |
| CAP | α-Chloroacétophénone (no CAS : ) | < 1 | |
| Chloropicrine | Trichloronitrométhane | Moyennement soluble : 1 620 mg·l-1 à 5 000 mg·l-1 à 22 °C, stable (pas d'Hydrolyse) à pH 7 | Également utilisé pour « gazer » des animaux dits « nuisibles » dans leur terrier |
| CK | Chlorure cyanurique (no CAS : ) | Soluble dans l'eau (60 à 70, voire 158 selon les sources) | |
| Chlorure d'étain(IV) | Tétrachlorure d'étain, Chlorure stannique no CAS : | Soluble dans l'eau froide | |
| Clark I | chlorodiphénylarsine (no CAS : ) | 2 | |
| Clark II | Diphénylcyanoarsine (no CAS : ) | 2 | |
| ZyKlon-B (Cyclon-B) | Cyanure d'hydrogène (Hydrogen Cyanide) (no CAS : ) | Miscible (1500) | |
| Diphosgène (ou « Agent DP ») | Trichlorométhyl chloroformate no CAS : | Presque insoluble | Ce produit a remplacé le diphosgène |
| Éthyl 2-Bromoacétate no CAS : | ? | Lacrymogène, d'abord utilisé par la police française en 1912, puis comme composant des obus à croix blanche (Weisskreuz) | |
| HN-2 | 2,2'-Dichloro-Nméthyldiéthylamine (no CAS : ) | Modérément soluble (12) | |
| HN-3 | Tris(2-chloroéthyl)amine N(CH2CH2Cl)3 (no CAS : ) | Insoluble (0.16) | Cytotoxique, vésicant |
| KSK [SK] | Ethyl Iodoacétate [623-48-3] | Insoluble | |
| Lewisite 1 [Agent L] 1 | 2-Chlorovinyl dichlorarsine (2-chlorovinyldichlorarsine) (no CAS : ) Lewisite 1 : 2-Chlorovinyldichlorarsine (2-chloroethenyl) (arsinous dichloride pour les anglophones) (no CAS : ) | Quasi-insoluble (0.51), mais un peu plus que l'Ypérite | Vésicant, cytotoxique, utilisé lors de la Première Guerre mondiale et de la guerre sino-japonaise |
| Lewisite 2 [Agent L] 2 | Lewisite 2 : Bis(2-chlorovinyl)chlorarsine (bis (2-chlorovinylarsonous) chloride pour les anglophones) (no CAS ) | Quasi-insoluble (0.51), mais un peu plus que l'Ypérite | Vésicant, cytotoxique, utilisé lors de la Première Guerre mondiale et de la guerre sino-japonaise |
| Lewisite 3 [Agent L] 3 | Lewisite 3 : Tris(2-chlorovinyl)arsine. (tris(2-chlorovinyl)arsine pour les anglophones) (no CAS ) | Quasi-insoluble (0.51), mais un peu plus que l'Ypérite | Vésicant, cytotoxique, utilisé lors de la Première Guerre mondiale et de la guerre sino-japonaise |
| Gaz moutarde Ypérite | Bis-(dichloroéthyl)-sulphide (no CAS : ) | Très peu soluble dans l'eau, car forme une croûte protectrice (0 à 0.07, mais jusqu'à 0,8 selon les sources) | Vésicant, cytotoxique, utilisé lors de la Première Guerre mondiale |
| Gaz Moutarde T [O-Mustard] | Bis(2-chloroethylthioethyl)ether (no CAS : ) | ? | Vésicant, cytotoxique, utilisé lors de la Première Guerre mondiale |
| N-Mustard [N-Lost, HN-1] | N-ethyl-2,2-dichlorodiethylamine (no CAS : ) | Presque insoluble | |
| Phosgène | Dichlorure de méthanoyle, Oxychlorure de carbone ou dichlorure de carbonyle no CAS : COCl2 | Très soluble dans l'eau avec laquelle il réagit (9) | Agent suffocant utilisé dès la première guerre mondiale |
| Sarin [Agent GB] | (RS)-O-isopropyl méthylphosphonofluoridate ou O-Isopropyl Méthylphosphonofluoridate no CAS : | Miscible à l'eau | Violemment neurotoxique (0,01 ppm peut être fatal). |
| Cyclosarin [Agent GF] | cyclohexyl méthylphosphonofluoridate | ? | Violemment neurotoxique |
| Soman [Agent GD] | méthylfluorophosphonate de pinacolyle (IUPAC) no CAS : | Données variant selon les sources : 15 à 34 ou moins de 21 | Hautement neurotoxique (deux fois plus que le Sarin, mais moins que le cyclosarin |
| Tabun [Agent GA] | éthyl N, Ndimethylphosphoramidocyanidate no CAS : | Miscible dans l'eau (72 à 120, selon les sources) | |
| Ypérite d'hiver | bis-(dichloroethyl)-sulphide [63 %] and 2-chlorovinyl dichlorarsine [37 %] (no CAS : et ) | ? | produit conçu pour être efficace dans le froid (moins soluble que l'Ypérite) |
Exemples d'agents toxiques ou écotoxiques de type explosif ou agent propulsif (utilisés dans les douilles, amorces, canons de marine, fusées…)
| Nom commun | Nom chimique | Solubilité dans l'eau (en gramme/litre) (+/- selon température, salinité, agitation) | Commentaire |
|---|---|---|---|
| Fulminate de mercure | Fulminate de mercure [CAS:628-86-4] | Très peu soluble (souvent mélangé à une cire) | |
| Amatol | 2,4,6-Trinitrophénol + Nitrate d'ammonium [CAS:8006-19-7] ; [CAS:88-89-1] et [CAS:6484-52-2] | Complètement soluble (14) | Eutrophisant |
| Cordite | Propulsif qui a connu de nombreuses formulations, à base de Nitrocellulose ; Nitroglycérine; nitroguanidine | Peu soluble (souvent mélangé à une cire) | Eutrophisant à long terme |
| HMX | Octahydro-1,3,5,7-Tetranitro-1,3,5,7-Tetrazocine [CAS: 2691-41-0] | Quasi-insoluble | |
| Lyddite | Acide picrique 2,4,6-Trinitrophénol [CAS:88-89-1] | Lentement soluble (14) | |
| PETN | Tétranitrate de pentaérythritol (Pentaérythritol tétranitrate) [CAS:78-11-5] | Faiblement soluble (<1) | |
| RDX cyclonite hexogène | Cyclotriméthylènetrinitramine Hexahydro-1,3,5-trinitro-1,3,5-triazine [CAS:121-82-4] | Insoluble | Explosif militaire parmi les plus puissants |
| Shellite | 70 % 2,4,6-Trinitrophénol + 30 % 2,4-Dinitrophénol [CAS:88-89-1] et [CAS:51-28-5] | Soluble (2,8 à 14 selon les sources) | Le dinitrophénol (dont existent 6 isomères) est toxique et écotoxique. (C'est un découplant de la chaîne respiratoire mitochondriale) |
| Tetryl | 2,4,6-Trinitrophénylméthyl nitramine [CAS:479-45-8] | Très peu soluble (0.2) | |
| TNB | 1,3,5-Trinitrobenzene [CAS:99-35-4] | Peu soluble (0,35) | |
| TNT | 2,4,6-Trinitrotoluène [CAS:118-96-7] | Très peu soluble (0,1) | |
Munition de tir sportif, et d'entraînement en salle
La récupération des projectiles est aisée en salle (balles et/ou diabolos de carabine ou pistolet à air comprimé), mais parfois plus délicate lorsque le projectile se pulvérise sur une surface dure (tirs sur cibles métalliques) ou en extérieur. Par ailleurs, les ogives semi-blindées comportent à leur base une surface non protégée qui, sous l'influence de la chaleur et de la pression de l'explosion de la charge propulsive tend à se vaporiser ou à disperser de fines particules de plomb et d'autres substances toxiques. Enfin la fumée de tir est dans tous les cas toxique. D'où la nécessité impérative d'un nettoyage efficace et régulier des salles de tir.
Des risques existent donc pour la santé. Ils peuvent être atténués par un usage généralisé de munitions alternatives. Les systèmes de ventilation forcée à flux laminaire sont efficaces pour protéger le tireur, mais que deviennent les vapeurs nocives généralement non filtrées et envoyées à l’extérieur ? Aux États-Unis, l'USEPA et la National Rifle Association préconisent la récupération et le recyclage du plomb dans les centres de tir (Sever, 1993). La fonte du plomb pour recyclage n’est cependant pas sans risque, ni sans produire des déchets toxiques.
Munitions de chasse
Munitions à balles
Elles semblaient poser moins de problème à court et moyen terme car on pensait qu'elles n’intoxiquaient « que » de gros animaux, nécrophages (dont certains rapaces tels que les vautours et condors) mais des études plus récentes ont montré qu'à l'impact de nombreuses balles se fragmentent et libèrent des particules et petits fragments de plomb bien plus contaminants que les gros morceaux les plus visibles[76] - [77].
Cartouches à grenaille de plomb
Elles sont responsables d'un grand nombre de cas de saturnisme aviaire, d’abord cité et étudié au Canada et aux États-Unis (dès le début du XXe siècle), puis très tardivement étudié en Europe où pourtant le plomb est utilisé en quantité plus importantes et depuis longtemps. Comme l'a montré D. Pain, les oiseaux empoisonnés se cachent soigneusement pour mourir, échappant ainsi aux observateurs, mais une expérience consistant à comparer (en Californie ; sur une réserve de 4 300 ha (39° 29′ N, 122° 20′ O) des canards dits « sentinelles » enfermés dans un enclos construit dans une zone autrefois chassées (puis transformée en réserve naturelle) à des canards « témoins » également enfermés mais dans un enclos construit à proximité a montré que les canards sentinelles contenaient près de deux fois plus de plomb que les autres[78].
Quantités
Selon un document de consensus scientifique de 2013, puis un document semblable, mais pour l'Europe[79], les munitions de chasse à base de plomb « sont probablement devenues la source de plomb la plus importante, largement non réglementée, sciemment déversée dans l'environnement aux États-Unis [et en Europe](…) La production de munitions à base de plomb est la seconde plus importante source de consommation annuelle de plomb aux États-Unis, représentant plus de 60 000 tonnes de plomb en 2012, après la consommation de plomb dans la fabrication des accumulateurs »[80].
Une cartouche moyenne contient 200 à 300 billes de plomb soit 30 à 35 g de plomb toxique (sachant que pour abattre un seul oiseau, il faut tirer 3 à 6 cartouches selon les sources).
Si chaque chasseur français (il y en a environ 1,7 million) n’utilisait qu’une seule cartouche de 32 g chaque année, il y aurait déjà 54,5 tonnes de plomb dispersées dans l'Environnement, soit 545 tonnes en 10 ans ! On estimait dans les années 1990 qu’en France, 250 millions de cartouches étaient tirées annuellement ;
- 3/4 pour la chasse (~6 500 t/an de plomb)
- 1/4 pour le ball-trap (plus de 2 000 t/an)
Tendance
En 1987, environ 405 millions de cartouches auraient été tirées (soit 12 960 t de plomb épandu en France métropolitaine en un an, à raison de 32 g/cartouche. En 1999, l'estimation était d'environ 250 millions de cartouches/an (8 000 t/an). Les émissions annuelles de plomb diminuent donc, mais il y a aggravation par accumulation ; le plomb émis chaque année devant être ajouté à celui des années précédentes, qui n’a pas disparu (le plomb n’est pas biodégradable).
Dans les dunes, sur l’estran ou dans les torrents, les plombs sont parfois rapidement érodés.
En Camargue, une étude a permis de montrer une augmentation de + 35 % du taux d'ingestion de 1965 à 1980 chez le canard Pilet (Anas acuta). Plus on a attendu pour supprimer le plomb, plus il était disponible, plus les intoxications ont pu être graves et nombreuses. Les munitions au plomb ont été interdites en France à partir de 2006 dans les zones humides.
Les oiseaux sont d’autant plus contaminés, que les plombs sont les plus nombreux, précisément là où ces oiseaux viennent s'alimenter, aux endroits les plus recherchés par les chasseurs d’oiseaux d’eau (200 000 à 300 000 en France vers l'an 2000). Autour des huttes, mares et étangs artificiels conçus pour attirer les oiseaux d’eau, on a trouvé jusqu'à 20 plombs no 4 dans le gésier d’un canard colvert (6 auraient suffi à le tuer).
À titre d’exemple, le cygne trompette a subi des mortalités massives dans le sud-ouest de la Colombie-Britannique - depuis 1925 ; ce sont 29 cygnes trompettes intoxiqués par le plomb qui ont été collectés en 1992, dans le lac Judson, en Colombie-Britannique. Le saturnisme par ingestion de grenaille de plomb reste la première cause de mortalité des cygnes trompettes et des cygnes siffleurs sauvages dans l'État de Washington (= 29 % de la mortalité constatée). Au moins 10 000 cygnes appartenant à 6 espèces auraient été déclarés morts de saturnisme dans 14 pays. Certains se sont demandé s’il pourrait y avoir un lien avec l’hypersensibilité apparente du cygne et du canard à la grippe aviaire en Europe, mais un éventuel lien ne semble pas avoir été étudié.
Au Canada : 1,2 à 6 millions d’oiseaux d’eau absorbaient des plombs (grenaille, voire plomb de pêche) chaque année avant interdiction ou restriction du plomb.
Entre 240 000 et 1,2 million d'oiseaux en mouraient chaque année estimait le gouvernement canadien.
On ignore quand les plombs existants seront indisponibles pour les oiseaux. (cf. vitesse d’enfouissement, bioturbation, montée des océans, etc.)
La situation était jugée « catastrophique » pour les oiseaux d’eau dès les années 1970 (U.S. Fish Wildl. Serv.)
La Réserve de Rice Lake (Illinois) a vu 1 500 oiseaux morts de saturnisme au printemps 1972. 75 % des Aythya affinis (canard plongeur) étudiés avaient au moins un plomb visible dans le gésier.
Mortalités souvent discrètes, parfois inattendues
Au Canada, l’hiver 1974–1975 l’inondation accidentelle d’un ancien ball-trap utilisé par les officiers de l’aviation royale canadienne durant la 2de guerre mondiale a brutalement tué par saturnisme aigu des centaines de canards et d'oies morts après y avoir picoré des billes de plomb. La dépollution du site a coûté plusieurs milliers de dollars américains.
Près de Montréal, ce sont des centaines de colverts, canards noirs, bernaches du Canada et cygnes siffleurs qui se sont empoisonnés pour les mêmes raisons. Des mortalités massives d’oiseaux domestiques ont été observées sous des retombées de ball-trap et par l’ONC dans un cas à la suite de retombées de « pluies de plomb » sur un élevage, émises par des chasseurs postés sur un pylône de chasse à la tourterelle, tirant dans la direction de cet élevage.
Ailleurs des poules, canards, oies, moutons ou des vaches ont ponctuellement été signalées mortes d’intoxication aigüe pour ces raisons en France, aux États-Unis, en Irlande.
Des cas de saturnisme létal et sublétal par ingestion de végétaux ensilés (acide) et/ou ayant poussé sur zone chassée ou sous un ball-trap ont également été signalés.
Par exemple, plusieurs milliers de billes de plomb se sont retrouvées dans la panse de vaches au Nord de la France, billes avalées via du maïs fourrager ayant poussé près d’un site de ball-trap.
De la luzerne (ensilée et acidifiée) reste contaminée et toxique, même après retrait des grenailles si ces dernières sont restées en contact avec la luzerne durant plusieurs semaines.
Contamination de la pyramide alimentaire
Aux États-Unis et en France, des études montrent respectivement que des gypaètes et des busards des roseaux étaient mortellement ou gravement contaminés (100 % des rapaces analysés gravement touchés pour la Camargue et le marais poitevin !). C’est d’ailleurs pour protéger le pygargue à tête blanche, emblème national du pays, que le plomb a été interdit aux États-Unis.
Contrairement à une idée reçue, bien d’autres espèces que les canards ou les cygnes sont touchées. Tous les oiseaux souffrent ou meurent de saturnisme s'ils avalent des plombs. Ainsi aux États-Unis une étude faite dans trois États a montré que 1 % à 6,5 % des tourterelles échantillonnées avaient des plombs dans le gésier ou de taux excessifs de plomb dans leurs tissus.
Et un saturnisme primaire a notamment été confirmé pour :
- Colin de Virginie
- Colin écaillé
- Faisan à collier
- Foulques
- Grue du Canada
- Perdrix grise
- Râle de Caroline
- Râle élégant
- Râle gris
- Plusieurs autres oiseaux des berges et rivages
Danger pour la santé humaine
Selon un document de consensus scientifique de 2013, basé sur « les meilleures données scientifiques disponibles »[80], le tir de munitions à base de plomb et l'accumulation de grenaille de plomb dans l'environnement posent des risques importants pour la santé humaine et des animaux sauvages, car :
- ) l'abandon de millions de balles et de grenaille de plomb dans la nature augmente considérablement les niveaux de plomb dans l'environnement[81], « en particulier dans les zones où l'activité de tir se concentre »[82] ;
- ) « l'utilisation de ces munitions présente aussi des risques d'exposition élevée au plomb pour leurs utilisateurs »[83] ;
- ) « Les balles à base de plomb utilisées pour tuer des animaux sauvages peuvent se fragmenter en centaines de petits morceaux, une grande proportion étant suffisamment petite pour être facilement ingérée par les animaux nécrophages ou incorporée dans la viande transformée pour la consommation humaine »[76] - [77] - [84] ;
- ) « Ces munitions à base de plomb sont une source importante d'exposition au plomb chez les humains qui mangent du gibier sauvage »[85] - [86] ; Les chasseurs consommant ce gibier ont souvent des grenailles ou fragments de plomb dans leur tractus gastro-intestinal[87] - [88].
Plusieurs pays européens dont l'Allemagne (2011)[89], l'Espagne (2012)[90], le Royaume-Uni (2012)[91] et la Finlande (2013)[92] ont formulé des avis officiels sur les risques qu'il y a à consommer fréquemment du gibier tiré avec des munitions au plomb, en particulier pour les jeunes enfants, les femmes enceintes ou les femmes souhaitant avoir des enfants.
Le plomb de munitions encore présent dans la viande est un danger pour la santé des consommateurs : chauffé, le plomb se diffuse plus facilement dans la chair cuite (plus encore en présence d'acide tel que vinaigre, citron, orange) et est absorbé plus facilement par le tube digestif[93].
Plombs incrustés
Un autre problème est que de nombreux oiseaux ne sont que blessés à la chasse ; ils s’enfuient avec des plombs incrustés dans leur chair. 20 à 30 % des individus apparemment sains d'oiseaux d’eau échantillonnés dans de nombreux endroits en Amérique du Nord étaient porteurs d'un ou de plusieurs plombs incrustés. Même chez des espèces protégées et difficiles à confondre avec des espèces chassables (jusqu’à 15 % des cygnes d'une population protégée de cygnes trompettes !). Il a été plus récemment démontré que des vautours et condors s’intoxiquent par ingestion de billes de plomb présentes dans la chair des cadavres qu’ils consomment ou en consommant la chair enrichie en plomb autour des blessures par balles qui ont tué des animaux qu'ils consomment. Le condor de Californie, second plus grand oiseau du monde est menacé de disparition (Janssen et al., 1986) et le saturnisme induit par la chasse semble -avec les collisions avec des véhicules ou lignes électriques - rester sa 1re cause de mortalité (chez l'adulte, les jeunes étant artificiellement nourris).
Les canards plongeurs se nourrissent dans les sédiments là où les plombs s'accumulent. Ils sont, comme on peut s'y attendre, plus vulnérables ; 2 à 3 fois plus fréquemment porteurs de grenaille dans le gésier que les autres ; l’ingestion de billes de plomb est ainsi 2,13 fois plus fréquente chez le morillon à collier que pour la moyenne des canards de surface (10,9 % contre 5,1 %), avec une concentration osseuse 2,8 fois plus élevée (48 % contre 17 %).
Sur le seul lac de Grand-Lieu (avant 1980 et la mise en réserve), 3 à 4 tonnes de plomb étaient tirées chaque année (avant mise en réserve). Plus de 37 % des fuligules milouins et plus de 13 % des colverts se sont avérés touchés par des problèmes graves de saturnisme. En France, la Camargue, l’estuaire de la Seine et de nombreuses zones humides, y compris classées en réserve naturelle (Oye-Plage par exemple) sont touchées.
Le cas du ball-trap
Le risque est aggravé en zones humides et/ou acides et accru à proximité des zones humides, forêts, landes, champs, élevages en plein air ou en enclos, pâturages, zones de cultures d’ensilage ou de fourrage, mais les sites très utilisés par le ball-trap sont tous gravement pollués, bien au-delà des normes en général. Par exemple, on a mesuré 215 millions de plombs/ha dans un cas.
Les « règlements » nationaux, et le règlement olympique imposent encore le plomb pour le tir et le ball-trap. L'Union internationale de tir et le Comité international olympique considéraient en 1994 que le tir sur cibles ne contribuait pas de façon sensible au problème de l'accumulation de grenailles de plomb dans l'environnement (Thomas, 1994).
En 2008 en Suisse, la plupart des clubs Ball-Trap utilisent des cartouches photodégradables et des pellets en acier (Bernard, 2007).
Le cas du tir à air comprimé
Dans ce cas les problèmes sont liés à l'utilisation de diabolos en plomb. Ils peuvent être récupérés et recyclés dans une filière appropriée et légale (la fonte artisanale du plomb expose ceux qui la pratiquent au saturnisme), mais c'est rarement le cas, hors des stands de tir. Le tir à air comprimé en extérieur est cause de dispersion de plomb dans l'environnement susceptible de poser problème à terme, même si la taille de ces plombs les exposent moins à être mangés par des oiseaux.
En particulier les plombs fichés dans l'écorce et le troncs des arbres peuvent poser des problèmes différés de pollution (ex. : combustion ou usinage du bois, qui seront source de vapeur de plomb).
Responsabilités
Elle est largement partagée (du fabricant à l'utilisateur en passant par le législateur), transfrontalière (une partie des migrateurs migrent avec du plomb ingéré et/ou accumulé), et pour ce qui concerne les contaminants non biodégradables ou les polluants organiques persistants (POPs), elle est aussi transgénérationnelle (elle concerne les générations futures).
De nombreuses alternatives existent aux composés les plus toxiques. Certains pays (Amérique du Nord, Europe du Nord) les ont rendues plus ou moins obligatoires.
Dans les pays en développement, la question semble rarement évoquée.
Pistes solutions, expérimentations
Concernant les munitions de chasse
Il y a un consensus scientifique sur le fait que tant pour des raisons de protection des écosystèmes, de la ressource en gibier que de santé publique le plomb doit être supprimé de toutes les munitions[94].
Depuis 2011, l'OMS considère qu'il n'y a pas de doses de plomb qui puisse être ingérée sans risque[95] - [96] ; les vendeurs et exportateurs de viande contenant des restes de plomb prennent donc une responsabilité en mettant sur le marché des viandes contaminées par des résidus et fragments de balle ou grenaille de plomb. (À titre d'exemple : vers 2015, la Nouvelle-Zélande exportait pour leur viande plus d'un million d'animaux sauvages par an, très souvent tués par des balles de plomb[97].
Munitions dites « alternatives » au plomb. Elles existent depuis plusieurs décennies[98], y compris pour le grand gibier[99] - [100] - [101] et sont même parfois même plus performantes que le plomb. Mais bien que disponibles dans une large gamme de calibres et vendues par au moins 30 marques américaines et 13 marques majeures en Europe (en 2015)[102] (y compris pour des modèles rares et récents d'armes) elles ne sont en 2015 que très peu utilisées, pour des raisons de perception de disponibilité, de coûts, d'efficacité/précision, d'autres formes de toxicité et d'encrassement du fusil. Selon les études récentes, en Europe, les coûts et efficacités sont maintenant similaires. Les craintes de perceptions et de précision réduite, et d'encrassement du fusil doivent être vérifiées par l'industrie et les organisations de chasseurs (et si elles sont fondées donner lieu à des solutions)[101]. Il existe des balles sans plomb à fragmentation, qui laisseront des fragments dans la viande (mais ces fragments seront non-toxiques ou bien moins toxiques que le plomb).
Les bénéfices environnementaux des alternatives au plomb sont prouvés : Par exemple pour protéger le Condor de Californie au bord de l'extinction (et dont la première cause de mortalité dans les années 1980 était le saturnisme aviaire), l’État de Californie a interdit en 2008 l'utilisation de munitions au plomb pour la plupart des actions de chasse effectuées dans les territoires fréquentés par cet oiseau[103].
Une étude a ensuite évalué l'efficacité de cette interdiction, en mesurant sur le même territoire la plombémie chez deux espèces sentinelles d'oiseaux, l'aigle doré (Aquila chrysaetos) et le vautour Cathartes aura un an après la mise en œuvre de l'interdiction[103]… et en comparant ce taux de plomb à ce qu'il était avant l'interdiction : La plombémie de ces oiseaux a « considérablement diminué après l'interdiction[103]. Ces résultats fournissent des preuves que le fait que les chasseurs se conforment aux règlements sur les munitions sans plomb suffit à réduire l'exposition au plomb chez les oiseaux prédateurs et nécrophages sur ces sites d'étude »[103].
En 2017 hormis en Californie où il est stipulé qu'une balle dite sans plomb (doit en contenir moins de 1 % en masse[104] il n'existe pas encore de norme nationale ou internationale définissant des critères clairs de non-toxicité pour les substituts de balles au plomb.
Pour les grenailles sans plomb un processus d'étude de la toxicité éventuelle des alternatives a été mis en place aux États-Unis à la fin des années 1990 (par le US Fish and Wildlife Service), uniquement pour les substituts aux grenailles de plomb utilisés pour la chasse au gibier d'eau[105].
Le cuivre est phytotoxique à faible dose pour les algues, et mortel pour divers microorganismes et de nombreux invertébrés aquatiques (c'est pour cela qu'il est utilisé dans les antifoulings et la bouillie bordelaise ; et le vert-de-gris semble toxique pour tous les organismes). Selon le études publiées de 2008 à 2015, sous forme de granulés de cuivre métallique (non oxydés) ingérés par des oiseaux ou mammifères, il ne se montre cependant pas toxique, y compris pour l'homme qui en ingère des fragments [106] - [107] - [108] - [109].
Selon Paulsen et al. en 2015 les doses de métaux libérés par la fragmentation des balles sans plomb dans des conditions simulées de stockage de la viande et d'ingestion humaine sont (pour les tests faits sur le cuivre, le fer, le zinc, l'étain et l'aluminium) moindres que les apports maximaux quotidiens recommandés pour les humains, et inférieures aux limites fixées par les grandes agences sanitaires[110]. Les auteurs signalent toutefois qu'une marque de balle vendue comme sans-plomb (Bionic Black, produite par la société RWS), contenait quand même 1,9 % de plomb en masse[110].
Risques organoleptiques. La chair d'animaux, les restes de sang et de lymphe contiennent de nombreux composés dont des enzymes et acides naturels qui restent actifs ou évoluent après la mort. Ils interagissent chimiquement avec les fragments, nanoparticules et particules métalliques dispersées par les munitions dans la chair. Certains métaux (alternatifs au plomb) ainsi libérés dans la viande pourraient modifier sa qualité organoleptique et/ou poser d'autres problèmes de toxicité ou poser des problèmes d'hygiène de conservation. Au moins deux études ont porté sur cette question. Elles n'ont pas identifié de risques particuliers :
- Dans le cas de projectiles en cuivre, des craintes existaient quant au risque qu'elles puissent contribuer à une modification du goût de la viande en oxydant les graisses. Une expérience a consisté d’ajouter de la poudre de cuivre (jusqu'à 28 mg/kg) dans des viandes hachées de porc et bœuf. L'indice de peroxyde (indice de rancissement) a augmenté après le chauffage à sec (et durant le stockage ultérieur), mais aux doses les plus élevées, l'oxydation des graisses a été retardée (de la même manière qu'on l'observe en introduisant du cuivre dans l'huile). La corrélation des substances réactives POV et acide thiobarbiturique (c'est-à-dire des produits d'oxydation secondaires) était forte et positive. Rien dans les résultats n'indiquent que le cuivre incorporés à la viande à partir de fragments de balles conduirait à une augmentation de l'oxydation des graisses dans la venaison ; au contraire selon les auteurs un taux de cuivre plus élevé pourrait freiner l'oxydation des graisses. C'est l'effet pro-oxydant des ions fer libérés à partir de la myoglobine lors de la cuisson et les différences en acides gras propre à chaque espèce chassée qui sont les facteurs d'oxydation des graisses[111].
- Le nickel est associé au cuivre dans les balles dites cupro-nickel ; chez 30 chevreuils et 3 cerfs sika tués avec des balles de cuivre nickelé, les taux de nickel et de cuivre (prélevés à 2-3 cm des blessures par balle) n'étaient pas significativement différents des contrôles faits dans la cuisse. Cependant chez l'Homme, au contact des muqueuses le nickel peut être source de démangeaisons, de prurit et parfois d'allergies[112]. Un test a consisté à immerger un type de balle cupro-nickel dans du « jus de viande » durant 7 jours (la venaison est couramment conservée plus de 7 jours avant cuisson) ; le projectile y a libéré jusqu'à 93 μg de Ni/10g de masse de balle. Une balle de construction identique mais faite de cuivre non-nickelée a elle libéré jusqu'à 250 μg de cuivre. Des balles chemisées de nickel entourées d'échantillons de viande de porc ont lors de tests de cuisson libéré de 2,8 à 4,3 μg de nickel vers la viande environnante. Les auteurs ont conclu de ces tests que « Selon les scénarios de contamination, les teneurs en Cu et Ni par portion de viande augmenteraient (respectivement de 20 et 3,3 μg) ; pour limiter l'absorption de cuivre et de nickel dans l'alimentation le besoin technologique de plaquage ou chemisage au nickel doit être soigneusement évalué ».
Concernant les munitions militaires immergées
De nombreux pays, après les avoir oublié inventorient[113] - [114] leurs dépôts de munitions non explosées, dans une perspective d'évaluation du risque[115], y compris, immergés et en particulier quand il s'agit d'armes chimiques, dont en mer Baltique par exemple[116], en cherchant à mieux évaluer les impacts écologiques et sur la faune, piscicole notamment[117].
Législation
Depuis des décennies, de nombreux auteurs plaident pour la généralisation obligatoire des munitions de chasse sans plomb, au double bénéfice de la santé humaine et de celle de la faune[118].
Le passage aux munitions sans plomb (ou dites « non toxiques ») est peu à peu imposée par des lois limitant ou interdisant l'utilisation ou la possession de grenailles de plomb et de balles de fusil (dans les zones humides au moins)[119], mais ces lois semblent parfois ou localement peu respectées, au détriment des écosystèmes et de la sécurité des consommateurs de gibier ; ainsi dans un texte de consensus publié par l'ONU, l'AEWA constatait en 2012 que les risques « subsistent en raison de l'absence de réglementation et, là où des réglementations existent, d'une mauvaise conformité et d'un manque d'application efficace »[120]. Et, à titre d' exemple, « le respect des réglementations introduites en 1999 restreignant l'utilisation de la grenaille de plomb pour tirer sur la sauvagine en Angleterre s'est avéré très faible, 70 % de la sauvagine d'origine locale achetée ayant été abattue illégalement avec du plomb[121]. Malgré cela, il n'y a pas eu de poursuites primaires et seulement une poursuite secondaire pour non-respect de la réglementation ».
Certains pays, pour certains usages obligent maintenant l'utilisation de munitions certifiées non toxiques ou moins toxiques : dans certains secteurs (comme les zones humides en France) ou pour certains types de chasse (chasse au gibier d'eau le plus souvent)[119].
L'Accord sur la conservation des oiseaux d'eau migrateurs d'Afrique-Eurasie (AEWA) visait à arrêter entre 1990 et 2000 toute utilisation de grenaille de plomb pour la chasse de certains oiseaux migrateurs (espèce connues pour être particulièrement vulnérables au saturnisme aviaire avec 254 espèces et 119 pays concernées).
Mais en 2019, dans l'union européenne, seuls le Danemark et les Pays-Bas avaient déjà totalement interdit la grenaille de plomb, dans tous les types de milieux. 16 pays l'avaient interdit dans toutes les zones humides (ex : France, Belgique) et parfois plus généralement pour toute chasse aux oiseaux d'eau. Et 5 pays n'interdisaient le plomb que dans certaines zones humides[119]. En Allemagne, la réglementation différait selon les régions.
En Amérique du Nord, la grenaille de plomb est interdite pour la chasse à la sauvagine[119].
Dans les pays concernés, la grenaille de plomb a été remplacée principalement par de la grenaille d'acier ou, moins fréquemment, par des alliages à base de bismuth ou de tungstène.
Parfois, certains produits ou composants de munitions sont ou pourraient être recyclés[122].
Certains champs de tir suggèrent ou imposent l'utilisation de munitions non-toxiques.
Les plans d'urgence et de gestion des risques peuvent inclure une dimension « munition » (cf. risque chimique et d'explosion)[123].
En 2014, pour la COP11 de la CMS, deux documents de consensus scientifique basés, selon leurs auteurs, sur des « preuves scientifiques accablantes », ont été fournies à l'ONU et aux représentants des États-membres, respectivement par le conseil scientifique de la CMS, et par et par le groupe de travail "Preventing Poisoning" avec la demande express qu'ils soient inclus en tant que déclaration dans les documents d'information de la COP11. Le 1er document est une déclaration sur les risques pour la faune et la santé humaine liés aux Munitions en Europe (publié en octobre 2014) et le second est une déclaration, signée en mars 2013, sur les risques pour la santé humaine induits par le plomb des munitions dispersé dans l'environnement[124]. Ces alertes portaient sur des données essentiellement récoltées aux Etats-Unis[125] et en Europe, mais la plupart des pays sont concernés par le problème. Elles portaient notamment sur le nombre et la gravité des empoisonnements d'oiseaux et autres animaux par le plomb de chasse, et sur le fait que les munitions à base de plomb sont devenues « la source non réglementée la plus importante de plomb délibérément émis dans l'environnement dans l'UE » où comme aux Etats-Unis, les autres sources de plomb[126] avaient dans les 50 années précédentes disparu ou fortement diminué grâce à la réglementation environnementale. En 2021, selon l'ONU le consensus scientifique est qu'« il n'existe pas de niveau d'exposition au plomb sans danger pour les espèces vertébrées. L'empoisonnement causé par l'ingestion de munitions au plomb et de poids de pêche en plomb qui sont dispersés pendant les activités de tir et de pêche entraîne des niveaux élevés de mortalité et de morbidité pour de nombreuses espèces d'oiseaux migrateurs, y compris des incidences au niveau des populations pour certaines ». Au sein de l'ONU, le PNUE a, en 2020, adopté la Résolution WCC-2016-Res-082 "sur la voie à suivre pour répondre aux préoccupations concernant l'utilisation de munitions en plomb dans la chasse", puis adopté une résolution visant à prévenir l'empoisonnement des oiseaux migrateurs[127], a confié un nouvau mandat à un « Groupe spécial intergouvernemental pour la suppression progressive de l'utilisation des munitions et agrès de pêche en plomb » aussi appelé « Intergovernmental task force on phasing out the use of lead ammunition and lead fishing weights »[128]. Ce groupe doit « accélérer la mise en œuvre des Lignes directrices dans ses sections pertinentes, si approprié » ; il s'agit notamment de faire cesser le saturnisme des oiseaux migrateurs (cf. UNEP/CMS/COP11/Doc.23.1.2, adoptées à l'occasion de la COP1)[129].
En novembre 2020 le parlement européen vote un règlement interdisant toute utilisation de munitions au plomb dans toutes les zones humides d'Europe, et dans une zone-tampon de 100 m autour des zones humides. Le texte, publié en janvier 2021, donne 2 ans de délai pour la transition, avec une interdiction effective en février 2023. Selon la fédération nationale des chasseurs français « c'est une première étape avant de tenter d'interdire partout l'utilisation de la grenaille de plomb, bien au-delà des zones humides. À plusieurs reprises la mobilisation de toutes les instances européennes (FACE – ELO) représentant les chasseurs et la filière chasse a conduit à un report des votes tentant d'imposer ce type d'interdiction. Le dernier vote au Parlement européen, le 25 novembre 2020 a été un échec pour les chasseurs. Toutefois, la Commission souhaitait imposer une zone de 400 m, mais elle a échoué. La mise en application de cette nouvelle règle au niveau Français devrait passer par une modification de l'arrêté du 1er août 1986 qui comporte depuis le 1er juin 2006 l'interdiction de la grenaille de plomb dans les zones humides en France ». La définition de "zone humide" est précisée dans le Règlement.
En 2021, le rapport commandé par la Commission européenne à l'agence européenne des produits chimiques (ECHA) confirme la nécessité d'interdiction totale du plomb dans les chevrotines et munitions de chasse ainsi que les articles de pêche contenant du plomb. Les citoyens ont été invités à donner leur avis[130]. Ce rapport estime que tous les ans, 127 millions d'oiseaux sont exposés à un empoisonnement par le plomb et à l'échelle des 27 États membres, environ un million d'enfants voient leur développement neurologique menacé par la consommation de gibier contaminé par le plomb provenant des munitions de chasse[130].
Recherche
La recherche (publique et privée) explore de nouvelles pistes d'inertage, de remédiation, de nouveaux moyens, plus doux, moins dangereux de destruction de certains composants toxiques, dont par exemple quand cela est possible par biodégradation[131], fongoremédiation[132], par photolyse[133] et/ou catalyse notamment[134], ainsi que de nouveaux moyens de « stabilisation » de déchets de munitions (dans de l'asphalte (bitume anionique et bitume cationique[135] par exemple), ou encore d'épuration des sols, de l'eau (par des microbes par exemple, quand il s'agit de composés organiques[136]) ou de sédiments, dont in situ[137].
Des milliers de molécules différentes, parfois complexes ont été utilisés pour fabriquer les poudres et explosifs des munitions, ainsi que des « gaz de combat ». Avec le temps, nombre de ces molécules se dégradent en autres molécules ou sont transformées par des microbes ou animaux (métabolites) en de nouvelles molécules. Ces nouvelles molécules peuvent interagir entre elles et/ou avoir des propriétés émergentes qu'il conviendrait de connaitre pour une bonne gestion du risque (évaluation de la toxicité, mais aussi de la persistance de ces molécules, ou de possibles synergies…). En complément des moyens allégés et plus rapide de détection de molécules connues[138]. Les chimistes peuvent maintenant s'appuyer sur des logiciels qui les aident à évaluer ces propriétés émergentes[139].
De nouvelles méthodes de dépollution des sols de terrains de ball-trap ou militaire pollués par les retombées de munitions sont testées, dont la phytoremédiation et le drainage électrocinétique[140] - [141] (méthodes longues et dans le second cas plutôt ex-situ consommatrice d'électricité (mais à bas voltage) et susceptible de priver le sol d'une partie de ses oligoéléments et demandant de bonnes conditions de température[142] et de pH[142] du substrat).
Coûts
Une évaluation financière faite aux États-Unis a considéré que le traitement des munitions anciennes pourrait coûter de $ 60 à $ 100 milliards[143]. Certains auteurs estiment que le problème est sous-estimé. Par exemple selon RD. Albright (2008), les environ 4 000 sites de défense répertoriés aux États-Unis (FUDS) n'incluent pas toutes les petites entreprises ayant produit des munitions et susceptibles d'avoir pollué le sol durant ce temps, et il en va de même pour les 16 000 sites militaires de dépôts de munitions ou explosifs recensés dans le monde[144].
Notes et références
- (en) Stephanie Handley-Sidhu, Miranda J. Keith-Roach, Jonathan R. Lloyd, David J. Vaughan « A review of the environmental corrosion, fate and bioavailability of munitions grade depleted uranium » Sci Total Environ. 2010;408(23):5690-700. (résumé)
- (en) Gary A. Pascoe, Keith Kroeger, Dwight Leisle, Robert J. Feldpausch « Munition constituents: Preliminary sediment screening criteria for the protection of marine benthic invertebrates » Chemosphere 2010;81(6):807-16. (résumé)
- (en) Richard D. Albright. « Introduction to Underwater Unexploded Ordnance and Its Impact on the Environment » Cleanup of Chemical and Explosive Munitions 2012, deuxième édition, pages 71-98 (résumé)
- (en) MacLean RS, U. Borgmann, D.G. Dixon. « Bioaccumulation kinetics and toxicity of lead in Hyalella azteca (Crustacea, Amphipoda) » Canadian Journal of Fisheries & Aquatic Sciences 1996;53:2212-20.
- (en) Guilherme R. Lotufo, William Blackburn, Sydney J. Marlborough, John W. Fleeger « Toxicity and bioaccumulation of TNT in marine fish in sediment exposures » Ecotoxicol Environ Saf. 2010;73(7):1720-7.
- (en) Sierra club, The Environmental Consequences of War ; http://www.sierraclub.ca
- Baubinas R., Taminskas J. (1997–1998), Natural resources used for military concerns: ecological consequences. Vilnius: Lietuvos geologijos tarnyba
- ELI (Environmental Law Institute) (1998), Addressing Environmental Consequences of War ; Washington. Juin 1998: 6.
- ELI (Environmental Law Institute) (2003), “Environmental Law Institute Environmental Consequences of War]” ; Associates Seminar, 1999-11-11. Environmental Law Institute ; juin 2003. http://www.eli.org/seminars/99archive/11.11.99dc.htm
- The Lancet, communiqué intitulé Trinitrotoluene poisoning : Officially communiated by the ministry of munitions ; The Lancet, Volume 188, Issue 4868, 16 December 1916, Pages 1026-1030
- Sénat des États-Unis (1979), Steel shot regulations : hearing before the Subcommittee on Administrative Practice and Procedure of the Committee on the Judiciary, United States Senate, Ninety-fifth Congress, second session, on oversight hearings--Fish and Wildlife Service, U.S. Department of the Interior, May 25, 1978 United States. Congress. Senate. Committee on the Judiciary. Subcommittee on Administrative Practice and Procedure - 1979 - 314 pages
- MATEO, rafael (2009), Lead poisoning in wildbird in Europe and the regulations adopted by different country ; in RT. Watson, M. Fuller, M. Pokras, and W. G. Hunt (2009), Ingestion of Lead from Spent Ammunition : Implications for Wildlife and Humans. The Peregrine Fund, Boise, Idaho, USA. DOI:10.4080/ilsa.2009.0107
- Baltrėnas P., Ignatavičius G. (2000), Strategy of Military Land Reuse in Lithuania. Approaches to the Implementation of Environment Pollution Prevention Technologies at Military Bases. RTO Proceedings. 39(12). 1–7. Cedex (France): NATO Publishing.
- Ronald L. Fournier, Deane A. Horne, Franklin G. Rinker, Kerm Jackson (1990), “Analysis and testing of the metal parts furnace for the demilitarization of chemical warfare munitions“ ; Journal of Hazardous Materials, Volume 23, Issue 1, p. 1-20 (résumé)
- Richard D. Albright (2008), The Continuing Search for Burial Sites ; Cleanup of Chemical and Explosive Munitions, 2008, p. 153-171 (résumé)
- Richard D. Albright (2012), Expanding and Enlarging a Remediation Site Location, Identification and Environmental Remediation, in Cleanup of Chemical and Explosive Munitions (deuxième édition) (voir pages 187 à 204), résumé
- HTMA : acronyme de heavy metal tungsten alloys
- Erik Q. Roedel, Danielle E. Cafasso, Karen W.M. Lee, Lisa M. Pierce (2012), Pulmonary toxicity after exposure to military-relevant heavy metal tungsten alloy particles ; Toxicology and Applied Pharmacology, Volume 259, Issue 1, 15 février 2012, pages 74-86 résumé)
- 91,1 % de tungstène, 6 % de cobalt et 2,9 % nickel
- WNiCo (92 % de tungstène, 5 % de nickel et 3 % de cobalt), WNiFe (92 % de tungstène, 5 % de nickel et 3 % de fer),
- Lawrence, J.E., Lamm, S.H., Pino, S., Richman, K., Braverman, L.E. 2000. The effect of short-term low-dose perchlorate on various aspects of thyroid function. Thyroid 10(8):659-663.
- Lawrence, J., Lamm, S., Braverman, L.E. 2001. Low dose perchlorate (3 mg daily) and thyroid function. Thyroid 11(3):295.
- Jimmie C. Oxley & al., Efficiency of perchlorate consumption in road flares, propellants and explosives ; https://dx.doi.org/10.1016/j.jenvman.2009.06.014, Journal of Environmental Management ; Volume 90, Issue 11, août 2009, Pages 3629–3634 (résumé)
- Données 2001, citées par EPA, avec cartes in EPA Review, 2002
- J Clausen, J Robb, D Curry, N Korte (2004), A case study of contaminants on military ranges : Camp Edwards, Massachusetts, USA - Environmental Pollution, Elsevier (résumé)
- Le parisien, Bordeaux : l'eau potable pourrait rester polluée pendant des années ; 2011-07-20
- Moore, Joseph L. Hohman, William L. Stark, Timothy M. (1998), Shot prevalences and diets of diving ducks five years after ban on use of lead shotshells at Catahoula Lake, Louisiana. J. Wildlife Man. 62; 564-569.
- (en) Greičiūtė K. et Vasarevičius S. (2003) « Investigation of the decrease of soil organic matter and soil pollution by heavy metals in areas intensively used for military activities » Proceedings of the Sixth Symosium and Exhibition “Environmental Contamination in Central and Eastern Europe and the Commonwealth of Independent States”, 527 p.
- D.R. Wellington, W.R. Mitchell (1991), Invitro cytotoxicity of certain munition nitroaromatic compounds ; Chemosphere, Volume 23, Issue 3, 1991, p. 363-373 (résumé
- Donnelly, K.W. Brown, G.S. Giam, B.R. Scott (1993), Acute and genetic toxicity of extracts of munitions wastewater contaminated soils ; Chemosphere, Volume 27, Issue 8, October 1993, p. 1439-1450 K.C.
- Dennis T. Burton, Steven D. Turley, Gregory T. Peters (1994), The acute and chronic toxicity of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) to the fathead minnow (Pimephales promelas) ; Chemosphere, Volume 29, Issue 3, aout 1994, Pages 567-579 (résumé)
- S.E. George, G. Huggins-Clark, L.R. Brooks (2001), Use of a Salmonella microsuspension bioassay to detect the mutagenicity of munitions compounds at low concentrations ; Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Volume 490, Issue 1, 25 janvier 2001, p. 45-56 (résumé)
- (en) K Greičiūtė, A Juozulynas, G Šurkienė, V Valeikienė (2007), http://www.lmaleidykla.lt/ojs/index.php/geologija/article/viewFile/1482/499 Research on soil disturbance and pollution with heavy metals in military grounds] ; Geologija ; Vilnius ; 2007 ; N°57 ; p 14 à 20 ; (ISSN 1392-110X)
- Roman, S. Corps étrangers intra-oculaires (CEIO) du segment postérieur de l'œil|Journal français d'ophtalmologie, vol 24, n°7, sept 2001, p. 769-777
- Per Leffler, Rune Berglind, Jan Sjöström, Jeff Lewis (2012 Munition related metals - Combined toxicity of Antimony, Copper, and Lead Toxicology Letters, Volume 211, Supplément, 17 juin 2012, Page S95 (Lien vers l'article (payant))
- B.S. Levine, E.M. Furedi, D.E. Gordon, J.J. Barkley, P.M. Lish (1990), Toxic interactions of the munitions compounds TNT and RDX in F344 rats ; Fundamental and Applied Toxicology, Volume 15, Issue 2, août 1990, pages 373-380 (résumé)
- (en) « Performance of Lead-Free versus Lead-Based Hunting Ammunition in Ballistic Soap », sur doi.org, (DOI 10.1371/journal.pone.0102015.g001, consulté le )
- (en) Felix Gremse, Oliver Krone, Mirko Thamm et Fabian Kiessling, « Performance of Lead-Free versus Lead-Based Hunting Ammunition in Ballistic Soap », PLOS ONE, vol. 9, no 7, , e102015 (ISSN 1932-6203, PMID 25029572, PMCID PMC4100882, DOI 10.1371/journal.pone.0102015, lire en ligne, consulté le )
- Mekki M (2017) Caractérisation physico-chimique et évaluation toxicologique de fumées particulaires produites lors de tirs de petit calibre et de fumigènes : étude comparative ; Thèse de Doctorat Spécialité « Aspects moléculaires et cellulaires de la biologie », Université de Rouen Normandie, soutenue le 9 juin
- A Denizot (1998), Verdun et ses champs de bataille extrait avec Google Books (voir p. 3).
- (en) Vasarevičius S. and Greičiūtė K. (2005), Soil pollution with heavy metals in territories used for military transport needs in Lithuanian military grounds. In: D. Cygas and D. Froehner (eds.), Proceedings of the 6th International Conference on Environmental Engineering. Environmental Protection, Water Management and Hydraulics. 1. Vilnius. 300–306.
- (en) Vasarevičius S., Greičiūtė K, (2004), Investigation of soil pollution with heavy metals in Lithuanian military grounds. Environmental Engineering and Landscape Management. XII(4). 132
- (en) Vasarevičius S., Greičiūtė K. (2006), Modeling of pollution with lead in shooting ranges of Gaižiūnai Military Ground. Geologija. 2. 15–24
- Ex : Démantèlement du site d'Aberdeen (avec worldwidescience.org)
- (en) Tine Missiaen, Pascal Feller (2008), Very-high-resolution seismic and magnetic investigations of a chemical munition dumpsite in the Baltic Sea Journal of Applied Geophysics, Volume 65, Issues 3–4, 1er septembre 2008, pages 142-154 ([résumé])
- (en) Beintema, N.H. (2001), Lead Poisoning in Waterbirds. International Update Report 2000. Wetlands International, Wageningen, The Netherlands. Available free for download or for purchase in hard copy.
- (en) Duranel A. (1999), AEWA - African-Eurasian Migratory Water Bird Agreement, Effets de l'ingestion de plombs de chasse sur le comportement alimentaire et la condition corporelle du Canard colvert (Anas platyrhynchos).
- Beck, N. et Granval P. (1997), Ingestion de plombs de chasse par la bécassine des marais (Gallinago gallinago) et la bécassine sourde (Lymnocryptes minimus) dans le Nord-Ouest de la France. Gibier Faune sauvage, Game Wild 14 (1): 65-70.
- « Pollution par le plomb de chasse », sur senat.fr (consulté le ).
- Bédry R, Brun P, Kandji M, Sudre E, Nadjimi-Sarram N, Mesli S, … & Gromb-Monnoyeur S (2018) Saturnisme aigu causé par une munition non chemisée avec une forte charge de plomb mou. Toxicologie Analytique et Clinique, 30(2), S24-S25 (résumé).
- Bellrose, F.C. (1959), Lead Poisoning as a mortality factor in waterfowl populations. Ill. Nat. Hist. Surv. Bull. 27(3): 235-288.
- Cooke, S. W. (1998), Lead poisoning in swans. Veterinary Record 142:228.
- Birkhead, M. (1982), Causes of mortality in the Mute Swan Cygnus olor in the river Thames. Journ. Zool. (Lond.) 198: 15-25.
- Pain Debborah (station biologique de la Tour du Valat), 1991, L'intoxication saturnine de l'avifaune : une synthèse des travaux français : Présentation des résultats des études sur le saturnisme par ingestion de plomb de chasse effectuées dans la Dombes, le lac de Grand Lieu, la vallée supérieure du Rhin et comparaison avec les résultats obtenus en Camargue, en Europe et en Amérique du Nord / Lead poisoning of wildfowl : a synthesis of french studies, Journal Gibier faune sauvage, vol. 8, pp. 79-92 (14 p) (ISSN 0761-9243)
- DURANEL A. (1999). Effet de l’ingestion de plomb de chasse sur le comportement alimentaire et la condition corporelle du canard colvert. Thèse de l'école nationale vétérinaire de Nantes, 95 p.
- Franson, J.C., M.R. Petersen, C.U. Meteyer, M.R. Smith (1995), Lead poisoning of spectacled eiders (Somateria fischeri) and of a common eider (Somateria mollissima) in Alaska. Journal of Wildlife Diseases 31:268-271.
- Demayo, A., M.C. Taylor, K.W. Taylor, & P.V. Hodson (1982), Toxic Effects of Lead and Lead Compounds on Human Health, Aquatic Life, Wildlife Plants, and Livestock. CRC Critical Reviews in Environmental Control. 12: 257-305
- Marie Pierre Verdier, « Du plomb dans l’assiette: une étude chez les Inuits d’Alaska », Recherches arctiques, CNRS,
- « Ball-trap : La pollution des plombs abandonnés dans l'environnement peut engager des responsabilités », sur Cpepesc, (consulté le ).
- Jerry R. Longcore (1974) Significance of lead residues in mallard tissues Patuxent Wildlife Research Center, U.S. Dept. of the Interior, Fish and Wildlife Service ; for sale by the Supt. of Docs., U.S. Govt. Print. Off., 1974 - 24 pages
- Glen C. Sanderson, Frank Chapman Bellrose (1986), A review of the problem of lead poisoning in waterfowl, Illinois. Natural History Survey Division ; Illinois Natural History Survey 34 pages
- Mondain-Monval J.Y., Desnouhes L., Taris J.P., 2002. Lead shot ingestion in waterbirds in the Camargue (France). Game & Wildlife Science 19: 237-246
- PIROT J.-Y., TARIS J.-P. (1987)Le saturnisme des Anatidés hivernant en Camargue : réactualisation des données = Lead poisoning of ducks wintering in the Camargue : an update (CNRS, cent. écologie Camargue), in Revue Gibier faune sauvage, vol. 4, p. 83-94 (3 p.) ; (ISSN 0761-9243)
- Hoffmann, L. 1960. Le saturnisme fléau de la sauvagine en Camargue. Terre & Vie 107 : 120-131.
- G Mauvais*, L Pinault* (1993), Le saturnisme des Anatidés (Anatidae) sur le site du lac de Grand-Lieu (Loire-Atlantique) (* École nationale vétérinaire Nantes, serv. pharmacie-toxicologie); in Revue : Gibier faune sauvage, vol. 10, n° juin 1993, p. 85-101
- Demayo, A., Taylor, M.C., Taylor, K.W., Hodson P.V. (1982). Toxic effects of lead and lead compounds on human health, aquatic life, wildlife, plants, and livestock. CRC Crit. Rev. Environ. Control 12(4):257– 305.
- (en) Antje Gerofke, Ellen Ulbig, Annett Martin et Christine Müller-Graf, « Lead content in wild game shot with lead or non-lead ammunition – Does “state of the art consumer health protection” require non-lead ammunition? », PLOS ONE, vol. 13, no 7, , e0200792 (ISSN 1932-6203, PMID 30048463, PMCID PMC6062035, DOI 10.1371/journal.pone.0200792, lire en ligne, consulté le ).
- Gouvernement des États-Unis ; Congrès (1977), Steel Shot: Hearings Before the Subcommittee on Fisheries and Wildlife Conservation and the Environment of the Committee on Merchant Marine and Fisheries, House of Representatives, Ninety-fifth Congress… November 11, 1977, Fairfield, Calif., May 6, 1978, Easton, Md Couverture United States. Congress. House. Committee on Merchant Marine and Fisheries. Subcommittee on Fisheries and Wildlife Conservation and the Environment. Government Printing Office, 1978, 280 p.
- Schwarte Max, Die Technik im Weltkriege. Berlin, Mittler, 1920, p. 610.
- Hanslian 1927
- Satu M. Somani and James A. Romano, Jr., Chemical warfare agents : toxicity at low levels. eds. Boca Raton, Fla., CRC Press, 2001. 447 p (voir aussi les références bilibographique de cet ouvrage)
- Hewitt, Alan D, Jenkins Thomas F, Ranney Thomas A, « Estimates for explosives residue from the detonation of army munitions ». ERDC/CRREL TR-03-16. Hanover, U.S. Army Engineer Research and Development Center, Cold Regions Research and Engineering Laboratory, 2003, p. 88.
- Talmage SS, Opresko DM, Maxwell CJ, Welsh CJ, Cretella FM, Reno PH, Daniel FB. (1999) |Nitroaromatic munition compounds: environmental effects and screening values | Rev Environ Contam Toxicol. ; 161:1-156 |résumé
- Thouin, H., Le Forestier, L., Gautret, P., Hube, D., Laperche, V., Dupraz, S., & Battaglia-Brunet, F. (2016). Characterization and mobility of arsenic and heavy metals in soils polluted by the destruction of arsenic-containing shells from the Great War. Science of the Total Environment, 550, 658-669.
- Henri Leval, « Quel combat contre l'arme chimique » p. 681 sur le site du Ministère des affaires étrangères et européennes
- Hunt, W.G., Watson, R.T., Oaks, J.L., Parish, C.N., Burnham, K.K., Tucker, R.L., Belthoff, J.R., and Hart, G. (2009). Lead bullet fragments in venison from rifle-killed deer: Potential for human dietary exposure. PLoS ONE 4(4): e5330.
- Knott, J., Gilbert, J., Hoccom, D., and Green, R. (2010). Implications for wildlife and humans of dietary exposure to lead from fragments of lead rifle bullets in deer shot in the UK. Sci. Total Environ. 409:95–99.
- Rocke et al (1997), Site-Specific lead exposure ; J. Wild. Manage. 61(1):228-234, PDF, 8p
- Group of Scientists (2014). Wildlife and human health risks from lead-based ammunition in Europe: A consensus statement by scientists., consulté 2016-12-28
- Bellinger, David C. & al (2013), Health Risks from Lead-Based Ammunition in the Environment - A Consensus Statement of Scientists (2013) http://escholarship.org/uc/item/6dq3h64x [Consulté 28 dec 2016], Université de Californie ; d'après USGS, 2013 : USGS. Mineral Industry Surveys, Lead. January, 2013; United States Geological Survey,http://minerals.usgs.gov/minerals)
- Rooney, CP, McClaren, RG & Cresswell, RJ, (1999). Distribution and phyto - availability of lead in a soil contaminated with lead shot. Water Air and Soil Pollution 116: 535-548. https://link.springer.com/article/10.1023%2FA%3A1005181303843
- U.S. EPA (2012). Integrated Science Assessment for Lead (Third External Review Draft). U.S. Environmental Protection Agency, Washington, DC, EPA/600/R-10/075C.
- NRC (2012), Potential Health Risks to DOD Firing-range Personnel from Recurrent Lead Exposure. National Research Council. National Academies Press, Washington, D.C.
- Pain, DJ, Cromie, RL, Newth, J, Brown, MJ, Crutcher, E, Hardman, P, Hurst, L, Mateo, R, Meharg, AA, Moran, AC, Raab, A, Taggart, MA, & Green, RE, (2010). Potential Hazard to Human Health from Exposure to Fragments of Lead Bullets and Shot in the Tissues of Game An imals. PLoS ONE 5(4): e10315. doi:10.1371/journal.pone.001031. http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0010315
- Hanning, R.M., Sandhu, R., MacMillan, A., Moss, L., Tsuji, L.J.S., and Nieboer, E. 2003. Impact of blood lead levels of maternal and early infant feeding practices of First Nation Cree in the Mushkegowuk Territory of northern Ontario, Canada. J. Environ. Monit. 5:241–5.
- Levesque, B., Duchesne, J.F., Gariepy, C., Rhainds, M., Dumas, P., Scheuhammer, A.M., Proulx, J.F., Déry, S., Muckle, G., Dallaire, F., and Dewailly, E. 2003. Monitoring of umbilical cord blood lead levels and sources assessment among the Inuit. Occup. Environ. Med. 60:693–5.
- Carey L.S. 1977. Lead shot appendicitis in northern native people. J. Can. Assoc. Radiol. 28:171–4.
- Reddy, E.R. 1985. Retained lead shot in the appendix. J. Can. Assoc. Radiol.36:47–8.
- BfR (Federal Institute for Risk Assessment, Germany), 2011. Lead fragments in game meat can be an added health risk for certain consumer groups 32/2011, 19.09.2011. http://www.bfr.bund.de/en/press_information/2011/32/lead_fragments_in_game_meat_can_be_an_added_health_risk_for_certain_consumer_groups-127610.html
- AESAN, 2012. Report of the Scientific Committee of the Spanish Agency for Food Safety and Nutrition (AESAN) in relation to the risk associated with the presence of lead in wild game meat in Spain. Reference Number: AESAN-2012-002. Report approved by the Scientific Com mittee on plenary session February 22th, 2012. http://aesan.msssi.gob.es/AESAN/docs/docs/evaluacion_riesgos/comite_cientifico/PLOMO_ CAZA.pdf
- FSA (2012). Advice to frequent eaters of game shot with lead. Food Standards Agency. http://www.food.gov.uk/news-updates/news/2012/5339/lead
- VKM (2013). Risk assessment of lead exposure from cervid meat in Norwegian consumers and in hunting dogs. Opinion of the Panel on Contaminants of the Norwegian Scientific Committee for Food Safety (VKM). 11-505, 129 pp. http://www.vkm.no/dav/cbfe3b0544.pdf
- Gilbert Charles, « Animaux plombés », sur L'Express (consulté le )
- Bundesinstitut für Risikobewertung BfR (2010) Bleibelastung von Wildbret durch Verwendung von Bleimunition bei der Jagd. Stellungnahme Nr. 040/ 2011 des BfR vom 3. Décembre 2010 | URL:http://www.bfr.bund.de/cm/343/bleibelastung-von-wildbret-durch-verwendung-von-bleimunitionbei-der-jagd.pdf
- JECFA (2011) Evaluation of certain food additives and contaminants. Geneva: WHO Technical Report Series; 2011|PDF, 237 pages
- EFSA (2010) Scientific Opinion on Lead in Food. EFSA Journal. |8(4):1570:151p.
- Buenz E.J (2016) Eliminating potential lead exposure in imported New Zealand wild game. Public health, 139, 236-237|DOI: https://dx.doi.org/10.1016/j.puhe.2016.06.025%7Crésumé
- Thomas VG (2013) Lead-free hunting rifle ammunition: product availability, price, effectiveness, and role in global wildlife conservation. Ambio 42(6):737–745
- Kanstrup, N., Balsby, T. J., & Thomas, V. G. (2016). Efficacy of non-lead rifle ammunition for hunting in Denmark. European journal of wildlife research, 62(3), 333-340 |résumé.
- Martin, A., Gremse, C., Selhorst, T., Bandick, N., Müller-Graf, C., Greiner, M., & Lahrssen-Wiederholt, M. (2017). Hunting of roe deer and wild boar in Germany: Is non-lead ammunition suitable for hunting?. PloS one, 12(9), e0185029.
- Thomas, V. G., Gremse, C., & Kanstrup, N. (2016). Non-lead rifle hunting ammunition: issues of availability and performance in Europe. European Journal of Wildlife Research, 62(6), 633-641
- Thomas VG (2013) Lead-free rifle ammunition: product availability, price, effectiveness, and role in global wildlife conservation. AMBIO 42:737–745. doi:10.1007/s13280-012-0361-7
- Kelly, T. R., Bloom, P. H., Torres, S. G., Hernandez, Y. Z., Poppenga, R. H., Boyce, W. M., & Johnson, C. K. (2011). Impact of the California lead ammunition ban on reducing lead exposure in golden eagles and turkey vultures. PLoS One, 6(4), e17656.
- California Department of Fish and Wildlife (2015) Nonlead certification information for ammo manufacturers. | URL: http://www.dfg.ca. gov/wildlife/hunting/lead-free/certification.html
- SFWS (US Fish and Wildlife Service) (1997) Migratory bird hunting: revised test procedure for nontoxic shot approval procedure for shot and shot coatings. Fed Register 62(320):63607 – 63615
- Thomas VG, Santore R, McGill IR (2007) Release of copper from sintered tungsten-bronze shot under different pH conditions and its potential toxicity to aquatic organisms. Sci Total Environ 374:71 – 79. doi: 10.1016/j.scitotenv.2006.10.004
- Thomas VG, McGill IR (2008) Dissolution of copper and tin from sintered tungsten-bronze shot in a simulated gizzard, and an assess- ment of their potential toxicity to birds. Sci Total Environ 394:283 – 289. doi: 10.1016/j.scitotenv2008.01.049
- Franson JC, Lahner LL, Meteyer CU, Rattner BA (2013) Copper pellets simulating oral exposure to copper ammunition: absence of toxicity in American kestrels ( Falco sparverius ). Arch Environ Contam Toxicol 62:145 – 153. doi: 10.1007/s00244-011-9671-1
- Irschik I, Bauer F, Sager M, Paulsen P (2013) Copper residues in meat from wild artiodactyls hunted with two types of rifle bullets manufactured from copper. Eur J Wildl Res 59:129 – 136. doi: 10.1007/s10344-012-0656
- Paulsen P, Bauer F, Sager M, Schumann-Irschik I (2015) Model studies for the release of metals from embedded rifle bullet fragments during simulated meat storage and food ingestion. Eur J Wildl Res 61:629 – 633. doi: 10.1007/s10344-015-0926-4
- Paulsen P, Schuhmann-Irschik I, Sager M & Bauer F (2017) Assessment of primary oxidation products in venison with embedded copper particles subjected to culinary processing. In Game meat hygiene: Food safety and security (pp. 582-585). Wageningen Academic Publishers|résumé.
- Paulsen P & Sager M (2017) Nickel and copper residues in meat from wild artiodactyls hunted with nickel-plated non-lead rifle bullets. European Journal of Wildlife Research, 63(4), 63
- (en) Trevor R. Dixon « News More reports of dangerous packages and munitions » Marine Pollution Bulletin 1987;18(4):146.
- (en) Trevor R Dixon, T.J Dixon « Report Munitions in British coastal waters » Marine Pollution Bulletin 1979;10(12):352–7.
- (en) Stamatelatos CJ, Everline, D.M. Ligon, B.A. Kuryk, T.S. Kartachak, W.E. Fraize, W.R. Rhyne. « Risk assessment for the selection of a chemical munitions disposal alternative » Reliability Engineering & System Safety 1990;27(2):179-12 M.G. (Résumé)
- (en) Tine Missiaen, Martin Söderström, Irina Popescu, Paula Vanninen (2010) « Evaluation of a chemical munition dumpsite in the Baltic Sea based on geophysical and chemical investigations » Sci Total Environ. 2010;408(17):3536-53. (résumé)
- (en) Hans Sanderson, Patrik Fauser, Marianne Thomsen, Peter B. Sørensen. « Screening level fish community risk assessment of chemical warfare agents in the Baltic Sea » J Hazard Mater. 2008;154(1–3):846–57. résumé
- Mateo R, Vallverdú-Coll N, López-Antia A, Taggart MA, Martínez-Haro M, Guitart R, Ortiz-Santaliestra ME (2014) Reducing Pb poisoning in birds and Pb exposure in game meat consumers : the dual benefit of effective Pb shot regulation. Environ. Int. 63, 163–168. (doi:10.1016/j.envint.2013.11.006)
- (en) Rafael Mateo et Niels Kanstrup, « Regulations on lead ammunition adopted in Europe and evidence of compliance », Ambio, vol. 48, no 9, , p. 989–998 (ISSN 0044-7447 et 1654-7209, PMID 30905055, PMCID PMC6675918, DOI 10.1007/s13280-019-01170-5, lire en ligne, consulté le )
- AEWA, « 5th Session of the Meeting of the Parties to AEWA », sur www.unep-aewa.org, (consulté le )
- Cromie, RL, Loram, A, Hurst, L, O'Brien, M, Newth, J, Brown, MJ, & Harradine, JP, 2010. Compliance with the Environmental Protection (Restrictions on Use of Lead Shot)(England) Regulations 1999. Report to Defra. Bristol. url: http://randd.defra.gov.uk/Document.aspx?Document=WC0730_9719_FRP.pdf ; http://www.zoo.cam.ac.uk/leadammuntionstatement/
- Nico H.A. van Ham (1998), Recycling and disposal of munitions and explosives ; Waste Management, Volume 17, Issues 2–3, 1998, pages 147-150 (résumé)
- An approach for deriving emergency planning zones for chemical munitions emergencies Journal of Hazardous Materials, Volume 30, Issue 3, mai 1992, pages 223-242 John H. Sorensen, Sam A. Carnes, George O. Rogers
- ONU/CMMS (2014) Scientific statements on wildlife and human health risks from lead-based ammunition in the environment A Consensus Statement by Scientists ; Convention on migratory species ; UNEP/CMS/COP11/Inf.16 ; 14 oct. 2014 ; 11th Meeting of the conference of the parties (COP11), Quito, Ecuador, 4-9 nov 2014 | https://www.cms.int/sites/default/files/document/COP11_Inf%2016_Scientific_Statements_Lead-based_Ammunition_E%20only_0.pdf
- (en) David C. Bellinger et Asa Bradman, « Health Risks from Lead-Based Ammunition in the Environment - A Consensus Statement of Scientists », (consulté le )
- Les principales sources de plomb étaient l'essence plombée, les peintures à base de plomb, les tuyaux de plomb et la soudure à base de plomb
- PNUE (2020) Résolution adoptée par la Conférence des Parties du PNU lors de sa 13ème réunion à Gandhinagar, en février ; url= https://www.cms.int/sites/default/files/document/cms_cop13_res.11.15_rev.cop13_f.pdf
- ONU/CMS (2021) Convention on the Conservation of Migratory Species of Wild Animals 52nd Meeting of the Standing Committee ; 21 – 29 September 2021 ; UNEP/CMS/StC52/Outcome.3 Terms of referenceof the interfovernmental task force on phasing out the use of lead ammunition and lead fishing weights (LEAD TASK FORCE) https://www.cms.int/sites/default/files/document/cms_stc52_outcome-3_tor-lead-task-force_e.pdf
- Ce groupe de travail a été mis en place Le groupe de travail sur le plomb a été établi par la Résolution 11.15 (Rev.COP13), point 18 ; voir aussi le comte rendu de la 52e Réunion du Comité permanent de la Convention sur la conservation des espèces migratrices appartenant à la faune sauvage (21 – 29 septembre 2021) ; ref UNEP/CMS/StC52/Résultat 3 (PDF, 154.56 KB)|url=https://www.cms.int/sites/default/files/document/cms_stc52_outcome-3_tor-lead-task-force_f.pdf
- Loïc Chauveau, « L'interdiction des munitions au plomb proposée », sur Sciences et Avenir, (consulté le )
- David L. Freedman, Kevin W. Sutherland (1998), Biodegradation of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) under nitrate-reducing conditions Water Science and Technology, Volume 38, Issue 7, 1998, Pages 33-40
- J.W. Bennett (1994), Prospects for fungal bioremediation of TNT munition waste ; International Biodeterioration & Biodegradation, Volume 34, Issue 1, Pages 21-34
- Balaji Rao, Wei Wang, Qingsong Cai, Todd Anderson, Baohua Gu (2013), Photochemical transformation of the insensitive munitions compound 2,4-dinitroanisole ; Science of The Total Environment, Volume 443, 15 January 2013, Pages 692-699 (Résumé)
- Agamemnon Koutsospyros, Julius Pavlov, Jacqueline Fawcett, David Strickland, Benjamin Smolinski, Washington Braida (2012), Degradation of high energetic and insensitive munitions compounds by Fe/Cu bimetal reduction Journal of Hazardous Materials, Volumes 219–220, 15 juin 2012, Pages 75-81 (résumé)
- Marketa Cervinkova, Milan Vondruska, Vratislav Bednarik, Antonin Pazdera (2007), Stabilization/solidification of munition destruction waste by asphalt emulsion Journal of Hazardous Materials, Volume 142, Issues 1–2, 2 avril 2007, pages 222-226
- Simon Toze, Luke Zappia (1999), Microbial degradation of munition compounds in production wastewater Water Research, Volume 33, Issue 13, septembre 1999, pages 3040-3045 (résumé)
- Heidi J Christopher, Gregory D Boardman, David L Freedman (2000), Aerobic biological treatment of 2,4-dinitrotoluene in munitions plant wastewater ; Water Research, Volume 34, Issue 5, avril 2000, pages 1595-1603 (résumé)
- S.D. Harvey, T.R.W. Clauss (1996), “Rapid on-line chromatographic determination of trace-level munitions in aqueous samples “; Journal of Chromatography A, Volume 753, Issue 1, 8 novembre 1996, Pages 81-89 (résumé)
- Erin R. Bennett, Jay Clausen, Eugene Linkov, Igor Linkov (2009), “Predicting physical properties of emerging compounds with limited physical and chemical data: QSAR model uncertainty and applicability to military munitions “ ; Chemosphere, Volume 77, Issue 10, novembre 2009, pages 1412-1418 ()
- Alshawabken A. N., Yeung A. T., Bricka M. R. (2003), Practical aspects of in-situ electrokinetic extraction. Journal of Environmental Engineering. 1. 27–35.
- Vasarevičius S., Greičiūtė K (2004), Investigation of soil pollution with heavy metals in Lithuanian military grounds. Environmental Engineering and Landscape Management. 12(4). 132.
- Baraud F., Tellier S., Astruc M (1999), Temperature effect on ionic transport during soil electrokinetic treatment ast constant pH. Journal of Hazardous Materials. 64. 263– 281.
- Richard D. Albright (2012), The Extent of the Munitions Problem, in Cleanup of Chemical and Explosive Munitions (2de édition), voir pages 15-27
- Richard D. Albright (2008), Cleanup of Chemical and Explosive Munitions Locating, Identifying Contaminants, and Planning for Environmental Remediation of Land and Sea Military Ranges and Ordnance Dumpsites, pages 19–32 ; 3 – The Extent of the Munitions Problem (résumé)
Voir aussi
Articles connexes
Bibliographie
- (en) Albright R.D (2012), The Extent of the Munitions Problem, in Cleanup of Chemical and Explosive Munitions (2e édition), voir âges 15-27
- Bellinger, David C. & al (2013), Health Risks from Lead-Based Ammunition in the Environment - A Consensus Statement of Scientists (2013) http://escholarship.org/uc/item/6dq3h64x [Consulté 28 dec 2016], Université de Californie.
- (en) Chappell Mark, Price Cynthia, George Robert (2012), Environmental chemistry of explosives & propellant compounds in soils & marine systems (ACS Symposium series, no 1069) ; , 448 p.
- (en) Fawcett D & van Vessem J (1995), Lead poisoning in waterfowl: international update report 1995 ; Joint Nature Conservation Committee (Great Britain), International Waterfowl and Wetlands Research Bureau ; Joint Nature Conservation Committee, 1995 - 65 pages
- Giovanni B. (2004), Impact écologique de l’utilisation de la grenaille de plomb sur les habitats terrestres et sur l’accumulation de plomb chez les oiseaux non aquatiques ; Convention relative à la conservation de la vie sauvage et du milieu naturel de l’Europe, 24e réunion, 22 p.
- Haig SM, D'Elia J, Eagles-Smith C, Fair JM, Gervais J, Herring G, Rivers JW, Schulz JH (2014), The persistent problem of lead poisoning in birds from ammunition and fishing tackle. The Condor 116, 408–428. (doi:10.1650/CONDOR-14-36.1)
- (en) George S.E, Huggins-Clark G, Brooks L.R (2001), Use of a Salmonella microsuspension bioassay to detect the mutagenicity of munitions compounds at low concentrations ; Mutation Research/Genetic Toxicology and Environmental Mutagenesis, Volume 490, Issue 1, , pages 45–56 (résumé)
- Mondain-Monval J.Y & Lamarque F. (2004), Saturnisme des anatidés : une bonne raison pour passer aux munitions sans plomb ; ONCFS ; Faune sauvage Spécial sanitaire no 261, p. 59-68
- (en) Øyvind Albert Voie, Arnt Johnsen, Arnljot Strømseng, Kjetil Sager Longva (2010), Environmental risk assessment of white phosphorus from the use of munitions — A probabilistic approach; Science of The Total Environment, Volume 408, Issue 8, , Pages 1833-1841
- (en) Mateo R (2009), Lead poisoning in wildbird in Europe and the regulations adopted by different country" ; in RT. Watson, M. Fuller, M. Pokras, and W. G. Hunt (2009), Ingestion of Lead from Spent Ammunition : Implications for Wildlife and Humans. The Peregrine Fund, Boise, Idaho, USA. DOI:10.4080/ilsa.2009.0107
- (en) J. Scott Feierabend (1983), Steel shot and lead poisoning in waterfowl : an annotated bibliography of research, 1976-1983 ; Resources Conservation Dept., National Wildlife Federation, 72 pages
- Pokras MA, Kneeland MK (2009) « lead uptake and effects across species lines: a conservation medicine approach »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?). In Ingestion of lead from spent ammunition: implications for wildlife and humans (eds RT Watson, M Fuller, M Pokras, WG Hunt), pp. 7–22. Boise, ID: The Peregrine Fund.
- (en) Tsujia L.J.S, Wainmanb B, Martina I, Sutherland C, Weberd J-P, Dumas P. & Nieboerb E (2008). The identification of lead ammunition as a source of lead exposure in First Nations: The use of lead isotope ratios. Sci. Total Environ. 393:291-298.
- (en) Thomas V.G (2013). Lead-free hunting rifle ammunition: Product availability, price, effectiveness, and role in global wildlife conservation. Ambio. Jan 4, DOI: 10.1007/s13280-012-0361-7
- (en) U.S. Fish and Wildlife Service. Office of Migratory Bird Management (1985), Use of lead shot for hunting migratory birds in the United States: draft supplemental environmental impact statement ; U.S. Fish and Wildlife Service
Vidéographie
- France 3 Les munitions de 14/18, poison des sols des Hauts-de-France ? ; 15/12/2017
Liens externes
- Réglementation canadienne pour des cartouches moins toxiques, évolution pour 2006-2007
- Présentation Le sans plomb sans peine, les cartouches sans plomb ; La nouvelle réglementation sur l’usage de la grenaille de plomb de chasse en France ; Arrêté du 21 mars 2002 art.1 (JORF 4 avril 2002), Fédération Nationale des Chasseurs.