Bromacétone
La bromacétone ou bromoacétone est un composé chimique (liquide incolore, toxique et inflammable[2]) de formule CH3COCH2Br. En chimie fine, c'est un précurseur à d'autres composés organiques. Il a été utilisé comme arme chimique et comme agent lacrymogène.
| Bromacétone | |

| |
| Formule et structure | |
| Identification | |
|---|---|
| Nom UICPA | 1-bromoacétone |
| Synonymes |
bromaéetone |
| No CAS | |
| No ECHA | 100.009.027 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | Liquide incolore |
| Propriétés chimiques | |
| Formule | H5BrO C=3 |
| Masse molaire[1] | 100,943 ± 0,002 g/mol H 4,99 %, Br 79,16 %, O 15,85 %, |
| Propriétés physiques | |
| T° fusion | −36,5 °C |
| T° ébullition | 137 °C |
| Masse volumique | 1,634 g·cm-3 |
| Point d’éclair | 51,1 °C |
| Pression de vapeur saturante | 1,1 kPa (20 °C) |
| Précautions | |
| Directive 67/548/EEC | |
 T+  N |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
La bromoacétone a été synthétisée dès le XIXe siècle[3].
Il a été utilisé durant la Première Guerre mondiale comme gaz de combat alors appelé BA par les Britanniques et B-Stoff (croix blanche) par les Allemands. En raison de sa toxicité, il est « obsolète » en tant qu'agent de lutte antiémeute et n'est plus utilisé.
Présence
La bromacétone semble naturellement présente dans certains végétaux. Elle a été trouvée pour moins de 1 % dans l'huile essentielle extraite d'algues prélevées à proximité des îles Hawaï[4].
Rémanence
Dans l'atmosphère, au soleil, il est dégradé photochimiquement.
Synthèse
La bromacétone est disponible dans le commerce, parfois stabilisée avec un oxyde de magnésium.
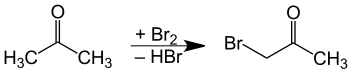
Elle est préparée par réaction du brome et de l'acétone[5], avec catalyse par un acide (mais une base pourrait aussi être utilisée).
Le brome effectue alors une substitution électrophile sur le carbone en α[6]. La principale difficulté de cette méthode est une bromation excessive, donnant des produits di- et tri-brominés.
Applications
La bromacétone est un réactif polyvalent utilisé en synthèse organique. Il est, par exemple, le précurseur de l'hydroxyacétone (pb 35-47 °/12 mm, N°CAS:116-09-6)[7].
Références
- Base de données Reptox, Bromoacétone
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Base de données Reptox, Bromoacétone, inflammable
- Sokolowsky, Berichte volume 9, p. 1687 (1876)
- B. Jay Burreson, Richard E. Moore, and Peter P. Roller, « Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta) », Journal of Agricultural and Food Chemistry, vol. 24, no 4, , p. 856–861 (DOI 10.1021/jf60206a040)
- Phoebus Levene, P. A., Bromoacetone, Org. Synth., coll. « vol. 2 », , p. 88
- William Reusch, « Carbonyl Reactivity », VirtualText of Organic Chemistry (consulté le )
- Levene, P. A.; Walti, A., Acetol, Org. Synth., coll. « vol. 2 », , p. 5
Voir aussi
Articles connexes
- Gaz de combat de la Première Guerre mondiale
- Chloracétone
- Fluoracétone