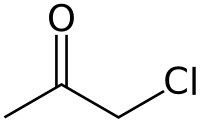
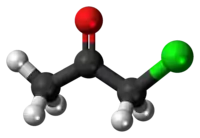
Chloracétone
La chloracétone ou chloroacétone est un composé organique chloré dérivé de l'acétone, de formule C3H5ClO.
| Chloracétone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom systématique | chloropropanone | |
| Synonymes |
chlorure d'acétonyle, 1-chloro-2-propanone, monochloroacétone, 1-chloro-2-cétopropane, 1-chloro-2-oxypropane |
|
| No CAS | ||
| No ECHA | 100.001.056 | |
| PubChem | 6571 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide rose clair à l'odeur âcre[1] | |
| Propriétés chimiques | ||
| Formule | C3H5ClO [Isomères] |
|
| Masse molaire[2] | 92,524 ± 0,005 g/mol C 38,94 %, H 5,45 %, Cl 38,32 %, O 17,29 %, |
|
| Propriétés physiques | ||
| T° fusion | −44 °C[1] | |
| T° ébullition | 119 °C[1] | |
| Solubilité | 100 g·L-1 (eau, (20 °C)[1] | |
| Masse volumique | 1,15 g·cm-3 (20 °C)[1] | |
| Densité de vapeur | 3,19[1] | |
| Densité de vapeur du mélange avec l'air | 1,09[1] | |
| T° d'auto-inflammation | 610 °C classe T1[1] |
|
| Point d’éclair | 35 °C[1] | |
| Limites d’explosivité dans l’air | 3,4 vol.% - [1] | |
| Pression de vapeur saturante | 8 hPa (20 °C) 105 hPa (50 °C) 185 hPa (65 °C)[1] |
|
| Viscosité dynamique | 1,11 mPa·s (25 °C)[1] | |
| Précautions | ||
| SGH[1] | ||
   |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 100 µL·kg-1 (cobaye, dermique)[3] 127 mg·kg-1 (souris, oral)[4] 141 mg·kg-1 (lapin, dermique)[4] 80 mg·kg-1 (rat, i.p.))[5]> 100 mg·kg-1 (rat, oral))[4] |
|
| CL50 | 262ppm/1H (rat, inhaltion)[4] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés[1]
La chloracétone se présente sous la forme d'un liquide rose clair à l'odeur âcre. C'est un liquide inflammable, qui peut former des mélanges explosifs avec l'air au-dessus de son point d'éclair (35 °C). Elle est soluble dans l'eau (100g/l), et présente une volatilité moyenne à basse. Elle présente des risques aigus ou chroniques pour la santé, et est dangereuse pour la vie aquatique.
La chloracétone se décompose lorsqu'elle est chauffée, produisant notamment du chlorure d'hydrogène, de l'acétone et des aldéhydes. Elle réagit dangereusement avec les agents oxydants et les bases. Lorsqu'elle est stockée pour une longue durée, la chloracétone se polymérise vigoureusement voire de façon explosive. Un échantillon ainsi stocké durant deux ans a explosé peu de temps après avoir été touché. Pour cette raison, elle et généralement vendue sous forme « stabilisée », par exemple en mélange avec 0,5 % de carbonate de calcium.
Histoire
Pendant la Première Guerre mondiale, le chloracétone a été utilisée par la France comme lacrymogène, d'abord en novembre 1914 sous le nom de « Tonite », puis plus tard en mélange avec le brome sous le nom de « Martonite ».
Production
La chloracétone est produite par chloration de l'acétone, par exemple en introduisant du dichlore gazeux dans une suspension de carbonate de calcium dans l'acétone. Si la chloration est trop forte, d'autres composés sont également produits, des di- ou trichloracétones. Ceux-ci sont beaucoup plus toxiques mais moins irritants que la (mono-)chloracétone. Les sous-produits peuvent ensuite être séparés par distillation, mais l'opération peut s'avérer délicate du fait de la proximité de leurs points d'ébullition respectifs.
La chloracétone peut également être synthétisée par réaction entre le dichlore et le dicétène.
Production accidentelle
En laboratoire, la chloracétone peut être produite et libérée accidentellement dans des réactions des chloration si de l'acétone est utilisée comme solvant, ou si de l'acétone est utilisée pour nettoyer du matériel contaminé par un agent de chloration ou du chlore lui-même (sous forme dissoute). Le contact provoque une irritation considérable, voire des brûlures graves aux yeux et la peau, et les voies respiratoires peuvent également touchées. Lors de la production de peroxyde d'acétone avec de l'acide chlorhydrique comme catalyseur, de la chloracétone peut se former si le mélange réactionnel devient trop chaud.
Purification
La chloracétone du commerce contient 5 % d'impuretés, notamment de l'oxyde de mésityle qui ne peut être éliminé par distillation. L'oxyde de mésityle peut être oxydé en utilisant KMnO4 en milieu acide pour former un diol (suivi d'une séparation avec l'éther), qui peut ensuite être éliminé par distillation[6].
Applications
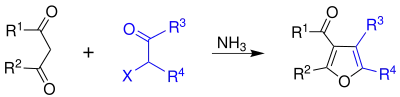
La chloracétone est utilisée pour faire des coupleurs de colorant (en) en photographie couleur et est un intermédiaire de synthèse[7]. La chloracétone peut également être utilisée dans la synthese de Feist-Benary (en) de furanes[8] :
La réaction du phénolate avec la chloracétone donne la phénoxyacétone[9] qui est ensuite utilisée pour produire de nombreux composés pharmaceutiques. Une quantité catalytique d'iodure de potassium est également nécessaire pour faciliter une réaction de Finkelstein.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Chloroaceton » (voir la liste des auteurs) et en allemand « Chloraceton » (voir la liste des auteurs).
- Entrée « 78-95-5 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 avril 2020 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Kodak Company Reports. Vol. 21 mai 1971
- Sargent EV, Kirk GD, Hite M., « Hazard evaluation of monochloroacetone », American Industrial Hygiene Association Journal, vol. 47, (PMID 3751887)
- Oyo Yakuri. Pharmacometrics. Vol. 33, Pg. 695, 1987.
- Phys. Chem. Chem. Phys., 2000,2, 237-245
- Gloria J. Hathaway et Nick H. Proctor, Proctor and Hughes' Chemical Hazards of the Workplace, Wiley-Interscience, , 143–144 p. (ISBN 978-0-471-26883-3, lire en ligne)
- Jie-Jack Li et E. J. Corey, Name Reactions in Heterocyclic Chemistry, Wiley-Interscience, , 160 p. (ISBN 978-0-471-30215-5, lire en ligne)
- Charles D. Hurd et Percy Perletz, « Aryloxyacetones1 », Journal of the American Chemical Society, vol. 68, no 1, , p. 38–40 (ISSN 0002-7863, DOI 10.1021/ja01205a012)