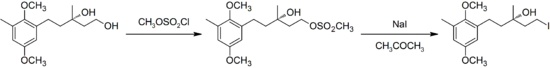Réaction de Finkelstein
La réaction de Finkelstein, du nom du chimiste allemand Hans Finkelstein[1], est une réaction de type SN2 provoquant l'échange d'un atome d'halogène par un autre sur un halogénoalcane. Cet échange d'halogénure est une réaction d'équilibre, mais l'équilibre peut être déplacé dans un sens, en jouant sur les différents solubilité des sels d'halogénures, ou en utilisant un sel d'halogénure en large excès.
- R-X + X′−
 R-X′ + X−
R-X′ + X−
Exemple
La réaction de Finkelstein « classique » est la conversion d'un chlorure d'alkyle ou d'un bromure d'alkye en un iodure d'alkyle par l'addition d'iodure de sodium dans l'acétone. Le principe derrière cette réaction est que l'iodure de sodium est soluble dans l'acétone, mais pas le chlorure de sodium ou le bromure de sodium. La réaction est ainsi déplacée par la précipitation d'un sel insoluble, ce qui le retire de l'équilibre en solution. Par exemple, le bromoéthane peut ainsi être converti en iodoéthane:
- CH3CH2Br (acétone) + NaI (acétone) → CH3CH2I (acétone) + NaBr (s)
Réactivité
Les halogénure d'alkyles réagissent de façon très différentes par la réaction de Finkelstein. La réaction fonctionne bien avec les halogénures primaire (sauf les halogénures de néopentyle) et exceptionnellement bien pour les halogénures d'allyle, de benzyle et d'α-carbonyle, alors que les composés secondaire ne réagissent qu'à la marge et les halogénure de vinyle, d'aryle et les halogénure tertiaires sont non-réactifs.
Le tableau ci-dessous donne les taux de réaction avec NaI dans l'acétone, à 60 °C[2] - [3] :
| Me-Cl | Bu-Cl | i-Pr-Cl | t-BuCH2-Cl | CH2=CH-CH2-Cl | PhCH2-Cl | EtOC(O)CH2-Cl | MeC(O)CH2-Cl |
|---|---|---|---|---|---|---|---|
| 179 | 1 | 0,0146 | 0,00003 | 64 | 179 | 1600 | 33000 |
Dérivés
En usage moderne, la définition de la réaction a été étendue à la conversion des alcools en halogénures d'alkyle, en convertissant d'abord l'alcool en ester de sulfonate (tosylates ou mésylates en général), puis en opérant la substitution. l’exemple ci-dessous est tiré d'une synthèse de l'acide chrysochlamique[4] :
Réaction d'halex
La réaction d'halex décrit une réaction d'échange d'halogène dans un composé aryle (HALogen EXchange). les atomes de chlore dans les chlorure d'aryle (avec des substituants à effet -I) sont remplacés par des atomes de fluor par réaction avec le fluorure de potassium dans un solvant polaire, tels que le DMF ou le DMSO à haute température[5].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Finkelstein reaction » (voir la liste des auteurs).
- (de) H. Finkelstein, « Darstellung organischer Jodide aus den entsprechenden Bromiden und Chloriden », Ber. Dtsch. Chem. Ges., vol. 43, no 2, , p. 1528–1532 (ISSN 0365-9496, DOI 10.1002/cber.19100430257).
- (en) A. Streitwieser, « Solvolytic Displacement Reactions at Saturated Carbon Atoms », Chem. Rev., vol. 56, no 4, , p. 571–752 (ISSN 0009-2665, DOI 10.1021/cr50010a001).
- (en) F. G. Bordwell et W. T. Brannen, « The Effect of the Carbonyl and Related Groups on the Reactivity of Halides in SN2 Reactions », J. Am. Chem. Soc., vol. 86, no 21, , p. 4645–4650 (ISSN 0002-7863, DOI 10.1021/ja01075a025).
- (en) D. J. Maloney et S. M. Hecht, « A Stereocontrolled Synthesis of δ-trans-Tocotrienoloic Acid », Org. Lett., vol. 7, no 19, , p. 4297–4300 (ISSN 1523-7060, PMID 16146411, DOI 10.1021/ol051849t).
- (en) G. C. Finger et C. W. Kruse, « Aromatic Fluorine Compounds. VII. Replacement of Aromatic -Cl and -NO2 Groups by -F », J. Am. Chem. Soc., vol. 78, no 23, , p. 6034–6037 (ISSN 0002-7863, DOI 10.1021/ja01604a022).