Acétone
L’acétone (nom féminin) est en chimie le composé le plus simple de la famille des cétones. De formule brute C3H6O, c'est un isomère du propanal. Son nom officiel UICPA est propanone mais elle est aussi connue sous les noms de diméthylcétone et bêta-cétopropane.
| Acétone | ||
| ||
 | ||
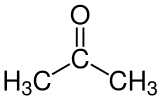
| Formule semi-développée et représentation 3D de l'acétone. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | propan-2-one | |
| Synonymes |
β-cétopropane |
|
| No CAS | ||
| No ECHA | 100.000.602 | |
| No CE | 200-662-2 | |
| PubChem | 180 | |
| FEMA | 3326 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | C3H6O [Isomères] |
|
| Masse molaire[2] | 58,079 1 ± 0,003 1 g/mol C 62,04 %, H 10,41 %, O 27,55 %, |
|
| pKa | 20[3] | |
| Moment dipolaire | 2,88 ± 0,03 D[4] | |
| Diamètre moléculaire | 0,482 nm[5] | |
| Propriétés physiques | ||
| T° fusion | −94,6 °C[6] | |
| T° ébullition | 56,05 °C (760 mmHg)[3] | |
| Solubilité | miscible avec l’eau, l’éthanol, l’oxyde de diéthyle, les esters[1], le benzène, le diméthylformamide, le chloroforme, la plupart des huiles[3] | |
| Paramètre de solubilité δ | 20,3 MPa1/2 (25 °C)[7] ; 22,1 J1/2·cm-3/2 (25 °C)[5] |
|
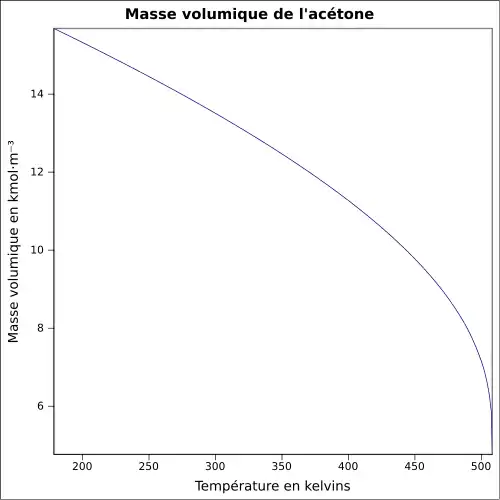
| Masse volumique | ||
| T° d'auto-inflammation | 465 °C[1] ou 538 °C[6] | |
| Point d’éclair | −18 °C (coupelle fermée)[1], −9,4 °C (coupelle ouverte)[6] |
|
| Limites d’explosivité dans l’air | 2,15–13 %vol[6] | |
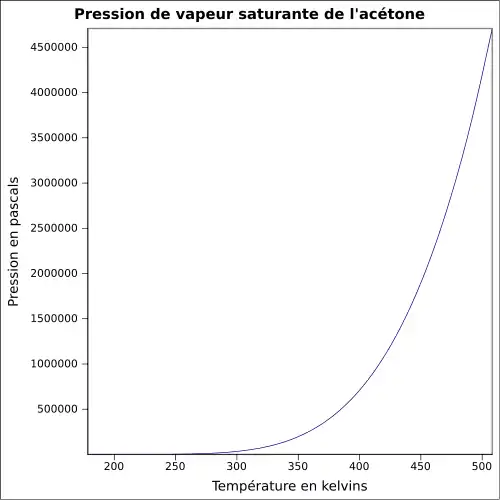
| Pression de vapeur saturante | 228 mbar à 20 °C 360 mbar à 30 °C 814 mbar à 50 °C 1 385 mbar à 65 °C |
|
| Viscosité dynamique | 0,32 cP (20 °C)[3] | |
| Point critique | 235 °C, 46,4 atm[3] | |
| Point triple | −94,5 °C | |
| Vitesse du son | 1 203 m/s à 20 °C[9] | |
| Thermochimie | ||
| S0liquide, 1 bar | 200,4 J mol−1 K−1 | |
| S0solide | −249,4 kJ mol−1 | |
| ΔfH0gaz | −218,5 kJ mol−1 | |
| ΔfH0liquide | −41 kJ mol−1 | |
| ΔfusH° | 5,7 kJ mol−1 | |
| ΔvapH° | 31,3 kJ mol−1 | |
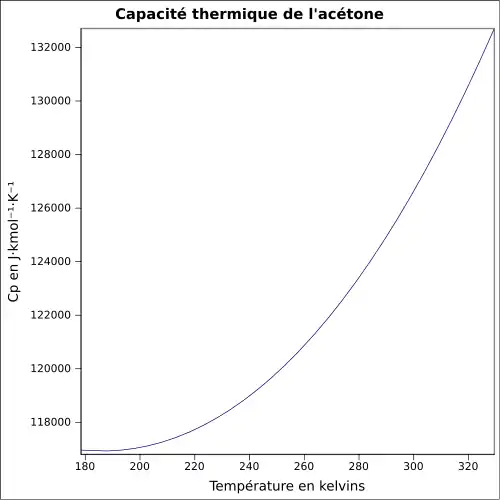
| Cp | 125,5 J mol−1 K−1 (liquide) 75 J mol−1 K−1 (gaz) |
|
| PCS | 1 789,9 kJ mol−1[11] (liquide) | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 9,703 ± 0,006 eV (gaz)[12] | |
| Constante diélectrique | 21,01 | |
| Cristallographie | ||
| Classe cristalline ou groupe d’espace | Pbcm[13] | |
| Paramètres de maille | a = 6,393 Å b = 5,342 Å |
|
| Volume | 366,55 Å3[13] | |
| Propriétés optiques | ||
| Indice de réfraction | 1,3560[5] | |
| Précautions | ||
| SGH[14] | ||
  Danger |
||
| SIMDUT[15] | ||
  B2, D2B, |
||
| NFPA 704 | ||
| Transport | ||
| Inhalation | irritation bronchique, troubles respiratoires, ébriété, obnubilation | |
| Yeux | rougeurs, douleur | |
| Ingestion | ébriété, obnubilation | |
| Écotoxicologie | ||
| DL50 | >5 000 mg kg−1 (oral), 20 g kg−1 (lapin, cutané)[6] |
|
| LogP | –0,24[1] | |
| Seuil de l’odorat | bas : 3,6 ppm[16], 47,5 mg m−3[3] ; |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
L'atterrisseur Philae de la sonde spatiale Rosetta a détecté ce composé à dix atomes sur la comète 67P/Tchourioumov-Guérassimenko[17], ce qui atteste la présence de cette molécule dans le Système solaire.
Propriétés physico-chimiques
L'acétone est un liquide incolore, inflammable, d'odeur caractéristique plutôt fruitée. Sa température de fusion est de −94,6 °C et celle d'ébullition de 56,05 °C. Elle a une densité de 0,783[6] et de 0,819 à 0 °C. C'est un composé très soluble dans l'eau (c'est une molécule polaire à chaîne carbonée courte), dans l'éthanol et dans l'éther. L'acétone est le dérivé le plus simple de la série des cétones aliphatiques et la présence de la double liaison carbone-oxygène lui confère l'essentiel de sa réactivité. C'est un solvant aprotique polaire.
L'acétone forme une hydrazone avec la phénylhydrazine et une oxime avec l'hydroxylamine. Une réduction par amalgame de sodium la convertit en alcool isopropylique ; une oxydation par l'acide chromique donne du monoxyde de carbone, et de l'acide acétique. Elle réagit avec l'ammoniaque pour former de la di- et triacétone amine (en) (TAA). Elle s'unit aussi directement avec le cyanure d'hydrogène pour former le nitrile d'acide 2-hydroxy-2-méthylbutyrique. Cette cyanhydrine, qui est le produit intermédiaire, est convertie par l'acide sulfurique (H2SO4) en ester sulfaté du méthacrylamide, dont l'hydrolyse donne du bisulfate d’ammonium et de l'acide méthacrylique.
Par l'action de divers réactifs, comme la chaux, la potasse caustique ou l'acide chlorhydrique, l'acétone est convertie en produits de condensation, en oxyde de mésityle C6H10O, en phorone C9H14O, etc.
Elle est convertie en mésitylène C9H12 (triméthylbenzène symétrique) par distillation en présence d'acide sulfurique. L'acétone a aussi été utilisée pour la production de teinture d’indigo artificiel. En présence de diiode, d'une base et d'eau, elle donne l'iodoforme.
L'acétone est aussi utilisée comme liquide réfrigérant, car le mélange avec la glace carbonique (CO2 solide) permet de descendre à −78 °C.
Production et synthèse
La synthèse de l'acétone a été décrite par Jean Béguin en 1610, préparée par pyrolyse de l’acétate de plomb[18].
L'acétone, extraite autrefois de l'acide pyroligneux résultant de la pyrolyse du bois, a été ensuite un produit dérivé de l'acide acétique.
En 1915, Chaim Weizmann découvre un moyen peu coûteux d'obtenir de l'acétone à partir de l'amidon, ce qui facilite la production de cordite, un explosif.
Au début des années 2000, la méthode la plus utilisée pour produire l'acétone est le procédé au cumène, qui permet de la fabriquer (ainsi que le phénol) à partir du benzène et du propylène. La production mondiale d'acétone est de l'ordre de 1,5 million de tonnes par an.
Utilisation
L'acétone est un solvant très utilisé dans l'industrie et en laboratoire car il a l'avantage de solubiliser de manière particulièrement rapide de nombreuses espèces organiques et parce qu'il est miscible avec l'eau.
C'est également un composé à la base de la fabrication de plastiques, de médicaments, et autres produits issus de l'industrie de synthèse. L'acétone est notamment utilisée dans l'industrie pour produire le bisphénol A par réaction avec le phénol. Le bisphénol A est un constituant important de nombreux polymères de type polycarbonate ou polyuréthane ainsi que de résines époxyde.
L'acétone est utilisée à grande échelle pour le transport et le stockage de l'acétylène : un récipient contenant un matériau poreux est rempli d'acétone, dans lequel l'acétylène est ensuite dissous (un litre d'acétone permet de dissoudre environ 250 L d'acétylène).
L'acétone est également le principal constituant de certains dissolvants utilisés pour retirer le vernis à ongles. Elle est également utilisée comme dissolvant pour dissoudre la colle et les fibres cellulosiques. Il est recommandé de ne pas utiliser d'acétone sur les fibres artificielles (acétate, triacétate et acrylique).
L'acétone est également utilisée pour le dégraissage industriel.
Des bains d'acétone sont utilisés pour la préparation des corps lors de la plastination.
Aspect biologique et microbiologique
L'acétone est une cétone corporelle, présente normalement, en très petites quantités, dans l'urine et dans le sang. De plus grandes quantités peuvent être trouvées après un jeûne et chez les patients diabétiques (dont la gestion de la glycémie est mauvaise) avec une déficience en insuline sévère ; une odeur fruitée de l’haleine causée par l'acétone est l'un des symptômes de la cétoacidose diabétique.
L'acétone existe naturellement dans les plantes, les arbres, gaz volcaniques, feux de forêts et comme un produit de la décomposition du gras animal. Elle est présente dans les gaz d'échappement, le tabac et les décharges. Les activités humaines en produisent plus que la nature.
Elle fait partie des produits formés par la distillation destructive du bois, sucre, cellulose, etc., et pour cette raison il est toujours présent dans l’esprit de bois brut, dont une grande proportion peut être récupérée par distillation fractionnée.
Effets sur la santé et sécurité
Le contact avec l'acétone peut provoquer des irritations ou des dégâts sur la peau. Une exposition importante et prolongée peut entraîner une perte de conscience.
Des études sur animaux de laboratoire ont démontré des dommages aux reins, au foie et aux nerfs, ainsi qu'au fœtus en cas d'exposition prolongée à des doses importantes d'acétone. Les animaux mâles montraient également des troubles voire des incapacités de reproduction. On ne sait pas si ce genre d'effets peut être observé chez l'humain.
Des doses millimolaires non toxiques d'acétone montrent un effet anticonvulsivant dans des modèles animaux d'épilepsie[19]. La valeur limite d'exposition professionnelle (VLEP) est fixée à 500 ppm (1 210 mg/m3) dans l'Union européenne.
L'inhalation d'acétone peut causer de l'irritation bronchique, des troubles respiratoires et l'ingestion d'acétone peut causer de l'ébriété et de l'obnubilation.
Toxicologie professionnelle
À de fortes concentrations, l'acétone provoque des effets dépresseurs du système nerveux central et une irritation des muqueuses. L'exposition cutanée répétée peut déclencher une dermatite de contact[20]. En raison des dangers d’incendie et d’explosion, des mesures de prévention et de protection s’imposent lors du stockage et de la manipulation de l’acétone : le choix des protections individuelles se fera en fonction des conditions au poste de travail, elles ne devront pas être source d’électricité statique. Lors des visites initiale et périodique, l'examen clinique recherchera des signes d’atteintes neurologique, oculaire, cutanée ou respiratoire chronique. Un effet sur la fertilité est soupçonné.
Notes et références
- ACETONE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « ACETONE », sur Hazardous Substances Data Bank (consulté le ).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- Acétone, INRS, fiche toxicologique FT3, 2008.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0-387-69002-6, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « Acetone », sur reciprocalnet.org (consulté le ).
- Fiche de sécurité fournie par Sigma-Aldrich, consultée le .
- « Acétone » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- (en) « Acetone », sur hazmap.nlm.nih.gov (consulté le ).
- (en) Fred Goesmann, Helmut Rosenbauer, Jan Hendrik Bredehöft, Michel Cabane, Pascale Ehrenfreund, Thomas Gautier, Chaitanya Giri, Harald Krüger, Léna Le Roy, Alexandra J. MacDermott, Susan McKenna-Lawlor, Uwe J. Meierhenrich, Guillermo M. Muñoz Caro, Francois Raulin, Reinhard Roll, Andrew Steele, Harald Steininger, Robert Sternberg, Cyril Szopa, Wolfram Thiemann et Stephan Ulamec, « Organic compounds on comet 67P/Churyumov-Gerasimenko revealed by COSAC mass spectrometry », Science, vol. 349, no 6247, (DOI 10.1126/science.aab0689, lire en ligne).
- Jean Béguin, trad. Jean Lucas Du Roi, Les elemens de chymie, de maistre Iean Beguin aumosnier du Roy, chez Mathieu Le Maistre, ruë sainct Iean de Latran à l'Arbre sec, (lire en ligne).
- Likhodii et al., 2003.
- Fiche toxicologique INRS FT3, .
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- (en) Medical Subject Headings
- (en) National Drug File
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Fiche internationale de sécurité, sur cdc.gov.
- (en) Acetone, sur webbook.nist.gov.
- (en) Hazardous Chemical Database, sur ull.chemistry.uakron.edu.