Polarité (chimie)
En chimie, la polarité est la façon dont les charges électriques négatives et positives sont réparties dans une molécule ou une liaison chimique. La polarité est due à la différence d'électronégativité entre les atomes qui la composent, aux différences de charge qu'elle induit, et à leur répartition dans l'espace. La molécule ou la liaison est ainsi considérée comme un dipôle électrostatique : plus les charges sont réparties de façon asymétrique, plus elle est polaire, et inversement. Si les charges sont réparties de façon totalement symétrique, elle sera apolaire, c'est-à-dire qu'elle n'a pas de polarité électrique et n'est donc pas un dipôle électrostatique.
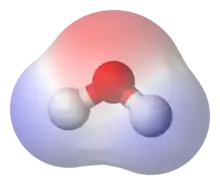
La polarité et ses conséquences (forces de van der Waals, liaison hydrogène) influent sur un certain nombre de caractéristiques physiques (tension superficielle, point de fusion, point d'ébullition, solubilité) ou chimiques (réactivité).
Théorie
Polarité d'une liaison
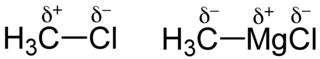
Dans une liaison, le doublet électronique peut ne pas être partagé équitablement entre les deux atomes : l'un des deux atomes peut avoir une force d'attraction sur le nuage électronique plus grande que l'autre. On appelle électronégativité cette capacité pour les atomes à attirer le nuage électronique. Ce partage inéquitable de la charge électronique transforme alors le couple atomique en dipôle. Tout se passe alors comme s'il y avait un transfert électronique partiel de l'atome le moins électronégatif vers l'atome le plus électronégatif. On introduit ce transfert fictif par des charges partielles : à l'atome le plus électronégatif qui attire à lui le doublet électronique, sera attribuée une charge partielle négative, notée -δe ou δ-, à l'autre une charge partielle positive, notée +δe ou δ+ (cette notation a été introduite en 1926 par Christopher et Hilda Ingold[1]). La liaison covalente prend alors un caractère ionique partiel.
En fonction de la différence d'électronégativité entre les atomes, la liaison interatomique varie entre deux extrêmes :
- quand la différence d'électronégativité est nulle ou très faible (typiquement, inférieure à 0,4 sur l'échelle de Pauling[alpha 1]), les charges partielles sont nulles (δe = 0) et la liaison est complètement apolaire : le doublet électronique est réparti équitablement entre les atomes, la liaison est dite covalente ;
- quand la différence d'électronégativité est très grande (typiquement, supérieure à 1,7[alpha 1]), les charges partielles deviennent formelles (δe = 1), la liaison perd de son caractère covalent pour tendre vers une liaison ionique pure : les atomes ne partagent plus un doublet, mais s'ionisent pour prendre une configuration de gaz noble, le moins électronégatif cédant un ou plusieurs électrons au plus électronégatif ;
- quand la différence d'électronégativité est intermédiaire (entre 0,4 et 1,7[alpha 1]), la liaison est qualifiée de covalente polarisée.
Polarité d'une molécule
Une molécule est un assemblage chimique constitué d'une ou plusieurs liaisons covalentes résultant de la combinaison des orbitales atomiques des atomes qui la composent. Dans cette molécule, en fonction de la nature et donc de l'électronégativité des atomes qui la composent, peuvent apparaître des charges partielles. La répartition de ces charges dans l'espace donne son caractère polaire ou non à la molécule :
- si le barycentre des charges positives et celui des charges négatives coïncident, la répartition des charges est symétrique dans la molécule et celle-ci est qualifiée d'apolaire ;
- en revanche, si les deux barycentres ne coïncident pas, il y a dans la molécule deux pôles distincts, de charges opposées. La séparation de ces pôles induit un moment dipolaire , dans la molécule, dont la norme est le produit de la distance entre les pôles par la charge. Plus la valeur du moment dipolaire est grande, plus la molécule est polaire.
La polarité d'une molécule influe sur ses propriétés physiques ou chimiques. Les composés apolaires se dissolvent en général mal dans les solvants polaires (en particulier les hydrocarbures, apolaires, ne se dissolvent en général pas dans l'eau, solvant polaire), contrairement aux composés polaires. Dans des molécules comparables, avec des masses molaires similaires, les molécules polaires ont en général un point d'ébullition plus élevé à cause des interactions dipôle-dipôle entre molécules. Le cas le plus commun de ce type d'interaction est la liaison hydrogène, particulièrement présent dans l'eau.
Molécules polaires
De nombreuses molécules très courantes sont polaires, comme le saccharose, une forme commune de sucre. Les sucres en général possèdent de nombreuses liaisons oxygène-hydrogène (groupe hydroxyle -OH) et sont en général très polaires. L'eau est un autre exemple de molécule polaire, ce qui permet aux molécules polaires d'être généralement solubles dans l'eau. Deux substances polaires sont très solubles entre elles de même qu'entre deux molécules apolaires grâce aux interactions de Van der Waals.
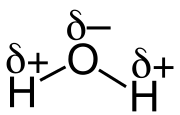 L'eau, un solvant polaire
L'eau, un solvant polaire
Autres exemples :
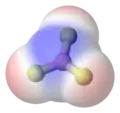
- le fluorure d'hydrogène, HF, où un atome d'hydrogène est lié par une liaison simple à un atome de fluor. Le fluor étant bien plus électronégatif que l'hydrogène (c'est même le plus électronégatif des éléments), la liaison est fortement polarisée, les électrons étant localisés plus près de l'atome de fluor ;
- l'ammoniac, NH3, est constitué d'un atome d'azote et des trois atomes d'hydrogène liés par des liaisons N-H faiblement polarisée (l'atome d'azote étant légèrement plus électronégatif que l'hydrogène). Cependant l'azote possède un doublet non-liant positionné proche d'un hypothétique quatrième sommet d'un tétraèdre (géométrie pyramide trigonale dans la théorie VSEPR). Cette région riche en électron crée un puissant dipôle à travers la molécule d'ammoniac ;
- dans l'ozone, O3, les liaisons O-O sont évidemment apolaires (pas de différence d'électronégativité puisqu'il s'agit du même élément), Cependant les électrons ne sont pas répartis de façon uniforme : l'atome central partage ses électrons avec deux atomes, formant de façon formelle une liaison simple avec l'un et une liaison double avec l'autre, ne possédant dans son entourage direct que cinq électrons (un doublet non liant + trois électrons dans chacune des liaisons), faisant apparaître une charge formelle de +1, alors que chacun des deux autres atomes se retrouvent — toujours formellement — à tour de rôle à avoir six ou sept électrons, leur donnant une charge formelle de -1/2. Ceci, et de par la géométrie coudée de la molécule résulte en un dipôle à travers toute la molécule.
 Fluorure d'hydrogène, le fluor étant représenté en jaune.
Fluorure d'hydrogène, le fluor étant représenté en jaune. Fluorure d'hydrogène : la zone rouge représente la région chargée partiellement de façon négative
Fluorure d'hydrogène : la zone rouge représente la région chargée partiellement de façon négative Ammoniac : le doublet non liant est représenté en jaune, les atomes d'hydrogène en blanc
Ammoniac : le doublet non liant est représenté en jaune, les atomes d'hydrogène en blanc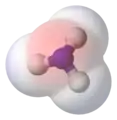 Ammoniac : la zone rouge représente la région chargée partiellement de façon négative
Ammoniac : la zone rouge représente la région chargée partiellement de façon négative Ozone
Ozone
Molécules apolaires
Une molécule peut être apolaire pour deux raisons : soit ses liaisons sont peu ou pas polaires, résultant en une distribution symétrique des électrons sur toute la molécule, soit parce que les charges créées par des liaisons polaires sont réparties de façon symétrique, faisant coïncider les barycentres des charges positives et négatives.
Des exemples de composés apolaires communs sont les hydrocarbures et les graisses. La plupart de ces molécules sont d'ailleurs insolubles à température ambiante dans l'eau (hydrophobie), solvant polaire. Cependant, beaucoup de solvants organiques sont capables de se dissoudre dans des composés polaires. Exemples :
- dans le méthane (CH4), les quatre liaisons C–H sont positionnées de façon tétraédrique autour de l'atome de carbone. Cette configuration symétrique annule tout effet dipolaire qui pourrait se créer du fait de la polarité, faible de toutes façons, des liaisons C-H ;
- le trifluorure de bore, (BF3, possède une géométrie trigonale plane, avec les trois liaisons polaires B-F arrangées de façon symétriques à 120e, faisant coïncider les barycentres des charges positives et négatives, résultant en un moment dipolaire nul ;
- le dioxygène (O2) ne présente pas de polarité car ses liaisons covalentes sont entre deux atomes identiques ne présentant donc pas de différence d'électronégativité, et ne sont donc pas polarisées, permettant une distribution symétrique des électrons sur toute la molécule.

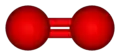 Dioxygène
Dioxygène
Notes et références
Notes
- Ces bornes de 0,4 et 1,7 sont classiques mais relativement arbitraires.
Références
- (en) The Origin of the "Delta" Symbol for Fractional Charges Jensen, William B. J. Chem. Educ. 2009, 86, 545. Lien
