Charge partielle
Une charge partielle est une charge électrique inférieure en valeur absolue à la charge élémentaire (c'est-à-dire inférieure à la charge de l'électron). Elle est souvent notée δ- lorsqu'elle est négative et δ+ lorsqu'elle est positive[1]. Elle s'exprime en coulombs ou en fraction de charge élémentaire.
Charge atomique partielle
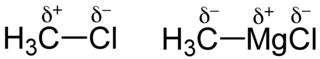
Les charges partielles proviennent d'une asymétrie de la distribution des électrons d'une liaison chimique. Les charges partielles qui en résultent sont une propriété locale des zones couvertes par la distribution et non de l'ensemble total. Par exemple les chimistes choisissent souvent d'observer une zone proche du noyau atomique. Quand un atome (électriquement neutre) se lie chimiquement à un autre atome plus électronégatif, ses électrons sont partiellement attirés par ce dernier le long de la liaison. Il en résulte une région avec une plus faible densité d'électrons qui possède alors une charge partielle positive, et une charge partielle négative sur l'atome qui a attiré des électrons (chargés négativement).
Dans une telle situation, la somme des charges partielles distribuées est toujours un nombre entier de charges élémentaires. On peut cependant trouver des zones où se trouve moins d'une charge élémentaire, par exemple autour du noyau. Ceci est dû au fait que les particules ne sont pas ponctuelles mais ont une extension spatiale régie par un principe d'incertitude dans le cadre de la mécanique quantique.
Utilisation
Les charges partielles sont utilisées en mécanique moléculaire des champs de force, pour calculer l'énergie d'interaction donnée par la loi de Coulomb. Les charges partielles permettent également une compréhension qualitative des structures et de la réactivité des molécules.
Méthodes de détermination
Malgré son utilité, le concept de charge partielle est souvent qualitatif. Une détermination quantitative de cette valeur nécessite en effet de disposer d'une théorie qui délimite l'espace occupé par chaque atome au sein d'une molécule, comme la théorie AIM (Atome in molecule)[2]. Plusieurs méthodes permettent de quantifier la charge partielle portée par un atome. Ces méthodes peuvent se classer en quatre catégories[3] dont les caractéristiques sont les suivantes :
- I. les charges ne sont pas définies en utilisant la mécanique quantique, mais à partir d'une approche arbitraire ou intuitive. Ces méthodes peuvent être basées sur des données expérimentales comme les moments dipolaires et les électronégativités ; par exemple, la relation proposée par Wilmshurst[4] donne la charge partielle pour une molécule diatomique AB comme le rapport entre la différence d'électronégativité de A et de B et la somme des électronégativités[5] :
- II. les charges dérivent d'une séparation des fonctions d'onde moléculaires en utilisant un schéma arbitraire basé sur les orbitales ;
- III. les charges sont basées sur une séparation d'une grandeur physique observable dérivant des fonctions d'onde, comme la densité électronique ;
- IV. les charges dérivent d'une cartographie semi empirique d'une charge de type II ou III pour reproduire expérimentalement des grandeurs observables comme les moments dipolaires.
Articles connexes
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Partial charge » (voir la liste des auteurs).
- Cette notation a été introduite en 1926 par Christopher Ingold et sa femme: (en) The Origin of the "Delta" Symbol for Fractional Charges Jensen, William B. J. Chem. Educ. 2009, 86, 545. Lien
- Gillespie R. & Popelier P. (2001). Chemical Bonding and Molecular Geometry, Oxford Univ. Press. Chapitre 6.
- C. J. Cramer, Essentials of Computational Chemistry : Theories and Methods, Wiley, , P278-289
- Wilmshurst, J. K. J. Chem. Phys. 1959, 30, 561–565.
- Meek T. & Garner L. (2005). Electronegativity and the Bond Triangle. J Chem. Educ. 82 p. 325.
Bibliographie
- J. Meister, W. H. E. Schwarz. Principal Components of Ionicity. J. Phys. Chem. 1994, 98, 8245-8252.
- Frank Jensen, Introduction to Computational Chemistry, 2nd Edition, Wiley (ISBN 978-0-470-01187-4)

