Composé organique
Les composés organiques sont les composés dont un des éléments chimiques constitutifs est le carbone[1], à quelques exceptions près. Ces composés peuvent être d’origine naturelle ou produits par synthèse[2].
Il est utile, au préalable, de distinguer les composés organiques des composés inorganiques.
Distinction entre composés organiques et composés inorganiques
Un composé est une espèce chimique constituée d’au moins deux éléments chimiques différents[3] - [4].
Composés organiques
L'étymologie du terme « organique » est historique. La chimie organique était, au début, la chimie des substances formées par les organismes vivants (végétaux, animaux et bactériens) à l’aide d’une mystérieuse « force vitale »[5]. L'étude des composés biochimiques a conduit les chimistes à éliminer par évaporation l'eau des organismes, et obtenir un poids sec résiduel dont la plus grande partie consiste en molécules carbonées. Quand ils les ont découvertes, ils ont cru que ces molécules carbonées n'existaient que dans les organismes vivants et les ont appelées molécules organiques pour les distinguer des molécules inorganiques du monde inanimé[6].
Une caractéristique du carbone consiste en l’aptitude qu’ont ses atomes à s’enchaîner les uns aux autres, par des liaisons covalentes, d'une façon presque indéfinie, pour former des chaînes carbonées d’une grande diversité qui caractérisent les molécules dites « organiques »[7]. Ces enchaînements carbonés constituent le squelette des composés organiques.
Quelques exemples
 Structure 3D
Structure 3D
- Tétrachloroéthylène (éléments constitutifs : carbone et chlore Cl)
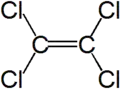 Formule développée plane
Formule développée plane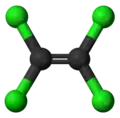 Structure 3D
Structure 3D
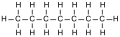 Formule développée plane
Formule développée plane Structure 2D
Structure 2D Structure 3D
Structure 3D Formule topologique (squelette carboné)
Formule topologique (squelette carboné)
 Structure 3D
Structure 3D Formule topologique (squelette carboné)
Formule topologique (squelette carboné)
- Structure
 Représentation de Kékulé
Représentation de Kékulé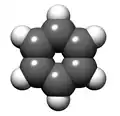 Modèle moléculaire
Modèle moléculaire
- 2. Squelette carboné (noyau benzénique)
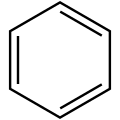 Représentation de Kékulé
Représentation de Kékulé Représentation avec les six électrons délocalisés
Représentation avec les six électrons délocalisés
- Phénoplastes (macromolécules constituées des éléments carbone, hydrogène et oxygène O)
Composés inorganiques
Les composés inorganiques sont tous les autres composés[3].
Ces composés représentaient, à l'origine, les substances que l'on trouve chez les êtres inanimés du « règne minéral »[5].
Alors que les composés organiques sont formés de liaisons covalentes ou à caractère covalent dominant, les composés « minéraux » sont souvent formés de liaisons ioniques ou à caractère ionique dominant[8] - [9].
Remarques :
- Les allotropes du carbone, tels que le diamant et le graphite, structures elles-mêmes basées sur des enchaînements d’atomes de carbone, n’appartiennent pas à la famille des composés organiques. Ce sont en effet des corps simples, constitués du seul élément carbone, et non des composés. Ils sont classés parmi les espèces minérales inorganiques[10] ;
- Certains composés carbonés peuvent être classés parmi les composés inorganiques. Quelques exemples sont fournis plus bas.
Les composés organiques
L'existence des composés organiques est fondée sur l'élément carbone.
Il existe une très grande diversité de composés organiques qui peuvent se rencontrer à l'état solide, liquide ou gazeux. De façon générale, les molécules organiques jouent un rôle important dans les réactions chimiques se produisant dans les organismes vivants et sont au cœur de l'industrie humaine via notamment les produits dérivés du pétrole. La branche de la chimie s'intéressant aux molécules organiques est la chimie organique.
Les molécules organiques contiennent le plus souvent au moins un atome de carbone (C) lié à un atome d’hydrogène (H), mais pas toujours. Il existe des composés organiques qui ne contiennent pas de liaison C-H : l'acide oxalique, l'acide trifluoroacétique, l'hexachloroéthane et l'urée en sont des exemples.
Les composés organiques naturels ont une origine biologique[2].
Les éléments constitutifs des composés organiques
Outre le carbone, les composés organiques ne contiennent qu’un éventail réduit d’éléments :
- l’hydrogène (H), l'oxygène (O), l’azote (N) ou plus rarement le soufre (S) ou le phosphore (P), dans le cas des composés organiques naturels[11] - [2] ;
- les composés synthétiques peuvent contenir d’autres éléments, comme les halogènes[12] - [11] - [1].
Une description plus précise de la famille des composés organiques diffère un peu selon les sources. Certaines citent des métaux parmi les éléments constitutifs des composés organiques synthétiques[11] - [1].
Des composés carbonés classés parmi les inorganiques
Quelques composés simples du carbone sont classés parmi les composés inorganiques.
Les composés cités sont généralement :
Le monoxyde de carbone (CO) et le dioxyde de carbone (CO2), l'acide carbonique, les carbonates et bicarbonates, les cyanures, les carbures (excepté les hydrocarbures)[13] - [12].
Remarques :
- Les carbonates, les bicarbonates et les cyanures sont en général des composés ioniques, dont le caractère est inorganique (voir la section « composés inorganiques »).
Ces composés sont des assemblages électriquement neutres de cations et d'anions carbonés classés, en l'occurrence, parmi les entités chimiques carbonées inorganiques :
- anions CO32− pour les carbonates, HCO3− pour les bicarbonates et CN− pour les cyanures ; - Il existe quelques carbonates organiques (exemples : carbonate d'éthylène, carbonate de diméthyle) et cyanures organiques (exemples : cyanure de vinyle, cyanure de benzyle), qui sont des composés carbonés synthétiques covalents dans lesquels les groupes CO3 et CN ne sont pas des ions.
Une définition au caractère exhaustif
Selon une directive européenne du 11 mars 1999[14], le terme « composé organique » désigne :
Tout composé contenant au moins l'élément carbone et un ou plusieurs des éléments suivants : hydrogène, halogènes, oxygène, soufre, phosphore, silicium ou azote, à l'exception des oxydes de carbone[15] et des carbonates et bicarbonates inorganiques.
La précision « inorganiques » est importante pour exclure les éventuelles formes organiques des composés cités dans les exceptions, comme il a été signalé dans les remarques plus haut.
Le cas des composés organométalliques
Les composés qui possèdent une liaison covalente métal-carbone entre un ou plusieurs atomes de métal et un ou plusieurs atomes de carbone de groupes « organyles[16] »[17], sont constitutifs d’une chimie appelée organométallique.
Ces composés illustrent le « caractère arbitraire et assez conventionnel dans certains cas »[18] de la distinction entre organique et inorganique :
- « Par exemple le développement récent de la chimie des composés organométalliques (composés avec liaison carbone-métal), celui de la chimie bioinorganique (trente éléments sont essentiels pour la vie, dont dix-sept métaux) illustrent le caractère très relatif des frontières séparant chimie minérale, chimie organique, voire biochimie[18]. »
Les composés organométalliques combinent en fait des aspects de la chimie organique et de la chimie inorganique. La chimie organométallique « constitue une sorte de pont entre la chimie organique et la chimie inorganique »[19].
Classification
Voici une liste des fonctions de la chimie organique avec, pour chacune d'elles, un exemple avec formule, nom et numéro CAS.
Pour les différentes représentations ci-dessous, voir « représentation des molécules » et « formule topologique ».
Composés carbonés (hydrocarbones ou carbures d'hydrogène)
- Hydrocarbures aliphatiques saturés
- Alcanes :
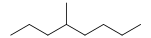 4-méthyloctane (CAS )
4-méthyloctane (CAS ) - Cycloalcanes :
- Alcanes :
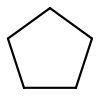 cyclopentane (CAS )
cyclopentane (CAS )
- Hydrocarbures éthyléniques ou oléfines ou alcènes
- Mono alcènes :
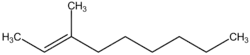 3-méthylnon-2-ène (CAS )
3-méthylnon-2-ène (CAS )
- Diènes :
- Allènes : buta-1,2-diène ou méthyl allène (CAS )
- Polyènes
- Cycloalcènes ou cyclènes :
- Diènes :
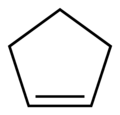 cyclopentène (CAS )
cyclopentène (CAS )
- Cyclodiènes :
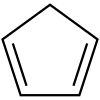 1,3-cyclopentadiène (CAS )
1,3-cyclopentadiène (CAS )
- Hydrocarbures acétyléniques ou alcynes :
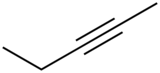 Pent-2-yne (CAS )
Pent-2-yne (CAS )
Fonctions organiques monovalentes
Dans ce cas, la fonction monovalente est celle où chaque carbone concerné est lié à un seul atome qui ne soit ni le carbone ni l'hydrogène, appelé un hétéroatome.
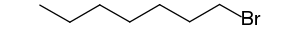
- 1-bromoheptane (CAS )
 4-bromobut-1-ène (CAS )
4-bromobut-1-ène (CAS )
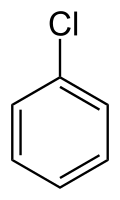
chlorure de phényle appelé aussi chlorobenzène (CAS )
 diméthylzinc (CAS )
diméthylzinc (CAS )
Dérivés monovalents avec oxygène
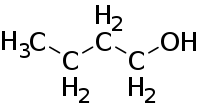 n-butanol (CAS )
n-butanol (CAS )
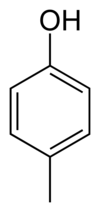
- 4-méthylphénol ou p-crésol
- méthoxyéthane (CAS )
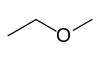
- Éther-sels des acides minéraux
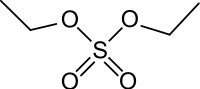 diéthyl sulfate (CAS )
diéthyl sulfate (CAS )
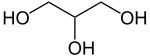 glycérol ou 1,2,3 propanetriol (CAS )
glycérol ou 1,2,3 propanetriol (CAS )
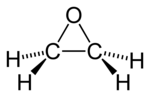 oxyde d'éthylène ou époxyéthane (CAS )
oxyde d'éthylène ou époxyéthane (CAS )
Dérivés monovalents avec azote
- Composés nitrés
 1-nitropropane (CAS )
1-nitropropane (CAS )
- Composés nitrosés
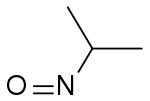 2-nitrosopropane (CAS )
2-nitrosopropane (CAS )
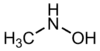 méthyl hydroxylamine (CAS )
méthyl hydroxylamine (CAS )
- Amines aliphatiques
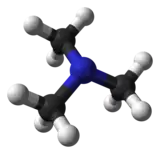 triméthylamine (CAS 75-50-3) éthylamine (CAS )
triméthylamine (CAS 75-50-3) éthylamine (CAS )
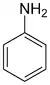 aniline ou amino benzène (CAS )
aniline ou amino benzène (CAS )
- Cétals (et les hémi-cétals, les acétals, les hémi-acétals)
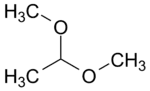 1,1 dimétoxy éthane (CAS )
1,1 dimétoxy éthane (CAS )
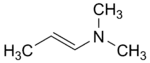 (CAS )
(CAS )
Fonctions organiques bivalentes
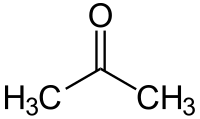 acétone ou 2-propanone (CAS )
acétone ou 2-propanone (CAS )
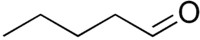 pentanal (CAS )
pentanal (CAS )
- méthylcétène (CAS )
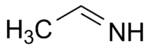 acetaldimine (CAS )
acetaldimine (CAS )
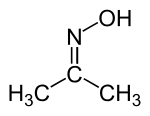 diméthylcétoxime, isopropylidèneazanol ou 2-propanone, oxime (CAS )
diméthylcétoxime, isopropylidèneazanol ou 2-propanone, oxime (CAS )
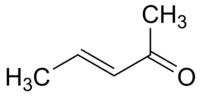 3 pentène-2-one (CAS )
3 pentène-2-one (CAS )
Fonctions organiques trivalentes
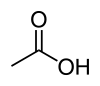 acide acétique
acide acétique
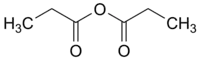 anhydride propionique (CAS )
anhydride propionique (CAS )
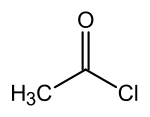 chlorure d'acétyle (CAS )
chlorure d'acétyle (CAS )
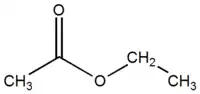 acétate d'éthyle (CAS )
acétate d'éthyle (CAS )
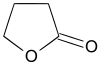 gamma-butyrolactone (CAS )
gamma-butyrolactone (CAS )
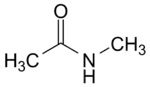 N-méthyl acétamide (CAS )
N-méthyl acétamide (CAS )
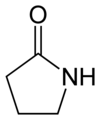 butyrolactame ou 2-pyrrolidone (CAS )
butyrolactame ou 2-pyrrolidone (CAS )
- acétonitrile (CAS )
Fonctions organiques tétravalentes
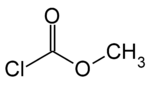 chloroformiate de méthyle (CAS )
chloroformiate de méthyle (CAS )
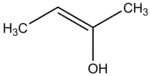 2-butène-2-ol (CAS )
2-butène-2-ol (CAS )
Dérivés insaturés
- Éthers isocyaniques
- isocyanate de méthyle (CAS )
 alcool allylique ou 2-propène-1-ol (CAS )
alcool allylique ou 2-propène-1-ol (CAS )
 3-pentène-1-ol (CAS )
3-pentène-1-ol (CAS )
Composés aromatiques
Les composés aromatiques contiennent un cycle d'atomes de carbone du type de celui du benzène ou similaire. Si le cycle contient un atome autre que du carbone, on parle d'hétérocycle.
- Benzène et ses dérivés
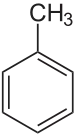 toluène (CAS
toluène (CAS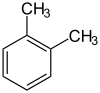 o-xylène (CAS )
o-xylène (CAS )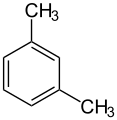 m-xylène (CAS )
m-xylène (CAS )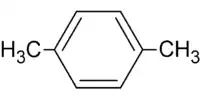 p-xylène (CAS )
p-xylène (CAS ) mésitylène ou 1,3,5-triméthylbenzène (CAS )
mésitylène ou 1,3,5-triméthylbenzène (CAS ) phtalimide (CAS )
phtalimide (CAS ) phtalimide de potassium
phtalimide de potassium  anhydride phtalique (CAS )
anhydride phtalique (CAS )
Autres composés
On peut également citer les composés issus d'autres branches reliées à la chimie organique :
- les polymères ;
- les composés organométalliques.
Notes et références
- Paul Arnaud, op.cit., p. 10
- Jean-Pierre Mercier, Philippe Godard, op.cit., p. 1.
- Peter Atkins, Loretta Jones, op.cit., p. 15.
- Jacques Angenault, op. cit., p. 104
- Paul Arnaud, op.cit., p. 2
- Gerald Karp, Biologie cellulaire et moléculaire: Concepts and experiments, De Boeck Supérieur, (lire en ligne), p. 41.
- Peter Atkins, Loretta Jones, op.cit., p. 389.
- Paul Arnaud, op.cit., p. 3
- En chimie organique, l'ionisation des composés est toujours très limitée (Raymond Quelet, op. cit., p. 4).
- Il existe quelques rares minéraux organiques, source : Claude GUILLEMIN, « MINÉRALOGIE », Encyclopædia Universalis [en ligne], consulté le 17 septembre 2014. URL : http://www.universalis.fr/encyclopedie/mineralogie/.
- Raymond Quelet, op. cit., p. 3
- Voir la section « une définition au caractère exhaustif »
- Paul Arnaud, op. cit., p. 1
- Texte de la directive, article 2, paragraphe 16, sur le site eur-lex.europa.eu.
- Monoxyde de carbone (CO), dioxyde de carbone (CO2). D'autres oxydes de carbone, inorganiques et organiques, sont présentés dans un tableau situé dans le bas de page de l’article « oxyde de carbone ».
- Groupe organyle : « tout groupe substituant organique, indépendamment de son groupe fonctionnel, possédant une valence libre sur un atome de carbone » (Robert Panico et al., op. cit., p. 59, et (en) cet article du Gold Book).
- Robert Panico et al., op. cit., p. 52, et (en) cet article du Gold Book.
- Maurice Bernard, op. cit., p. 2.
- Huheey, Keiter et al., op. cit, chapitre 15, p. 623 - Présentation en ligne - Lire en ligne
Voir aussi
Bibliographie
- Jacques Angenault (1995), La Chimie – dictionnaire encyclopédique, 2e édition, Éditions Dunod (ISBN 2100024973)
- Paul Arnaud (1990), Cours de chimie organique, 15e édition, Premier cycle universitaire, Éditions Dunod (ISBN 2040197168)
- Jean-Pierre Mercier, Philippe Godard (1995), Chimie organique - Une initiation, Presses polytechniques et universitaires romandes (ISBN 2880742935)
- Peter Atkins, Loretta Jones (1998), Chimie - molécules, matière, métamorphoses, 3e édition, De Boeck Université (ISBN 2744500283)
- Maurice Bernard (1994), Cours de chimie minérale , 2e édition, Premier cycle universitaire, Éditions Dunod (ISBN 2100020676)
- Raymond Quelet (1964), Précis de chimie, vol. III - Chimie organique, candidats aux certificats d’études supérieures préparatoires, Presses universitaires de France
- Robert Panico, Jean-Claude Richer, Jean Rigaudy (1996), Nomenclature et Terminologie en Chimie organique, Éditions techniques de l'ingénieur (ISBN 2850590010)
- Huheey, Keiter et al. (1996), Chimie inorganique, De Boeck Université (ISBN 2804121127)
- (en) Louis F. Fieser et Mary Fieser, Introduction to organic chemistry, DC Heath and Company, Boston
- Donald J. Cram et George S. Hammond, Chimie organique, Gauthier-Villars, Paris, 1965
- (pt) Geraldo Camargo de Carvalho, Química orgânica moderna (2 vol.), Livraria Nobel
- (pt) Arthur I. Vogel, Química orgánica qualitativa (3 vol.), Ao Livro Técnico, 1971
- (en) John H. Fletcher, Otis C. Dermer, Robert B. Fox, Nomenclature of organic compounds. Principe and practice, Advances in Chemistry Series 126-1974
- A. Kurmann, Chimie organique générale (3 vol.), Librairie Armand Colin, 1960