Xylène
Le xylène, ou diméthylbenzène, est un groupe d'hydrocarbures aromatiques dérivés méthylés du benzène. Il est représenté par trois isomères structuraux : 1,2-diméthylbenzène, 1,3-diméthylbenzène et 1,4-diméthylbenzène (appelés respectivement ortho-diméthylbenzène, méta-diméthylbenzène et para-diméthylbenzène). Le xylène technique est un mélange des trois isomères, de composition voisine de méta- (60 %), ortho- (10-25 %) et para- (10-25 %).
Structure et isomères
Tout comme pour le benzène, la structure du xylène est plane. C'est un composé aromatique, et les électrons formant les liaisons π du cycle sont délocalisés, ce qui entraîne une stabilité importante de la structure.
Les préfixes o-, p- ou m- indiquent à quels atomes de carbone du noyau aromatique sont fixés les groupements méthyle. En numérotant les atomes de carbone à partir d'un atome lié à un groupement méthyle, le composé est du o-xylène (1,2-diméthylbenzène) si l'atome de carbone adjacent, numéroté 2, est également lié à un groupement méthyle. Si le carbone numéroté 3 est lié à un groupement méthyle, le composé est le m-xylène (1,3-diméthylbenzène). Si le carbone numéroté 4 est lié à un groupement méthyle, le composé est le p-xylène (1,4-diméthylbenzène).
Propriétés physico-chimiques
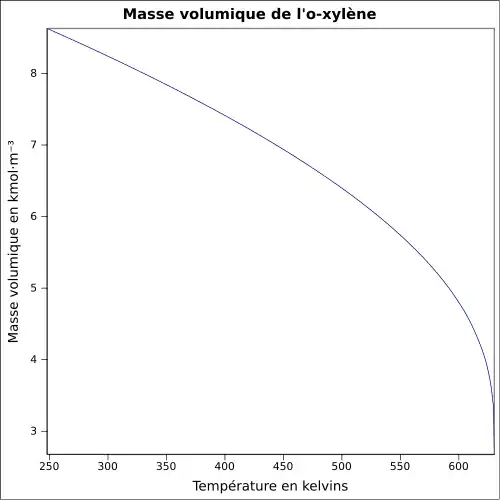
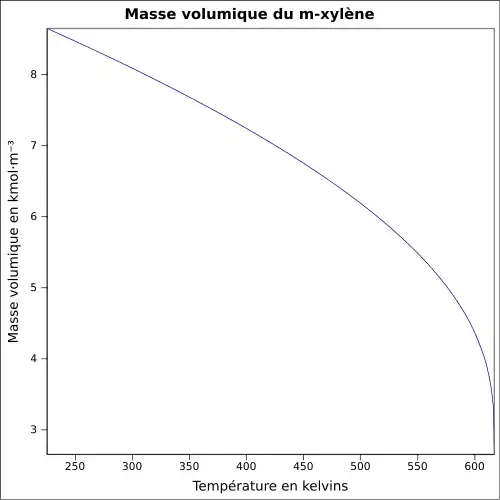
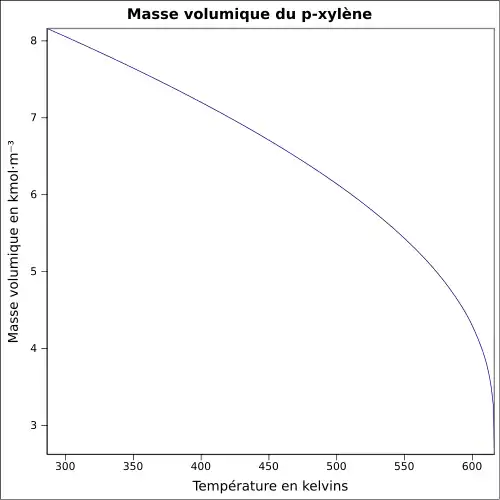
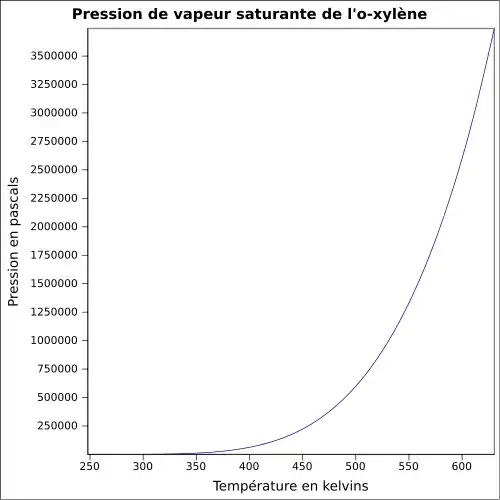
Le xylène est un liquide incolore, d'odeur désagréable et très inflammable. Il est naturellement présent dans le pétrole et le goudron de houille, et se forme durant les feux de forêts. Les propriétés chimiques diffèrent peu d'un isomère à l'autre. La température de fusion est comprise entre −47,87 °C (m-Xylène) et 13,26 °C (p-Xylène). La température d'ébullition est voisine de 140 °C pour tous les isomères. La densité est de 0,87 (le composé est plus léger que l'eau). L'odeur du xylène devient détectable pour des concentrations de l'ordre de 0,08 à 3,7 ppm, et le goût est apparent dans l'eau pour des concentrations de l'ordre de 0,53 à 1,8 ppm.
| Isomères du xylène | ||||
|---|---|---|---|---|
| Général | ||||
| Nom | o-xylène | m-xylène | p-xylène | |
| Nom complet | 1,2-diméthylbenzène | 1,3-diméthylbenzène | 1,4-diméthylbenzène | |
| Autre nom | o-xylol | m-xylol | p-xylol | |
| Formule chimique | C8H10 | |||
| SMILES | Cc1c(C)cccc1 | Cc1cc(C)ccc1 | Cc1ccc(C)cc1 | |
| Masse molaire | 106,16 g/mol | |||
| Apparence | liquide incolore | |||
| Numéro CAS | ||||
| Numéro CAS pour le mélanges des 3 isomères | ||||
| Propriétés physiques | ||||
| Densité | 0,88, liquide
|
0,86, liquide
|
0,86, liquide
| |
| Solubilité dans l'eau | quasiment insoluble | |||
| Soluble dans les solvants non polaires comme les hydrocarbures aromatiques | ||||
| Paramètre de solubilité δ | 18,0 MPa1/2 (25 °C)[2] | |||
| Température de fusion | −25 °C (248 K) | −48 °C (225 K) | 13 °C (286 K) | |
| Température d'ébullition | 144,43 °C [3] | 139,1 °C [3] | 138,2 °C [3] | |
| Température d'auto-inflammation | 463 °C (736 K) | 527 °C (800 K) | 528 °C (801 K) | |
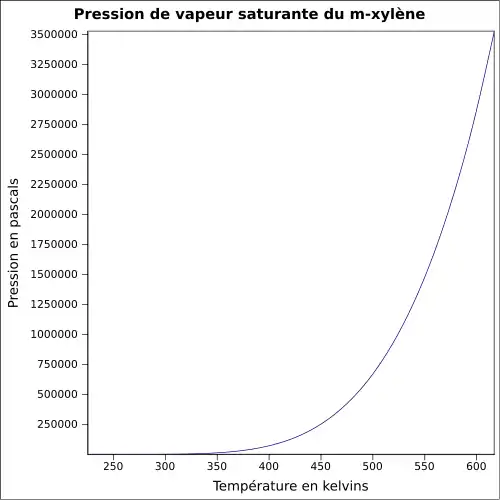
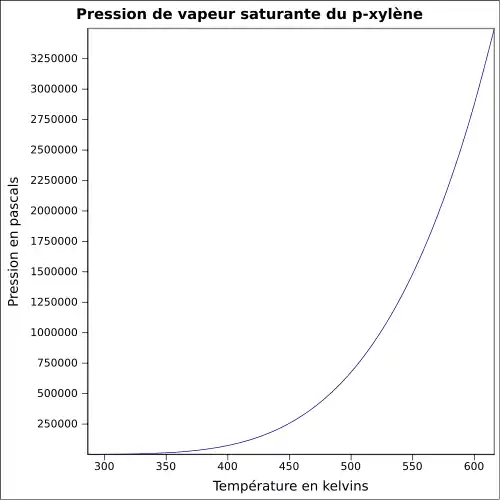
| Pression de vapeur | ~8 hPa à 20 °C |
~8 hPa à 20 °C |
~8 hPa à 20 °C | |
| Point critique | 357,18 °C [3] | 343,9 °C [3] | 343,05 °C [3] | |
| Thermochimie | ||||
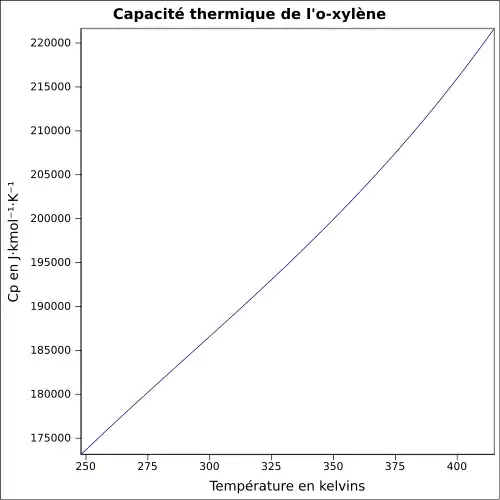
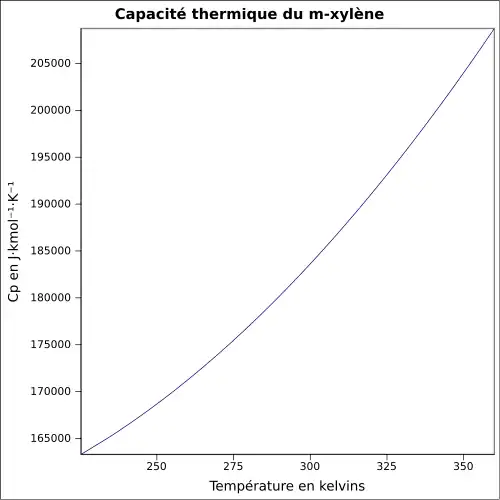
| Cp | ||||
| Sécurité | ||||
| Dangers | inflammable, toxique par ingestion et inhalation, réagit avec les acides forts et les oxydants forts | |||
| Point d'éclair | 32 °C | 27 °C | 27 °C | |
| Phrases R et S | R: 10 - 20/21 - 38 | |||
| NFPA 704 | ||||
| SIMDUT (mélange d'isomères)[5] |   B2, D2A, D2B, | |||
| SIMDUT[6] - [7] - [8] |   B2, D2B, |
  B2, D2B, |
  B2, D2A, D2B, | |
| SGH[9] |   Attention | |||
| DJA | 1,5 mg/kg p.c./jour[10] | |||
| Composés dérivés | ||||
| Hydrocarbures aromatiques | toluène, mésitylène, benzène, éthylbenzène | |||
| Autres | xylénols - analogues du phénol | |||
| Sauf mentions contraires, les valeurs sont données pour les composés à l'état standard (à 25 °C, 100 kPa) | ||||
Utilisation
Le xylène est utilisé comme solvant, notamment en tant que céruménolytique. Il est aussi utilisé par les industries de l'impression, du caoutchouc et du cuir. Il est employé comme réactif de départ pour la production d'acide téréphtalique, utilisé comme monomère pour la production de polymères de type téréphtalate. Le xylène est également utilisé pour le nettoyage, comme pesticide, utilisé aussi en parasitologie dans la méthode de KOHN pour vérifier la bonne déshydratation de frottis de selle, comme diluant pour la peinture ainsi que dans les vernis et les encres. Il est présent en faibles quantités dans les carburants pour l'aviation ainsi que dans l'essence (voir l'article « Pouvoir calorifique »). En présence de réactifs oxydants, comme le permanganate de potassium KMnO4, le groupement méthyle peut être oxydé jusqu'à former un acide carboxylique. Lorsque les deux groupements méthyle sont oxydés, le o-xylène forme l'acide phtalique et le p-xylène l'acide téréphtalique.
Production et synthèse
Le xylène est produit à partir du pétrole dans l'industrie pétrochimique. En termes de volume, c'est l'un des trente composés chimiques les plus produits aux États-Unis (environ 450 000 tonnes par an).
Séparation des isomères
Les températures d'ébullition des trois isomères étant très proches, il n'est pas possible de les séparer par distillation.
L'oxydation du xylène par de l'acide nitrique dilué porté à ébullition n'affecte que les isomères ortho et para. Un traitement à l'hydroxyde de sodium permet de séparer les acides phtalique et téréphtalique ainsi obtenus et d'obtenir l'isomère méta pur.
L'isomère para peut être obtenu en distillant le xylène à la vapeur d'eau. La première fraction du distillat est refroidie, laissant l'isomère para cristalliser.
Une agitation du xylène en présence d'acide sulfurique concentré transforme les isomères ortho et méta en leurs acides sulfoniques. Les acides sulfoniques sont ensuite transformés en leurs sels de sodium et séparés par cristallisation. Une distillation de ces sels en présence de chlorure d'ammonium regénère les hydrocarbures[11].
Le o-xylène peut être séparé des deux autres isomères par rectification.
Néanmoins il est envisageable de procéder par distillation azéotropique via un mélange de 3-méthylbutan-1-ol, de propanoate de méthyle et de pentan-3-one[12].
Rejets dans l'environnement
Le xylène est notamment produit par les incendies de forêt (en partie anthropiques), mais il fait aussi partie des produits chimiques abondamment rejetés par l'industrie dans l'environnement.
À titre d'exemple les statistiques officielles du Canada sur les rejets de contaminants atmosphériques indiquaient un rejet annuel de 6 670,1 tonnes par an déclarées pour le xylène (mélange d'isomères) pour l'industrie canadienne.
Effets sur la santé
Le xylène a un effet nocif sur la santé et notamment sur le cerveau. Ils varient selon le type et la durée d'exposition (aiguë ou chronique).
- Des niveaux d'exposition élevés pour des périodes même courtes peuvent entraîner des maux de tête, un défaut de coordination des muscles, des vertiges, la confusion mentale et des pertes du sens de l'équilibre.
- Des expositions à des taux élevés durant de courtes périodes peuvent occasionner une irritation de la peau, des yeux, du nez et de la gorge, des difficultés respiratoires, des problèmes pulmonaires, une augmentation des temps de réaction, une perte de mémoire, des irritations d'estomac et des altérations du fonctionnement du foie et des reins.
- Des taux d'exposition très élevés, notamment dans le cadre professionnel, peuvent entraîner la perte de conscience voire la mort.
Les études sur des animaux montrent que des concentrations de xylène élevées entraînent une augmentation du nombre d'animaux mort-nés, ainsi que des retards de croissance et de développement. Dans beaucoup de cas, ces mêmes concentrations ont également des effets négatifs sur la santé des mères. L'effet d'expositions de la mère à de faibles concentrations de xylène sur le fœtus n'est pas connu à l'heure actuelle.
Le xylène est toutefois utilisé en médecine. Il entre dans la composition de gouttes auriculaires utilisées pour ramollir les bouchons de cérumen et faciliter leur expulsion par action mécanique (jet d'eau)[13].
Dégradation du xylène
Le xylène se dégrade plus ou moins lentement sous l'effet des UV solaires et de diverses interactions avec l'environnement, encore mal comprises. On soupçonne qu'il puisse être biodégradé par certains microbes. On a montré que certaines levures telles que Saccharomyces cerevisiae et Kluyveromyces marxianus supportent une concentration élevée (jusqu'à 25 % (v/v) de xylène dans le milieu de culture), à condition que le milieu contienne aussi une autre source de carbone métabolisable par ces levures (du lactosérum ou du glucose par exemple), mais une thèse soutenue en 2003 « n'a pas permis de démontrer la capacité des levures à dégrader le xylène »[14].
Références
- (de) Bewertung von Toluol- und Xylol-Immissionen. Erich Schmidt Verlag, Berlin (2000), (ISBN 3503040714)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part II. Aromatic and Cyclic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 33, no 2, , p. 541 (DOI 10.1063/1.1647147)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 3, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-859-4)
- « Xylène (mélange d'isomères) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Xylène (ortho-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Xylène (meta-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Xylène (para-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- (en) Irving Wetherbee Fay, The chemistry of the coal-tar dyes, Londres, D. Van Nostrand company, , 467 p., p. 19
- (en) « Separation of o-xylene from p-xylene and m-xylene by azeotropic distillation », sur freepatentsonline.com, (consulté le ).
- « Cerulyse 5% solution auriculaire », sur vidal.fr, (consulté le )
- Labrecque, M. H. (2003) Étude de la capacité de deux souches de levures utilisées dans certaines applications alimentaires à dégrader le xylène (Doctoral dissertation, Université Laval), PDF, 86 pages