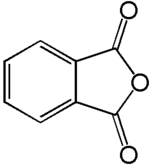
Anhydride phtalique
L'anhydride phtalique est une molécule de formule C8H4O3. C'est l'anhydride de l'acide phtalique. C'est un composé de grande importance en chimie, notamment pour la fabrication de résines synthétiques, de plastiques, de colorants et de pigments.
| Anhydride phtalique | ||
| ||
 | ||
| Représentations de l'anhydride phtalique | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-benzofuran-1,3-dione | |
| Synonymes |
1,3-isobenzofuranedione |
|
| No CAS | ||
| No ECHA | 100.001.461 | |
| No CE | 201-607-5 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux blancs, brillants, d'odeur caractéristique[1]. | |
| Propriétés chimiques | ||
| Formule | C8H4O3 [Isomères] |
|
| Masse molaire[2] | 148,115 6 ± 0,007 6 g/mol C 64,87 %, H 2,72 %, O 32,41 %, |
|
| Propriétés physiques | ||
| T° fusion | 131 °C[1] | |
| T° ébullition | 284 °C (sublime)[1] | |
| Solubilité | 0,62 g/100g,eau (réagit lentement avec l'eau) |
|
| Masse volumique | 1,53 g·cm-3[1] | |
| T° d'auto-inflammation | 570 °C[1] | |
| Point d’éclair | 152 °C (coupelle fermée)[1] | |
| Limites d’explosivité dans l’air | 1,7–10,4 %vol[1] | |
| Pression de vapeur saturante | 0,1 kPa à (20 °C)[3] 2,4 kPa à (150 °C) |
|
| Thermochimie | ||
| S0solide | 180,0 J K−1 mol−1 [4] | |
| ΔfH0solide | −460,37 kJ mol−1 [4] | |
| ΔvapH° | 52,1 kJ mol−1 [4] | |
| Cp | ||
| Précautions | ||
| SGH[6] | ||
   Danger |
||
| SIMDUT[7] | ||
 D2A, D2B, |
||
| NFPA 704 | ||
| Écotoxicologie | ||
| LogP | 1,6[1] | |
| Seuil de l’odorat | bas : 0,05 ppm[8] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Synthèse
Jusque dans les années 1960, l'anhydride phtalique était presque exclusivement produit par oxydation catalytique du naphtalène, extrait du goudron de houille (coal tar).
- C10H8 + 4.5 O2 → C6H4(CO)2O + 2 H2O + 2 CO2
Il fut à partir des années 1960, et de façon croissante (85 % de la production dans les années 1980, la quasi-totalité de nos jours) synthétisé à partir de l'ortho-xylène, produit par reformage ou par craquage du pétrole.
- C6H4(CH3)2 + 3 O2 → C6H4(CO)2O + 3 H2O
Dans les deux cas, on utilise un réacteur catalytique, le catalyseur est l'oxyde de vanadium(V). On injecte un mélange gazeux contenant l'hydrocarbure initial et une grande quantité d'air préchauffé autour de 150°C. La réaction étant exothermique (ΔrH°=-1797 kJ/mol pour le naphtalène et ΔrH°=-1116 kJ/mol pour l'ortho-xylène), il faut évacuer la chaleur produite pour que la température dans le réacteur ne dépasse pas 450°C[9].
En sortie de réacteur, les gaz contenant l’anhydride phtalique gazeux sont refroidis à 75°C par un échangeur thermique à ailettes. L'anhydride se solidifie sur des tubes à ailettes. À intervalles réguliers, on augmente la température de chaque tube à 180°C, l'anhydride fond et est récupéré.
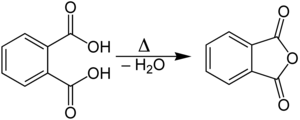
En laboratoire, l'anhydride phtalique est obtenu par chauffage et déshydratation de l'acide phtalique :
Utilisations
La principale utilisation de l'acide phtalique est la synthèse d'esters, couramment appelés phtalates.
Sécurité
En cas de contact, il est irritant pour la peau et les yeux. L'inhalation peut conduire à une irritation de type bronchique. L'ingestion répétée induit des atteintes hépatiques et surrénaliennes [10].
Références
- ANHYDRIDE PHTALIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Anhydride phtalique - Fiche toxicologique n° 38 », sur www.inrs.fr (consulté le )
- (en) « Phthalic anhydride », sur https://webbook.nist.gov (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-859-2)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Anhydride phtalique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Phthalic anhydride », sur hazmap.nlm.nih.gov (consulté le )
- N. Lepeu, « Anhydride phtalique - Procédé « moyenne température » », Techniques de l'Ingénieur, , article no J6155V1
- « Anhydride phtalique - Fiche toxicologique n° 38 », sur www.inrs.fr (consulté le )