Chimie bioinorganique
La chimie bioinorganique (ou biochimie inorganique ou biochimie minérale) est une spécialité scientifique à l'interface chimie-biologie, se situant plus précisément entre la biochimie et la chimie minérale (chimie des éléments métalliques).
Elle s'intéresse aux espèces chimiques contenant des atomes métalliques dans les systèmes biologiques. La chimie bioinorganique s'intéresse également à la synthèse de complexes artificiels pour comprendre le fonctionnement des systèmes biologiques, voire pour en reproduire l'activité (on parle dans ce cas de chimie biomimétique).
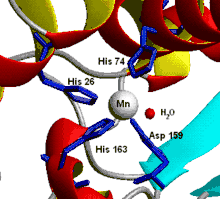
Exemples historiques
Paul Ehrlich a utilisé des composés de l'arsenic pour le traitement de la syphilis, démontrant la pertinence d'utiliser des éléments métalliques (en l'occurrence, l'arsenic est un métalloïde) en médecine. Cette stratégie porta ses fruits avec la découverte de l'activité anti-cancéreuse du cisplatine (cis-PtCl2(NH3)2).
La première protéine à avoir été cristallisée a été l'uréase. Il a été montré par la suite que cette protéine contenait du nickel au site actif. Dorothy Crowfoot Hodgkin a montré cristallographiquement que la vitamine B12 contenait un complexe macrocyclique de cobalt.
La découverte de la structure de l'ADN par Watson et Crick a montré le rôle structurant des unités phosphates sous forme polymérique.
Les métaux en biologie
La chimie bioinorganique s'intéresse à divers systèmes distincts. Ces domaines incluent le transport et le stockage des ions métalliques, les métalloenzymes[1]: métalloenzymes hydrolytiques, les métalloprotéines à transfert d'électrons, les métalloprotéines servant au transport et à l'activation du dioxygène ainsi que des systèmes bioorganométalliques (avec une liaison métal-carbone). La chimie bioinorganique s'intéresse aussi à l'étude de la dynamique des cations métalliques dans les systèmes biologiques et à la conception de médicaments à base d'éléments métalliques.
Transport et stockage des ions métalliques
Le transport et stockage des ions métalliques s'interesse aux canaux ioniques, pompes ioniques (par exemple la NaKATPase) et aux autres protéines ou petites molécules (tels que les sidérophores) dont le but est de contrôler la concentration de cations métalliques dans les cellules.
Diverses maladies, comme la maladie de Wilson sont dus à un dysfonctionnement de l'homéostasie des cations métalliques. Dans le cas de la maladie de Wilson, il s'agit du Cu(II).
Transfert d'électrons
Les métalloprotéines à transfert d'électrons peuvent se ranger en trois catégories principales :
- les protéines contenant des clusters fer-soufre telles que les rubrédoxines, les ferrédoxines, les protéines de Rieske, et l'aconitase (EC ) ;
- les protéines à cuivre bleu ;
- les cytochromes.
Ces protéines se lient à des transporteurs d'électrons non métalliques tels que le nicotinamide adénine dinucléotide (NAD) et le flavine adénine dinucléotide (FAD).
Métalloenzymes hydrolytiques
Les métalloenzymes hydrolytiques incluent des protéines qui catalysent les réactions d'hydrolyse. Dans le cycle catalytique de ces enzymes l'eau joue le rôle de ligand pour le cation métallique dans certains intermédiaires. Des exemples de cette classe de protéines sont l'anhydrase carbonique, les métallophosphatases et les métalloprotéinases (telles que la carboxypeptidase).
Dioxygène
Les métalloprotéines de transport et d'activation du dioxygène utilisent des éléments métalliques tels que le fer, le cuivre ou le manganèse. L'hème est utilisé par les globules rouges au sein de l'hémoglobine. D'autres métalloprotéines servant au transport de l'oxygène sont la myoglobine, l'hémocyanine, et l'hémérythrine. Les oxydases et les oxygénases sont trouvés dans la majorité des organismes vivants pour utiliser le dioxygène pour réaliser des fonctions importantes telles que le dégagement d'énergie dans avec la cytochrome c oxydase ou l'oxydation de petites molécules avec le système cytochrome P450 oxydase/cytochrome P450 ou la méthane monooxygénase. D'autres métalloprotéines sont destinées à protéger les organismes vivants contre le stress oxydant. Ces systèmes incluent les peroxydases, catalases et superoxyde dismutases. Dans le cadre de la photosynthèse un site actif composé de 4 ions de manganèse sert à l'oxydation de l'eau.
Cycle de l'azote
Le métabolisme de l'azote utilise des éléments métalliques. La nitrogénase (enzyme à molybdène et fer) est associée au métabolisme de l'azote. Plus récemment l'importance cardiovasculaire et neuronale du monoxyde d'azote (NO) a été découverte. NO est produit par la NO synthase, une protéine contenant un groupement hème.
Dihydrogène
Le dihydrogène est un vecteur énergétique très important dans le monde bactérien. Il est produit principalement comme sous-produit de la réduction de l'azote par la nitrogénase ou par fermentation. Mais le dihydrogène ne s'accumule pas dans la nature (contrairement au dioxygène), parce qu'il est immédiatement réoxydé, soit dans la bactérie où il a été produit, soit dans une bactérie vivant dans le même environnement. Dans les bactéries anaérobies sulfato-réductrices, les électrons sont transférés vers le sulfate ; dans les bactéries « knallgas », c’est le dioxygène qui accepte les électrons. Cette réaction rédox est liée au métabolisme bioénergétique: la synthèse d'ATP par respiration.
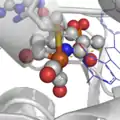 Le site actif des hydrogénases à Fer.
Le site actif des hydrogénases à Fer.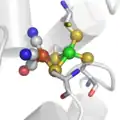 Le site actif des hydrogénases "FerFer".
Le site actif des hydrogénases "FerFer".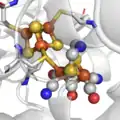 Le site actif des hydrogénases "NiFer".
Le site actif des hydrogénases "NiFer".
D'un point de vue moléculaire, trois types de métalloenzymes, appelées hydrogénases, métabolisent le dihydrogène, grâce à des sites actifs inorganiques qui ne contiennent comme éléments métalliques que du fer et dans certains cas du nickel. Beaucoup d'autres éléments de transition peuvent activer l'hydrogène dans les catalyseurs synthétiques, mais le fer et le nickel sont particulièrement abondants dans la Nature.
La trois structures de sites actifs définissent les trois familles d'hydrogénases. Les hydrogénases "à Fer" (qui ont longtemps état appelées "hydrogénases sans fer") catalysent l'hydrogénation de la méthenyltétrahydrométhanoptérine (méthényl-H4MPT+) pour former du méthylène-H4MPT, une réaction impliquée dans la méthanogenèse bactérienne. Les hydrogénases de type "FeFe" et "NiFe" catalysent l'oxydation et/ou la production du dihydrogène: 2H+ + 2e− = H2. L'hydrogénase "à Fer" conserve son activité quand l'ion fer est remplacé par du manganèse[2].
Les hydrogénases ont des masses moléculaires comprises entre 50 kDa et 600 kDa, et sont constituées de une à dix-huit protéines (celles ci sont alors assemblées dans un complexe multi-fonctionnel qui incorpore de nombreux cofacteurs en plus du site actif).
Systèmes bioorganométalliques
Les systèmes bioorganométalliques tels que les hydrogénases et la méthyl-cobalamine sont des exemples biologiques de chimie organométallique.
Par ailleurs, certains composés organométalliques comme le titanocene Y (en) sont considérés en tant que médicaments.
Applications en médecine
La chimie bioinorganique aide à mieux comprendre comment les espèces métalliques interagissent avec les organes et l'organisme.
Certaines de ces espèces sont toxiques, et grâce au synchrotron et à la métallomique, on a récemment montré que leurs interactions avec la circulation sanguine ont une grande importance, car elle déterminent notamment quelle espèce métallique de métaux et métalloïdes atteindra quel organe cible, et car ces métaux/métalloïdes diminuent la disponibilité des organes-cibles en oligo-éléments essentiels. Selon Sophia Sarpong-Kumankomah et al. (2018), les processus bioinorganiques à l'œuvre dans le système sanguin jouent un rôle fondamental dans l'étiologie de nombreuses maladies humaines encore incomprises, car ils déterminent « de manière critique » quelles espèces métalliques entreront ou non dans les organes cibles toxicologiquement vulnérables[3].
Les empoisonnements chroniques par les éléments traces métalliques sont connus, et ils montrent que des doses extrêmement faibles d'espèces métalliques et métalloïdes toxiques peuvent à la longue gravement affecter la santé[3]. Les réactions biomoléculaires à l'œuvre dans le sang et impliquant ces espèces interférent négativement avec les oligo-éléments, le plasma et les érythrocytes dans la circulation sanguine. C'est le cas par exemple avec les arsénites qui, chez les mammifères, interfèrent avec la distribution corporelle entière des sélénites ; de même avec la mercuration de l'hémoglobine dans le cytosol des érythrocytes[3].
Cette hypothèse invite à aussi développer le technique de détoxification du sang vis-à-vis des métaux toxiques[3].
Médicaments
Le cisplatine, judicieusement dosé, est utilisé contre de nombreux types de cancer (chimiothérapie).
Imagerie
Les agents de contraste à base de Gd(III) pour l'IRM
Systèmes artificiels
Les techniques d'étude des métaux en biologie
Spectroscopies
Cinétique chimique et électrochimie
- Electrochimie
- Titrages rédox
Voir aussi
Liens externes
Bibliographie
- (en) Ivano Bertini, Harry B. Gray, Edward I. Stiefel, Joan Selverstone Valentine, Biological Inorganic Chemistry, University Science Books, 2007, (ISBN 1-891389-43-2)
- (en) Rosette M. Roat-Malone, Bioinorganic Chemistry : A Short Course, Wiley-Interscience, 2002, (ISBN 0-471-15976-X)
- Stephen J. Lippard, Jeremy M. Berg, Principes de biochimie minérale, De Boeck-Wesmael, 1997, (ISBN 2-8041-2517-3)
- (en) Wolfgang Kaim, Brigitte Schwederski, Bioinorganic Chemistry: Inorganic Elements in the Chemistry of Life, John Wiley & Sons, 1994, (ISBN 0-471-94369-X)
- (en) Lawrence Que, Jr., ed., Physical Methods in Bioinorganic Chemistry, University Science Books, 2000, (ISBN 1-891389-02-5)
- (en) J.J.R. Fraústo da Silva and R.J.P. Williams, The biological chemistry of the elements: The inorganic chemistry of life, 2e éd., Oxford University Press, 2001, (ISBN 0-19-850848-4)
Références
- (en) Jing Liu, Saumen Chakraborty, Parisa Hosseinzadeh et Yang Yu, « Metalloproteins Containing Cytochrome, Iron–Sulfur, or Copper Redox Centers », Chemical Reviews, vol. 114, no 8, , p. 4366–4469 (ISSN 0009-2665 et 1520-6890, PMID 24758379, PMCID PMC4002152, DOI 10.1021/cr400479b, lire en ligne, consulté le )
- Hui-Jie Pan, Gangfeng Huang, Matthew D. Wodrich et Farzaneh Fadaei Tirani, « A catalytically active [Mn]-hydrogenase incorporating a non-native metal cofactor », Nature Chemistry, vol. 11, no 7, , p. 669–675 (ISSN 1755-4349, PMID 31110253, PMCID 6591119, DOI 10.1038/s41557-019-0266-1, lire en ligne, consulté le )
- (en) Sophia Sarpong-Kumankomah, Matthew A. Gibson et Jürgen Gailer, « Organ damage by toxic metals is critically determined by the bloodstream », Coordination Chemistry Reviews, vol. 374, , p. 376–386 (DOI 10.1016/j.ccr.2018.07.007, lire en ligne, consulté le ).
- (en) Keith S. Wilson, « An Introduction to X-Ray Crystallography », dans eLS, American Cancer Society, (ISBN 978-0-470-01590-2, DOI 10.1002/9780470015902.a0025432, lire en ligne), p. 1–16
- Ivano Bertini, Paola Turano et Alejandro J. Vila, « Nuclear magnetic resonance of paramagnetic metalloproteins », Chemical Reviews, vol. 93, no 8, , p. 2833–2932 (ISSN 0009-2665, DOI 10.1021/cr00024a009, lire en ligne, consulté le )
- (en) Ivano Bertini, Claudio Luchinat, Giacomo Parigi et Roberta Pierattelli, « NMR Spectroscopy of Paramagnetic Metalloproteins », ChemBioChem, vol. 6, no 9, , p. 1536–1549 (ISSN 1439-7633, DOI 10.1002/cbic.200500124, lire en ligne, consulté le )
- (en) Patrick Bertrand, Electron Paramagnetic Resonance Spectroscopy: Fundamentals, Springer International Publishing, (ISBN 978-3-030-39662-6, lire en ligne)
- (en) Patrick Bertrand, Electron Paramagnetic Resonance Spectroscopy: Applications, Springer International Publishing, (ISBN 978-3-030-39667-1, lire en ligne)
- Wilfred R Hagen, « Metallomic EPR spectroscopy », Metallomics, vol. 1, no 5, , p. 384–391 (ISSN 1756-5901, DOI 10.1039/b907919j, lire en ligne, consulté le )
- (en) Wilfred R. Hagen, « EPR spectroscopy as a probe of metal centres in biological systems », Dalton Transactions, no 37, , p. 4415–4434 (ISSN 1477-9234, DOI 10.1039/B608163K, lire en ligne, consulté le )
- (en) Maxie M. Roessler et Enrico Salvadori, « Principles and applications of EPR spectroscopy in the chemical sciences », Chemical Society Reviews, vol. 47, no 8, , p. 2534–2553 (ISSN 1460-4744, DOI 10.1039/C6CS00565A, lire en ligne, consulté le )
- (en) « Mössbauer spectroscopy of Fe/S proteins », Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, vol. 1853, no 6, , p. 1395–1405 (ISSN 0167-4889, DOI 10.1016/j.bbamcr.2014.12.005, lire en ligne, consulté le )
- (en) Frank Neese, « A critical evaluation of DFT, including time-dependent DFT, applied to bioinorganic chemistry », JBIC Journal of Biological Inorganic Chemistry, vol. 11, no 6, , p. 702–711 (ISSN 1432-1327, DOI 10.1007/s00775-006-0138-1, lire en ligne, consulté le )
- (en) Frank Neese, « Prediction of molecular properties and molecular spectroscopy with density functional theory: From fundamental theory to exchange-coupling », Coordination Chemistry Reviews, theory and Computing in Contemporary Coordination Chemistry, vol. 253, no 5, , p. 526–563 (ISSN 0010-8545, DOI 10.1016/j.ccr.2008.05.014, lire en ligne, consulté le )
- (en) Frank Neese, William Ames, Gemma Christian et Mario Kampa, « Dealing with Complexity in Open-Shell Transition Metal Chemistry from a Theoretical Perspective: Reaction Pathways, Bonding, Spectroscopy, And Magnetic Properties », dans Advances in Inorganic Chemistry, vol. 62, Academic Press, coll. « Theoretical and Computational Inorganic Chemistry », (lire en ligne), p. 301–349
- (en) Frank Neese, « High-Level Spectroscopy, Quantum Chemistry, and Catalysis: Not just a Passing Fad », Angewandte Chemie International Edition, vol. 56, no 37, , p. 11003–11010 (ISSN 1521-3773, DOI 10.1002/anie.201701163, lire en ligne, consulté le )