Adénosine triphosphate
L’adénosine triphosphate, ou ATP, est un nucléotide formé à partir d'un nucléoside associé à un triphosphate. Dans la biochimie de tous les êtres vivants connus[2], l'ATP fournit l'énergie nécessaire aux réactions chimiques du métabolisme, à la locomotion, à la division cellulaire, ou encore au transport actif d'espèces chimiques à travers les membranes biologiques. Afin de libérer cette énergie, la molécule d'ATP est clivée, par hydrolyse, en adénosine diphosphate (ADP) et en phosphate, réaction qui s'accompagne d'une variation d'enthalpie libre standard ΔrG°' de −30,5 kJ mol−1[3]. Les cellules régénèrent ensuite l'ATP à partir de l'ADP essentiellement de trois manières différentes : par phosphorylation oxydative dans le cadre de la respiration cellulaire, par photophosphorylation dans le cadre de la photosynthèse, et par phosphorylation au niveau du substrat au cours de certaines réactions chimiques exergoniques, par exemple au cours de la glycolyse ou du cycle de Krebs. Ainsi, le corps humain ne contient à chaque instant qu'environ 250 g d'ATP[4] - [5] mais consomme et régénère chaque jour de l'ordre de son propre poids en ATP[6]. Les ATP synthases sont responsables[2] de la manipulation de l'ATP.
| Adénosine triphosphate | |
 Structure de l'adénosine triphosphate 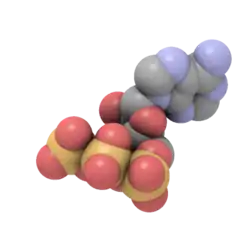 .svg.png.webp) ATP4−, espèce dominante en solution aqueuse |
|
| Identification | |
|---|---|
| Nom UICPA | adénosine-5’-(triphosphate tétrahydrogène) |
| Synonymes |
Adénosine-5’-triphosphate |
| No CAS | |
| No ECHA | 100.000.258 |
| No CE | 200-283-2 |
| DrugBank | DB00171 |
| PubChem | 5957 |
| ChEBI | 15422 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C10H16N5O13P3 [Isomères] |
| Masse molaire[1] | 507,181 ± 0,014 g/mol C 23,68 %, H 3,18 %, N 13,81 %, O 41,01 %, P 18,32 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
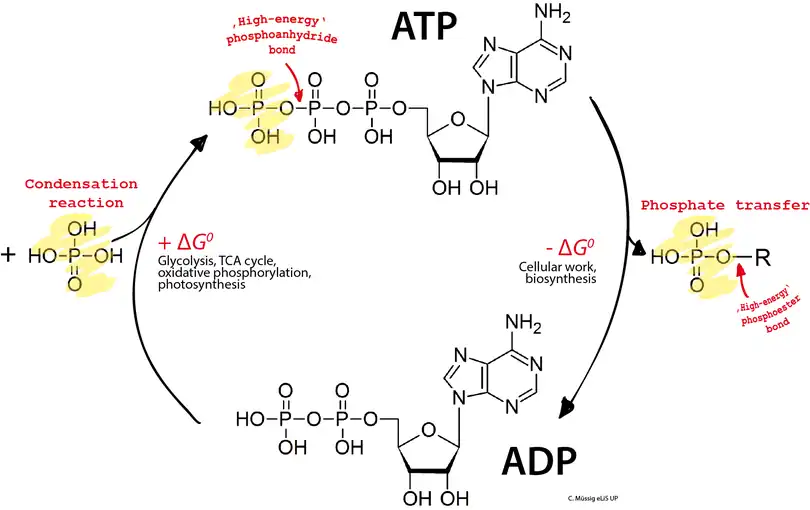
La molécule d'ATP consiste en un groupe triphosphate lié à l'atome de carbone 5’ d'un résidu de ribose, un pentose, dont l'atome de carbone 1’ est lié à l'atome d'azote 9’ d'un résidu d'adénine, une base purique. Les deux liaisons phosphoanhydride P–O–P du groupe triphosphate sont des liaisons à haut potentiel de transfert, c'est-à-dire que leur clivage par hydrolyse libère une importante quantité d'énergie : il s'agit d'une réaction exergonique. Le couplage d'une telle réaction exergonique avec une réaction endergonique, c'est-à-dire qui absorbe de l'énergie, est susceptible de rendre cette dernière thermodynamiquement possible. De cette façon, les réactions du métabolisme qui nécessitent un apport d'énergie, telles que les réactions de biosynthèse, qui ne se produisent spontanément que très lentement ou pas du tout, peuvent se dérouler bien plus rapidement dans les cellules.
L'ATP est le précurseur d'un certain nombre de cofacteurs enzymatiques importants, comme le NAD+ ou la coenzyme A. C'est également une coenzyme de transfert de groupes phosphate associée de manière non covalente aux enzymes de la famille des kinases. Ces dernières interviennent dans la transduction de certaines voies de signalisation cellulaire, par phosphorylation de protéines et d'enzymes cibles, dont l'activité se trouve ainsi régulée, ou par phosphorylation de lipides. L'ATP est également le substrat de l'adénylate cyclase, qui le convertit en AMP cyclique. Celui-ci est un messager secondaire intracellulaire, prenant la suite notamment d'hormones telles que le glucagon et l'adrénaline pour agir sur le métabolisme du glycogène, des glucides et des lipides en général[7]. Le rapport entre la concentration d'ATP et la concentration d'AMP est utilisé par les cellules pour déterminer leur charge énergétique, c'est-à-dire la quantité d'énergie dont elles disposent, ce qui leur permet, selon les cas, d'orienter leur métabolisme vers la production ou vers le stockage de l'énergie métabolique[8]. Par ailleurs, l'ATP est utilisé par les ARN polymérases dans le processus de transcription de l'ADN en ARN ribosomique et en ARN messager.
L'ATP a été découvert en 1929 par le biochimiste allemand Karl Lohmann[9] et, parallèlement, par les biochimistes américain Cyrus Fiske et indien Yellapragada Subbarao (en)[10]. C'est l'Allemand Fritz Albert Lipmann qui a suggéré qu'il joue le rôle d'intermédiaire entre réactions qui libèrent de l'énergie et réactions qui en absorbent. L'ATP a été synthétisé en laboratoire pour la première fois en 1948 par Alexander Robert Todd.
Propriétés
Physique et chimie
L'ATP est composé d'adénine, de ribose et de trois groupes phosphate formant un groupe triphosphate. Ces trois groupes phosphate sont désignés, depuis le ribose en allant vers l'extérieur, par les lettres grecques α (alpha), β (bêta) et γ (gamma). L'ATP est par conséquent étroitement apparenté à l'AMP, l'un des monomères de l'ARN, et au dAMP, l'un des monomères de l'ADN. L'ATP est très soluble dans l'eau. Il demeure relativement stable en solution aqueuse pour des pH compris entre 6,8 et 7,4, mais est rapidement hydrolysé à des pH plus acides ou plus basiques. Par conséquent, l'ATP se conserve le mieux sous forme de sel anhydre.
L'ATP est en revanche instable dès qu'il n'est plus dans une solution tampon à pH neutre. Il s'hydrolyse alors en ADP et phosphate. Cela provient du fait que les liaisons hydrogène entre les molécules d'eau d'une part et l'ADP et le phosphate d'autre part sont plus fortes que les liaisons phosphoanhydride P–O–P unissant les groupes phosphate les uns aux autres dans la molécule d'ATP. Par conséquent, l'ATP tend à se dissocier presque entièrement en ADP et phosphate au bout d'un temps plus ou moins long lorsqu'il est en solution dans l'eau.

En solution aqueuse neutre, l'ATP dissous est ionisé quatre fois pour former l'anion ATP4−, avec une faible proportion d'ions ATP3−[11].
Comme l'ATP possède plusieurs groupes chargés négativement en solution neutre, il peut chélater des cations métalliques avec une forte affinité. La valeur molaire de la constante de liaison pour certains de ces cations métalliques courants vaut ainsi[12] :
Ces interactions sont suffisamment fortes pour que l'essentiel de l'ATP4− soit présent dans les cellules en complexe avec Mg2+[11] - [13].
Thermodynamique
Lorsqu'un système thermodynamique est loin de l'équilibre, il possède une enthalpie libre de réaction qui lui permet de fournir un travail, au sens thermodynamique. Les cellules vivantes maintiennent un rapport de concentrations entre l'ATP et ADP voisin de 5, ce qui est une dizaine d'ordres de grandeur supérieur au rapport de concentration qui s'établit à l'équilibre, où presque tout l'ATP est dissocié en ADP et phosphate. En raison de cet écart par rapport à l'équilibre, l'hydrolyse de l'ATP en ADP et phosphate libère une grande quantité d'énergie.
C'est l'hydrolyse des deux liaisons phosphoanhydride liant les groupes phosphate adjacents de l'ATP qui libère l'énergie de cette molécule. Pour cette raison, on qualifie souvent, par commodité mais abusivement, ces liaisons phosphoanhydride de liaisons riches en énergie[14]. Cette caractéristique est cependant trompeuse, car ces liaisons ne recèlent pas par elles-mêmes plus d'énergie que les autres, et leur rupture requiert un apport d'énergie d'activation comme pour la rupture de toute autre liaison ; ce n'est que leur environnement moléculaire qui fait que leur hydrolyse est exergonique[15], avec une variation d'enthalpie libre de réaction standard de −30,5 kJ mol−1 (négative car de l'énergie est libérée au cours de la réaction) :
Réciproquement, la réaction de phosphorylation de l'ADP en ATP est endergonique, avec une variation d'enthalpie libre standard de 30,5 kJ mol−1 (positive car l'énergie est absorbée au cours de la réaction) :
La réaction d'hydrolyse de l'ATP en AMP et pyrophosphate HP2O73− est davantage exergonique, avec une variation d'enthalpie libre standard de réaction de −45,6 kJ mol−1 :
Fonctions biologiques
Métabolisme, organisation et mobilité des cellules
L'ATP est consommé dans les cellules par les processus biochimiques et physiologiques qui requièrent de l'énergie, dits endergoniques, et continuellement régénéré par les processus qui libèrent de l'énergie, dits exergoniques. De cette façon, l'ATP permet de transférer de l'énergie entre des processus spatialement séparés. C'est la principale source d'énergie pour la grande majorité des fonctions cellulaires, telles que le métabolisme, les biosynthèses, le transport actif à travers les membranes biologiques, ou encore la motilité des cellules et la locomotion des organismes complexes (contraction musculaire).
L'ATP intervient également dans le maintien de la structure cellulaire ainsi que dans sa mobilité en facilitant l'assemblage et le désassemblage des éléments du cytosquelette. De la même manière, il fournit l'énergie de la contraction musculaire en catalysant le raccourcissement des filaments d'actine et de myosine, ce qui est un besoin essentiel des animaux, indispensable à leur locomotion et à leur respiration — tant du point de vue de la ventilation de leurs poumons que du fonctionnement de leur cœur, chargé de faire circuler leur sang oxygéné à travers tout l'organisme.
Signalisation cellulaire
L'ATP participe aux mécanismes de signalisation cellulaire en étant reconnu par les récepteurs purinergiques (en), qui sont peut-être les récepteurs les plus abondants dans les tissus des mammifères[16]. Chez l'homme, ce rôle de signalisation cellulaire est important à la fois dans le système nerveux central et dans le système nerveux périphérique. Les récepteurs purinergiques P2 sont ainsi activés par libération d'ATP par les synapses, les axones et les cellules gliales[17]. Les récepteurs P2Y (en) sont par exemple des récepteurs couplés à la protéine G qui modulent le niveau intracellulaire de calcium et, parfois, celui d'AMP cyclique.
À l'intérieur des cellules, l'ATP est utilisé par les kinases comme sources de groupes phosphate pour réaliser les phosphorylations. La phosphorylation des protéines et des lipides membranaires sont des formes courantes de transduction de signal. On observe par exemple une activation de protéines par phosphorylations en cascade avec les MAP kinases[18]. L'ATP est également le substrat de l'adénylate cyclase, qui produit l'AMP cyclique, messager secondaire déclenchant la libération du calcium de ses points de stockage intracellulaires[19]. Cette forme de transduction de signal est particulièrement importante dans le fonctionnement du cerveau, bien qu'elle intervienne également dans une multitude d'autres processus cellulaires[20].
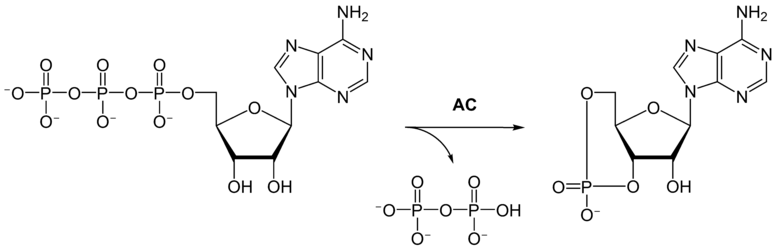 Conversion de l'ATP en AMP cyclique par l'adénylate cyclase.
Conversion de l'ATP en AMP cyclique par l'adénylate cyclase.
Réplication de l'ADN et transcription en ARN

Chez tous les êtres vivants connus, les désoxyribonucléotides constituant l'ADN sont produits par une ribonucléotide réductase (RNR) à partir des ribonucléotides correspondants[21]. Ces enzymes réduisent le résidu de ribose en désoxyribose à l'aide d'un groupe sulfhydryle –SH d'un résidu de cystéine qui forme un pont disulfure avec un autre résidu de cystéine au cours de la réaction[21]. Leur forme réduite est régénérée sous l'action de la thiorédoxine ou de la glutarédoxine.
La régulation des ribonucléotide réductases et des enzymes apparentées maintient l'équilibre dans la cellule entre désoxyribonucléotides et ribonucléotides les uns par rapport aux autres. Une concentration trop faible en désoxyribonucléotides inhibe la réparation de l'ADN ainsi que sa réplication, ce qui finit par tuer la cellule, tandis qu'un rapport anormal entre les concentrations des différents désoxyribonucléotides est mutagène en raison de l'accroissement de la probabilité d'incorporer une base nucléique erronée lors de la réplication de l'ADN par les ADN polymérases. La régulation ou les différences de spécificité des ribonucléotide réductases sont peut-être à l'origine de l'altération de cet équilibre au sein du pool de désoxyribonucléotides observée en situation de stress cellulaire telle que l'hypoxie[22].
Lors de la transcription de l'ADN en ARN ribosomique et en ARN messager, l'ATP est l'un des quatre nucléotides incorporés dans l'ARN par les ARN polymérases. L'énergie requise pour alimenter cette polymérisation provient de l'hydrolyse du groupe pyrophosphate de l'ATP[23]. Le processus est le même que celui de la biosynthèse de l'ADN hormis le fait que l'ATP est utilisé à la place de la désoxyadénosine triphosphate (dATP).
Régénération
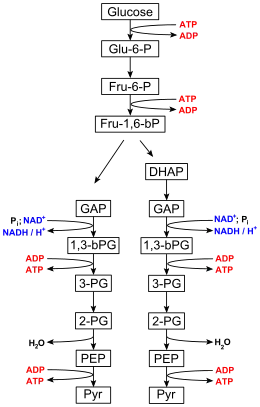
La concentration intracellulaire de l'ATP est typiquement de l'ordre de 1 à 10 mmol/L[24]. L'ATP peut être régénéré à partir d'ADP au moyen de l'énergie libérée par l'oxydation de glucides ou de lipides à travers un ensemble de processus appelé respiration cellulaire. Environ 30 molécules d'ATP peuvent être produites pour chaque molécule de glucose oxydée[25]. Les oses (sucres) sont déjà des molécules en partie oxydées, de sorte qu'un acide gras peut générer plus de molécules d'ATP par atome de carbone (16 pour le palmitate et 6 pour le glucose) et constituent l'essentiel des reserves et des fournitures en énergie pour le corps ; mais les sucres, étant solubles dans l'eau, sont plus rapidement disponibles et oxydés[26]. L'essentiel de l'ATP produit par les eucaryotes non photosynthétiques provient de la phosphorylation oxydative au sein des mitochondries. La β-oxydation et le cycle de Krebs se déroulent également dans les mitochondries, qui peuvent occuper jusqu'au quart du volume d'une cellule ; le reste de l'ATP produit par ces organismes est régénéré par phosphorylation au niveau du substrat, par exemple au cours de la glycolyse ou par fermentation dans le cytoplasme. Les plantes et les bactéries photosynthétiques, quant à elles, produisent de l'ATP essentiellement par photophosphorylation.
Glycolyse
Le glucose est converti en pyruvate par une voie métabolique appelée glycolyse. La plupart des êtres vivants réalisent cette transformation dans le cytoplasme de leurs cellules, mais certains protozoaires, tels que ceux de la classe des kinétoplastidés, la réalisent dans un organite spécialisé appelé glycosome[27]. Deux molécules d'ATP sont produites pour chaque molécule de glucose oxydée par cette voie, au niveau de deux enzymes qui réalisent une phosphorylation au niveau du substrat : la phosphoglycérate kinase et la pyruvate kinase. Deux molécules de NADH sont également produites à partir de NAD+, qui peuvent être oxydées par la chaîne respiratoire et produire des molécules d'ATP supplémentaires. Le pyruvate produit à l'issue de la glycolyse est un substrat du cycle de Krebs.
Cycle de Krebs
Dans les mitochondries, le pyruvate est oxydé par le complexe pyruvate déshydrogénase pour former de l'acétyl-CoA. Cette dernière est oxydée en CO2, NADH et FADH2 par le cycle de Krebs, avec production également de GTP, qui est énergétiquement équivalement à l'ATP.
Le NADH et le FADH2 cèdent leurs électrons à haut potentiel de transfert à la chaîne respiratoire, qui produit des molécules d'ATP supplémentaires par phosphorylation oxydative, à raison de 2 à 3 molécules d'ATP par molécule de NADH, et de 1 à 2 molécules d'ATP par FADH2[25]. L'essentiel de l'ATP des cellules non photosynthétiques est produit de cette façon. Bien que le cycle de Krebs ne requière pas directement la présence d'oxygène O2, il ne peut fonctionner sans celui-ci car c'est l'oxygène qui sert d'accepteur final d'électrons à la chaîne respiratoire, permettant la régénération du NAD+ et du FAD à partir du NADH et du FADH2 produits par le cycle de Krebs : en l'absence d'oxygène, ce dernier cesse de fonctionner faute de NAD+ et de FAD.
Phosphorylation oxydative
La circulation des électrons à travers la chaîne respiratoire permet le pompage de protons hors de la matrice mitochondriale, ce qui génère un potentiel électrochimique de membrane à travers la membrane mitochondriale interne en raison du gradient de concentration de protons qui en découle. La dissipation de ce potentiel électrochimique de membrane par les ATP synthases fournit l'énergie nécessaire à la phosphorylation de l'ADP en ATP : on parle de couplage chimiosmotique entre la chaîne respiratoire et la phosphorylation de l'ADP. L'ATP synthase est une enzyme complexe qui possède un rotor moléculaire actionné par le reflux des protons depuis l'espace intermembranaire mitochondrial et qui transmet l'énergie de ces derniers jusqu'au niveau de la phosphorylation de l'ADP[28].
Navettes mitochondriales du NAD+/NADH
La régénération de l'ATP dans les mitochondries à partir du NADH produit dans le cytosol implique de faire traverser la membrane mitochondriale interne au NADH vers la matrice mitochondriale et au NAD+ dans l'autre sens. En effet, ces molécules ne peuvent traverser cette membrane par elles-mêmes, aussi ce sont leurs électrons à haut potentiel de transfert qui la traversent. Les eucaryotes utilisent essentiellement deux moyens pour cela : la navette malate-aspartate et, dans une moindre mesure, la navette du glycérol-3-phosphate.
- La navette malate-aspartate fait tout d'abord intervenir une malate déshydrogénase, qui réduit une molécule d'oxaloacétate cytosolique en malate. Ce dernier peut franchir la membrane mitochondriale interne en empruntant un antiport malate-α-cétoglutarate, et, parvenu dans la matrice mitochondriale, le malate est oxydé à nouveau en oxaloacétate par une l'isoforme mitochondriale de la malate déshydrogénase mitochondriale (mMDH), convertissant une molécule de NAD+ en NADH. L'oxaloacétate mitochondrial est converti en aspartate sous l'action d'une aspartate aminotransférase mitochondriale (mAST) par transfert d'un groupe amine du glutamate, ce dernier donnant alors de l'α-cétoglutarate. L'aspartate emprunte un antiport glutamate-aspartate pour franchir la membrane mitochondriale interne et rejoindre le cytosol, tandis que l'α-cétoglutarate fait de même à l'aide d'un antiport malate-α-cétoglutarate. L'aspartate cytosolique est converti en oxaloacétate par une aspartate aminotransférase cytosolique (cAST), qui produit également du glutamate à partir de l'α-cétoglutarate.
- La navette du glycérol-3-phosphate est moins répandue que la précédente mais ne nécessite pas de traverser la membrane mitochondriale interne, ce qui la rend plus rapide bien qu'elle conduise à générer moins d'ATP par molécule de NADH oxydée, de sorte qu'elle est utilisée préférentiellement par les cellules qui nécessitent de mobiliser rapidement de grandes quantités d'énergie, c'est-à-dire essentiellement les muscles et le cerveau. Une glycérol-3-phosphate déshydrogénase soluble (EC ) convertit tout d'abord la dihydroxyacétone phosphate (DHAP) en glycérol-3-phosphate, ce qui régénère le NAD+ à partir du NADH. Une glycérol-3-phosphate déshydrogénase de la membrane mitochondriale interne (EC ) décharge les électrons du glycérol-3-phosphate sur une molécule de FAD pour donner du FADH2 et régénérer la DHAP ; le FADH2 réduit à son tour une ubiquinone, dont les électrons rejoignent ensuite la chaîne respiratoire au niveau de la coenzyme Q-cytochrome c réductase (complexe III).
Translocase ATP/ADP
De manière semblable à ce qu'on observe pour le NAD+, l'ATP régénéré dans les mitochondries est essentiellement consommé dans le cytoplasme et dans le noyau, où se forme de l'ADP qui doit être phosphorylé en ATP à l'intérieur des mitochondries. Ces flux de matière impliquent de faire circuler l'ADP à travers la membrane mitochondriale interne depuis le cytosol vers la matrice mitochondriale, tandis que l'ATP régénéré dans les mitochondries traverse cette membrane dans le sens inverse pour être consommé dans le cytosol et dans le noyau. La membrane mitochondriale interne étant imperméable également à l'ADP et à l'ATP, ces molécules doivent emprunter des protéines membranaires intégrales appelées translocases ATP/ADP pour la traverser.
Photophosphorylation
Chez les plantes, l'ATP est produit par photophosphorylation dans la membrane des thylakoïdes à l'intérieur des chloroplastes. Le principe est semblable à celui mis en œuvre dans le cadre de la phosphorylation oxydative[29], avec un couplage chimiosmotique de même nature, à la différence que l'énergie provient des photons captés par les pigments photosynthétiques et non de l'oxydation des glucides et des lipides. Une partie de cet ATP est consommé dans le chloroplaste pour produire des glucides à travers le cycle de Calvin.
Stockage de l'ATP
Les stocks d'ATP de l'organisme ne dépassent pas quelques secondes de consommation. En principe, l'ATP est recyclée en permanence, et tout processus qui bloque sa régénération provoque rapidement la mort de l'organisme contaminé. En effet, en situation physiologique, nous produisons chaque jour l'équivalent de notre poids en ATP, et l'ATP produit est immédiattement consommé notamment pour maintenir l'activité de la pompe Na K ATPase. On comprend aisément que la diminution voir l'absence de production d'ATP soit rapidement néfaste, au vu de l'énorme quantité produite et nécessaire. C'est par exemple le cas de certains gaz de combat conçus à cet effet, ou de poisons, comme le cyanure, qui bloque la cytochrome c oxydase de la chaîne respiratoire dans les mitochondries, ou l'arsenic, qui remplace le phosphore et rend inutilisables les molécules phosphorées.
La créatine peut jouer le rôle d'accumulateur en stockant un groupe phosphate à haut potentiel de transfert depuis une molécule d'ATP, susceptible d'être transféré ultérieurement à une molécule d'ADP pour régénérer de l'ATP :
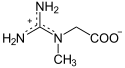 |
+ ATP ADP + | 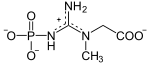 |
| Créatine | Phosphocréatine | |
| Créatine kinase – EC | ||
L'ATP en tant que tel ne peut être stocké dans les cellules, de sorte que l'énergie métabolique est stocké par exemple sous forme de lipides dans le tissu adipeux ou de glucides tels que le glycogène chez les animaux ou d'amidon chez les plantes.
Régulation
La production d'ATP dans une cellule d'eucaryote aérobie est étroitement régulée par allostérie, par rétroaction et par la concentration des substrats des différentes enzymes de la glycolyse et de la phosphorylation oxydative. Les points de contrôle se trouvent au niveau de réactions qui sont tellement favorables du point de vue thermodynamique qu'elles sont en fait irréversibles dans les conditions physiologiques.
Glycolyse
L'hexokinase est directement inhibée par le produit de la réaction qu'elle catalyse, à savoir le glucose-6-phosphate, tandis que la pyruvate kinase est inhibée par l'ATP lui-même. Le principal point de régulation de la glycolyse est la phosphofructokinase (PFK), qui est inhibée allostériquement lorsque l'ATP est abondant mais est activée lorsque c'est l'AMP qui est abondant. L'inhibition de cette enzyme par l'ATP est inhabituelle dans la mesure où l'ATP est un substrat de la réaction qu'elle catalyse. La forme biologiquement active de cette enzyme est un tétramère qui existe dans deux conformations possibles, dont l'une seulement peut se lier au fructose-6-phosphate, qui est le second substrat de cette enzyme. La protéine possède deux sites de liaison à l'ATP : le site actif est accessible dans l'une et l'autre conformation, mais la liaison de l'ATP au site inhibiteur stabilise la conformation qui ne se lie que faiblement au fructose-6-phosphate. Un certain nombre d'autres petites molécules sont susceptibles de compenser l'effet inhibiteur de l'ATP et ainsi réactiver la phosphofructokinase ; c'est par exemple le cas de l'AMP cyclique, des ions ammonium, des ions phosphate, du fructose-1,6-bisphosphate et du fructose-2,6-bisphosphate.
Cycle de Krebs
Le cycle de Krebs est essentiellement régulé par la disponibilité de ses substrats clés, notamment le rapport entre la concentration en NAD+ et NADH, ainsi que les concentrations en calcium, phosphate, ATP, ADP et AMP. Le citrate est un inhibiteur de la citrate synthase agissant par rétroaction, ainsi qu'un inhibiteur de la phosphofructokinase, ce qui lie la régulation du cycle de Krebs à celle de la glycolyse.
Phosphorylation oxydative
La régulation de la phosphorylation oxydative repose essentiellement sur la cytochrome c oxydase, qui est régulée par la disponibilité de son substrat, à savoir le cytochrome c réduit. La quantité de cytochrome c réduit disponible dépend directement de la quantité des autres substrats :
- 1⁄2 NADH + cyt coxydé + ADP + Pi 1⁄2 NAD+ + cyt créduit + ATP,
d'où l'équation ci-dessous, déduite de cet équilibre :
Ainsi, un rapport de concentrations [NADH] ⁄ [NAD+] élevé ou un rapport de concentrations [ADP][Pi] ⁄ [ATP] élevé (membre de droite de cette égalité) impliquent un rapport de concentrations [cyt créduit] ⁄ [cyt coxydé] élevé (membre de gauche), c'est-à-dire une concentration élevée en cytochrome c réduit, et une forte activité de la cytochrome c oxydase.
Un niveau de régulation supplémentaire est introduit par le taux de transport de l'ATP et du NADH entre la matrice mitochondriale et le cytosol[30].
Liaisons aux protéines

Certaines protéines qui se lient à l'ATP possèdent un repliement caractéristique appelé pli Rossmann, motif structurel général des protéines qui se lient aux nucléotides, comme celles qui se lient au NAD[31]. Les protéines qui se lient à l'ATP les plus courantes, appelées kinases, ont en commun un petit nombre de caractéristiques structurelles communes. Les protéine kinases, qui forment le plus grand groupe de kinases, partagent ainsi des particularités structurelles spécialisées dans la liaison à l'ATP et les transferts de groupes phosphate[32].
L'ATP requiert généralement la présence d'un cation divalent pour former un complexe avec des protéines. Il s'agit presque toujours d'un cation de magnésium Mg2+, qui se lie aux groupes phosphate de l'ATP. Ce cation réduit significativement la constante de dissociation du complexe ATP–protéine sans affecter la capacité de l'enzyme à catalyser sa réaction chimique une fois l'ATP lié[33]. La présence des cations de magnésium peut constituer un mécanisme de régulation des kinases[34].
Analogues de l'ATP
Il est fréquent de recourir à des expériences in vitro pour étudier les processus biochimiques faisant intervenir l'ATP, et les inhibiteurs d'enzymes utilisant l'ATP, telles que les kinases, sont des instruments utiles pour examiner la liaison et les états de transition impliqués dans les réactions qui font intervenir l'ATP. On utilise également des analogues de l'ATP en cristallographie aux rayons X afin de déterminer la structure de protéines formant un complexe avec l'ATP, souvent en association avec d'autres substrats[35]. Les analogues de l'ATP les plus utiles sont ceux qui ne s'hydrolysent pas comme le ferait l'ATP, et bloquent l'enzyme dans un état proche du complexe ATP–enzyme. L'adénosine 5′-[γ-thio]triphosphate (ATPγS), par exemple, est un analogue de l'ATP très couramment utilisé en laboratoire[36] - [37] - [38] : l'un des atomes d'oxygène du phosphate γ est remplacé par un atome de soufre, et l'ATPγS s'hydrolyse à une vitesse considérablement moindre que celle de l'ATP, de sorte qu'il agit comme inhibiteur des processus dépendant de l'hydrolyse d'une molécule d'ATP. Il existe cependant des enzymes capables de les hydrolyser à des vitesses assez élevées lorsqu'elles sont en concentration suffisante, ce qui implique de devoir interpréter avec prudence les résultats obtenus avec de tels inhibiteurs[39].
En cristallographie, les états de transition d'hydrolyse sont étudiés à l'aide de complexes d'ions vanadate.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Jasmine A. Nirody, Itay Budin et Padmini Rangamani, « ATP synthase: Evolution, energetics, and membrane interactions », Journal of General Physiology, vol. 152, no 11, , e201912475 (ISSN 0022-1295 et 1540-7748, PMID 32966553, PMCID PMC7594442, DOI 10.1085/jgp.201912475, lire en ligne, consulté le )
- (en) Variation d'enthalpie libre, sur le site de Marc Kirschner, Harvard Medical School.
- (en) « 'Nature's batteries' may have helped power early lifeforms », sur Science Daily, (consulté le )
- (en) David E. Bryant, Katie E. R. Marriott, Stuart A. Macgregor, Colin Kilner, Matthew A. Pasek et Terence P. Kee, « On the prebiotic potential of reduced oxidation state phosphorus: the H-phosphinate–pyruvate system », Chemical Communications, vol. 46, no 21, , p. 3726-3728 (PMID 20386792, DOI 10.1039/C002689A, Bibcode 2010LPICo1538.5264B, lire en ligne)
- (en) Susanna Törnroth-Horsefield et Richard Neutze, « Opening and closing the metabolite gate », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 50, , p. 19565-19566 (PMID 19073922, PMCID 2604989, DOI 10.1073/pnas.0810654106, lire en ligne)
- (en) Eunüs S. Ali, Jin Hua, Claire H. Wilson, George A. Tallis, Fiona H. Zhou, Grigori Y. Rychkov et Greg J. Barritt, « The glucagon-like peptide-1 analogue exendin-4 reverses impaired intracellular Ca2+ signalling in steatotic hepatocytes », Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, vol. 1863, no 9, , p. 2135-2146 (PMID 27178543, DOI 10.1016/j.bbamcr.2016.05.006, lire en ligne)
- (en) D. Grahame Hardie et Simon A. Hawley, « AMP-activated protein kinase: the energy charge hypothesis revisited », BioEssays, vol. 23, no 12, , p. 1112-1119 (PMID 11746230, DOI 10.1002/bies.10009, lire en ligne)
- (en) Karl Lohmann, « Über die Pyrophosphatfraktion im Muskel », Naturwissenschaften, vol. 17, no 31, , p. 624-625 (DOI 10.1007/BF01506215, lire en ligne)
- (en) Koscak Maruyama, « The Discovery of Adenosine Triphosphate and the Establishment of Its Structure », Journal of the History of Biology, vol. 24, no 1, , p. 145-154 (DOI 10.1007/BF00130477, JSTOR 4331161, lire en ligne)
- (en) A. C. Storer et A. Cornish-Bowden, « Concentration of MgATP2− and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions », Biochemical Journal, vol. 159, no 1, , p. 1-5 (PMID 11772, PMCID 1164030, DOI 10.1042/bj1590001, lire en ligne)
- (en) John E. Wilson et Arnold Chin, « Chelation of divalent cations by ATP, studied by titration calorimetry », Analytical Biochemistry, vol. 193, no 1, , p. 16-19 (PMID 1645933, DOI 10.1016/0003-2697(91)90036-S, lire en ligne)
- (en) « Magnesium in cardiac energy metabolism », Journal of Molecular and Cellular Cardiology, vol. 18, no 10, , p. 1003-1013 (PMID 3537318, DOI 10.1016/S0022-2828(86)80289-9, lire en ligne)
- (en) Britton Chance, Howard Lees et John R. Postgate, « The Meaning of “Reversed Electron Flow” and “High Energy Electron” in Biochemistry », Letters to Nature, vol. 238, no 5363, , p. 330-331 (PMID 4561837, DOI 10.1038/238330a0, lire en ligne)
- Biologie moléculaire de la cellule Par Harvey Lodish, Arnold Berk, Paul Matsudaira, James Darnell, Chris A. Kaiser, Pierre L. Masson - page 301
- (en) Maria P. Abbracchio, Geoffrey Burnstock, Alexei Verkhratsky et Herbert Zimmermann, « Purinergic signalling in the nervous system: an overview », Trends in Neurosciences, vol. 32, no 1, , p. 19-29 (PMID 19008000, DOI 10.1016/j.tins.2008.10.001, lire en ligne)
- (en) R. Douglas Fields et Geoffrey Burnstock, « Purinergic signalling in neuron–glia interactions », Nature Reviews, vol. 7, no 6, , p. 423-436 (PMID 16715052, PMCID 2062484, DOI 10.1038/nrn1928, lire en ligne)
- (en) Neeti Sanan Mishra, Renu Tuteja et Narendra Tuteja, « Signaling through MAP kinase networks in plants », Archives of Biochemistry and Biophysics, vol. 452, no 1, , p. 55-68 (PMID 16806044, DOI 10.1016/j.abb.2006.05.001, lire en ligne)
- (en) Margarita Kamenetsky, Sabine Middelhaufe, Erin M. Bank, Lonny R. Levin, Jochen Buck et Clemens Steegborn, « Molecular Details of cAMP Generation in Mammalian Cells: A Tale of Two Systems », Journal of Molecular Biology, vol. 362, no 4, , p. 623-639 (PMID 16934836, PMCID 3662476, DOI 10.1016/j.jmb.2006.07.045, lire en ligne)
- (en) Jacques Hanoune et Nicole Defer, « Regulation and role of adenylyl cyclase isoforms », Annual Review of Pharmacology and Toxicology, vol. 41, , p. 145-174 (PMID 11264454, DOI 10.1146/annurev.pharmtox.41.1.145, lire en ligne)
- (en) JoAnne Stubbe, « Ribonucleotide reductases: amazing and confusing », Journal of Biological Chemistry, vol. 265, no 10, , p. 5329-5332 (PMID 2180924, lire en ligne)
- (en) Korakod Chimploy, Mary Lynn Tassotto et Christopher K. Mathews, « Ribonucleotide Reductase, a Possible Agent in Deoxyribonucleotide Pool Asymmetries Induced by Hypoxia », Journal of Biological Chemistry, vol. 275, no 50, , p. 39267-39271 (PMID 11006282, DOI 10.1074/jbc.M006233200, lire en ligne)
- (en) Catherine M. Joyce et Thomas A. Steitz, « Polymerase structures and function: variations on a theme? », Journal of bacteriology, vol. 177, no 22, , p. 6321-6329 (PMID 7592405, PMCID 177480, lire en ligne)
- (en) I. Beis et E. A. Newsholme, « The contents of adenine nucleotides, phosphagens and some glycolytic intermediates in resting muscles from vertebrates and invertebrates », Biochemical Journal, vol. 152, no 1, , p. 23-32 (PMID 1212224, PMCID 1172435, DOI 10.1042/bj1520023, lire en ligne)
- (en) P.R. Rich, « The molecular machinery of Keilin's respiratory chain », Biochemical Society Transactions, vol. 31, no 6, , p. 1095-1105 (PMID 14641005, DOI 10.1042/bst0311095, lire en ligne)
- « La beta oxydation oxidation acide gras lipides corps cetonique cetogenese Enseignement recherche biochimie enzymologie bioinformatique Emmanuel Jaspard Universite Angers biochimej », sur univ-angers.fr (consulté le ).
- (en) Marilyn Parsons, « Glycosomes: parasites and the divergence of peroxisomal purpose », Molecular Microbiology, vol. 53, no 3, , p. 717-724 (PMID 15255886, DOI 10.1111/j.1365-2958.2004.04203.x, lire en ligne)
- (en) Jan Pieter Abrahams, Andrew G. W. Leslie, René Lutter et John E. Walker, « Structure at 2.8 Å resolution of F1-ATPase from bovine heart mitochondria », Nature, vol. 370, no 6491, , p. 621-628 (PMID 8065448, DOI 10.1038/370621a0, lire en ligne)
- (en) John F. Allen, « Photosynthesis of ATP—Electrons, Proton Pumps, Rotors, and Poise », Cell, vol. 110, no 3, , p. 273-276 (PMID 12176312, DOI 10.1016/S0092-8674(02)00870-X, lire en ligne)
- (en) C. Dahout-Gonzalez, H. Nury, V. Trézéguet, G. J.-M. Lauquin, E. Pebay-Peyroula et G. Brandolin, « Molecular, Functional, and Pathological Aspects of the Mitochondrial ADP/ATP Carrier », Physiology, vol. 21, no 4, , p. 242-249 (PMID 16868313, DOI 10.1152/physiol.00005.2006, lire en ligne)
- (en) S. T. Rao et Michael G. Rossmann, « Comparison of super-secondary structures in proteins », Journal of Molecular Biology, vol. 76, no 2, , p. 241, IN1, 251-250-256 (PMID 4737475, DOI 10.1016/0022-2836(73)90388-4, lire en ligne)
- (en) Eric D. Scheeff et Philip E. Bourne, « Structural Evolution of the Protein Kinase–Like Superfamily », PLoS Computational Biology, vol. 1, no 5, , e49 (PMID 16244704, PMCID 1261164, DOI 10.1371/journal.pcbi.0010049, lire en ligne)
- (en) Phillip Saylor, Chengqian Wang, T. John Hirai et Joseph A. Adams, « A Second Magnesium Ion Is Critical for ATP Binding in the Kinase Domain of the Oncoprotein v-Fps », Biochemistry, vol. 37, no 36, , p. 12624-12630 (PMID 9730835, DOI 10.1021/bi9812672, lire en ligne)
- (en) Xiaofeng Lin, Marina K Ayrapetov et Gongqin Sun, « Characterization of the interactions between the active site of a protein tyrosine kinase and a divalent metal activator », BMC Biochemistry, vol. 6, , p. 25 (PMID 16305747, PMCID 1316873, DOI 10.1186/1471-2091-6-25, lire en ligne)
- (en) Clive R. Bagshaw, « ATP analogues at a glance », Journal of Cell Science, vol. 114, no Pt 3, , p. 459-460 (PMID 11171313, lire en ligne)
- (en) S. M. Honigberg, D. K. Gonda, J. Flory et C. M. Radding, « The pairing activity of stable nucleoprotein filaments made from recA protein, single-stranded DNA, and adenosine 5'-(gamma-thio)triphosphate », Journal of Biological Chemistry, vol. 260, no 21, , p. 11845-11851 (PMID 3840165, lire en ligne)
- (en) J. A. Dantzig, J. W. Walker, D. R. Trentham et Y. E. Goldman, « Relaxation of muscle fibers with adenosine 5'-[gamma-thio]triphosphate (ATP[gamma S]) and by laser photolysis of caged ATP[gamma S]: evidence for Ca2+-dependent affinity of rapidly detaching zero-force cross-bridges », Proceedings of the National Academy of Sciences of the United States of America, vol. 85, no 18, , p. 6716-6720 (PMID 3413119, PMCID 282048, DOI 10.1073/pnas.85.18.6716, JSTOR 32451, Bibcode 1988PNAS...85.6716D, lire en ligne)
- (en) T. Kraft, L. C. Yu, H. J. Kuhn et B. Brenner, « Effect of Ca2+ on weak cross-bridge interaction with actin in the presence of adenosine 5'-[gamma-thio]triphosphate) », Proceedings of the National Academy of Sciences of the United States of America, vol. 89, no 23, , p. 11362-11366 (PMID 1454820, PMCID 50550, DOI 10.1073/pnas.89.23.11362, JSTOR 2360707, Bibcode 1992PNAS...8911362K, lire en ligne)
- (en) Andrea M. Resetar et Joseph M. Chalovich, « Adenosine 5'-(.gamma.-thiotriphosphate): an ATP analog that should be used with caution in muscle contraction studies », Biochemistry, vol. 34, no 49, , p. 16039-16045 (PMID 8519760, DOI 10.1021/bi00049a018, lire en ligne)

![{\displaystyle {\frac {[\mathrm {cyt~c_{reduit}} ]}{[\mathrm {cyt~c_{oxyde}} ]}}=\left({\frac {[\mathrm {NADH} ]}{[\mathrm {NAD} ]^{+}}}\right)^{\frac {1}{2}}\left({\frac {[\mathrm {ADP} ][\mathrm {P_{i}} ]}{[\mathrm {ATP} ]}}\right)K_{\mathrm {eq} }}](https://img.franco.wiki/i/89e75ceb7b27981ba88688fe6369101117a55af0.svg)