Site actif
Le site actif désigne en catalyse la partie du catalyseur qui va interagir avec le(s) substrat(s) pour former le(s) produit(s). Cette notion concerne tous les types de catalyseurs, mais on l'associe généralement aux enzymes. Le site actif des catalyseurs fait l'objet d'études poussées dans le cadre de la recherche de nouveaux catalyseurs et de l'étude des mécanismes réactionnels en biochimie.. Or, si la structure du site actif est modifié, la catalyse ne peut avoir lieu.
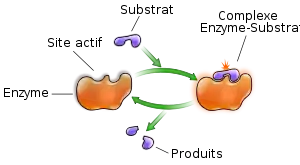
Définition
L'activité des enzymes est liée à la présence dans leur structure d'un site particulier appelé le site actif qui a la forme d'une cavité ou d'un sillon. Les molécules ou ligands sur lesquelles agit une enzyme sont définies comme les substrats de la réaction enzymatique. Elles se fixent dans le site actif de l'enzyme en formant des interactions avec la surface de la cavité du site actif. Ces interactions permettent en particulier d'orienter le(s) substrat(s) pour favoriser la réaction. Les groupements fonctionnels de certains des résidus d'acides aminés qui forment la cavité du site actif peuvent alors participer à la réaction. On parle de résidus catalytiques ou de résidus du site actif.
Le mécanisme par lequel une enzyme fixe les substrats dans son site actif peut suivre plusieurs schémas alternatifs :
- Historiquement, le premier modèle proposé est celui de Fischer, dit modèle "clé-serrure". Il est basé sur l'hypothèse d'une complémentarité de forme entre le substrat et la cavité du site actif. Le modèle "clé-serrure" est statique, la complémentarité de forme étant préexistante, il n'y a pas de déformation ni du substrat, ni de l'enzyme lors de la formation de l'interaction entre les deux[1].
- Le modèle de l'ajustement induit de Koshland. Il est basé sur l'hypothèse que la structure de l'enzyme se déforme pour s'adapter à son substrat. Une partie de l'énergie d'interaction entre l'enzyme et son substrat est utilisée pour permettre cette déformation, qui contribue à mettre l'enzyme dans une conformation active. C'est un modèle dynamique ou la structure de l'enzyme n'est pas figée[2].
- Le modèle de la sélection conformationnelle. Ce schéma postule l'existence d'un équilibre préexistant entre différentes conformations de l'enzyme. Le substrat se fixe préférentiellement à l'une de ces conformations et déplace donc l'équilibre vers la forme active de l'enzyme. C'est aussi un modèle dynamique.
La différence entre le modèle par sélection conformationnelle et l'ajustement induit est que dans le premier cas, la déformation précède l'interaction avec le ligand, tandis que dans le second, c'est la formation de l'interaction qui induit cette déformation.
Les mécanismes de reconnaissance de différentes enzymes se rapprochent plus ou moins de l'un de ces différents schémas. L'ajustement induit, par exemple, a été bien étudié dans le cas des hexokinases.
D'autres modèles tiennent compte de spécificités des enzymes, tels que l'ajustement du substrat à la forme du site actif par exemple (l'adaptation du substrat aurait pour conséquence une torsion de celui-ci, défavorable énergétiquement en l'absence de l'enzyme, mais qui faciliterait dans ce contexte la réaction chimique : modèle de Jenks) ou un ajustement imparfait permettant une vitesse de réaction modérée. Dans tous les cas, la fixation du substrat sur l'enzyme a pour conséquence la formation du complexe enzyme-substrat, ou complexe E/S, indispensable à la réaction enzymatique. Cette dernière fait intervenir les acides aminés d'un site catalytique. L'enzyme peut alors accélérer considérablement une des réactions biochimiques faisant intervenir ce substrat. À la fin de la réaction, l'enzyme est intacte et peut intervenir sur une autre molécule de substrat. Pendant la réaction, le substrat a pu être transformé en produit de la réaction.
L'enzyme est constituée de deux parties :
- Le site de reconnaissance (ou site de liaison au substrat) ; permettant de fixer le substrat grâce à certains acides aminés
- Le site catalytique (où a lieu la transformation du substrat) ; permettant de transformer le substrat grâce à des acides aminés qui interagissent avec le substrat.
Notes et références
- (en) S.M. Sullivan, « Enzymes with lid-gated active sites must operate by an induced fit mechanism instead of conformational selection », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, , p. 13829–13834 (DOI 10.1073/pnas.0805364105)
- (en) Daniel E. Koshland, « Application of a Theory of Enzyme Specificity to Protein Synthesis », Proc. Natl. Acad. Sci. U.S.A., vol. 44, , p. 98–104 (PMID 16590179, DOI 10.1073/pnas.44.2.98)