Acétyl-coenzyme A
L'acétyl-coenzyme A, usuellement écrite acétyl-CoA, est la forme « activée » de l'acide acétique, c'est-à-dire le thioester que forme ce dernier avec la coenzyme A. C'est une molécule à haut potentiel d'hydrolyse située au carrefour de plusieurs voies métaboliques importantes. L'acétyl-CoA peut ainsi résulter, sous l'action du complexe pyruvate déshydrogénase, de la décarboxylation oxydative du pyruvate, issu par exemple de la glycolyse, ou de la dégradation des acides gras par β-oxydation (hélice de Lynen) dans le cadre de la lipolyse (dégradation des lipides). Il intervient principalement comme substrat du cycle de Krebs pour être oxydé en CO2 et coenzymes réduites telles que le NADH+H+ et l'ubiquinol (CoQ10H2), ainsi que comme substrat de voies anaboliques telles que la biosynthèse des acides gras, selon une série de réactions semblables à la réciproque de la β-oxydation. Lors d'un jeûne prolongé, lorsque la néoglucogenèse a réduit la concentration en oxaloacétate disponible pour permettre à l'acétyl-CoA d'entrer dans le cycle de Krebs, l'acétyl-CoA conduit à la formation de corps cétoniques — acétylacétate (H3C–CO–CH2–COO−), β-D-hydroxybutyrate (H3C–CHOH–CH2–COO−) et acétone (H3C–CO–CH3) — qui sont utilisés comme sources d'énergie métabolique par les muscles, le cœur et le cerveau. L'acétyl-CoA intervient également dans la biosynthèse de l'acétylcholine, un neurotransmetteur, par acétylation de la choline sous l'effet de la choline acétyltransférase.
| Acétyl-coenzyme A | |
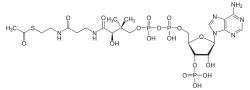  Structure de l'acétyl-coenzyme A |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.000.719 |
| No CE | 200-790-9 |
| PubChem | 444493 |
| ChEBI | 15351 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C23H38N7O17P3S [Isomères] |
| Masse molaire[1] | 809,571 ± 0,033 g/mol C 34,12 %, H 4,73 %, N 12,11 %, O 33,6 %, P 11,48 %, S 3,96 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Fonctions biochimiques
Conversion du pyruvate en acétyl-CoA
La décarboxylation oxydative du pyruvate en acétyl-CoA est catalysée par le complexe pyruvate déshydrogénase. Il existe d'autres réactions permettant de former de l'acétyl-CoA à partir du pyruvate, comme la dismutation du pyruvate en acétyl-CoA et formiate par la pyruvate formiate lyase.
Synthèse directe
L'acétyl-CoA peut être formée par acétylation directe de la coenzyme A sous l'action de l'acétyl-CoA synthase à partir de méthane CH4 et de dioxyde de carbone CO2. Cette réaction intervient par exemple dans la modulation de l'expression génétique par formation d'histone acétyltransférases permettant l'acétylation des histones[2], ainsi que dans la voie de Wood-Ljungdahl de fixation du carbone en conditions anaérobies[3] à l'aide d'une enzyme dont le site actif contient du nickel[4].
Entrée dans le cycle de Krebs
L'acétyl-CoA est produite à la fois par la dégradation des glucides via la glycolyse et par la dégradation des acides gras constituant les lipides via la β-oxydation. Elle entre dans le cycle de Krebs des mitochondries en réagissant avec l'oxaloacétate pour former du citrate, avec libération d'une coenzyme A libre. L'unité acétyle cédée y est oxydée en CO2 et coenzymes réduites telles que le NADH+H+ et l'ubiquinol (CoQ10H2) qui sont à leur tour entièrement oxydées en H2O par la chaîne respiratoire ; l'énergie libérée par ces oxydations génère un gradient électrochimique à travers la membrane mitochondriale interne qui permet la phosphorylation de l'ADP en ATP sous l'action de l'ATP synthase par couplage chimiosmotique.
Formation de corps cétoniques
Dans le foie, l'oxaloacétate peut être utilisé pour la biosynthèse de glucose par néoglucogenèse en cas de jeûne prolongé, de régime pauvre en glucides, d'effort physique intense et prolongé, et de diabète de type 1 non contrôlé. Dans ces conditions, marquées par un taux de glucagon élevé et un taux d'insuline très bas dans le sang, l'oxaloacétate est réduit en malate, qui quitte les mitochondries pour être converti en glucose dans le cytoplasme des hépatocytes, d'où il gagne la circulation sanguine. Par conséquent, l'oxaloacétate cesse d'être disponible dans le foie pour la condensation avec l'acétyl-CoA, de sorte que ce dernier se condense avec lui-même pour former de l'acétoacétyl-CoA H3C–CO–CH2–COS–CoA et du β-D-hydroxybutyrate H3C–CHOH–CH2–COO−, qui donnent spontanément de l'acétone H3C–CO–CH3 : ces trois composés sont généralement désignés comme corps cétoniques. Ils sont libérés dans la circulation sanguine d'où ils peuvent être absorbés par toute cellule de l'organisme pourvue de mitochondries : ces cellules reforment de l'acétyl-CoA à partir de ces corps cétoniques et dégradent cet acétyl-CoA dans leurs mitochondries pour en retirer l'énergie métabolique.
Contrairement aux acides gras, les corps cétoniques peuvent franchir la barrière hémato-encéphalique et sont donc également disponibles comme composés énergétiques utilisables par le cerveau et le système nerveux central à la place du glucose.
La production de corps cétoniques en réponse à un stress physiologique (jeûne, régime pauvre en glucides, effort intense prolongé) est appelée cétose ; l'excès de corps cétoniques résultant d'un diabète de type 1 est appelé acidocétose.
Biosynthèse des acides gras
Lorsque le taux sanguin d'insuline est élevé et celui de glucagon est bas (typiquement après les repas), l'acétyl-CoA issu de la glycolyse et l'oxaloacétate se condensent pour former du citrate qui, au lieu d'être dégradé par le cycle de Krebs, quitte les mitochondries pour rejoindre le cytoplasme où il est clivé en oxaloacétate et acétyl-CoA par l'ATP citrate lyase. L'oxaloacétate retourne dans les mitochondries sous forme de malate[5]. L'acétyl-CoA cytosolique peut alors être utilisé pour la biosynthèse des acides gras par carboxylation de l'acétyl-CoA en malonyl-CoA par l'acétyl-CoA carboxylase[5]. Cette réaction a lieu principalement dans le foie, le tissu adipeux et les glandes mammaires, où les acides gras sont liés au glycérol pour former des triglycérides, principaux composés de stockage de l'énergie métabolique chez la plupart des animaux. Les acides gras sont également des constituants des phospholipides, la majeure partie des bicouches lipidiques des membranes biologiques.
Chez les plantes, la synthèse de novo des acides gras a lieu dans les plastes. De nombreuses graines accumulent de grandes réserves d'huiles végétales pour favoriser la germination et le développement de la plante jusqu'à ce que celle-ci puisse subvenir à ses besoins par photosynthèse.
Production de cholestérol
L'acétyl-CoA cytosolique peut également se condenser avec l'acétoacétyl-CoA pour former de la 3-hydroxy-3-méthylglutaryl-CoA (HMG-CoA) sous l'action de l'HMG-CoA synthase, qui est l'étape limitante de la biosynthèse du cholestérol par la voie du mévalonate. Le cholestérol intervient comme constituant des membranes biologiques, dans la biosynthèse des hormones stéroïdiennes, des acides biliaires et des vitamines D.
Autres utilisations
L'acétyl-CoA intervient également dans diverses autres voies métaboliques :
- comme donneur de groupe acétyle lors de l'acétylation de certains résidus de lysine par des acétyltransférases au cours des modifications post-traductionnelles d'histones et de protéines non histones ;
- comme précurseur de la malonyl-CoA par carboxylation dans le cytosol sous l'effet de l'acétyl-CoA carboxylase, ce qui ouvre la voie à la production de flavonoïdes et de polycétides apparentés, à l'élongation d'acides gras pour produire cires, cuticule et huile chez les brassicacées, et pour la malonisation de protéines et d'autres composés phytochimiques[6], tels que des sesquiterpènes, des brassinostéroïdes et des stérols membranaires.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hidekazu Takahashi, J. Michael McCaffery, Rafael A. Irizarry et Jef D. Boeke, « Nucleocytosolic acetyl-coenzyme a synthetase is required for histone acetylation and global transcription », Molecular Cell, vol. 23, no 2, , p. 207-217 (PMID 16857587, DOI 10.1016/j.molcel.2006.05.040, lire en ligne)
- (en) Javier Seravalli, Manoj Kumar et Stephen W. Ragsdale, « Rapid Kinetic Studies of Acetyl-CoA Synthesis: Evidence Supporting the Catalytic Intermediacy of a Paramagnetic NiFeC Species in the Autotrophic Wood−Ljungdahl Pathway », 41, vol. 6, , p. 1807-1819 (PMID 11827525, DOI 10.1021/bi011687i, lire en ligne)
- (en) Eric L. Hegg, « Unraveling the Structure and Mechanism of Acetyl-Coenzyme A Synthase », Accounts of Chemical Research, vol. 37, no 10, , p. 775-783 (PMID 15491124, DOI 10.1021/ar040002e, lire en ligne)
- (en) P. Ferré et F. Foufelle, « SREBP-1c transcription factor and lipid homeostasis: clinical perspective », Hormone Research, vol. 68, no 2, , p. 78-82 (PMID 17344645, DOI 10.1159/000100426, lire en ligne)
- (en) Beth L. Fatland, Basil J. Nikolau et Eve Syrkin Wurtele, « Reverse Genetic Characterization of Cytosolic Acetyl-CoA Generation by ATP-Citrate Lyase in Arabidopsis », The Plant Cell, vol. 17, no 1, , p. 182-203 (PMID 15608338, PMCID 544498, DOI 10.1105/tpc.104.026211, JSTOR 4130763, lire en ligne)