Voie de Wood-Ljungdahl
La voie de Wood-Ljungdahl, parfois appelée voie réductrice de l'acétyl-CoA[1], est un ensemble de réactions biochimiques d'acétogenèse rencontrées chez certaines bactéries, notamment des acétogènes telles que Clostridium et quelques bactéries sulfato-réductrices à Gram négatif, ainsi que certaines archées, notamment méthanogènes[2], et sulfato-réductrices telles que les genres Archaeoglobus (A. fulgidus) et Ferroglobus de l'embranchement des Euryarchaeota, voire chez certaines Crenarchaeota[3].
Cette voie permet à ces microorganismes d'utiliser l'hydrogène H2 comme donneur d'électrons et le dioxyde de carbone CO2 à la fois comme accepteur d'électrons et comme source d'atomes de carbone pour les biosynthèses. Rappelant le procédé Monsanto de production industrielle de l'acide acétique, elle consiste à réduire le CO2 en monoxyde de carbone CO qui est ensuite converti en acétyl-CoA ; ces deux réactions sont catalysées par des métalloenzymes rédox, la CO déshydrogénase et l'acétyl-CoA synthase, respectivement[1] - [4].
Biochimie
La formation d'acétate CH3COO− à partir d'hydrogène H2 et de dioxyde de carbone CO2 est thermodynamiquement favorable dans les conditions standard, avec une variation d'enthalpie libre standard ΔG°’ valant −95 kJ·mol-1[5] à −104 kJ·mol-1 selon les auteurs :
Il existe de nombreuses variantes de cette voie métabolique, différant par les cofacteurs et les accepteurs d'électrons impliqués. Ce catabolisme consiste en deux voies distinctes, dites « branche du méthyle » et « branche du carbonyle » — dans la littérature, on parle également respectivement de voies « orientale » (eastern) et « occidentale » (western)[6] :
- la branche du méthyle, découverte par Lars Ljungdahl, au cours de laquelle une molécule de CO2 est réduite en groupe méthyle –CH3 ;
- la branche du carbonyle, dont l'élucidation doit beaucoup aux travaux de Harland Wood (en), au cours de laquelle une seconde molécule de CO2 est réduite en CO.
Si la voie de Wood-Ljungdahl elle-même n'est pas cyclique, à la différence d'autres voies de fixation du carbone telles que le cycle de Krebs inverse ou le cycle de Calvin, la branche du méthyle a en revanche un fonctionnement cyclique avec, chez les archées, également un sous-cycle de régénération du méthanofurane.
Chez les bactéries

Branche du méthyle
Une molécule de CO2 est réduite en formiate HCOO− par la formiate déshydrogénase NADP-dépendante (EC ), qui diffère de la formiate déshydrogénase (EC ) par l'utilisation du cofacteur NADPH. Cette enzyme est une sélénoprotéine, qui contient de la sélénocystéine ainsi que du tungstène :
Le formiate est ensuite condensé sur une molécule de tétrahydrofolate sous l'action de la formiate-tétrahydrofolate ligase (EC ) pour former du 10-formyltétrahydrofolate avec hydrolyse concomitante d'une molécule d'ATP en ADP et Pi :
- Tétrahydrofolate + HCOO− + ATP 10-formyltétrahydrofolate + ADP + Pi.
Le 10-formyltétrahydrofolate subit alors une série de réactions qui le convertissent en 5-méthyltétrahydrofolate via le 5,10-méthylènetétrahydrofolate, réactions au cours de laquelle le groupe formyle –CHO est réduit en groupe méthyle –CH3, lequel est ensuite transféré par une méthyltransférase à l'atome de cobalt d'une méthylcobalamine jouant le rôle de cofacteur d'une protéine fer-soufre à corrinoïde[7] (CFeSP). Cette protéine se lie ensuite à l'acétyl-CoA synthase, ce qui lui permet de fournir le groupe méthyle de la condensation à suivre.
Branche du carbonyle
La seconde molécule de CO2 est réduite en monoxyde de carbone CO par la CO déshydrogénase (CODH, EC ), qui demeure liée à l'acétyl-CoA synthase :
où A représente un accepteur d'électrons. Cette enzyme peut former un complexe membranaire avec l'hydrogénase, ou hydrogène lyase (EC ), qui catalyse quant à elle la réaction :
- H2 + A AH2, A représentant un accepteur d'électrons.
Ces deux enzymes, qui sont des protéines fer-soufre contenant du nickel, permettent, lorsqu'elles fonctionnent ensemble, de réduire le CO2 en CO en utilisant directement l'hydrogène H2 du milieu environnant. Les microorganismes qui se développent en présence de CO peuvent fixer ce dernier directement sans devoir préalablement réduire de CO2 par la CODH pour le former.
Enfin, l'acétyl-CoA synthase (EC ) produit de l'acétyl-CoA à partir (1) du groupe méthyle –CH3 fourni par la protéine à corrinoïde au cours de la branche du méthyle, (2) du monoxyde de carbone C≡O formé si besoin par la CODH qui fournit le groupe carbonyle >C=O, et (3) de la coenzyme A :
- [CH3] + [CO] + CoA–SH → CoA–S–CO–CH3.
Chez les archées
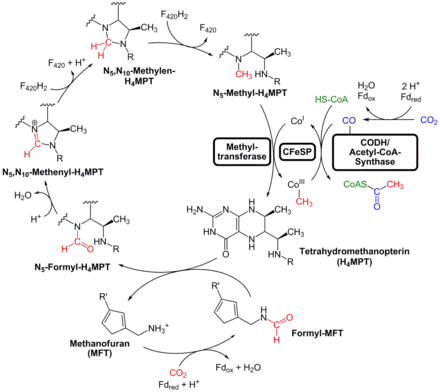
La voie de Wood-Ljungdahl est essentiellement semblable chez les archées à celle qu'on trouve chez les bactéries, hormis quelques différences détaillées ci-dessous.
Ainsi, le cofacteur de la branche du méthyle diffère entre bactéries et archées : là où les premières utilisent le THF, les secondes en utilisent deux : le méthanofurane (MFR) est tout d'abord formylé en formylméthanofurane (formyl-MFR) avec oxydation d'une ferrédoxine, puis le formyl-MFR cède son groupe formyle à la tétrahydrométhanoptérine (THMPT) pour donner de la formyltétrahydrométhanoptérine (formyl-THMPT), laquelle est réduite en méthyltétrahydrométhanoptérine (méthyl-THMPT) par une séquence de réactions semblable à celle observée chez les bactéries, les électrons provenant de la coenzyme F420.
La branche du carbonyle des archées utilise une ferrédoxine pour réduire le CO2 en CO, tout comme la branche du méthyle lors de la formylation du méthanofurane.
Implications
Ce mode de fixation du carbone est probablement le plus ancien apparu sur terre, peut-être un milliard d'années avant que ne commence la libération de l'oxygène[5]. L'acétyl-CoA formée peut ensuite être convertie en pyruvate par une enzyme à ferrédoxine, la pyruvate synthase (EC ) qui catalyse la fixation d'une troisième molécule de CO2 :
- CO2 + Acétyl-CoA + 2 ferrédoxines réduites + 2 H+ pyruvate + CoA–SH + 2 ferrédoxines oxydées.
Le pyruvate peut alors être converti en triose phosphate moyennant l'hydrolyse en ADP de trois molécules d'ATP. C'est un moyen énergétiquement économe de produire de tels précurseurs métaboliques, mais cette voie nécessite de nombreux cofacteurs et surtout des métaux pas toujours abondants dans les systèmes biologiques : fer, cobalt, nickel et molybdène ou tungstène.
Notes et références
- (en) Stephen W. Ragsdale, « Metals and Their Scaffolds To Promote Difficult Enzymatic Reactions », Chemical Reviews, vol. 106, no 8, , p. 3317-3337 (lire en ligne) DOI 10.1021/cr0503153
- (en) Nicole Matschiavelli, Ellen Oelgeschläger, Berardino Cocchiararo, Johannes Finke et Michael Rother, « Function and Regulation of Isoforms of Carbon Monoxide Dehydrogenase/Acetyl Coenzyme A Synthase in Methanosarcina acetivorans », Journal of Bacteriology, vol. 194, no 19, , p. 5377-5387 (lire en ligne) DOI 10.1128/JB.00881-12
- (en) Ivan A. Berg, W. Hugo Ramos-Vera, Anna Petri, Harald Huber et Georg Fuchs, « Study of the distribution of autotrophic CO2 fixation cycles in Crenarchaeota », Microbiology, vol. 156, no 1, , p. 256-269 (lire en ligne) DOI 10.1099/mic.0.034298-0
- (en) P.A. Lindahl, « Nickel-carbon bonds in acetyl-coenzyme a synthases/carbon monoxide dehydrogenases », Metal Ions in Life Sciences, vol. 6, , p. 133-150 (lire en ligne)
- (en) Stephen W. Ragsdale, « Life with Carbon Monoxide », Critical Reviews in Biochemistry and Molecular Biology, vol. 39, no 3, , p. 165-195 (lire en ligne) DOI 10.1080/10409230490496577
- (en) Stephen W. Ragsdale, « The Eastern and Western branches of the Wood/Ljungdahl pathway: how the East and West were won », BioFactors, vol. 6, no 1, , p. 3-11 (lire en ligne)
- (en) S. I. Hu, E. Pezacka et H. G. Wood, « Acetate synthesis from carbon monoxide by Clostridium thermoaceticum. Purification of the corrinoid protein », Journal of Biological Chemistry, vol. 259, , p. 8892-8897 (lire en ligne)
