Acide acétique
L'acide éthanoïque ou acide acétique est un acide carboxylique avec une chaîne carbonée théorique en C2, analogue à l'éthane, de formule semi-développée CH3-CO-OH ou courte AcOH, où Ac signifie « CH3CO »[21], du groupe acétyle. L'adjectif du nom courant provient du latin acetum, signifiant vinaigre. En effet, l'acide acétique représente le principal constituant du vinaigre après l'eau, puisqu'il lui donne son goût acide et son odeur piquante détectable à partir d'1 ppm[22].
| Acide éthanoïque | |
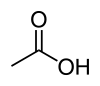
 |
|
| Formule topologique et représentation 3D de l'acide acétique. | |
| Identification | |
|---|---|
| Nom UICPA | acide éthanoïque |
| Nom systématique | acide acétique |
| Synonymes |
acide acétique glacial |
| No CAS | |
| No ECHA | 100.000.528 |
| No CE | 200-580-7 |
| No RTECS | AF1225000 |
| Code ATC | G01 S02 |
| DrugBank | DB03166 |
| PubChem | 176 |
| ChEBI | 15366 |
| No E | E260 |
| FEMA | 2006 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, d'odeur âcre et fortement vinaigrée[1]. |
| Propriétés chimiques | |
| Formule | C2H4O2 [Isomères] |
| Masse molaire[2] | 60,052 ± 0,002 5 g/mol C 40 %, H 6,71 %, O 53,29 %, |
| pKa | 4,76 à 25 °C[3] |
| Moment dipolaire | 1,70 ± 0,03 D[4] |
| Diamètre moléculaire | 0,442 nm[5] |
| Propriétés physiques | |
| T° fusion | 16,64 °C[6] |
| T° ébullition | 117,9 °C[6] |
| Solubilité | Miscible avec l'eau, l'acétone, l'alcool, le benzène, le glycérol, l'éther, le tétrachlorure de carbone ; pratiquement insol. dans le disulfure de carbone[3]. |
| Paramètre de solubilité δ | 20,7 MPa1/2 (25 °C)[7] ; |
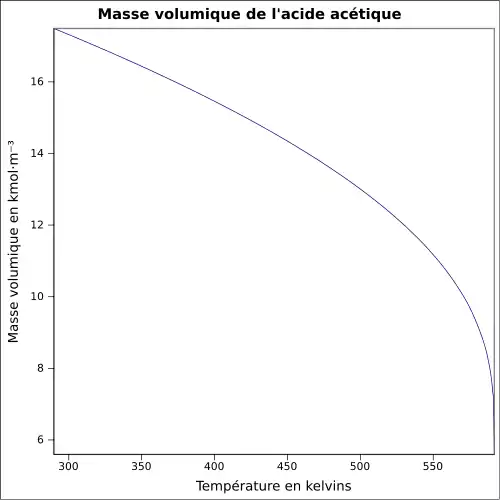
| Masse volumique | 1,049 2 g cm−3 (liquide,20 °C)[6]
|
| T° d'auto-inflammation | 465 °C[10] |
| Point d’éclair | 39 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 5,4–16 %vol[1] |
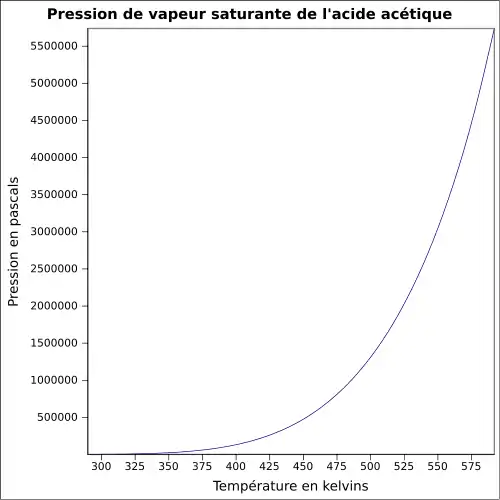
| Pression de vapeur saturante | 1,5 kPa à 20 °C[1]
|
| Viscosité dynamique | 1,22 mPa s à 25 °C |
| Point critique | 4,53 MPa à 319,56 °C[10] |
| Thermochimie | |
| S0gaz, 1 bar | 282,848 J mol−1 K−1[11] |
| S0liquide, 1 bar | 158,0 J mol−1 K−1[11] |
| ΔfH0gaz | −433 kJ mol−1[11] |
| ΔfH0liquide | −483,52 kJ mol−1[11] |
| ΔfusH° | 11,728 kJ mol−1 à 16,75 °C[11] |
| ΔvapH° | 23,7 kJ mol−1 à 117,95 °C[11] |
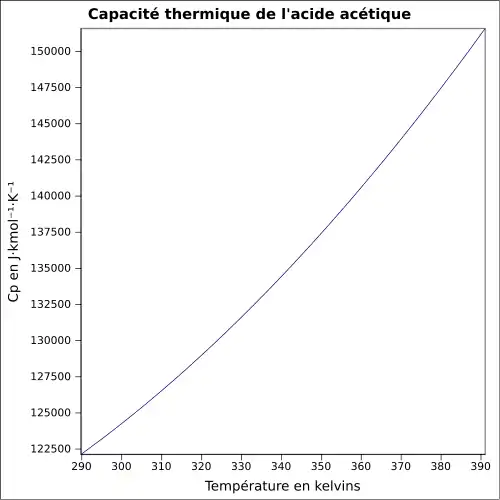
| Cp | 123,1 J mol−1 K−1 (liquide, 25 °C) 63,44 J mol−1 K−1 (gaz, 25 °C)[11] |
| PCS | 874,2 kJ mol−1[13] (liquide) |
| PCI | −875,16 kJ mol−1[11] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,65 ± 0,02 eV (gaz)[14] |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | Pna21[15] |
| Paramètres de maille | a = 13,151 Å b = 3,923 Å |
| Volume | 297,27 Å3[15] |
| Propriétés optiques | |
| Indice de réfraction | 1,372 0[6] |
| Précautions | |
| SGH[16] - [17] | |
  Danger |
|
| SIMDUT[18] | |
  B3, E, |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| DL50 | 3,31 g kg−1 (rat, oral) 525 mg kg−1 (souris, i.v.)[19] |
| LogP | –0,31[1] |
| Seuil de l’odorat | bas : 0,03 ppm haut : 0,15 ppm[20] |
| Composés apparentés | |
| Isomère(s) | Glycolaldéhyde |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
La distillation du vinaigre, attestée dès l'époque médiévale en Europe, a permis d'obtenir l'acide acétique pur, liquide combustible incolore à forte odeur de vinaigre, de masse volumique de l'ordre d'1,05 g/cm3 à 20 °C qui se solidifie par simple immersion dans un bain eau-glace[23]. Il est encore connu sous le nom d'acide acétique glacial ou autrefois de vinaigre fort. C'est le premier acide industriel connu.
Ce liquide très faiblement conducteur, incolore, inflammable et hygroscopique représente à température ambiante un des plus simples acides monocarboxyliques, avec l'acide formique. Son acidité caractérisée en solution aqueuse par un pKa = 4,76 vient de sa capacité à perdre temporairement le proton de sa fonction carboxylique, le transformant ainsi en ion acétate CH3COO−. C'est un acide faible.
Cet acide coagule le latex et a des propriétés bactériostatiques, ce qui permet de l'utiliser comme désinfectant. Il est également utilisé comme composant d'insecticides et d'agent de nettoyage pour la fabrication de semi-conducteurs[22]. Il est corrosif et ses vapeurs sont irritantes pour le nez et les yeux.
Très corrosif vis-à-vis des tissus organiques et vivants, il doit être manipulé avec soin. Bien qu'il n'ait pas été jugé cancérogène ou dangereux pour l'environnement, il peut causer des brûlures ainsi que des dommages permanents à la bouche, au nez, à la gorge et aux poumons. À certaines doses et en co-exposition chronique avec un produit cancérogène, son caractère irritant en fait un promoteur tumoral de tumeurs (bénignes et malignes)[22]. Ceci a été démontré expérimentalement chez le rat[22].
Dans le corps humain, l'acide acétique est normalement produit après la consommation d'alcool : l'éthanol est converti en acétaldéhyde qui est alors converti en acide acétique sous l'influence de l'enzyme acétaldéhyde déshydrogénase et ensuite en acétyl-coA par la ligase acétate-CoA.
Production
La demande mondiale d'acide acétique est d'environ 6,5 millions de tonnes par an (Mt/an). Industriellement, il est produit par l'oxydation en phase liquide du n-butane, ou il est récupéré dans la production d'acétate de cellulose ou d'alcool polyvinylique.
Usages
C'est un réactif très utilisé dans l'industrie ou les laboratoires, notamment :
- comme solvant : miscible à l'eau et à divers solvants organiques tels l'éthanol, l'éther diéthylique, le glycérol[22] mais insoluble dans le disulfure de carbone[22], c'est aussi un bon solvant des gommes, résines, du phosphore, du soufre et d’acides halogénohydriques[22] ? ;
- dans la production d'anhydride acétique, acétate de cellulose, d'acétate de vinyle monomère, et d'autres acétates, ainsi que de médicaments, pesticides, colorants, la fabrication de produits photographiques[22] ;
- dans l'alimentation (production de vinaigres de fruit[22]…), additif alimentaire ;
- les textiles[22] ;
- comme agent de nettoyage (de semi-conducteurs[22]) ;
- coagulant (du latex naturel[22]) ;
- bactériostatique (en solution[22]) ;
- dans la fabrication de plastiques tels le polytéréphtalate d'éthylène (PET) ou l'acétate de cellulose, utile à la production d'acétate de vinyle (peintures, adhésifs) et de solvants organiques ;
- comme additif dans les produits dérivés du tabac (arôme) ;
- mordançage lors de colorations de coupes histologiques (ex. : coloration au carmino-vert) ;
- processus d'hydrolyse[24], de condensation[24] et/ou de gélification pour la fabrication de catalyseur ou lors du procédé sol-gel[25] ;
- antibactérien et acidification gastrique dans l'élevage notamment porcin[26].
Nomenclature
Le nom trivial ancien, acide acétique, dérive d'acetum, mot latin qui désigne le vinaigre ou aceti-vinum. Il est encore le plus utilisé dans l'espace francophone et anglophone mais l'IUPAC a normalisé le terme acide éthanoïque, à la place de l'ancien nom chimique français acide éthylique. Plus tolérant que la nomenclature IUPAC en 1960, les Chemical Abstracts ont conservé néanmoins les noms courants pour les deux premiers acides carboxyliques en C1 et C2, soit l'acide formique et l'acide acétique.
Acide acétique glacial reste aussi un nom trivial qui désigne communément l'acide acétique pur au laboratoire. Similaire au nom allemand « Eisessig » (littéralement : vinaigre glacé), ce nom s'explique par les cristaux d'acide acétique semblables à de la glace qui se forment à une température légèrement inférieure à la température ambiante (à moins de 17 °C, température de fusion de l'acide acétique pur).
L'abréviation la plus courante pour l'acide acétique est AcOH ou HOAc, Ac désignant le groupe fonctionnel acétyle CH3−CO−.
La formule brute de l'acide acétique est C2H4O2. On l'écrit également souvent CH3COOH ou CH3CO2H afin de mieux traduire sa structure. L'ion résultant de la perte du proton H+ porte le nom d'acétate. Acétate peut également faire référence à un sel contenant cet anion ou à un ester de l'acide acétique.
Historique

Le vinaigre fort est connu en Mésopotamie il y a plus de 3 000 ans av. J.-C.[27]. Les bactéries acétiques produisant l'acide acétique à partir du vin et d'oxygène ont été décrites par le chimiste Louis Pasteur. Elles sont présentes partout dans le monde civilisé, et toute culture pratiquant le brassage de la bière ou du vin a inévitablement découvert le vinaigre, résultat naturel de l'évolution de ces boissons alcoolisées laissées à l'air libre.
L'usage de l'acide acétique en chimie remonte à l'Antiquité. Au IIIe siècle av. J.-C., le philosophe grec Théophraste décrit comment le vinaigre agit sur le métal et produit ainsi des pigments utiles pour l'art, incluant le plomb blanc (carbonate de plomb) et vert-de-gris, un mélange vert de sels de cuivre incluant l'acétate de cuivre II (tous produits toxiques). Les anciens Romains faisaient bouillir le « vin aigre » dans des récipients de plomb pour produire un sirop très sucré appelé sapa. Le sapa était riche en acétate de plomb, une substance sucrée appelée sucre de plomb ou sucre de Saturne, et qui provoqua de nombreux empoisonnements au plomb dans l'aristocratie romaine, la maladie correspondant à une intoxication aiguë ou chronique par le plomb est notamment nommée saturnisme. L'alchimiste perse Jabir Ibn Hayyan (Geber) concentra l'acide acétique à partir du vinaigre par distillation.
Durant la Renaissance, l'acide acétique « glacial » était préparé par distillation sèche d'acétates de métal. Au XVIe siècle, l'alchimiste allemand Andreas Libavius en décrivit la procédure, et compara l'acide pur ainsi produit au vinaigre. La présence d'eau dans le vinaigre a tant d'influence sur les propriétés de l'acide acétique que pendant des siècles de nombreux chimistes ont cru que l'acide acétique glacial et l'acide présent dans le vinaigre étaient deux substances différentes. C'est le chimiste français Pierre Auguste Adet qui prouva qu'ils étaient le même composé chimique.
En 1847, le chimiste allemand Hermann Kolbe synthétisa l'acide acétique à partir de matières inorganiques pour la première fois. La séquence de cette réaction consistait en la chloration de disulfure de carbone en tétrachlorométhane, suivie d'une pyrolyse en tétrachloroéthylène, puis d'une chloration aqueuse en acide trichloroacétique, et enfin conclure par une réduction par électrolyse pour obtenir l'acide acétique[28].
Vers 1910, la majorité de l'acide acétique glacial était obtenue à partir de la « liqueur pyroligneuse » issue de la distillation du bois[27]. L'acide acétique était isolé grâce à un traitement à l'hydroxyde de calcium, et l'acétate de calcium ainsi obtenu était alors acidifié par un ajout d'acide sulfurique pour reformer l'acide acétique. L'Allemagne en produisait à l'époque 10 000 tonnes par an, dont 30 % était utilisé pour la production de colorant indigo[29] - [30].
Propriétés physico-chimiques
Acidité
L'atome d'hydrogène (H) du groupe carboxyle (–COOH) des acides carboxyliques tels que l'acide acétique peut être libéré sous forme d'ion H+ (proton). C'est la capacité à libérer ce proton qui lui confère son acidité. L'acide acétique est un acide faible, mono-protonique en solution aqueuse, avec un pKa d'environ 4,8 à 25 °C. Une solution à 1,0 mol/L (concentration du vinaigre domestique) a un pH de 2,4, ce qui signifie que 0,4 % des molécules d'acide acétique sont dissociées.

Dimère cyclique

La structure cristalline de l'acide acétique[31] montre que les molécules se mettent par deux en dimères connectés par des liaisons hydrogène. Ces dimères peuvent aussi être observés sous forme gazeuse à 120 °C. Ils sont probablement également présents dans la phase liquide de l'acide acétique pur, mais sont rapidement brisés à la moindre présence d'eau. Cette dimérisation existe chez d'autres acides carboxyliques. Elle a également lieu en solution aqueuse avec une constante d'association KD dont la valeur est proche de 1[32].
Solvant
L'acide acétique liquide est un solvant protique hydrophile (polaire), similaire à l'éthanol et l'eau. Avec une constante diélectrique moyenne de 6,2, il peut dissoudre non seulement les composés polaires tels que les sels inorganiques et les sucres, mais aussi les composés non polaires tels que les huiles, ou des corps purs comme le soufre et le diiode. Il se mélange facilement avec de nombreux autres solvants polaires ou non polaires tels que l'eau, le chloroforme ou l'hexane. Ces propriétés de solvant et la miscibilité de l'acide acétique font qu'il est largement utilisé dans l'industrie chimique.
Réactions chimiques
L'acide acétique est corrosif pour de nombreux métaux, notamment le fer, le magnésium et le zinc. Il forme du dihydrogène et des sels de métaux appelés acétates. L'aluminium forme au contact de l'oxygène une fine couche d'oxyde d'aluminium relativement résistante, qui recouvre sa surface. Aussi les réservoirs d'aluminium sont-ils souvent utilisés pour transporter l'acide acétique. Les acétates de métal peuvent être produits à partir du mélange d'acide acétique et d'une base appropriée, comme dans la réaction bicarbonate de sodium+vinaigre qui donne de l'eau et du CO2. À la notable exception de l'acétate de chrome(II), presque tous les acétates sont solubles dans l'eau.
- Mg (s) + 2 CH3COOH (aq) → (CH3COO)2Mg (aq) + H2 (g)
- NaHCO3 (s) + CH3COOH (aq) → CH3COONa (aq) + CO2 (g) + H2O (l)
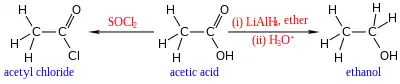
L'acide acétique subit également les réactions typiques des acides carboxyliques, en particulier la formation d'éthanol par réduction, et la formation de dérivés tels que le chlorure d'acétyle par substitution nucléophile d'acyle. Parmi d'autres dérivés de substitution, on trouve l'anhydride acétique. Cet anhydride est le résultat de la perte d'une molécule d'eau par deux molécules d'acide acétique. Les esters de l'acide acétique peuvent être formés par l'estérification de Fischer, et on peut également l'utiliser pour produire des amides. Chauffé au-delà de 440 °C, l'acide acétique se décompose en dioxyde de carbone et méthane, ou en eau et cétène.
Détection
L'acide acétique peut être détecté grâce à son odeur caractéristique. Les sels d'acide acétique dissous dans une solution de chlorure de fer (III) donnent une profonde couleur rouge qui disparaît après acidification. En chauffant les acétates avec du tri-oxyde d'arsenic, on obtient de l'oxyde de cacodyle qui peut être identifié par ses vapeurs malodorantes.
Biochimie
Le groupe acétyle, dérivé de l'acide acétique, est fondamental pour la biochimie de quasiment toutes les formes de vie. Lorsqu'il est lié au coenzyme A, il a une importance centrale dans le métabolisme des glucides et des lipides. Cependant, la concentration d'acide acétique libre dans les cellules est maintenue à un niveau bas, afin de ne pas perturber le contrôle du pH. À la différence d'autres acides carboxyliques à longue chaîne carbonée (acides gras), l'acide acétique n'apparaît pas dans la formation de triglycérides naturels. Il existe un triglycéride artificiel de l'acide acétique, la triacétine (triacétate de glycéryle), qui est couramment utilisé comme additif alimentaire (dans les cosmétiques, les aliments et certains médicaments) et comme solvant.
L'acide acétique est naturellement produit et sécrété par certaines bactéries, en particulier Acetobacter et Clostridium acetobutylicum (en) ainsi que la levure Saccharomyces cerevisiae.
Ces bactéries sont présentes dans certaines denrées alimentaires, l'eau, le lait (bactéries lactiques[33]) et le sol, et l'acide acétique se forme naturellement lorsque des fruits ou autres denrées alimentaires se décomposent. L'acide acétique est aussi un composant de la lubrification vaginale des humains et d'autres primates, où il semble faire office d'agent antibactérien[34].
Production et synthèse
L'acide acétique est produit de façon synthétique ou par fermentation bactérienne. Aujourd'hui, la méthode biologique ne concerne plus que 10 % de la production, mais elle demeure importante pour la fabrication de vinaigre car, dans la plupart des pays, la loi dispose que le vinaigre à usage alimentaire doit être d'origine biologique. Environ 75 % de l'acide acétique destiné à l'industrie chimique est produit par carbonylation du méthanol, voir détails ci-dessous. Le reste est constitué de diverses méthodes alternatives[35].
La production totale d'acide acétique est estimée à 5 Mt/an, dont environ la moitié vient des États-Unis. La production européenne arrive aux alentours de 1 Mt/an et est en diminution. Enfin, 0,7 Mt/an sont fabriquées au Japon. 1,5 Mt/an sont recyclées, ce qui amène le marché mondial à 6,5 Mt/an[36] - [37]. Les deux plus grands producteurs sont Celanese et BP Chimie. On trouve aussi parmi les principaux producteurs Millenium Chimie, Sterling Chimie, Samsung, Eastman, et Svens Etanolkemi.
Carbonylation du méthanol
La grande partie de l'acide acétique non recyclé est produit par carbonylation du méthanol. Dans ce procédé, le méthanol et le monoxyde de carbone réagissent pour produire l'acide acétique selon l'équation : CH3OH + CO → CH3COOH
Ce procédé utilise de l'acide iodhydrique comme intermédiaire et se produit en trois étapes. Un catalyseur, généralement un complexe métallique, est nécessaire pour la carbonylation (étape 2).
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
En modifiant le processus, l'anhydride acétique peut être produit par la même usine. Le méthanol et le monoxyde de carbone étant des matières premières courantes, la carbonylation du méthanol est longtemps apparue comme une méthode intéressante pour la production de l'acide acétique. Henry Dreyfus de la British Celanese a développé une usine pilote de carbonylation du méthanol dès 1925[10]. Cependant, le manque de matériel adéquat pour contenir le mélange réactionnel corrosif aux pressions nécessaires (200 atm ou plus) a freiné la commercialisation de cette méthode pendant un certain temps. Le premier processus commercialisé de carbonylation du méthanol, qui utilise du cobalt comme catalyseur, a été développé par l'entreprise chimique allemande BASF en 1963. En 1968, on a découvert un nouveau catalyseur à base de rhodium (cis−[Rh(CO)2I2]−) capable d'agir efficacement à basse pression et avec très peu de sous-produits. La première usine utilisant ce catalyseur a été bâtie par l'entreprise américaine Monsanto en 1970, et la carbonylation du méthanol catalysée au rhodium est devenue la méthode dominante de production d'acide acétique (connue sous le nom de « procédé Monsanto »). Vers la fin des années 1990, BP a commercialisé le catalyseur Cativa ([Ir(CO)2I2]−), favorisé par le ruthénium. Ce processus est plus écologique et efficace[38] que le précédent, et a largement supplanté le processus Monsanto, souvent dans les mêmes usines.
Oxydation de l'acétaldéhyde
Avant la commercialisation du processus Monsanto, la majeure partie de l'acide acétique était produit par oxydation de l'acétaldéhyde. Cette méthode demeure la seconde plus importante voie de synthèse de l'acide acétique, bien qu'elle ne soit pas compétitive avec la carbonylation du méthanol. L'acétaldéhyde peut être produit par oxydation de butane ou de naphta léger, oxydation de l'éthylène ou encore par hydratation de l'acétylène.
Quand le butane ou le naphta léger est chauffé dans l'air en présence de différents ions métalliques, en particulier de manganèse, de cobalt et de chrome, un peroxyde se forme puis se décompose pour former de l'acide acétique : 2 C4H10 + 5 O2 → 4 CH3COOH + 2 H2O On travaille avec une combinaison de température et de pression permettant d'avoir un mélange réactionnel aussi chaud que possible tout en gardant le butane à l'état liquide. 150 °C et 55 atm sont des conditions habituelles. Plusieurs sous-produits peuvent être formés, parmi lesquels la butanone, l'acétate d'éthyle, l'acide formique et l'acide propanoïque. Ces sous-produits ont également une valeur marchande, et les conditions de réaction peuvent être altérées pour en produire davantage si cela a un avantage économique. Cependant, la séparation de l'acide acétique de ses sous-produits ajoute au coût du processus. Avec des conditions et des catalyseurs similaires à ceux utilisés pour l'oxydation du butane, l'acétaldéhyde peut être oxydé par le dioxygène de l'air pour produire de l'acide acétique : 2 CH3CHO + O2 → 2 CH3COOH
Grâce aux catalyseurs modernes, cette réaction peut atteindre un rendement de plus de 95 %. Les principaux sous-produits sont l'acétate d'éthyle, l'acide formique et le formaldéhyde. Tous ces composés ont une température d'ébullition inférieure à celle de l'acide acétique et peuvent être facilement séparés par distillation.
Oxydation de l'éthylène
L'acétaldéhyde peut être préparé à partir de l'éthylène via le procédé Wacker, puis oxydé comme détaillé ci-dessus. Plus récemment, une transformation de l'éthylène en acide acétique en une seule étape a été commercialisée par l'entreprise Shōwa Denkō, qui a ouvert une usine d'oxydation d'éthylène à Oita, Japon, en 1997[39]. Le processus est catalysé par un catalyseur métallique à base de palladium avec l'assistance d'un hétéropolyacide tel que l'acide tungstosilicique. Ce processus pourrait être un concurrent de la carbonylation du méthanol pour les petites usines (100 à 250 kt/an) en fonction du prix de l'éthylène.
Synthèse malonique
- Synthèse malonique, en utilisant un halogénométhane comme substituant (R-X).
Commerce
En 2014, la France est nette importatrice d'acide acétique, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 430 €[40].
Divers
L'acide acétique, utilisé topique en ORL, fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[41].
Notes et références
- ACIDE ACETIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « ACETIC ACID » dans la base de données Hazardous Substances Data Bank (consulté le 16 juillet 2012).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 3-4.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 0387690026, lire en ligne), p. 294.
- (en) Șerban Moldoveanu, Sample preparation in chromatography, Elsevier, , 930 p. (ISBN 0444503943), p. 258.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- Wagner, Frank S. (1978), Acetic acid, dans Grayson, Martin (Éd.), Kirk-Othmer Encyclopedia of Chemical Technology, 3e éd., New York, John Wiley & Sons.
- (en) « Acetic acid », sur NIST/WebBook (consulté le 28 août 2009).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « Acetic acid », sur reciprocalnet.org (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- SIGMA-ALDRICH
- « Acide acétique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009.
- (en) « Acide acétique », sur ChemIDplus, consulté le 28 août 2009
- « Acetic acid », sur hazmap.nlm.nih.gov (consulté le )
- « Acide acétique », sur societechimiquedefrance.fr (consulté le ).
- INRS, Fiche toxicologique, Plaquette de 8 pp Ref FT 24, version 2019
- La température de fusion avoisine 16,6 °C. Sa température d'ébullition est légèrement inférieure à 117,9 °C. Le produit est inflammable avec un point éclair inférieur à 40 °C alors que le point d'auto-inflammation s'élève à 465 °C.
- Khelifi, L., Ghorbel, A., Garbowski, E. et Primet, M. (1997), « Préparation par voie sol-gel de catalyseurs Pt/Al2O3 pour la combustion catalytique », Journal de chimie physique, 94, 2016-2026.
- Rezgui, S., Ghorbel, A. et Gates, B. C. (1995), Contrôle de la préparation de catalyseurs oxydes mixtes de chrome et d'aluminium par procédés sol-gel, Journal de chimie physique, 92, 1576-1588, résumé.
- Barbara Brutsaert, « Acides organiques et acides gras à chaîne moyenne », 9ème Journée Productions porcines et avicoles, (lire en ligne)
- Pierre de Menten, Dictionnaire de chimie : Une approche étymologique et historique, De Boeck, , 395 p. (ISBN 978-2-8041-8175-8, lire en ligne), p. 20
- Goldwhite, Harold (2003). New Haven Sect. Bull. Am. Chem. Soc. (September 2003).
- Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry, Part 1, Organic. Londres, Crosby Lockwood, p. 330–31.
- Schweppe, Helmut (1979), Identification of dyes on old textiles, J. Am. Inst. Conservation, 19 (1/3), 14–23.
- Jones, R.E. et Templeton, D.H. (1958), The crystal structure of acetic acid, Acta Crystallogr., 11 (7), 484–87.
- J. Chen, C. L. Brooks et H. Sherega, « Revisiting the Carboxylic Acid Dimers in Aqueous Solution », J. Phys. Chem. B, vol. 112, p. 242-249, 2008.
- Lafon-Lafourcade, S., Lucmaret, V. et Joyeux, A. (1980), « Quelques observations sur la formation d'acide acétique par les bactéries lactiques », OENO One, 14 (3), 183-194, résumé.
- Dictionary of Organic Compounds, 6e éd., vol. 1, 1996, Londres, Chapman & Hall (ISBN 978-0-412-54090-5).
- Yoneda, Noriyki ; Kusano, Satoru ; Yasui, Makoto ; Pujado, Peter et Wilcher, Steve (2001), Appl. Catal. A: Gen., 221, 253–265.
- Production report, Chem. Eng. News, 11 juillet 2005, 67–76.
- Suresh, Bala (2003), Acetic Acid, CEH Report 602.5000, SRI International.
- Lancaster, Mike (2002), Green Chemistry, an Introductory Text, Cambridge, Royal Society of Chemistry, p. 262–266 (ISBN 978-0-85404-620-1).
- Sano, Ken-ichi ; Uchida, Hiroshi et Wakabayashi, Syoichirou (1999), Catalyst Surveys from Japan, 3, 55–60.
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=29152100 (consulté le ).
- WHO Model List of Essential Medicines, 18th list, avril 2013.
Voir aussi
Articles connexes
Bibliographie
- J. Avom, J. K. Mbadcam, M. R. L. Matip et P. Germain, « Adsorption isotherme de l’acide acétique par des charbons d’origine végétale », African Journal of Science and Technology, vol. 2, no 2, (ISSN 1607-9949, DOI 10.4314/ajst.v2i2.44663, lire en ligne, consulté le ).
- D. Brodzki, B. Denise et G. Pannetier, « Propriétés catalytiques des complexes des métaux précieux : carbonylation du méthanol en acide acétique en presence de composes de l'iridium (I) », Journal of Molecular Catalysis, vol. 2, no 3, , p. 149–161 (ISSN 0304-5102, DOI 10.1016/0304-5102(77)80048-5, lire en ligne, consulté le ).
- Louis Pasteur, Nouveau procédé industriel de fabrication du vinaigre, Mallet-Bachelier, (lire en ligne).