Butanone
La butanone (méthyl éthyl cétone ou éthyl méthyl cétone, MEC ou MEK en anglais) est une cétone généralement utilisée en tant que solvant. Il s'agit d'un liquide incolore qui possède une odeur piquante ressemblant à celle de l'acétone.
| Butanone | |||

| |||
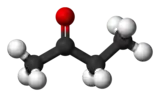 | |||
| Structure de la butanone. | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | butanone | ||
| Synonymes |
Éthylméthylcétone, butan-2-one |
||
| No CAS | |||
| No ECHA | 100.001.054 | ||
| No CE | 201-159-0 | ||
| No RTECS | EL6475000 | ||
| PubChem | 6569 | ||
| ChEBI | 28398 | ||
| FEMA | 2170 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C4H8O [Isomères] |
||
| Masse molaire[2] | 72,105 7 ± 0,004 1 g/mol C 66,63 %, H 11,18 %, O 22,19 %, |
||
| Moment dipolaire | 2,779 ± 0,015 D[3] | ||
| Diamètre moléculaire | 0,525 nm[4] | ||
| Propriétés physiques | |||
| T° fusion | −86 °C[1] | ||
| T° ébullition | 79,59 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 290 g l−1[1] | ||
| Paramètre de solubilité δ | 18,7 J1/2·cm-3/2 (25 °C)[4] | ||
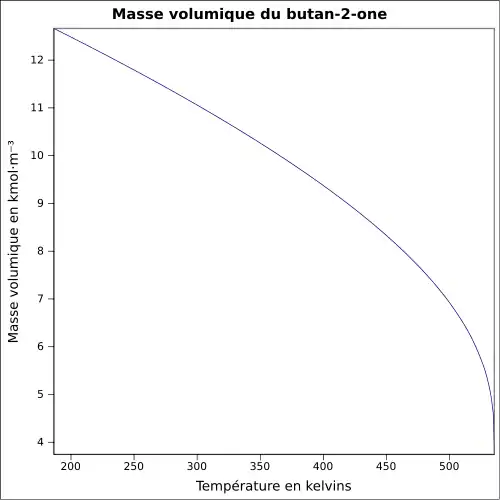
| Masse volumique | 0,8 g cm−3[1]
|
||
| T° d'auto-inflammation | 505 °C[1] | ||
| Point d’éclair | −9 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 1,8–11,5 %vol[1] | ||
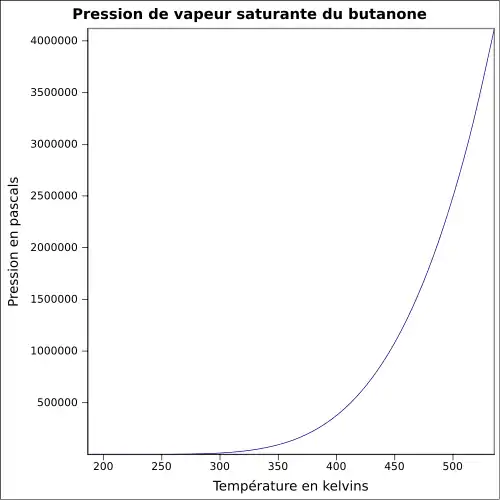
| Pression de vapeur saturante | à 20 °C : 10,5 kPa[1]
|
||
| Point critique | 41,6 bar, 262,55 °C[6] | ||
| Thermochimie | |||
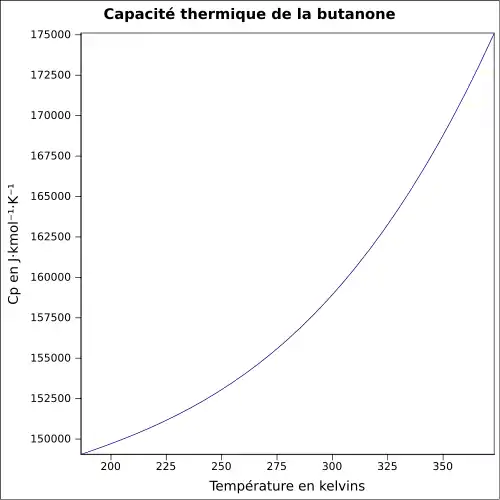
| Cp | |||
| PCS | 2 444,1 kJ·mol-1[7] (liquide) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,52 ± 0,04 eV (gaz)[8] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,3769[4] | ||
| Précautions | |||
| SGH[9] | |||
  Danger |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 0,29[1] | ||
| Seuil de l’odorat | bas : 2 ppm haut : 85 ppm[10] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
Une des voies de synthèse de la butanone est l'oxydation du butan-2-ol en utilisant un catalyseur basé sur le cuivre, le zinc ou le bronze.
- CH3CH(OH)CH2CH3 → CH3C(O)CH2CH3 + H2
Utilisation
La butanone est utilisée en plasturgie comme solvant (plastiques ABS, gommes et résines). Avec du polystyrène, elle forme une pâte ciment utilisée pour coller des pièces plastiques ensemble. La butanone est également très largement employée dans l'industrie des adhésifs.
Références
- METHYLETHYLCETONE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- « 2-Butanone », sur hazmap.nlm.nih.gov (consulté le ).
Liens externes
- Fiche toxicologique no 14 de l'Institut national de recherche et de sécurité, « Butanone ou Méthyléthylcétone » [PDF], sur inrs.fr (consulté le )
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.