Bicouche lipidique
Une bicouche lipidique, ou double couche lipidique, est une fine membrane polaire constituée de deux feuillets de molécules de lipides. Ces membranes forment une barrière continue autour des cellules et sont un élément essentiel assurant leur homéostasie, en régulant la diffusion des ions et des molécules à travers elle. La membrane cellulaire de presque tous les organismes vivants et de nombreux virus est constituée d'une bicouche lipidique, de même que les membranes entourant le noyau cellulaire et les organites. Les bicouches lipidiques sont imperméables aux molécules hydrophiles et surtout aux ions, ce qui permet aux cellules de réguler notamment le pH et la salinité de leur cytosol à l'aide de protéines transmembranaires assurant une fonction de transporteur membranaire susceptible de générer et d'entretenir un gradient de concentration de diverses espèces chimiques entre le cytoplasme et le milieu extracellulaire.
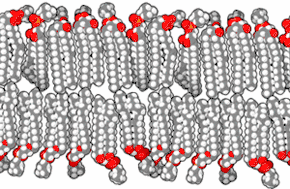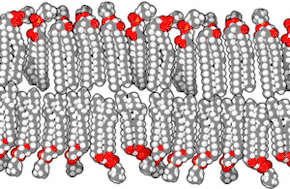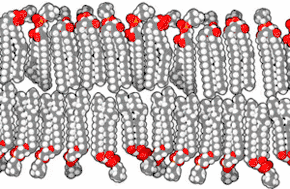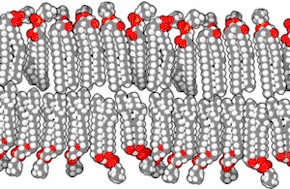
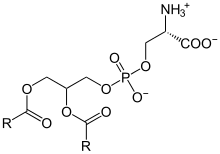
Les membranes biologiques sont constituées principalement de phospholipides, dont les molécules, amphiphiles, comprennent une tête polaire et deux queues aliphatiques. Ces molécules, lorsqu'elles se trouvent en milieu aqueux, s'organisent de façon à minimiser les interactions entre les queues aliphatiques et les molécules d'eau, adoptant par auto-assemblage moléculaire une configuration en micelles, liposomes, vésicules ou doubles couches lipidiques, dans lesquelles les têtes polaires sont en contact avec l'eau tandis que les queues aliphatiques se rassemblent pour former un milieu presque totalement anhydre. Les bicouches lipidiques étant très fines et très fragiles, leur étude est délicate et requiert des techniques avancées de microscopie électronique et de microscopie à force atomique.
La nature et la configuration des groupes présents sur les têtes hydrophiles des bicouches lipidiques détermine les propriétés chimiques de leur surface. Certains motifs moléculaires sont par exemple susceptibles d'identifier une cellule en vue de son élimination par le système immunitaire. La nature des queues aliphatiques conditionne quant à elle les propriétés physiques de la membrane, notamment sa température de fusion : plus les queues sont longues et linéaires, plus elles tendent à figer en formant un cristal bidimensionnel de molécules de lipides ordonnées ; les interactions entre molécules à l'intérieur de la bicouche lipidique déterminent également les propriétés mécaniques de la membrane, notamment sa résistance à l'étirement et à la flexion. Ces propriétés sont très souvent étudiées en laboratoire à l'aide de modèles artificiels de bicouches lipidiques dont on maîtrise certains paramètres.
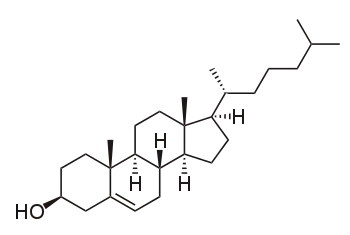
Les membranes biologiques contiennent généralement d'autres lipides que des phospholipides. Ainsi, le taux de cholestérol des membranes cellulaires animales est un paramètre important qui détermine les propriétés physicochimiques de ces membranes, notamment en augmentant leur résistance et leur imperméabilité. Le cholestérol contribue également à réguler l'activité de certaines protéines membranaires intégrales, qui fonctionnent lorsqu'elles sont intégrées à une membrane biologique, certaines d'entre elles étant par exemple impliquées dans de nombreux processus de fusion des bicouches, comme dans le cas de la fécondation d'un ovule par un spermatozoïde ou de l'entrée d'un virus dans une cellule.
Structure
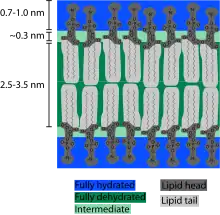
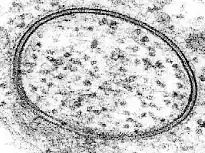
Coupe transversale d'une membrane biologique
Une bicouche lipidique est une structure très fine en comparaison de son étendue. Le diamètre d'une cellule de mammifère est typiquement d'une dizaine de micromètres (1 μm = 10−6 m) tandis que l'épaisseur d'une membrane plasmique est de l'ordre de quelques nanomètres (1 nm = 10−9 m). La coupe transversale d'une bicouche lipidique montre plusieurs régions bien différenciées, dont les propriétés spécifiques et les interactions avec l'environnement sont étudiées à l'aide notamment de techniques de réflectivité des rayons X[1], de diffusion de neutrons (en)[2] et de résonance magnétique nucléaire.
La région extérieure sur chaque face de la bicouche lipidique est constituée par les têtes hydrophiles des lipides. Cette région est entièrement hydratée et mesure environ 0,8 à 0,9 nm d'épaisseur. Le groupe phosphate des phospholipides se trouve dans cette région, environ 0,5 nm à l'extérieur du cœur hydrophobe[3]. Dans certains cas, la région hydratée peut s'étendre bien davantage, par exemple lorsque des protéines ou des glucides sont liés aux têtes hydrophiles. C'est par exemple le cas de la couche de lipopolysaccharide qui recouvre la membrane externe de certaines bactéries[4], contribuant à maintenir une couche hydratée autour de ce microorganisme et donc à prévenir sa déshydratation.
Immédiatement en dessous de la région hydratée, entre celle-ci et le cœur hydrophobe, se trouve une zone intermédiaire d'environ 0,3 nm d'épaisseur et partiellement hydratée. À travers cette région, la concentration molaire en eau passe d'environ 2 mol·L-1 côté hydrophile à presque zéro côté hydrophobe[5] - [6]. La région hydrophobe est épaisse d'environ 3 à 4 nm, mais cette valeur dépend largement de la nature des molécules de lipides qui la constituent[1] - [7] ainsi que de la température, notamment autour de la transition de phase (température de fusion de la membrane)[8].
Composition asymétrique des feuillets interne et externe
La composition des feuillets interne et externe est différente dans de nombreuses bicouches lipidiques naturelles. Les feuillets internes (cytoplasmiques) des hématies humaines (globules rouges du sang) sont essentiellement constitués de phosphatidyléthanolamine, de phosphatidylsérine, de phosphatidylinositol et de phosphoinositides. Les feuillets externes, quant à eux, sont constitués essentiellement de phosphatidylcholine, de sphingomyéline et de glycolipides[9] - [10]. Dans certains cas, cette asymétrie provient de l'endroit où les lipides sont produits dans la cellule et reflète leur orientation initiale[11]. La signification biologique de l'asymétrie de la composition lipidique des membranes biologiques n'est pas entièrement comprise, mais il est clair qu'elle intervient dans de nombreux processus biologiques. Ainsi, lors de l'apoptose, la phosphatidylsérine du feuillet intérieur passe dans le feuillet extérieur, où elle est reconnue par des macrophages, qui l'éliminent.
Cette asymétrie résulte, au moins en partie, du fait que la plupart des lipides sont produits et insérés dans le feuillet interne des bicouches lipidiques. Certains sont ensuite transférés dans le feuillet externe (mouvement rare appelé flip-flop) sous l'effet d'un type d'enzymes spécifiques appelées floppases[12] - [13]. D'autres lipides, tels que la sphingomyéline, semblent en revanche être produits dans le feuillet extérieur.
Outre les flopases, il existe d'autres enzymes de transfert de lipides entre feuillets d'une bicouche lipidique : les flippases, qui transfèrent certains lipides depuis le feuillet externe vers le feuillet interne, et les scramblases, qui les transfèrent dans les deux sens de façon aléatoire, comme dans le cas de la phosphatidylsérine lors d'un processus d'apoptose. Cependant, l'asymétrie dans la composition lipidique des deux feuillets d'une membrane cellulaire ne se dissipe normalement pas rapidement car les bascules spontanées de lipides d'un feuillet à l'autre sont des événements extrêmement rares[14].
Il est possible de reproduire une telle asymétrie en laboratoire lors de la réalisation de modèles synthétiques de bicouches lipidiques. Certains types de très petites vésicules synthétiques deviennent spontanément asymétriques, mais le mécanisme qui produit cette asymétrie est très différent de celui à l'œuvre dans les membranes biologiques[15]. On peut également produire des bicouches synthétiques à composition lipidique asymétrique en superposant deux monocouches de Langmuir-Blodgett[16] ou en fusionnant les feuillets d'une vésicule et d'une couche de Langmuir-Blodgett[17]. Cette asymétrie peut cependant s'estomper au fil du temps dans la mesure où les lipides de ces bicouches tendent à basculer d'un feuillet à l'autre, ce qui homogénéise leur composition[18].
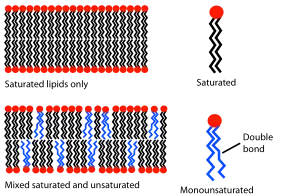
Propriétés physiques et transitions de phase
Tous les lipides ont une température caractéristique de transition de phase appelée fusion à laquelle ils passent de l'état de gel à l'état liquide. Les membranes biologiques possèdent également une température de fusion qui dépend de leur composition en lipides : une membrane gelée est constituée de molécules qui ne diffusent pratiquement pas, tandis qu'une membrane liquide est constituée de molécules qui diffusent au sein de leur feuille de la bicouche lipidique en échangeant leur position avec une molécule voisine plusieurs millions de fois par seconde ; dans les deux cas, les diffusions transversales (bascules) d'un feuillet à l'autre demeurent très rares[19].
La présence de mouvements au sein des membranes est due à l'absence de liaisons covalentes. Les propriétés physiques des phases des bicouches lipidiques sont largement déterminées par les forces de van der Waals et les interactions hydrophobes entre molécules lipidiques adjacentes[20], et ces forces s'exercent essentiellement entre les queues hydrophobes des lipides. Plus ces queues hydrophobes sont longues, plus elles offrent de possibilités d'interactions avec les molécules voisines dans leur feuillet de la bicouche, ce qui diminue la fluidité de la membrane et élève son point de fusion. À l'inverse, les lipides courts offrent moins de possibilités d'interactions avec les molécules voisines, ce qui accroît la fluidité de la membrane et abaisse son point de fusion[7].
Outre la longueur des chaînes aliphatiques des phospholipides, leur degré d'insaturation peut également influer sur la température de fusion des membranes biologiques. En effet, une double liaison introduit généralement une courbure dans les queues hydrophobes des lipides membranaires, ce qui perturbe leur empilement au sein de leur feuillet de la bicouche lipidique, réduisant les possibilités d'interactions entre molécules voisines, d'où fluidification de la membrane et abaissement du point de fusion de cette dernière ; l'empilement moins serré des molécules lipidiques a également pour conséquence d'augmenter la perméabilité membranaire aux ions et aux molécules de petite taille telles que l'eau[7].
La plupart des membranes naturelles sont un mélange complexe de différentes molécules lipidiques. Si certains constituants sont liquides à une température donnée tandis que d'autres sont gelés à cette température, les deux phases peuvent coexister dans des régions distinctes de la membrane. Cette séparation de phase joue un rôle déterminant dans les phénomènes biochimiques dans la mesure où des composants de la membrane telles que les protéines peuvent séparer l'une et l'autre phase[21] et donc être localement concentrés ou activés. Un constituant particulièrement important de nombreux systèmes à phase mixte est le cholestérol, qui module la perméabilité, la résistance mécanique et les interactions biochimiques des bicouches lipidiques.
« La fluidité membranaire est un excellent compromis pour la cellule ; une membrane trop rigide serait gênante pour la mobilité, alors qu'une membrane trop fluide ne permettrait pas l'organisation de la structure cellulaire ni le support structurel de la cellule. La fluidité membranaire autorise les interactions au sein de la membrane, tel que l'assemblage des protéines membranaires. Elle permet également le mouvement de composants membranaires responsables de processus cellulaires tels que le mouvement cellulaire, la croissance, la division, la sécrétion et la formation de jonctions cellulaires. La fluidité membranaire permet également à la bicouche lipidique de se refermer si elle est tordue ou piquée[22]. »
Propriétés chimiques et nature des surfaces
Si les queues hydrophobes des lipides déterminent essentiellement les propriétés physiques des membranes, la nature chimique des têtes polaires détermine essentiellement les propriétés chimiques de leur surface. Les bicouches lipidiques biologiques sont constituées principalement de phospholipides ainsi que d'une proportion variable de sphingolipides tels que la sphingomyéline et de stérols tels que le cholestérol. Parmi les phospholipide, les plus abondants sont les phosphatidylcholines (PC), qui constituent environ la moitié des phospholipides des cellules de mammifères[23]. La phosphocholine forme un groupe de tête zwitterionique, car elle porte une charge électrique négative sur le groupe phosphate et une charge électrique positive sur l'ammonium quaternaire, la résultante étant une charge nulle pour l'ensemble de la molécule.
Outre les phosphatidylcholines, les membranes biologiques comprennent des phosphatidylsérines (PS), des phosphatidyléthanolamines (PE) et des phosphatidylglycérols (PG). Ces groupes de tête alternatifs confèrent souvent une fonctionnalité biologique spécifique qui est très dépendante du contexte. Par exemple, la présence de phosphatidylsérine dans le feuillet externe de la membrane plasmique des érythrocytes (globules rouges) est un marqueur cellulaire d'apoptose[24] alors que la même molécule dans les vésicules de la plaque de croissance de l'épiphyse est nécessaire à la nucléation des cristaux d'hydroxyapatite lors du processus d'ostéogenèse[25] - [26]. Contrairement à la phosphatidylcholine, la tête hydrophile des autres phospholipides est porteuse d'une charge électrique négative au niveau des groupes phosphate, ce qui peut jouer sur les interactions électrostatiques des petites molécules avec la bicouche lipidique[27].
Fonctions biologiques
Confinement et séparation
La principale fonction des membranes biologiques est de séparer les compartiments aqueux — vésicules, organites, cellules elles-mêmes — de leur environnement : séparation entre le contenu des vésicules et organites d'une part et le cytosol d'autre part, et séparation entre le cytoplasme et le milieu extracellulaire. Cette fonction est essentielle à toutes les formes de vie connues, et est intrinsèque à la définition même d'un organisme vivant. Cette barrière prend la forme d'une bicouche lipidique chez la plupart des êtres vivants hormis certaines archées dont la membrane plasmique est constituée d'une monocouche d'étherlipides particuliers[4].
La première forme de vie apparue sur Terre pourrait ainsi n'avoir été qu'une simple vésicule en forme de liposome emprisonnant un minimum d'information génétique (codée sur de l'ADN ou sur d'autres supports moléculaires aujourd'hui disparus) et quelques molécules liposolubles fonctionnant comme symports de phosphate et de protons afin de produire de l'énergie métabolique destinée à synthétiser davantage de phospholipides membranaires[28].
La fonction de séparation et de confinement des membranes biologiques repose sur leur cœur hydrophobe, qui s'oppose à la diffusion des ions et des molécules polaires à travers elles. Le noyau, les mitochondries et les chloroplastes sont entourés d'une double bicouche lipidique, d'autres structures — telles que la membrane plasmique, le réticulum endoplasmique, l'appareil de Golgi et les lysosomes — sont entourés d'une simple bicouche lipidique[29].
La membrane plasmique des procaryotes est constituée d'une simple bicouche lipidique, mais peut être renforcée par une paroi bactérienne constituée non de lipides mais de protéines et de polysaccharides. Les membranes intracellulaires des eucaryotes, qu'elles soient constituées d'une simple ou d'une double bicouche lipidique, constituent ce qu'on appelle le système endomembranaire, rassemblent généralement la majeure partie de la surface membranaire de la cellule, davantage que la membrane plasmique. Dans les hépatocytes du foie par exemple, la membrane plasmique ne représente que 2 % de la surface de bicouche lipidique cellulaire, alors que le réticulum endoplasmique représente plus de 50 % de cette surface, et les mitochodries environ 30 % supplémentaires[30].
Signalisation cellulaire
La forme la plus commune de signalisation cellulaire est peut-être la transmission synaptique, où un influx nerveux qui a atteint l'extrémité d'un axone est transmis au neurone suivant via libération de neurotransmetteurs. Cette transmission est rendue possible par l'action de vésicules synaptiques chargées des neurotransmetteurs devant être libérés pour la transmission du signal. Ces vésicules fusionnent avec la membrane plasmique du neurone au niveau du terminal pré-synaptique et libèrent leur contenu à l'extérieur de la cellule. Les neurotransmetteurs libérés diffusent alors à travers la synapse jusqu'au terminal post-synaptique.
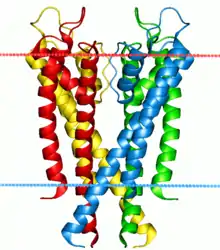
Les bicouches lipidiques sont également impliquées dans les mécanismes de transduction de signal dans la mesure où elles hébergent les protéines membranaires intégrales. Ces dernières forment une classe de biomolécules très importante et très vaste. On estime que le protéome humain est constitué de peut-être jusqu'à un tiers de protéines membranaires[31].
Certaines de ces protéines sont liées à l'extérieur de la membrane plasmique. C'est par exemple le cas de la glycoprotéine CD59, liée à la membrane par un résidu de glycosylphosphatidylinositol, qui inhibe la polymérisation du composant 9 du complément (en) (C9) conduisant à la formation du complexe d'attaque membranaire, ce qui protège la cellule de sa destruction par le système immunitaire. Le virus de l'immunodéficience humaine (VIH) évite la destruction par le système immunitaire de l'hôte notamment en greffant sur sa propre surface de telles protéines présentes à la surface des cellules de son hôte[30].
D'autres protéines traversent la membrane de part en part et peuvent relayer des signaux extérieurs à la cellule jusqu'à l'intérieur de celle-ci. La principale classe de tels récepteurs membranaires est celle des récepteurs couplés aux protéines G (RCPG). Ces RCPG sont responsables de l'essentiel de l'aptitude d'une cellule à détecter son environnement et, en raison de cette fonction importante, environ 40 % des médicaments modernes ciblent les RCPG[32].
Outre les processus de signalisation via des protéines ou la diffusion de transmetteurs en solution, les bicouches lipidiques peuvent également directement participer à la signalisation cellulaire. Un exemple classique est l'apoptose déclenchée par la phosphatidylsérine. Cette dernière est normalement présente dans le feuillet intérieur de la bicouche lipidique formant la membrane plasmique ; lorsque le processus d'apoptose s'amorce, une scramblase catalyse la bascule aléatoire de la phosphatidylsérine entre les deux feuillets de la bicouche, ce qui a pour effet d'équilibrer la concentration en phosphatidylsérine sur les deux faces de la membrane plasmique. La présence de phosphatidylsérine dans le feuillet extérieur de la membrane plasmique déclenche la phagocytose de la cellule à éliminer.
Transport à travers la bicouche
Diffusion passive
La plupart des molécules polaires sont peu solubles dans le cœur hydrophobe d'une bicouche lipidique, qui est de ce fait peu perméable à elles. Cet effet est particulièrement marqué pour les espèces porteuses d'une charge électrique, dont les coefficients de perméabilité sont inférieurs à ceux de la même espèce polaire neutre[33]. Les anions diffusent généralement mieux à travers les bicouches lipidiques que les cations[34] - [35]. Par rapport aux ions, les molécules d'eau jouissent en fait une assez grande perméabilité à travers les membranes, comme en témoigne le gonflement osmotique de vésicules et de cellules placées dans un milieu aqueux dont la concentration en solutés diminue : ce phénomène ne serait pas observé si les membranes biologiques étaient imperméables à l'eau ; la perméabilité anormalement élevée des bicouches lipidiques vis-à-vis des molécules d'eau n'est pas encore entièrement comprise et son origine continue d'être âprement débattue[36]. La vitesse de diffusion des petites molécules apolaires non chargées à travers les bicouches lipidiques et de plusieurs ordres de grandeur plus élevée que celle des ions et de l'eau. Cela vaut autant pour les lipides que pour les solvants organiques tels que le chloroforme et l'éther diéthylique. Les molécules plus grosses diffusent plus lentement, indépendamment de leur nature polaire ou apolaire.
Pompes à ions et canaux ioniques
Deux catégories de protéines particulières ont trait aux gradients de concentration ionique autour des membranes plasmique et intracellulaire, telles que celles des mitochondries et des thylakoïdes dans les cellules animales et végétales respectivement : les pompes à ions et les canaux ioniques. Il s'agit dans les deux cas de protéines membranaires intégrales qui traversent la bicouche lipidique de part en part, mais leur fonctionnement est assez différent[37] :
- Les pompes à ions sont les protéines qui génèrent et maintiennent les gradients chimiques en utilisant une source d'énergie externe pour déplacer les ions contre leur gradient de concentration vers la région de potentiel chimique le plus élevé. La source d'énergie peut être l'hydrolyse d'une molécule d'ATP, comme dans le cas de la pompe sodium-potassium (également appelée Na+-K+ ATPase), ou l'utilisation d'un gradient chimique préexistant comme dans le cas des symports et antiports, à l'exemple de l'échangeur sodium-calcium. C'est notamment grâce aux pompes à ions que les cellules sont capables de réguler leur pH interne via le pompage des protons.
- Les canaux ioniques sont des protéines qui dissipent les gradients chimiques en utilisant leur potentiel chimique pour réaliser une tâche ou envoyer un signal. Le canal sodium en est sans doute l'exemple le plus étudié et le mieux connu : c'est le canal ionique qui permet la conduction du potentiel d'action le long des axones des neurones. Tous les canaux ioniques sont équipés d'une sorte de déclencheur ou d'un mécanisme de « blocage » : dans le cas du canal sodium, il s'agit de la polarisation électrique, mais d'autres canaux ioniques peuvent être activés par la liaison d'un agoniste moléculaire ou par l'altération conformationnelle d'une protéine voisine.
Endocytose et exocytose
Certaines molécules ou particules sont trop grosses ou trop hydrophiles pour franchir efficacement la membrane plasmique, alors que d'autres substances, qui peuvent la franchir, doivent parfois être absorbées par la cellule ou expulsée par elle en des quantités qui dépassent les possibilités de la diffusion passive et du transport actif par des pompes membranaires : dans ces deux cas, la cellule recours aux processus d'endocytose (absorption) et d'exocytose (expulsion) de telles substances. Dans le premier cas, une invagination de la membrane plasmique entoure la substance à absorber jusqu'à se refermer sur elle en formant une vésicule intracellulaire, appelée phagosome dans le cas de la phagocytose d'une particule solide. Dans le second cas, une vésicule se forme au sein de la cellule et fusionne avec la membrane plasmique pour libérer son contenu dans le milieu extracellulaire. Endocytose et exocytose s'appuient sur des mécanismes moléculaires au fonctionnement très différents, mais ces deux processus sont intimement liés et ne peuvent fonctionner l'un sans l'autre, ne serait-ce qu'à travers le volume de lipides membranaires impliqué[38]. C'est une surface équivalente à la membrane plasmique entière qui est typiquement recyclée chaque demi-heure par endocytoses et exocytoses successives dans une cellule normale[39]. Si ces deux processus ne s'équilibrent pas convenablement, la membrane plasmique voit sa surface s'accroître ou se réduire considérablement en quelques minutes, au point de compromettre la survie de la cellule.
Électroporation
L'électroporation, ou électroperméabilisation, est l'augmentation rapide de la perméabilité de la bicouche lipidique induite par l'application d'un champ électrique extérieur élevé à travers la membrane. Expérimentalement, ce phénomène est utilisé pour introduire des molécules hydrophiles dans les cellules, notamment pour permettre aux grosses molécules électriquement très chargées telles que l'ADN de franchir la membrane plasmique, ce qui leur serait autrement impossible[40]. L'électroporation est par conséquent l'une des voies principales pour la transfection et la transformation bactérienne. Il a même été proposé que l'électroporation résultant des impacts de foudre pourrait être un mécanisme de transfert horizontal de gènes[41].
L'augmentation de la perméabilité affecte essentiellement le transport des ions et d'autres espèces hydratées, ce qui implique que le mécanisme sous-jacent est la création de trous entièrement hydratés de dimensions nanométriques dans la membrane. Électroporation et claquage résultent tous deux de l'application d'un champ électrique sur la membrane, mais les mécanismes impliqués dans ces deux cas sont très différents : le claquage résulte de l'ionisation du diélectrique sous l'effet du champ électrostatique, ce qui le rend conducteur ; l'électroporation résulte de la réorganisation des lipides membranaires pour former des pores aqueux conducteurs.
Notes et références
- (en) Barbara A. Lewis et Donald M. Engelman, « Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles », Journal of Molecular Biology, vol. 166, no 2, , p. 211-217 (PMID 6854644, DOI 10.1016/S0022-2836(83)80007-2, lire en ligne)
- (en) G. Zaccai, J. K. Blasie et B. P. Schoenborn, « Neutron Diffraction Studies on the Location of Water in Lecithin Bilayer Model Membranes », Proceedings of the National Academy of Sciences of the United States of America, vol. 72, no 1, , p. 376-380 (PMID 16592215, DOI 10.1073/pnas.72.1.376, lire en ligne)
- (en) John F. Nagle et Stephanie Tristram-Nagle, « Structure of lipid bilayers », Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes, vol. 1469, no 3, , p. 159-195 (lire en ligne) DOI 10.1016/S0304-4157(00)00016-2
- Parker J, Madigan MT, Brock TD, Martinko JM, Brock biology of microorganisms, Englewood Cliffs, N.J, Prentice Hall, , 10th éd. (ISBN 0-13-049147-0).
- (en) Derek Marsh, « Polarity and permeation profiles in lipid membranes », Proceedings of the National Academy of Sciences of the United States of America, vol. 98, no 14, , p. 7777-7782 (lire en ligne) DOI 10.1073/pnas.131023798
- (en) Derek Marsh, « Membrane water-penetration profiles from spin labels », European Biophysics Journal, vol. 31, no 7, , p. 559-562 (lire en ligne) DOI 10.1007/s00249-002-0245-z
- (en) W. Rawicz, K. C. Olbrich, T. McIntosh, D. Needham et E. Evans, « Effect of Chain Length and Unsaturation on Elasticity of Lipid Bilayers », Biophysical Journal, vol. 79, no 1, , p. 328-339 (lire en ligne) DOI 10.1016/S0006-3495(00)76295-3
- (en) Hermann Träuble et Duncan H. Haynes, « The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition », Chemistry and Physics of Lipids, vol. 7, no 4, , p. 324-335 (lire en ligne) DOI 10.1016/0009-3084(71)90010-7
- (en) Mark S. Bretscher, « Asymmetrical lipid bilayer structure for biological membranes », Nature, vol. 236, , p. 11-12 (lire en ligne) DOI 10.1038/236011a0
- (en) A. J. Verkleij, R. F. A Zwaal, B. Roelofsen, P. Comfurius, D. Kastelijn et L. L. M. van Deenen, « The asymmetric distribution of phospholipids in the human red cell membrane. A combined study using phospholipases and freeze-etch electron microscopy », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 323, no 2, , p. 178-193 (lire en ligne) DOI 10.1016/0005-2736(73)90143-0
- (en) R. M. Bell, L. M. Ballas et R. A. Coleman, « Lipid topogenesis », Journal of Lipid Research, vol. 22, , p. 391-403 (lire en ligne)
- (en) Mark S. Bretscher, « Membrane Structure: Some General Principles », Science, vol. 181, no 4100, , p. 622-629 (lire en ligne) DOI 10.1126/science.181.4100.622
- (en) J. E. Rothman et E. P. Kennedy, « Rapid transmembrane movement of newly synthesized phospholipids during membrane assembly », Proceedings of the National Academy of Sciences of the United States of America, vol. 74, no 5, , p. 1821-1825 (lire en ligne) DOI 10.1073/pnas.74.5.1821
- (en) Harden M. McConnell, Roger D. Kornberg, « Inside-outside transitions of phospholipids in vesicle membranes », Biochemistry, vol. 10, no 7, , p. 1111-1120 (lire en ligne) DOI 10.1021/bi00783a003
- (en) Burton J. Litman, « Determination of molecular asymmetry in the phosphatidylethanolamine surface distribution in mixed phospholipid vesicles », Biochemistry, vol. 13, no 14, , p. 2844-2848 (lire en ligne) DOI 10.1021/bi00711a010
- (en) Jonathan M. Crane, Volker Kiessling et Lukas K. Tamm, « Measuring Lipid Asymmetry in Planar Supported Bilayers by Fluorescence Interference Contrast Microscopy », Langmuir, vol. 21, no 4, , p. 1377-1388 (lire en ligne) DOI 10.1021/la047654w
- (en) Edwin Kalb, Sammy Frey et Lukas K. Tamm, « Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 1103, no 2, , p. 307-316 (lire en ligne) DOI 10.1016/0005-2736(92)90101-Q
- (en) Wan-Chen Lin, Craig D. Blanchette, Timothy V. Ratto et Marjorie L. Longo, « Lipid Asymmetry in DLPC/DSPC-Supported Lipid Bilayers: A Combined AFM and Fluorescence Microscopy Study », Biophysical Journal, vol. 90, no 1, , p. 228-237 (lire en ligne) DOI 10.1529/biophysj.105.067066
- (en) Berg, Howard C., Random walks in biology, Princeton, N.J, Princeton University Press, , Extended Paperback éd., 152 p. (ISBN 0-691-00064-6).
- Le modèle du film étirable, en adhérant aux plats, reproduit ces forces.
- (en) Christian Dietrich, Zoya N. Volovyk, Moshe Levi, Nancy L. Thompson et Ken Jacobson, « Partitioning of Thy-1, GM1, and cross-linked phospholipid analogs into lipid rafts reconstituted in supported model membrane monolayers », Proceedings of the National Academy of Sciences of the United States of America, vol. 98, no 19, , p. 10642-10647 (lire en ligne) DOI 10.1073/pnas.191168698
- Gerard J Tortora, Bryan Derrickson, Anatomie et physiologie, De Boeck supérieur, , p. 64.
- (en) Yeagle, Philip, The membranes of cells, Boston, Academic Press, , 2nd éd., 349 p. (ISBN 0-12-769041-7).
- (en) Valerie A. Fadoka, Donna L. Bratton, S. Courtney Frasch, Mary L. Warner et Peter M. Henson, « The role of phosphatidylserine in recognition of apoptotic cells by phagocytes », Cell Death & Differentiation, vol. 5, no 7, , p. 551-562 (lire en ligne) DOI 10.1038/sj.cdd.4400404
- (en) H. Clarke Anderson, Rama Garimella et Sarah E. Tague, « THE ROLE OF MATRIX VESICLES IN GROWTH PLATE DEVELOPMENT AND BIOMINERALIZATION », Frontiers in Bioscience, vol. 10, , p. 822-837 (lire en ligne) DOI 10.2741/1576
- (en) E. D. Eanes, A. W. Hailer, « Calcium phosphate precipitation in aqueous suspensions of phosphatidylserine-containing anionic liposomes », Calcified Tissue International, vol. 40, no 1, , p. 43-48 (lire en ligne) DOI 10.1007/BF02555727
- (en) J. Kim, M. Mosior, L. A. Chung, H. Wu et S. McLaughlin, « Binding of peptides with basic residues to membranes containing acidic phospholipids », Biophysical Journal, vol. 60, no 1, , p. 135-148 (lire en ligne) DOI 10.1016/S0006-3495(91)82037-9
- (en) Arthur L. Koch, « Primeval cells: Possible energy-generating and cell-division mechanisms », Journal of Molecular Evolution, vol. 21, no 3, , p. 270-277 (lire en ligne) DOI 10.1007/BF02102359
- (en) Cell Membrane Structure sur la version anglophone du manuel en ligne consacré aux Sciences du vivant de l'université de Tokyo.
- Alberts, Bruce, Molecular biology of the cell, New York, Garland Science, , 4th éd. (ISBN 0-8153-4072-9).
- (en) Pier Luigi Martelli, Piero Fariselli et Rita Casadio, « An ENSEMBLE machine learning approach for the prediction of all-alpha membrane proteins », Bioinformatics, vol. 19 (Suppl. 1), , i205-i211 (lire en ligne) DOI 10.1093/bioinformatics/btg1027
- Filmore D, « It's A GPCR World », Modern Drug Discovery, vol. 11, , p. 24–9
- (en) A. C. Chakrabarti, « Permeability of membranes to amino acids and modified amino acids: Mechanisms involved in translocation », Amino Acids, vol. 6, no 3, , p. 213-229 (lire en ligne) DOI 10.1007/BF00813743
- (en) H. HAUSER, M. C. PHILLIPS et M. STUBBS, « Ion Permeability of Phospholipid Bilayers », Nature, vol. 239, , p. 342-344 (lire en ligne) DOI 10.1038/239342a0
- (en) Demetrios Papahadjopoulo et J.C. Watkins, « Phospholipid model membranes. II. Permeability properties of hydrated liquid crystals », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 135, no 4, , p. 639-652 (lire en ligne) DOI 10.1016/0005-2736(67)90095-8
- (en) S. Paula, A. G. Volkov, A. N. Van Hoek, T. H. Haines et D. W. Deamer, « Permeation of protons, potassium ions, and small polar molecules through phospholipid bilayers as a function of membrane thickness », Biophysical Journal, vol. 70, no 1, , p. 339-348 (lire en ligne) DOI 10.1016/S0006-3495(96)79575-9
- (en) Eric Gouaux et Roderick MacKinnon, « Principles of Selective Ion Transport in Channels and Pumps », Science, vol. 310, no 5753, , p. 1461-1465 (lire en ligne) DOI 10.1126/science.1113666
- (en) Eckart D. Gundelfinger, Michael M. Kessels et Britta Qualmann, « Temporal and spatial coordination of exocytosis and endocytosis », Nature Reviews Molecular Cell Biology, vol. 4, , p. 127-139 (lire en ligne) DOI 10.1038/nrm1016
- (en) R. M. Steinman, S. E. Brodie et Z. A. Cohn, « Membrane flow during pinocytosis. A stereologic analysis », Journal of Cell Biology, vol. 68, no 3, , p. 665-687 (lire en ligne) DOI 10.1083/jcb.68.3.665
- (en) E. Neumann, M. Schaefer-Ridder, Y. Wang et P. H. Hofschneider, « Gene transfer into mouse lyoma cells by electroporation in high electric fields », The EMBO Journal, vol. 1, no 7, , p. 841-845 (lire en ligne)
- (en) Sandrine Demanèche, Franck Bertolla, François Buret, Renaud Nalin, Alain Sailland, Philippe Auriol, Timothy M. Vogel et Pascal Simonet, « Laboratory-Scale Evidence for Lightning-Mediated Gene Transfer in Soil », Applied and Environmental Microbiology, vol. 67, no 9, , p. 3440-3444 (lire en ligne) DOI 10.1128/AEM.67.8.3440-3444.2001