Pompe sodium-potassium
La pompe sodium-potassium ou Na+-K+ ATPase est une protéine transmembranaire hétérotétramère dont l'activité enzymatique utilise l'énergie issue de la dégradation de l'ATP en ADP et phosphate inorganique pour transporter des ions potassium et sodium contre leur gradient de concentration. Elle joue un rôle dans le maintien du potentiel de repos des cellules nerveuses, musculaires et cardiaques. Cette pompe électrogénique permet d'échanger les ions sodium (Na+) issus du milieu intracellulaire avec les ions potassium (K+) issus du milieu extracellulaire dans un rapport précis (3 Na+/2 K+). Cette pompe est responsable du rétablissement de l'équilibre initial après un potentiel d'action.
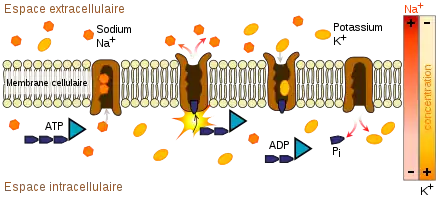
La digoxine et l'ouabaïne ou strophanthine bloquent la pompe sodium. La digitaline et palytoxine ont le même effet. Cette pompe est présente sur tous les types de cellules. Un arrêt de son activité n'est pas compatible avec la survie cellulaire.
Cette protéine consomme 20 % de l'énergie (ATP) des astrocytes[1].
Dénominations
Son nom est Na+-K+ ATPase. On la désigne parfois comme pompe à sodium car elle a d'abord été caractérisée comme responsable du transport actif de sodium. Une autre façon de la nommer est pompe à Na+-K+ ou pompe à Na+/K+.
Rôle physiologique
La pompe sodium joue un rôle essentiel dans le maintien d'un potentiel électrochimique de membrane, lequel constitue la force motrice pour le transport secondaire de molécules "entraînées" à travers des transporteurs membranaires secondaires ( cotransporteurs ou échangeurs). Le courant potassique "de fuite" définit quant à lui le potentiel de membrane. Et, dans les cellules excitables, ce potentiel électrochimique permet le déclenchement de potentiel d'action et de potentiel postsynaptique qui sont les éléments unitaires de la signalisation neuronale. Certaines évaluations estiment que l'énergie consommée par les pompes sodium pour maintenir le potentiel électrochimique pendant l'activité des neurones représente la moitié de l'énergie consommée par le cerveau, lequel représente 20 % du métabolisme au repos[2].
Cette pompe permet aussi le maintien du volume de la cellule. Celui-ci dépend de l'hydratation de la cellule.
Structure
La pompe sodium est composée de plusieurs sous-unités :
- la sous-unité est la sous-unité catalytique. Elle a 10 segments transmembranaires (M1-M10). On en connaît quatre isoformes avec un poids moléculaire réparti de 110 à 113 kDa.
- la sous-unité aurait plus un rôle d'auxiliaire, pour l'adressage de l'oligomère, la stabilisation de la structure du complexe protéique et participerait à l'hydrolyse de l'ATP. Elle est aussi impliquée dans la liaison de la ouabaïne, l'inhibiteur de la pompe sodium. Elle a un segment transmembranaire, et un poids moléculaire d'environ 60 kDa.
- la sous-unité n'est pas essentielle à l'activité de la pompe sodium. Elle n'est pas exprimée dans tous les types cellulaires. Son expression dans des cellules HEK modifie l'affinité de la pompe à l'ATP, et sa présence dans le néphron modifie l'affinité avec les ions sodium et potassium. Il est permis de penser que d'autres sous-unités modifient les propriétés biophysiques de la pompe de la même manière.
Mécanisme catalytique
La pompe sodium appartient à la famille des ATPases de type P, qui sont caractérisées par leur capacité à transporter des ions à travers la membrane en utilisant l'énergie de la dégradation d'un ATP. Le mécanisme de transport actif d'ion par les ATPases de type P s'explique par l'alternance de deux états conformationnels et l'existence de plusieurs équilibres d'affinité entre les espèces ioniques, l'ATP et la pompe dans ses deux états.
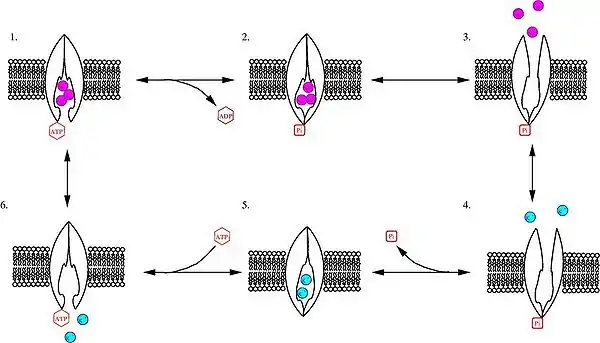
Ce schéma réactionnel est quelque peu dépassé depuis la démonstration d'un nouveau modèle de fonctionnement s'inspirant du modèle des canaux ionique : la pompe étant alors décrite comme un canal ionique à doubles portes couplées[3].
- Dans l'état E1, la pompe a une forte affinité avec l'ATP (Kd = 0,1 à 0,2 µM) et avec Na+ (Kd = 0,19 à 0,26 mM).
- La pompe peut alors être phosphorylée par le phosphate de l'ATP. Trois ions Na+ sont enfermés.
- La pompe passe de l'état E1 à l'état E2. Elle perd sa forte affinité pour le sodium (K1/2 = 14 mM) et acquiert une forte affinité pour le potassium (Kd 0,1 mM). Les trois ions Na+ sont relargués dans le milieu extracellulaire,
- et 2 ions K+ s'associent à la pompe.
- La liaison du potassium provoque une déphosphorylation spontanée de la pompe qui enferme 2 ions K+.
- L'ATP intracellulaire facilite le relargage des ions K+, ce qui provoque un passage de l'état E2 à l'état E1. Alors que l'affinité de l'ATP avec la pompe à l'état E2 était très faible (K1/2 = 0,45 mM), elle redevient importante à l'état E1. Le cycle peut recommencer.
Il ne faut pas oublier qu'il s'agit à chaque fois d'équilibre chimique. C'est la juxtaposition de tous ces états parmi une grande population de canaux qui aboutit à un flux net d'ions Na+ vers l'extérieur et d'ions K+ vers l'intérieur.
Son fonctionnement dépend de la température : plus cette dernière augmente, plus il est facilité et ce jusqu'à +50 °C, au-delà on constate des effets délétères de la température sur le fonctionnement cellulaire.
Notes et références
- "Energetic demands of the Na+/K+ ATPase in mammalian astrocytes", Ian A Silver.
- Simon B. Laughlin, « Energy as a constraint on the coding and processing of sensory information », Current Opinion in Neurobiology, 2001.
- « Three distinct and sequential steps in the release of sodium ions by the Na+/K+-ATPase », Nature, n° 403, pp. 898-901, 2000.
Voir aussi
Bibliographie
- Georgios Scheiner-Bobis, « The sodium pump, its molecular properties and mechanisms of ion transport », Eur. J. Biochem., n° 269, pp. 2424-2433, 2002.



