Canal sodium
Un canal sodium, ou sodique, est un canal ionique spécifique aux ions sodium. Il en existe de plusieurs types. Le premier à avoir été décrit est le canal sodique du potentiel d'action, responsable entre autres de la dépolarisation du neurone et du myocyte, de la propagation du signal nerveux et de la propagation de l'activation électrique du myocarde.
Il faut différencier les canaux sodium stricts des canaux perméants aux cations, c’est-à-dire principalement sodium et potassium. À la différence de ces derniers, les canaux sodium sont imperméables aux ions potassium.
Différents types de canaux sodium
Système nerveux central
Les cellules excitables du système nerveux central maintiennent de façon active (c’est-à-dire en consommant de l'énergie) une différence de potentiel d'environ −70 mV entre les milieux intra- et extracellulaires. Des protéines spécialisées permettent d'inverser la polarité de ces cellules dans le but de propager un influx le long de la cellule sous forme d'un potentiel d'action (PA). Certaines classes de canaux sodium (canaux sodium dépendants du voltage, ou VOC Na+ [Voltage-Operated Channels]) présentent ces propriétés.
Ces canaux sont des hétérotrimères αβ1β2. Seule la sous-unité α est indispensable à l'activité électrique, mais les sous-unités β stabilisent le canal.
- β1 : composée de 190 acides aminés, de poids moléculaire 36 kilodaltons (kDa), codée par un seul gène. Elle se fixe à α et β2 par des liaisons non covalentes.
- β2 : composée de 188 aminoacides, de poids moléculaire 22kDa avec nombreux sites de glycosylation. Elle s'associe avec α par des liaisons disulfures.
Le canal se présente sous trois conformations : ouvert, fermé et inactivé :
- ouvert : le canal est perméable aux ions
- fermé : le canal est imperméable aux ions et peut être activé immédiatement
- inactivé : c'est l'étape située entre les conformations ouverte et fermée. Le canal vient d'être obturé, il est imperméable aux ions mais ne peut pas être rouvert immédiatement (notion de période réfractaire durant laquelle le canal ne peut pas s'ouvrir)
Le cycle de fonctionnement du canal est donc le suivant : Fermé - Ouvert - Inactivé - Fermé.
Dans la sous-unité α existe un segment particulier (segment 4), le senseur de potentiel. Il possède des charges positives portées par des résidus lysine ou arginine tous les 3 résidus. Lors de la dépolarisation, le segment S4 se déplace sous l'influence des charges positives du sodium.
L'inactivation se fait par insertion d'un segment inactivateur qui bouche l'orifice du canal.
La sélection des ions se fait par le nombre des charges négatives présentes au côté extracellulaires et portées par des fonctions carboxyliques (COO−)
Ce canal possède 8 sites de fixation de drogues :
- Site 1 : fixation de tétrodotoxine (poison du fugu) sur la sous-unité α
- Site 2 : fixation de batrachotoxines sur le segment S6 de la sous-unité α entraînant une activation permanente
- Site 3 : fixation de toxines α de scorpions et de toxines d'anémones de mer (ralentissement de la repolarisation)
- Site 4 : fixation de toxines β de scorpions et du DDT (dichlorodiphényltrichloroéthane, un insecticide organochloré) qui prolonge l'ouverture du canal
- Site 5 : fixation de ciguatoxine. Surtout sur les canaux Na+ du tube digestif : diarrhées
- Site 6 : fixation de delta-conotoxines. Effet identique aux toxines α de scorpion
- Site 7 : fixation des anesthésiques locaux (système nerveux périphérique)
- Site 8 : absent chez l'homme, uniquement chez l'insecte. Fixation des pyréthrinoïdes
Régulation des canaux sodium par des voies de signalisation cellulaire
La régulation des canaux sodium peuvent se faire par modification post-traductionnelle comme les protéines kinases qui ont une action par phosphorylation sur les canaux sodiques :
- Protéine kinase A : le ligand se fixe sur le récepteur à protéine G qui transforme un GTP en GDP ce qui induit la synthèse d'AMPc ce qui active la protéine kinase A qui entraine une phosphorylation des canaux sodiques. La phosphorylation induit une augmentation ou une diminution de l'amplitude du courant sodique.
- Protéine kinase C : le ligand se fixe sur le récepteur à protéine G ce qui entraine la phospholipase C β qui induit une libération de DAG et IP3. DAG active la protéine kinase C qui induit une phosphorylation du canal sodique qui ralentit son inactivation.
- Protéine kinase II : Par voie de la calcium-calmoduline qui entraine une accélération de l'inactivation du canal sodique.
- Protéine kinase G : Par voie de la guanynyl cyclase qui entraine une inhibition des canaux.
Cibles thérapeutiques
Les canaux sodium sont des cibles thérapeutiques de premier choix. Ils sont la cible de bon nombre d'antiarythmiques, d'antiépileptiques ainsi que de certains anesthésiques locaux. Certains insecticides utilisent également des inhibiteurs des canaux sodium.
Chrysanthème
Certaines molécules sont naturelles, extraites du chrysanthème comme la pyréthrine, mais d'autres molécules sont synthétisées comme le dichlorodiphényltrichloroéthane. Ces insecticides ralentissent l'inactivation des canaux et augmentent leur probabilité d'ouverture ce qui induit une dépolarisation. Ils préviennent l'inactivation des canaux en empêchant la fermeture de la porte d'inactivation du canal ce qui empêche la repolarisation membranaire, provoquant une hyperexcitabilité des nerfs et ainsi une paralysie excitatrice, mortelle chez l'insecte.
Anesthésiques locaux
Principalement la lidocaïne qui bloque les influx ioniques en maintenant les canaux dans un état inactivé. Ainsi l'influx nerveux n'est plus possible.
Anti-arythmiques
Ils freinent la vitesse de dépolarisation et ralentissent la conduction de l'influx au niveau des cellules myocardiques. Diminution de l'entrée de sodium.
Ils sont répartis en 3 classes :
- Quinidine, disopyramide : entraine également un léger blocage des canaux potassiques
- Lidocaïne, méxilétine, phénytoïne
- Flécaïnide, propafénone, cibenzoline : entrainent un faible blocage additionnel sur les canaux potassiques
Anti-épileptiques
Principalement phénytoïne, carbamazépine, oxcarbazépine
Stabilisent les membranes du neurone devenu hyperexcitable en bloquant les flux sodiques. Ces molécules ont une liaison préférentielle à la forme inactive des canaux sodium.
Cœur
Le comportement des canaux sodiques du myocarde est très semblable à celui du système nerveux. La sous-unité alpha la plus abondante dans le myocarde est le Nav1.5.
Épithéliums
Le canal sodium de la membrane apicale des cellules épithéliales est appelé ENaC, pour Epithelial Na Channel. Il présente la spécificité d'être inhibé par l'amiloride. Il est responsable du transport par l'épithélium de sodium. Les épithéliums concernés sont les épithéliums pulmonaires, rénaux, coliques distaux, ainsi que plusieurs glandes exocrines, telles que les glandes salivaires ou les glandes sudoripares. Ce canal est impliqué dans certaines formes d'hypertension ainsi que, peut-être, dans la mucoviscidose. Ce canal est aussi présent dans les cellules papillaires fongiformes de la partie antérieure de la langue, où il est responsable de la transduction du goût salé et du goût acide.
Structure moléculaire
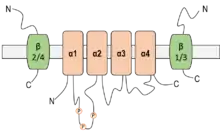
Le canal ENaC est formé à partir de trois sous-unités de poids moléculaires allant de 60 à 75 kDa : α (alpha), β (bêta) et γ (gamma) codées par trois gènes localisés sur les chromosomes 12 et 16. Chaque sous-unité est composée de deux segments transmembranaires, d'une large partie extracellulaire comportant des sites de glycosylation, ainsi que d'une partie intracellulaire formée par les extrémités N et C-terminales comportant des sites de régulation. Seule la sous-unité α peut former des canaux fonctionnels complets. Les sous-unités β et γ s'associent avec la sous-unité α pour donner des canaux aux propriétés biophysiques modifiées.
Autres
Bibliographie
- Diego Alvarez de la Rosa, Cecilia M. Canessa, Gregor K. Fyfe, Ping Zhang Structure and Regulation of Amiloride-Sensitive Sodium Channels, Annual Review of Physiology, Volume 62, , pp. 573-594.
Notes et références