Glycolyse
La glycolyse (γλῠκὖς glykýs « sucré » et λύσις lýsis « libération ») ou voie d'Embden-Meyerhof-Parnas est une voie métabolique d'assimilation du glucose et de production d'énergie. Elle se déroule dans le hyaloplasme (ou cytosol) de la cellule. Comme son nom l'indique elle nécessite du glucose et permet de produire du pyruvate. Ce dernier peut soit entrer dans le cycle de Krebs, qui se déroule dans la mitochondrie des eucaryotes ou le cytoplasme des bactéries en aérobiose, soit être métabolisé par fermentation en anaérobiose, pour produire par exemple du lactate ou de l'éthanol.
Principe général
La glycolyse est un mécanisme de régénération d'ATP qui ne nécessite pas d'oxygène. Au cours de ce processus, on assiste à :
- des réactions d'oxydo-réduction au cours desquelles un accepteur d'électrons (coenzyme NAD+) est réduit :
- des synthèses d'ATP par phosphorylation d'ADP (formation de quatre molécules d'ATP, mais consommation de deux molécules d'ATP, soit au total formation nette de deux molécules d'ATP) :
Le symbole Pi représente ici le phosphate inorganique HPO42−, ou hydrogénophosphate[1].
La glycolyse se traduisant par la réduction de coenzymes, elle s'accompagne donc de l'oxydation de molécules organiques. On peut dire qu'elle correspond à l'oxydation du glucose en pyruvate :
- glucose + 2 NAD+ → 2 CH3-CO-COO− + 2 (NADH + H+),
couplée à :
soit au total
- glucose + 2 ADP + 2 Pi + 2 NAD+ → 2 pyruvate* + 2 ATP + 2 (NADH + H+) + 2 H2O.
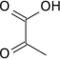
* Le pyruvate CH3-CO-COO− désigne en toute rigueur la base conjuguée de l'acide pyruvique CH3-CO-COOH.
La glycolyse est d'une importance cruciale pour l'organisme car c'est la voie principale du métabolisme du glucose. Elle est l'unique source métabolique de l'énergie pour le cerveau, les muscles squelettiques se contractant rapidement ou les érythrocytes, sauf en période de jeûne prolongé ou d'activité physique prolongée[2]. En effet, dès que les réserves en glycogènes hépatiques seront terminées, le corps dégradera ses lipides pour relâcher dans le sang des acides gras libres et du glycérol, qui seront transformés par béta-oxydation en corps cétoniques. Ce seront alors ces corps cétoniques qui iront nourrir le cerveau et le reste du corps. Une fois produit, le pyruvate peut suivre plusieurs voies métaboliques suivant les conditions du milieu[3].
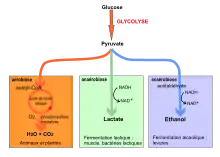
- Dans la plupart des tissus, quand l'oxygène est abondant, le pyruvate s'oxyde en perdant le groupe carboxyle sous forme de CO2, et l'unité à deux carbones restant rentre dans le cycle de l'acide citrique puis subit des phosphorylations oxydatives, dans un processus appelé respiration cellulaire.
- Sinon en absence d'oxygène, le pyruvate peut être réduit en lactate grâce à l'oxydation couplée du NADH+H+ en NAD+. Ce processus nommé fermentation lactique, se rencontre aussi chez certains micro-organismes, comme les bactéries lactiques utilisées dans la fabrication du yaourt.
- Enfin, chez des micro-organismes comme les levures et dans les tissus de certaines plantes, le pyruvate peut être réduit en alcool éthylique (éthanol), là aussi avec oxydation couplée du NADH en NAD+. C'est la fermentation alcoolique.
Étapes de la glycolyse
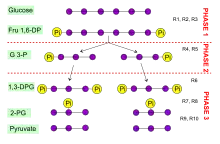
La série de 10 réactions de la glycolyse peut se décomposer en trois phases :
- Phase 1 : le glucose, une espèce à 6 atomes de carbone C, est d'abord phosphorylé en position C6 et C1 (réactions 1, 2 et 3) ;
- Phase 2 : il est ensuite clivé en deux molécules à trois carbones sous forme de glycéraldéhyde-3-phosphate (réactions 4 et 5)
- Phase 3 : l'énergie investie dans les phosphorylations est enfin récupérée sous forme d'ATP (réactions 6 à 10).
| Étapes de la glycolyse |
Phosphorylation du glucose en glucose-6-phosphate
Cette réaction nécessite un cation Mg2+ comme cofacteur et consomme une molécule d'ATP pour phosphoryler chaque molécule de glucose. Elle contribue à maintenir la concentration en glucose relativement basse dans le cytoplasme afin de faciliter l'entrée de molécules de glucose supplémentaires. De surcroît, le glucose-6-phosphate ne peut plus quitter la cellule, car la membrane plasmique n'a pas de transporteur pour cette molécule.

+ ATP → ADP + H+ + 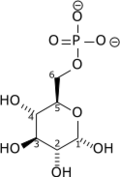
Glucose Glucose-6-phosphate Hexokinase – EC
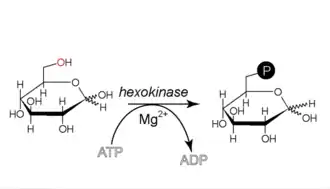
Cette réaction est irréversible. Elle est catalysée par une kinase, soit une hexokinase, non spécifique du glucose qui, chez les mammifères, se trouve le plus souvent dans le muscle, soit une glucokinase, spécifique du glucose. Ces deux enzymes ont des constantes de Michaelis (KM) différentes avec pour valeurs respectives 0,1 mM et 10 mM en sachant que la KM est inversement proportionnelle a l'affinité de l'enzyme pour ses substrats. Ces deux enzymes sont Mg2+ dépendantes. Chez l'homme, la glucokinase est localisée dans le foie et dans les cellules pancréatiques. En effet, cette dernière est parfaitement adaptée à la fonction de stockage du foie (elle fonctionne principalement lors d'afflux de glucose importants, après un repas par exemple, et contribue ainsi à la régulation de la glycémie). Un dysfonctionnement de cette enzyme est donc responsable de certains types de diabète (diabètes MODY qui, pour 50 % des cas, sont dus à une mutation de la glucokinase).
La phosphorylation du glucose n'est pas spécifique de la glycolyse. Cette étape sert également de point de départ dans la voie des pentoses phosphates ou pour la glycogénogenèse.
Remarque : toutes les réactions qui ont une variation d'enthalpie libre élevée sont irréversibles, et comme cette phosphorylation est énergétiquement très favorisée, la réaction est irréversible. C'est pourquoi ces enzymes sont très régulées afin d'éviter l'emballement du système, à l'instar des deux autres étapes irréversibles de la glycolyse. (Phosphofructokinase-1, Pyruvate kinase). L'hexokinase est notamment inhibée par son propre produit, le glucose-6-phosphate (rétrocontrôle négatif), et son expression génique est induite par l'insuline. La glucokinase n'est quant à elle pas inhibée par le glucose-6-phosphate, mais son expression génique est induite par l'insuline.
Isomérisation en fructose-6-phosphate
Le α-D-glucose-6-phosphate produit au cours de la glycolyse est isomérisé en β-D-fructose-6-phosphate par la glucose-6-phosphate isomérase (GPI) ou phosphohexose isomérase. Cette réaction est réversible, et demeure orientée vers la droite en raison de la concentration en Fru-6-P, maintenue assez faible en raison de sa consommation immédiate par l'étape suivante de la glycolyse.
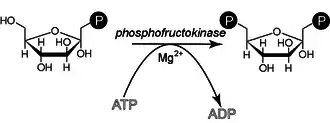
Phosphorylation en fructose-1,6-bisphosphate
Le β-D-fructose-6-phosphate (Fru-6-P) produit au cours de la réaction précédente est phosphorylé en β-D-fructose-1,6-bisphosphate (Fru-1,6-BP) par la phosphofructokinase-1 (PFK-1) à partir d'une molécule d'ATP, convertie en ADP. Cette consommation d'énergie rend cette étape irréversible, et constitue un point de régulation majeur de la vitesse de la glycolyse. Un cation Mg2+ intervient comme cofacteur.
Il existe, essentiellement chez des organismes autres que les animaux, des enzymes différentes capables de phosphoryler le fructose-6-phosphate à partir de pyrophosphate inorganique au lieu d'ATP. C'est le cas de la diphosphate fructose-6-phosphate 1-phosphotransférase (PFP), qu'on trouve chez de nombreuses plantes, certaines bactéries, des archées et des protistes. De rares archées possèdent une variante de la phosphofructokinase utilisant, cette fois, de l'ADP et non de l'ATP.
Cette réaction, catalysée par une phosphofructokinase (PFK) est irréversible et Mg2+ dépendante. Cette enzyme catalyse la première étape qui soit spécifique de la glycolyse. Elle est très fortement régulée de manière allostérique par l'ATPlibre (l'ATPlibre est la forme de l'ATP non complexé au magnésium), qui est le produit final « utile » de la glycolyse. Plus la concentration en ATPlibre est importante, plus cette réaction est lente et, inversement, plus la concentration en ATPlibre est faible, plus l'enzyme est active. Il s'agit d'un système d'autocontrôle de la glycolyse. Plusieurs modèles mathématiques de la glycolyse ont été mis au point et montrent que cette étape est la plus importante de celles qui contrôlent le flux de la glycolyse.
L'inhibition par l'ATP est réversible par l'AMP, ce qui permet de garder un rapport ATP/AMP constant.
Mais elle est surtout régulée par le fructose-2,6-bisphosphate : en effet, la production de fructose-2,6-bisphosphate à partir du fructose-6-phosphate a pour seule fonction de mettre en évidence une saturation de la voie en fructose-6-phosphate (« trop plein »), car le fructose-2,6-bisphosphate n'a pas de devenir métabolique. Par allostérie, le fructose-2,6-bisphosphate active donc la phosphofructokinase-1 afin de stimuler la consommation de fructose-6-phosphate et ainsi empêcher sa propre formation.
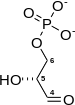
Clivage en glycéraldéhyde-3-phosphate et dihydroxyacétone phosphate
Le β-D-fructose-1,6-bisphosphate est clivé par une lyase, la fructose-bisphosphate aldolase, en D-glycéraldéhyde-3-phosphate (G3P) et dihydroxyacétone phosphate (DHAP).
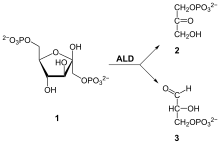 Clivage du Fru-1,6-BP par l'aldolase.
Clivage du Fru-1,6-BP par l'aldolase.
Il existe deux classes d'aldolases susceptibles de cliver le fructose-1,6-bisphosphate : la classe I chez les animaux et les plantes, et la classe II chez les mycètes et les bactéries ; ces deux classes d'enzymes utilisent des mécanismes différents pour cliver ce cétose.
Isomérisation de la dihydroxyacétone phosphate en glycéraldéhyde-3-phosphate
La dihydroxyacétone phosphate est isomérisée en D-glycéraldéhyde-3-phosphate par la triose-phosphate isomérase. Cette réaction est peu favorisée, elle a lieu à raison de 5 % dans le sens « dihydroxyacétonephosphate → glycéraldéhyde-3-phosphate » et à 95 % dans l'autre sens.
Bien qu'à l'équilibre la forme cétose (DHAP) soit beaucoup plus abondante que la forme aldose (G3P), la transformation DHAP → G3P est rapide car le composé G3P est éliminé en permanence par les réactions suivantes de la glycolyse[4].
Ainsi, chaque molécule de β-D-fructose-1,6-bisphosphate donne en fin de compte deux molécules de D-glycéraldéhyde-3-phosphate (G3P).
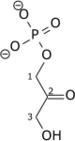
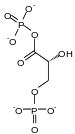
Phosphorylation en acide 1,3-bisphosphoglycérique
Le D-glycéraldéhyde-3-phosphate est phosphorylé en 1,3-bisphospho-D-glycérate (1,3-BPG) par la glycéraldéhyde-3-phosphate déshydrogénase avec réduction concomitante d'une molécule de NAD+ en NADH + H+ ; c'est la seule étape de la glycolyse où est formé du pouvoir réducteur, sous forme de NADH + H+. Cette réaction est équilibrée du point de vue de la charge électrique et du nombre d'atomes d'hydrogène par le fait que le phosphate inorganique (Pi) existe, dans le milieu cytoplasmique, sous forme d'ion hydrogénophosphate HPO42−.
Cette réaction d'oxydoréduction, réversible et catalysée par une oxydo-réductase, conduit à la formation d'une liaison acylthioester à haut potentiel de transfert. Cette étape constitue le début de la seconde partie de la glycolyse. L'énergie contenue dans les liaisons à haut potentiel de transfert va être utilisée pour la synthèse de l'ATP. Les coenzymes sont réduites (gain d'électrons).
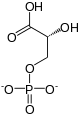
Conversion en 3-phosphoglycérate avec récupération d'ATP
Le groupe phosphate à haut potentiel de transfert du 1,3-bisphospho-D-glycérate (1,3-BPG) permet de phosphoryler une molécule d'ADP en ATP pour former le 3-phospho-D-glycérate (3PG) sous l'action de la phosphoglycérate kinase ; c'est la première étape de la glycolyse où de l'énergie est récupérée sous forme réutilisable, emmagasinée dans l'ATP.
Isomérisation en 2-phosphoglycérate
Le 3-phospho-D-glycérate est isomérisé en 2-phospho-D-glycérate (2PG) par la phosphoglycérate mutase.
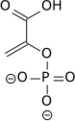
Conversion en phosphoénolpyruvate
Le 2-phospho-D-glycérate (2PG) est déshydraté par une lyase, l’énolase (ou phosphopyruvate hydratase), pour former le phosphoénolpyruvate (PEP). Un cation Mg2+ est requis comme catalyseur de la réaction de déshydratation, tandis qu'un second Mg2+ intervient avec un rôle « conformationnel » en coordination avec le groupe carboxyle du 2-phospho-D-glycérate.
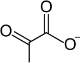
Conversion en pyruvate avec récupération d'ATP
Le groupe phosphate à haut potentiel de transfert (ΔG°' = −61,9 kJ mol−1) du phosphoénolpyruvate permet la phosphorylation d'une molécule d'ADP en ATP par la pyruvate kinase. Un cation Mg2+ est nécessaire à cette réaction comme cofacteur.
Au cours de cette réaction, le phosphoénolpyruvate est en fait converti en énolpyruvate de façon irréversible par la pyruvate kinase[5], l'énolpyruvate donnant ensuite du pyruvate de façon réversible par tautomérie.
Bilan de la glycolyse
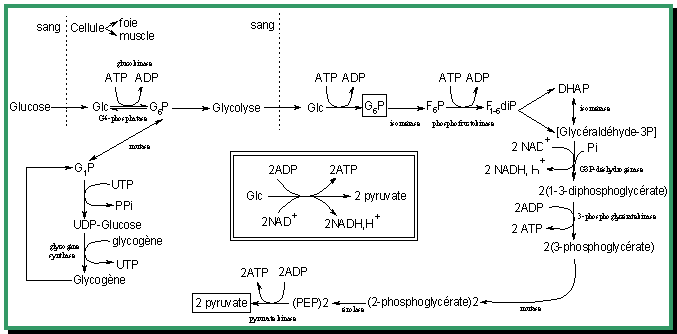
Sont utilisées :
- 1 mole de glucose
- 2 moles de coenzymes oxydées (NAD+)
- 4 moles d'ADP
- 2 moles d'ATP
- 2 moles de phosphate inorganique
Pour produire :
- 2 moles de pyruvate
- 2 moles de coenzymes réduites (NADH)
- 4 moles d'ATP
- 2 moles d'ADP
- 2 moles d'eau
- 2 moles de protons (H+)
De sorte que 2 mol d'ATP sont produites en traitant 1 mol de glucose.
Régulation de la glycolyse
La glycolyse est principalement régulée au niveau de trois enzymes clés : la PFK-1, la pyruvate kinase et l'hexokinase.
Régulation de la PFK-1
La PFK-1 est régulée de façon allostérique :
- L'ATP et le citrate agissent comme des inhibiteurs
- L'AMP et le fructose-2,6-bisphosphate agissent comme des activateurs.
La concentration en fructose-2,6-bisphosphate est donc primordiale sur la glycolyse. Elle est régulée par la phosphofructokinase-2 dont l'activité est différente selon l'état de phosphorylation :
- sous l'effet de l'insuline (hormone hypoglycémiante), elle est déphosphorylée et catalyse la réaction fructose-6-phosphate + ATP → fructose-2,6-bisphosphate + ADP ; la concentration de fructose-2,6-bisphosphate augmente et la glycolyse est accélérée.
- sous l'effet du glucagon (hormone hyperglycémiante), elle est phosphorylée et catalyse la réaction : fructose-2,6-bisphosphate + H2O → fructose-6-phosphate + Pi ; la concentration de fructose-2,6-bisphosphate diminue et la glycolyse est ralentie.
Régulation de la pyruvate kinase
La pyruvate kinase est régulée allostériquement et ceci de façon ubiquitaire :
- L'AMP et le fructose-1,6-bisphosphate sont des activateurs
- L'ATP, l'acétyl-CoA et l'alanine sont des inhibiteurs.
Au niveau du foie, elle est également régulée de façon covalente (par l'action d'hormones)
- le glucagon agit en phosphorylant cette enzyme, ce qui a pour effet de l'inhiber
- l'insuline réalise l'action inverse, ce qui a pour effet d'activer la pyruvate kinase.
Régulation au niveau de l'hexokinase
L'activité de cette enzyme est inhibée par le produit de la réaction, le glucose-6-phosphate. Si celui-ci s'accumule, sa production diminue rapidement pour s'équilibrer avec sa consommation. Ce processus évite l'accumulation de métabolites.
Réoxydation des coenzymes
La glycolyse cesse lorsque les coenzymes réduites ne sont pas réoxydées, notamment lorsque le NADH n'est pas régénéré sous la forme NAD+. Par exemple, l'étape catalysée par la glycéraldéhyde-3-phosphate déshydrogénase ne peut se produire sans NAD+ :
 |
| Oxydation couplée à une phosphorylation du glycéraldéhyde-3-phosphate (G3P) en 1,3-bisphosphoglycérate (1,3-BPG) |
.
Il existe deux voies métaboliques principales pour cela, suivant l'état rédox du milieu[6] :
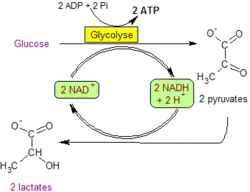
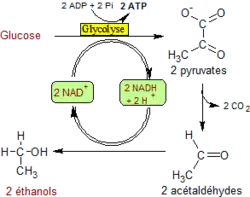
- 1) l'une, en milieu anaérobie, appelée fermentation, se fait par phosphorylation au niveau du substrat et acceptation d'électrons par une substance organique. Il en existe de plusieurs sortes : fermentation lactique (qui se produit dans le muscle non oxygéné), fermentation butyrique, fermentation alcoolique[7]. Dans la fermentation lactique, le pyruvate est réduit directement par le NADH en lactate. Dans la fermentation alcoolique provoquée par des levures, la glycolyse se prolonge par deux réactions supplémentaires : la décarboxylation du pyruvate en acétaldéhyde puis la réduction de ce dernier en éthanol. C'est donc dans le premier cas, le pyruvate qui sert d'accepteur final d'électrons et l'acétaldéhyde dans le second cas.
 |
 | |
| Fermentation lactique : la régénération du NAD+ est assurée par la réduction directe du pyruvate en lactate pyruvate + 2 H+ + 2 e− → lactate |
Fermentation alcoolique : la régénération du NAD+ est assurée par la réduction de l'acétaldéhyde en éthanol acétaldéhyde + 2 H+ + 2 e− → éthanol |
- 2) l'autre voie, en milieu aérobie, se fait par phosphorylation oxydative (par exemple en utilisant l'oxygène de l'air comme accepteur d'électron final) et est appelée respiration, certains parlent de respiration cellulaire pour la différencier de la ventilation pulmonaire, bien que les contextes d'utilisation ne prêtent pas à confusion. Elle a lieu au niveau de la chaîne respiratoire des mitochondries (phosphorylation oxydative) chez les eucaryotes et dans le cytoplasme des bactéries. Elle fait intervenir une cytochrome oxydase et entraine la formation d'H2O.
 |
| glycolyse → cycle de Krebs → chaîne respiratoire L'accepteur final de protons et d'électrons est l'oxygène de l'air |
Le bilan énergétique de la glycolyse suivie de la respiration (32 ATP) est environ 20 fois plus élevé que celui de la glycolyse suivie de la fermentation (2 ATP pour la fermentation lactique).
Notes et références
- Biologie moléculaire de la cellule par Harvey Lodish, Arnold Berk, Paul Matsudaira, James Darnell, Chris A. Kaiser, Pierre L. Masson - page 301.
- (en) Stephen D. Anton, Keelin Moehl, William T. Donahoo et Krisztina Marosi, « Flipping the Metabolic Switch: Understanding and Applying Health Benefits of Fasting », Obesity (Silver Spring, Md.), vol. 26, no 2, , p. 254–268 (ISSN 1930-7381, PMID 29086496, PMCID 5783752, DOI 10.1002/oby.22065, lire en ligne, consulté le )
- (en) Reginald H. Garrett et Charles M. Grisham, Biochemistry, Wadsworth Publishing Co Inc, , 5e éd., 1280 p. (ISBN 978-1-133-10629-6 et 1-133-10629-3, lire en ligne)
- Pascal Ribéreau-Gayon, Denis Dubourdieu, Bernard Donèche et Aline Lonvaud, Traité d’œnologie, t. 1 : Microbiologie du vin. Vinifications, Dunod, , 6e éd. (ISBN 978-2-10-058234-1 et 2-10-058234-8)
- (en) S. H. Seeholzer, A. Jaworowski, I. A. Rose, « Enolpyruvate: chemical determination as a pyruvate kinase intermediate », Biochemistry, vol. 30, no 3, , p. 727-732 (lire en ligne)
- Georges B. Johnson, Jonathan B. Losos, Peter H. Raven et Susan S. Singer (trad. de l'anglais), Biologie : Version luxe, Bruxelles/Paris, De Boeck Supérieur, , 1406 p. (ISBN 978-2-8041-6638-0)
- Joseph-Pierre Guiraud, Microbiologie alimentaire, Dunod, , 2e éd. (ISBN 978-2-10-057008-9 et 2-10-057008-0)
Voir aussi
Articles connexes
Autres voies de dégradation du glucose :
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- La logique chimique de la glycolyse (anglais)
- Une animation simplifiée du processus de glycolyse (français)