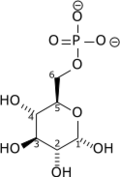
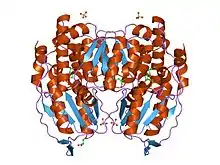
Glucose-6-phosphate isomérase
La glucose-6-phosphate isomérase (GPI), également appelée phosphoglucose isomérase (PGI) et phosphohexose isomérase (PHI), est une isomérase qui catalyse la réaction[2] - [3] :
| Glucose-6-phosphate isomérase | ||
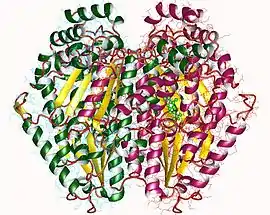 Dimère de glucose-6-phosphate isomérase de lapin de garenne (PDB 1HOX) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | GPI | |
| N° EC | 5.3.1.9 | |
| Homo sapiens | ||
| Locus | 19q13.11 | |
| Masse moléculaire | 63 147 Da[1] | |
| Nombre de résidus | 558 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Cela correspond à un réarrangement intramoléculaire entre le D-glucose-6-phosphate et le D-fructose-6-phosphate :
Chez l'homme, cette enzyme est codée par le gène GPI[4] - [5], situé sur le chromosome 19. Le produit de ce gène intervient, dans le cytoplasme des cellules, à la 2e étape de la glycolyse ainsi que dans la gluconéogenèse et dans la voie des pentoses phosphates[6]. Dans le milieu extracellulaire, où elle est également appelée neuroleukine[3], elle agit comme neurotrophine favorisant la survie des motoneurones de muscles squelettiques et des neurones récepteurs (sensoriels). Elle agit également comme une lymphokine (en) qui favorise la sécrétion d'immunoglobulines. Enfin, les cellules cancéreuses sécrètent également cette protéine, appelée dans ce contexte facteur autocrine de motilité[7] (AMF), qui stimule la formation des métastases[8].
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Wilfried Kugler et Max Lakomek, « Glucose-6-phosphate isomerase deficiency », Clinical Haematology, vol. 13, no 1, , p. 89-101 (PMID 10916680, DOI 10.1053/beha.1999.0059, lire en ligne)
- (en) Srinivas Somarowthu, Heather R. Brodkin, J. Alejandro D’Aquino, Dagmar Ringe, Mary Jo Ondrechen et Penny J. Beuning, « A tale of two isomerases: compact versus extended active sites in ketosteroid isomerase and phosphoglucose isomerase », Biochemistry, vol. 50, no 43, , p. 9283-9295 (PMID 21970785, DOI 10.1021/bi201089v, lire en ligne)
- (en) HUGO Gene Nomenclature Committee « GPI – glucose-6-phosphate isomerase. »
- (en) National Center for Biotechnology Information « GPI glucose-6-phosphate isomerase [Homo sapiens]. »
- (en) A. T. Cordeiro, P. H. C. Godoi, C. H. T. P. Silva, R. C. Garratt, G. Oliva et O. H. Thiemann, « Crystal structure of human phosphoglucose isomerase and analysis of the initial catalytic steps », Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, vol. 1645, no 2, , p. 117-122 (PMID 12573240, DOI 10.1016/S1570-9639(02)00464-8, lire en ligne)
- (en) Y. Dobashi, H. Watanabe, Y. Sato, S. Hirashima, T. Yanagawa, H. Matsubara et A. Ooi, « Differential expression and pathological significance of autocrine motility factor/glucose-6-phosphate isomerase expression in human lung carcinomas », The Journal of Pathology, vol. 210, no 4, , p. 431-440 (PMID 17029220, DOI 10.1002/path.2069, lire en ligne)
- (en) Hideomi Watanabe, Kenji Takehana, Masayo Date, Tetsuya Shinozaki et Avraham Raz, « Tumor Cell Autocrine Motility Factor Is the Neuroleukin/Phosphohexose Isomerase Polypeptide », Cancer Research, vol. 56, no 13, , p. 2960-2963 (PMID 8674049, lire en ligne)
- (en) Christopher Davies et Hilary Muirhead, « Crystal structure of phosphoglucose isomerase from pig muscle and its complex with 5-phosphoarabinonate », Proteins, vol. 49, no 4, , p. 577-579 (PMID 12402366, DOI 10.1002/prot.10255, lire en ligne)