Glucose-6-phosphate
Le glucose-6-phosphate est un composé organique abondant dans les cellules vivantes dans la mesure où l'essentiel du glucose qui pénètre dans une cellule est phosphorylé sur son carbone 6[3]. Il s'agit d'un métabolite de départ tant pour la glycolyse que pour la voie des pentoses phosphates, et il peut également être converti en glycogène ou en amidon pour être stocké.
| Glucose-6-phosphate | |||
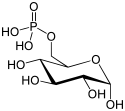  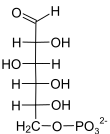 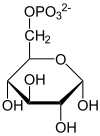 Structure du D-glucose-6-phosphate (en bas : projections de Fischer et de Haworth) |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | [(2R,3S,4S,5R)-3,4,5,6-tétrahydroxyoxan-2-yl]méthyldihydrogénophosphate | ||
| Synonymes |
Glc-6-P |
||
| No CAS | |||
| No CE | 200-286-9 | ||
| PubChem | 5958 | ||
| ChEBI | 4170 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C6H13O9P [Isomères] |
||
| Masse molaire[1] | 260,135 8 ± 0,008 4 g/mol C 27,7 %, H 5,04 %, O 55,35 %, P 11,91 %, |
||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
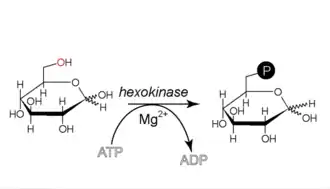
Conversion du glucose en glucose-6-phosphate

+ ATP → ADP + 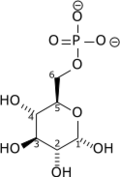
Glucose Glucose-6-phosphate Hexokinase – EC
Cette réaction nécessite un cation Mg2+ comme cofacteur et consomme une molécule d'ATP pour phosphoryler chaque molécule de glucose. Elle contribue à maintenir la concentration en glucose relativement basse dans le cytoplasme afin de faciliter l'entrée de molécules de glucose supplémentaires. De surcroît, le glucose-6-phosphate ne peut plus quitter la cellule, car la membrane plasmique n'a pas de transporteur pour cette molécule. Selon les circonstances, ce glucose-6-phosphate peut connaître plusieurs destinées :
- si le glucose-6-phosphate et l'ATP sont abondants, le glucose-6-phosphate est mis en réserve sous forme de glycogène par la glycogénogenèse ;
- s'il manque de l'ATP et des squelettes carbonés pour les biosynthèses, le glucose-6-phosphate est dégradé par la glycolyse ;
- s'il manque du NADPH + H+ et du ribose-5-phosphate, le glucose-6-phosphate est dégradé par la voie des pentoses phosphates.
Dégradation du glucose-6-phosphate par la glycolyse


Glucose-6-phosphate Fructose-6-phosphate Glucose-6-phosphate isomérase – EC
L'α-D-glucose-6-phosphate est isomérisé en β-D-fructose-6-phosphate par la glucose-6-phosphate isomérase. Cette réaction est réversible, et demeure orientée vers la droite en raison de la concentration en β-D-fructose-6-phosphate, maintenue assez faible du fait de sa consommation immédiate par l'étape suivante de la glycolyse.
Régénération du glucose-6-phosphate
La régénération du glucose-6-phosphate peut intervenir de deux façons :
- la glycogénolyse à partir du glycogène ;
- la néoglucogenèse à partir du pyruvate.
Avantages de la phosphorylation du glucose
La phosphorylation du glucose en glucose-6-phosphate permet le maintien du substrat dans la cellule. En effet lorsque le glucose est phosphorylé, il ne diffuse pas facilement à travers la membrane cellulaire[4].
Par ailleurs la conversion rapide en glucose-6-phosphate permet de favoriser la diffusion du glucose à l'intérieur de la cellule : la diminution de la concentration du glucose intracellulaire permet la formation d'un gradient. La cellule peut alors continuer à absorber du glucose.
Enfin la phosphorylation du glucose est le premier point de contrôle de la glycolyse : une augmentation de la concentration en G6P entraîne l'inhibition de l'hexokinase.
Lorsque la quantité de glucose-6-phosphate est élevée, il va y avoir inhibition par effet allostérique de l'hexokinase qui le produit à partir du glucose. La concentration en glucose-6-phosphate va alors rester en équilibre. Dans le foie, la glucokinase, variante de l'hexokinase qui intervient dans le contrôle de la glycémie, ne sera pas régulée par le glucose-6-phosphate.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Franz M. Matschinsky et David F. Wilson, « The Central Role of Glucokinase in Glucose Homeostasis: A Perspective 50 Years After Demonstrating the Presence of the Enzyme in Islets of Langerhans », Frontiers in Physiology, vol. 10, , p. 148 (ISSN 1664-042X, PMID 30949058, PMCID PMC6435959, DOI 10.3389/fphys.2019.00148, lire en ligne, consulté le )
- « 2-deoxy-2-[18F]fluoro-D-glucose with positron… », Molecular Imaging & Biology, vol. 6, no 2, , p. 106 (ISSN 1536-1632, DOI 10.1016/j.mibio.2004.01.141, lire en ligne, consulté le )

