Phosphoglycérate kinase
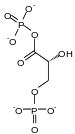
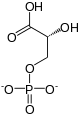
La phosphoglycérate kinase (PGK) est une phosphotransférase qui catalyse la réaction :
| Phosphoglycérate kinase 1 | ||
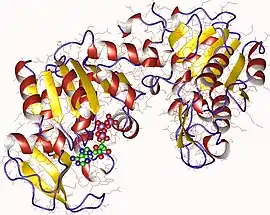 Monomère de phosphoglycérate kinase de porc avec ATP en vert (PDB 1VJD) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | PGK1 | |
| N° EC | 2.7.2.3 | |
| Homo sapiens | ||
| Locus | Xq21.1 | |
| Masse moléculaire | 44 615 Da[1] | |
| Nombre de résidus | 417 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Phosphoglycérate kinase 2 | ||
| Caractéristiques générales | ||
| Symbole | PGK2 | |
| N° EC | 2.7.2.3 | |
| Homo sapiens | ||
| Locus | 6p12.3 | |
| Masse moléculaire | 44 796 Da[1] | |
| Nombre de résidus | 417 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Cette enzyme intervient à la 7e étape de la glycolyse en transférant de manière réversible un groupe phosphate du 1,3-bisphosphoglycérate (1,3-BPG} sur de l'ADP pour former de l'ATP et du 3-phosphoglycérate (3PG). Elle intervient également dans la néoglucogenèse en catalysant la réaction inverse, c'est-à-dire la conversion du 3-phosphoglycérate en 1,3-bisphosphoglycérate avec conversion concomitante d'une molécule d'ATP en ADP.
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Isoformes
Deux isoenzymes de phosphoglycérate kinase ont été identifiées chez l'homme, appelées PGK1 et PGK2. Elles partagent une séquence peptidique identique à 87-88 %, mais, bien qu'elles soient semblables structurellement et fonctionnellement, elles sont exprimées très différemment : le gène de la PGK1 est située sur le chromosome X et est exprimée de manière ubiquitaire dans toutes les cellules, tandis que la PGK2 est encodée sur un autosome et est spécifique aux spermatides méiotiques et posméiotiques[3].
Structure et fonctionnement
On trouve la phosphoglycérate kinase chez pratiquement tous les êtres vivants, et sa séquence a été particulièrement conservée au cours de l'évolution. Il s'agit d'une enzyme monomérique de 415 résidus d'acides aminés contenant deux domaines de taille à peu près égale correspondant à l'extrémité N-terminale et à l'extrémité C-terminale de la protéine[4]. Le 3-phosphoglycérate se lie au domaine N-terminal tandis que le substrat nucléotidique (ADP ou ATP) se lie au domaine C-terminal de l'enzyme. Les deux domaines de la protéines sont séparés par une fente et sont reliées par deux hélices α[3]. Le cœur de chacun de ces deux domaines est constitué d'un feuillet β à six brins parallèles entouré d'hélices α. Cette structure en deux domaines permet des changements conformationnels de grande ampleur de type flexion articulée semblables à ceux de l'hexokinase[5]. Ces deux lobes peuvent se replier de manière indépendante. ce qui est cohérent avec l'existence d'intermédiaires de repliement ne présentant qu'un seul domaine replié[6] - [7]. Si la liaison de chacun des substrats induit des changements conformationnels de manière indépendante, la liaison des deux substrats en même temps est indispensable pour que ces changements conduisent les deux domaines à se refermer, ce qui permet de réaliser le transfert du groupe phosphate[3].
L'enzyme tend à privilégier la conformation ouverte avec de brèves périodes pendant lesquelles elle est refermée en mode catalytique, ce qui permet aux substrats et aux produits de diffuser rapidement autour des sites de liaison. La conformation ouverte est stabilisée en raison de la présence de chaînes latérales hydrophobes exposée à la surface de la protéine lorsque celle-ci est en conformation refermée[6].
Les cations de magnésium Mg2+ sont normalement complexés avec les groupes phosphate des substrats nucléotidiques de la phosphoglycérate kinase. L'enzyme est inactive en l'absence de magnésium[8]. Ce cation permet d'écranter la charge électrique négative des ligands de l'enzyme afin de permettre la substitution nucléophile : cette stabilisation de charge est une caractéristique typique des transferts de groupes phosphate catalysés par les phosphotransférases[9].
Pathologies
Chez l'homme, un déficit en PGK est associé à une anémie hémolytique et à des troubles mentaux[10].
Notes et références
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) H. C. Watson, N. P. Walker, P. J. Shaw, T. N. Bryant, P. L. Wendell, L. A. Fothergill, R. E. Perkins, S. C. Conroy, M. J. Dobson et M. F. Tuite, « Sequence and structure of yeast phosphoglycerate kinase », The EMBO Journal, vol. 1, no 12, , p. 1635-1640 (PMID 6765200, PMCID 553262, lire en ligne)
- (en) Laurent R. Chiarelli, Simone M. Morera, Paola Bianchi, Elisa Fermo, Alberto Zanella, Alessandro Galizzi et Giovanna Valentini, « Molecular Insights on Pathogenic Effects of Mutations Causing Phosphoglycerate Kinase Deficiency », PLoS One, vol. 7, no 2, , e32065 (PMID 22348148, PMCID 3279470, DOI 10.1371/journal.pone.0032065, lire en ligne)
- (en) Apratim Dhar, Antonios Samiotakis, Simon Ebbinghaus, Lea Nienhaus, Dirar Homouz, Martin Gruebele et Margaret S. Cheung, « Structure, function, and folding of phosphoglycerate kinase are strongly perturbed by macromolecular crowding », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, no 41, , p. 17586-17591 (PMID 20921368, PMCID 2955104, DOI 10.1073/pnas.1006760107, JSTOR 20780502, lire en ligne)
- (en) Sandeep Kumar, Buyong Ma, Chung-Jung Tsai, Haim Wolfson et Ruth Nussinov, « Folding funnels and conformational transitions via hinge-bending motions », Cell Biochemistry and Biophysics, vol. 31, no 2, , p. 141-164 (PMID 10593256, DOI 10.1007/BF02738169, lire en ligne)
- (en) J. M. Yon, M. Desmadril, J. M. Betton, P. Minard, N. Ballery, D. Missiakas, Gaillard-Miran S., D. Perahia et L. Mouawad, « Flexibility and folding of phosphoglycerate kinase », Biochimie, vol. 72, nos 6-7, , p. 417-429 (PMID 2124145, DOI 10.1016/0300-9084(90)90066-P, lire en ligne)
- (en) Louiza Zerrad, Angelo Merli, Gunnar F. Schröder, Andrea Varga, Éva Gráczer, Petra Pernot, Adam Round, Mária Vas et Matthew W. Bowler, « A Spring-loaded Release Mechanism Regulates Domain Movement and Catalysis in Phosphoglycerate Kinase », Journal of Biological Chemistry, vol. 286, no 16, , p. 14040-14048 (PMID 21349853, DOI 10.1074/jbc.M110.206813, lire en ligne)
- (en) « Importance of aspartate residues in balancing the flexibility and fine-tuning the catalysis of human 3-phosphoglycerate kinase », Biochemistry, vol. 51, no 51, , p. 10197-10207 (PMID 23231058, DOI 10.1021/bi301194t, lire en ligne)
- (en) Matthew J. Cliff, Matthew W. Bowler, Andrea Varga, James P. Marston, Judit Szabó, Andrea M. Hounslow, Nicola J. Baxter, G. Michael Blackburn, Mária Vas et Jonathan P. Waltho, « Transition State Analogue Structures of Human Phosphoglycerate Kinase Establish the Importance of Charge Balance in Catalysis », Journal of the American Chemical Society, vol. 132, no 18, , p. 6507-6516 (PMID 20397725, DOI 10.1021/ja100974t, lire en ligne)
- (en) (en) Yoshida A, Tani K, « Phosphoglycerate kinase abnormalities: functional, structural and genomic aspects », Biomed. Biochim. Acta, vol. 42, nos 11-12, (PMID 6689547)