Cytochrome c oxydase
La cytochrome c oxydase, ou complexe IV de la chaîne respiratoire aérobie, est une oxydoréductase membranaire qui catalyse la réaction de réduction du dioxygène. Cette enzyme est située dans la membrane plasmique de nombreuses bactéries et dans la membrane mitochondriale interne chez les eucaryotes aérobies.
| N° EC | EC |
|---|---|
| N° CAS | |
| Cofacteur(s) | Cu2+ |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Réaction catalysée
Les 4 électrons servant à la réduction complète du dioxygène en eau sont transférés à l'enzyme par quatre cytochromes[3] - [4] - [5] :
- 4 ferrocytochrome c + O2 + 8 H+matriciel 4 ferricytochrome c + 2 H2O + 4 H+intermembranaire.
Structure et fonctionnement
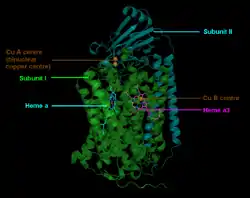
Le complexe IV de la chaîne respiratoire, également appelé cytochrome a3, est une grosse protéine membranaire intégrale possédant plusieurs groupes prosthétiques métalliques et 14 sous-unités protéiques chez les mammifères[6], dont onze sont encodées par des gènes du noyau cellulaire et trois proviennent du génome mitochondrial. Il contient deux hèmes, l'un appartenant à un cytochrome a et l'autre appartenant à un cytochrome a3, ainsi que deux centres à cation de cuivre, notés centres CuA et CuB[7].
Le cytochrome a3 et le centre CuB forment un centre binucléaire qui est le site de réduction de l'oxygène O2 en H2O[3]. À l'état le plus oxydé, les cations métalliques Fe3+ et Cu2+ de ce centre binucléaire sont distants de 4,5 Å; et sont coordonnés à un anion hydroxyde HO−.
Deux ferrocytochromes c réduits par le complexe III (coenzyme Q-cytochrome c réductase) à l'étape précédente de la chaîne respiratoire, se lient à proximité du centre binucléaire CuA, auquel ils cèdent leur électron. CuA cède à son tour ces électrons au cytochrome a, qui les transfère au centre binucléaire a3-CuB. Les cations métalliques de ce dernier sont réduits à l'état Fe2+ et Cu+, tandis que l'anion hydroxyde est protoné pour donner une molécule d'eau, qui est éliminée. Le site vacant entre les deux ions métalliques est occupé par une molécule d'oxygène, qui est rapidement réduite en acceptant d'une part deux électrons du Fe2+ pour former un dérivé oxo Fe4+=O, d'autre part deux électrons issus pour l'un du Cu+ et pour l'autre de l'hydroxyle ionisé –O− du résidu de Tyr-244 converti en radical tyrosyle –O•, pour former, après protionation, un anion hydroxyde HO− lié au centre CuB.
Un troisième ferrocytochrome c cède son électron au centre binucléaire a3-CuB, lequel permet de réduire le radical –O• terminal du résidu tyrosyle en groupe –O− susceptible de redonner un hydroxyle –OH par protonation, tandis qu'un autre proton est donné à l'hydroxyde HO− lié au centre CuB pour former une seconde molécule d'eau H2O, qui est libérée. Un quatrième ferrocytochrome c cède alors son électron au centre CuA, ce qui a pour effet de dissocier le complexe Fe4+=O en Fe3+ et en anion hydroxyde HO− lié au centre CuB oxydé à l'état Cu2+, rétablissant l'état initial.
Les études par cristallographie aux rayons X ont mis en évidence une modification post-traductionnelle inhabituelle liant l'atome de carbone C6 du résidu de Tyr-244 à l'atome d'azote ε de la chaîne latérale du résidu d'His-240 (selon la numérotation des résidus de l'enzyme bovine). Cette modification post-traductionnelle joue un rôle déterminant dans la capacité du centre binucléaire a3-CuB de recevoir quatre électrons afin de pouvoir réduire une molécule d'oxygène O2 en deux molécules d'eau H2O. On avait d'abord pensé que la formation d'eau passait par la formation de peroxyde d'hydrogène, ce qui était susceptible de produire des anions superoxyde O2•−, mais il s'est avéré plus probable que le mécanisme consiste en un transfert direct de quatre électrons à une molécule d'oxygène avec rupture de la liaison O–O, ce qui éviterait la formation d'ions superoxyde.
Inhibiteurs
Les anions cyanure CN−, sulfure S2−, azoture N3− ainsi que le monoxyde de carbone CO sont des inhibiteurs compétitifs du complexe IV[8], ce qui conduit à l'asphyxie de la cellule. Le méthanol CH3OH est métabolisé en acide formique HCOOH, lequel est un autre inhibiteur de la cytochrome c oxydase. Des taux élevés d'ATP dans la matrice mitochondriale conduisent également à l'inhibition de cette enzyme[9].
Notes et références
- (en) Tomitake Tsukihara, Hiroshi Aoyama, Eiki Yamashita, Takashi Tomizaki, Hiroshi Yamaguchi, Kyoko Shinzawa-Itoh, Ryosuke Nakashima, Rieko Yaono et Shinya Yoshikawa, « The Whole Structure of the 13-Subunit Oxidized Cytochrome c Oxidase at 2.8 Å », Science, vol. 272, no 5265, , p. 1136-1144 (PMID 8638158, DOI 10.1126/science.272.5265.1136, Bibcode 1996Sci...272.1136T, lire en ligne)
- (en) Kazumasa Muramoto, Kunio Hirata, Kyoko Shinzawa-Itoh, Shinji Yoko-o, Eiki Yamashita, Hiroshi Aoyama, Tomitake Tsukihara et Shinya Yoshikawa, « A histidine residue acting as a controlling site for dioxygen reduction and proton pumping by cytochrome c oxidase », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 19, , p. 7881-7886 (PMCID 1876541, DOI 10.1073/pnas.0610031104, JSTOR 25427587, Bibcode 2007PNAS..104.7881M, lire en ligne)
- Mårten Wikström, Klaas Krab et Vivek Sharma, « Oxygen Activation and Energy Conservation by Cytochrome c Oxidase », Chemical Reviews, vol. 118, no 5, , p. 2469–2490 (ISSN 0009-2665, PMID 29350917, PMCID PMC6203177, DOI 10.1021/acs.chemrev.7b00664, lire en ligne, consulté le )
- (en) Shinya Yoshikawa, Atsuhiro Shimada et Kyoko Shinzawa-Itoh, « Respiratory Conservation of Energy with Dioxygen: Cytochrome c Oxidase », Metal Ions in Life Sciences, vol. 15, , p. 89-130 (PMID 25707467, DOI 10.1007/978-3-319-12415-5_4, lire en ligne)
- (en) Gereon M. Yee et William B. Tolman, « Transition Metal Complexes and the Activation of Dioxygen », Metal Ions in Life Sciences, vol. 15, , p. 131-204 (PMID 25707468, DOI 10.1007/978-3-319-12415-5_5, lire en ligne)
- (en) Eduardo Balsa, Ricardo Marco, Ester Perales-Clemente, Radek Szklarczyk, Enrique Calvo, Manuel O. Landázuri et José Antonio Enríquez, « NDUFA4 Is a Subunit of Complex IV of the Mammalian Electron Transport Chain », Cell Metabolism, vol. 16, no 3, , p. 378-386 (PMID 22902835, DOI 10.1016/j.cmet.2012.07.015, lire en ligne)
- (en) T. Tsukihara, H. Aoyama, E. Yamashita, T. Tomizaki, H. Yamaguchi, K. Shinzawa-Itoh, R. Nakashima, R. Yaono et S. Yoshikawa, « Structures of metal sites of oxidized bovine heart cytochrome c oxidase at 2.8 Å », Science, vol. 269, no 5227, , p. 1069-1074 (PMID 7652554, PMCID 1995Sci...269.1069T, DOI 10.1126/science.7652554, lire en ligne)
- (en) Jose-Ramon Alonso, Francesc Cardellach, Sònia López, Jordi Casademont et Òscar Miró, « Carbon Monoxide Specifically Inhibits Cytochrome C Oxidase of Human Mitochondrial Respiratory Chain », Pharmacology & Toxicology, vol. 93, no 3, , p. 142-146 (PMID 12969439, DOI 10.1034/j.1600-0773.2003.930306.x, lire en ligne)
- (en) Susanne Arnold et Bernhard Kadenbach, « Cell Respiration is Controlled by ATP, an Allosteric Inhibitor of Cytochrome-c Oxidase », FEBS Journal, vol. 249, no 1, , p. 350-354 (PMID 9363790, DOI 10.1111/j.1432-1033.1997.t01-1-00350.x, lire en ligne)
