Superoxyde
L'ion superoxyde, noté O2•− ou O2− (la deuxième écriture ne fait pas apparaître explicitement le caractère radicalaire) est issu de la réduction monoélectronique du dioxygène (O2)[1]. L'ion superoxyde est paramagnétique.

Composés de l'ion superoxyde
Des sels de l'ion superoxyde tels que le superoxyde de potassium (KO2) se forment naturellement par réaction directe du dioxygène avec certains métaux.
Stabilité en solution
Le superoxyde est thermodynamiquement instable, quel que soit le pH, par rapport à sa dismutation en peroxyde d'hydrogène H2O2 et en dioxygène O2. La réaction de dismutation nécessite des protons (H+).
Donc, aux pH élevés (faible concentration de H+), c'est-à-dire avec une grande concentration de HO− par rapport à la concentration des ions Hydrogène H+, les solutions contenant l'ion superoxyde peuvent avoir une certaine stabilité cinétique.
En revanche, l'ion superoxyde est stable en solution organique anhydre.
Importance biologique
L'ion superoxyde est une espèce réactive oxygénée (nom scientifique des « radicaux libres »). C'est un déchet métabolique toxique mais naturellement produit dans toutes les cellules des êtres vivants respirant le dioxygène, en particulier au sein des mitochondries (où ce superoxyde est probablement surtout produit par le complexe I et le complexe III), ainsi que par plusieurs autres enzymes, par exemple la xanthine oxydase[2].
Bien qu'instable en solution aqueuse, sa concentration stationnaire serait trop élevée pour la vie cellulaire sans un bon système de protection : l'enzyme superoxyde dismutase. Cette enzyme protectrice est produite par presque tous les organismes vivants connus en présence d'oxygène ; il en existe plusieurs variantes (isoformes). Elle catalyse très efficacement la neutralisation du superoxyde, presque aussi vite que sa capacité à se diffuser spontanément en solution.
D'autres protéines pouvant être à la fois oxydées et réduites par le superoxyde présentent une faible activité de type SOD ; c'est par exemple le cas de l'hémoglobine). L'inactivation génétique («knock-out») de l'enzyme SOD chez des animaux de laboratoire produit des phénotypes délétères chez des organismes aussi différents que des bactéries et des mammifères. Elle a fourni de précieux indices pour mieux comprendre les mécanismes de toxicité du superoxyde in vivo.
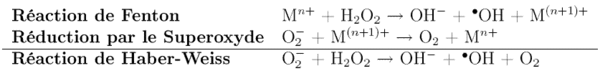
Le système immunitaire utilise la toxicité de cet ion pour tuer nombre de microorganismes aérobies infectieux ou envahissants : les phagocytes produisent du superoxyde en quantité via l'enzyme NADPH oxydase et l'utilisent pour détruire les agents pathogènes phagocytés.
Les mutations dans le gène codant la NADPH oxydase provoquent un syndrome d'immunodéficience dit Granulomatose septique, maladie caractérisée par une susceptibilité extrême aux infections, en particulier par des organismes positifs à la catalase.
De même des microorganismes génétiquement modifiés pour ne pas synthétiser la superoxyde dismutase (SOD) perdent leur virulence.
Toxicité
Sa toxicité intrinsèque a plusieurs causes :
- La cause principale est la réaction de Haber-Weiss : le superoxyde peut réagir avec le peroxyde d'hydrogène, pour donner le radical hydroxyle hautement réactif, qui peut être à l'origine d'une oxydation délétère des constituants cellulaires.
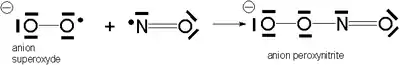
Cette réaction est négligeable sauf en cas de catalyse par les ions de certains métaux de transition (fer ou cuivre notamment). - Cet ion superoxyde peut aussi réagir avec le monoxyde d'azote pour donner l'anion peroxynitrite, un agent oxydant et nitrant puissant très toxique.
L'absence de SOD cytosolique augmente spectaculairement la mutagenèse et l'instabilité génomique. Les souris dépourvues de SOD mitochondriale (MnSOD) meurent en moyenne 21 jours après la naissance en raison de phénomènes de neurodégénérescence, cardiomyopathies et/ou acidose lactique[2].
Les souris dépourvues de SOD cytosolique (CuZnSOD) sont viables mais souffrent de pathologies multiples dont cancer du foie, atrophie musculaire, cataractes, involution thymique, anémie hémolytique et déclin très rapide de la fertilité chez la femelle, avec l'âge, qui induisent une moindre durée de vie[2].
Le superoxyde est la source ou l'une des sources (pathogenèse) de nombreuses maladies (notamment liées à l'empoisonnement par rayonnement et blessures hyperoxiques), et il semble impliqué dans le vieillissement par dommages oxydatifs infligés aux cellules. Son rôle dans la pathogenèse de certaines maladies est fort (par exemple, les souris et les rats surexprimant CuZnSOD ou MnSOD sont plus résistants aux accidents vasculaires cérébraux et aux infarctus du myocarde), cependant son rôle dans le vieillissement n'est pas encore clair ni même prouvé. Chez des organismes modèles (ex : levure, drosophile ou souris), la suppression génétique de CuZnSOD réduit l'espérance de vie et accélère certaines caractéristiques du vieillissement (cataractes, atrophie musculaire, dégénérescence maculaire, involution thymique), mais inversement une augmentation des niveaux de CuZnSOD, ne semble pas (sauf peut-être chez Drosophila) augmenter constamment la durée de vie[2]. On suppose en général que les dommages oxydatifs (dont le superoxyde n'est qu'une des nombreuses causes possibles) ne sont qu'une partie des facteurs limitant la durée de vie.
Remarque : Les organismes anaérobies y sont moins sensibles. Ainsi une levure dépourvue de SOD mitochondriale et cytosolique se développe très mal dans l'air, mais assez bien dans un milieu anoxique.
Intermédiaires de superoxyde de Fe (III)
La première étape de l'activation de O2 par les complexes fer-porphyrine implique une liaison avec l'ion Fe (II). Les tentatives initiales de préparation de ces adduits Fe-O2 1:1 ont rencontré des difficultés en raison de la propension de ces premiers modèles à subir une auto-oxydation via des intermédiaires (μ-η1: η1-peroxo) diiron. Mais des travaux récents ont apporté de nouvelles idées et la présence de superoxyde a pu être confirmée par plusieurs moyens, dont la spectroscopie à rayons X, à rayons L ou par la spectroscopie Mössbauer[3].
Dosage dans les systèmes biologiques
Il est rendu très difficile par la haute réactivité du superoxyde en présence d'autres molécules et par sa très courte demi-vie dans la cellule[4].
Un moyen détourné est de convertir le superoxyde, dès qu'il se forme, en peroxyde d'hydrogène, qui est assez stable pour laisser le temps de le quantifier par exemple par une méthode fluorimétrique[4]. Comme radical libre, le superoxyde a un « signal RPE » fort. Il est donc possible de le détecter ainsi, mais uniquement quand il est significativement présent. Or en raison de ses effets, il est intéressant de pouvoir le mesurer aux très faibles doses. En outre, cette mesure nécessite aujourd'hui des conditions non physiologiques dont un pH élevé (qui ralentit la dismutation spontanée). Des outils de type "pièges à spin" sont en développement. Ils peuvent réagir avec le superoxyde, formant un radical méta-stable (demi-vie de 1 à 15 minutes) plus facilement détectable par Résonance paramagnétique électronique (RPE). Le piégeage a d'abord été réalisé avec du DMPO, mais plus récemment des dérivés de phosphore (ex : DEPPMPO, DIPPMPO) ont amélioré la demi-vie du radical, et sont plus largement utilisés.
Superoxyde et cancer
Des chercheurs de l'UCL ont réussi chez l'animal de laboratoire à bloquer des métastases de deux types de cancers (mélanome et cancer du sein), simplement en inactivant le superoxyde par des molécules existantes, en cours de tests de phase 2 pour traiter la maladie de Parkinson ou l'hépatite C (et qui n'ont pas montré de toxicité pour l'homme). Ils ouvrent une nouvelle piste de traitement, encore à tester chez l'Homme[5].
Bibliographie
- Sawyer, D. T. Superoxide Chemistry, McGraw-Hill, DOI 10.1036/1097-8542.669650
- Muller, F. L., Lustgarten, M. S., Jang, Y., Richardson, A. and Van Remmen, H. (2007). "Trends in oxidative aging theories.". Free Radic. Biol. Med. 43 (4): 477–503. doi:10.1016/j.freeradbiomed.2007.03.034. .
- Yee, Gereon M.; Tolman, William B. (2015). "Chapter 5, Section 2.2.2 Fe(III)-Superoxo Intermediates". In Peter M.H. Kroneck and Martha E. Sosa Torres. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. 15. Springer. pp. 141–144. doi:10.1007/978-3-319-12415-5_5.
- Rapoport, R.; Hanukoglu, I.; Sklan, D. (mai 1994). "A fluorimetric assay for hydrogen peroxide, suitable for NAD(P)H-dependent superoxide generating redox systems.". Anal Biochem. 218 (2): 309–13. doi:10.1006/abio.1994.1183. .
- Cancer: l'incroyable découverte belge qui bloque les métastases, RTBF, 02-06-2017
