NADPH oxydase
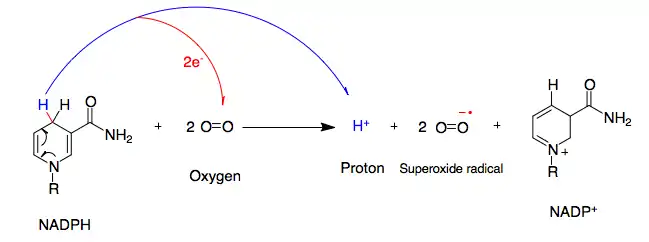
La NADPH oxydase (NOX) est un complexe enzymatique membranaire appartenant à la classe des oxydoréductases (enzymes de classe I). C'est l'enzyme clé de l'explosion oxydative, où elle catalyse la réaction d’oxydation du NADPH par l'oxygène O2, ce qui produit du NADP+, de l'H+ et de l'O2−. Ces deux derniers réagissent ensuite sous l'action de la superoxyde dismutase pour former du peroxyde d'hydrogène H2O2, lequel réagit enfin sous l'action de la myéloperoxydase avec un proton H+ et un ion chlorure Cl− pour donner de l'acide hypochloreux HOCl et une molécule d'eau H2O[1].
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Ce complexe enzymatique permet donc la synthèse de dérivés réactifs de l'oxygène mais augmente également l'activité des peptidases[2].
Chez l'humain, on connaît sept variantes de la NADPH oxydase : NOX1, 2, 3, 4, 5, et DUOX1 et 2, ces variantes ont toutes une fonction spécifique au sein de l’organisme (cf "rôles physiologiques").
Chez les champignons, il existe trois variantes de la NADPH Oxydase : NoxA (homologue de Nox1), NoxB (homologue de Nox2) et NoxC.
Distribution dans le vivant
On trouve ce complexe enzymatique chez les animaux, chez les plantes[3], où il régule la croissance des cellules, et chez les champignons, où il agit comme déclencheur de différentes phases du développement du mycélium[4].
Les cellules phagocytaires, en particulier les neutrophiles et les macrophages, contiennent en grande quantité la NADPH oxydase NOX2, aussi appelée par conséquent NADPH oxydase du phagocyte. NOX2 est l'isoforme historiquement le plus étudié et le mieux connu de la famille. Les caractéristiques générales des NADPH oxydases données dans cet article sont basées sur ce prototype.
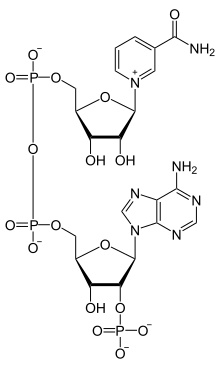
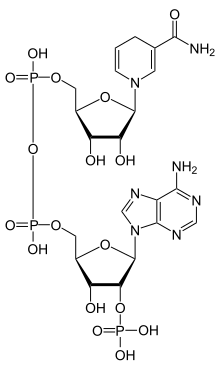
Coenzyme : NADP+/NADPH
Le nicotinamide adénine dinucléotide phosphate (NADP) est un coenzyme utilisé notamment dans les réactions d’anabolisme. Il provient principalement de la phase oxydative de la voie des pentoses phosphates.
Ce coenzyme, sous forme réduite NADPH, peut être oxydé par l’oxygène moléculaire O2 en NADP+ sous l’action de la NOx. Ceci aboutit à la formation de ROS (O2.-, H2O2, HOCl).
Rôles physiologiques
NOX1 et 4 interviennent dans la synthèse de l’angiotensine II (au niveau du rein).
NOX2 intervient dans le phénomène de la phagocytose.
NOX3 a un rôle dans la biosynthèse des organes otolithiques (au niveau de l'appareil vestibulaire).
NOX5 intervient dans l’angiogénèse et l’apoptose.
DUOX1 et 2 sont des éléments clés dans la synthèse des hormones thyroïdiennes (au niveau de la glande thyroïde).
Rôles en phytopathologie
NOX A et B interviennent dans la formation des appressoriums et des sclérotes.
Description de l’enzyme
Localisation
A l'échelle de la cellule, le complexe fonctionnel NADPH oxydase (NOX2) est localisé différemment selon la fonction cellulaire dans laquelle il est impliqué. Il sera par exemple au niveau de la membrane des phagolysosomes (issus de la fusion entre un phagosome et un lysosome dans les macrophages) ou des phagosomes (neutrophiles), lors de la phagocytose ce qui contribuera à la destruction du corps phagocyté. L'activation peut aussi avoir lieu à la membrane plasmique, en particulier dans le cas des processus inflammatoires.
Sous-unités
La NADPH oxydase est composée de six sous-unités se regroupant pour former le complexe enzymatique au niveau de la membrane plasmique du phagolysosome. Cette association permet l'oxydation du NADPH en NADP+, ce qui aboutit à la synthèse de ROS[5].
Le cytochrome b558
Le cytochrome b558 est intégré à la membrane, constitué de deux sous-unités : p22phox et Nox2.
Dans les neutrophiles au repos, la plupart du cytochrome b558 est concentré dans les granules spécifiques. Lors de l’activation du neutrophile, les granules fusionnent avec la membrane du phagosome.
Rap 1A
Rap 1A est une petite protéine G de 22 kDa, très abondante dans les neutrophiles. Les petites protéines G lient le GTP (guanosine triphosphate) / GDP (guanosine diphosphate). Elles sont actives lorsqu’elles sont liées à une molécule de GTP. Rap1A est associée au cytochrome b558 dans les neutrophiles. Sous sa forme active (liée au GTP), Rap1A se fixe plus étroitement au cytochrome b558. Le rôle de Rap1A n’a pas encore été clairement élucidé. Elle pourrait être un régulateur de la NADPH oxydase.
Sous-unité p47phox
La sous-unité p47phox assure la fonction « d’organisateur » ou « d’adaptateur » en permettant la translocation de p67phox et p40phox à la membrane.
Sous-unité p67phox
Le facteur p67phox est « l’activateur » du complexe oxydase. Son association au cytochrome b558 est essentielle à l’activité oxydase.
Sous-unite p40phox
Plus récemment, l’importance de p40phox dans la production de O2.- (ion superoxyde)a été confirmée dans le cadre d’une activation induite par phagocytose via le récepteur FcγR . Dans ces conditions, la protéine p40phox n’est pas primordiale dans le processus d’assemblage mais plutôt dans la régulation de l’activité après assemblage complet au niveau du phagosome.
Sous-unité Rac
La protéine Rac, membre de la famille des petites GTPases, est un élément essentiel à l’activité oxydase lorsqu’elle est sous sa forme liée au GTP.
Il y association directe entre Rac et le cytochrome b558. Au repos, Rac est cytoplasmique et associée à une protéine RhoGDI (GDP dissociation inhibitor) qui la maintient sous forme inactive liée au GDP. L’activation du neutrophile induit la dissociation de RhoGDI, permettant l'échange du GDP par un GTP, convertissant Rac dans une conformation active, permettant sa translocation à la membrane.
Implications dans des pathologies
L'activité des NOX, quand insuffisante, peut être à l'origine de pathologies telles que les inflammations chroniques, les maladies cardio-vasculaires et diverses maladies liées au vieillissement (arthrose)
Concernant NOX 1, 4 et 5, les données concernant la physiopathologie sont fragmentaires mais on suspecte leur rôle dans l’hypertension.
Une déficience concernant NOX 2 peut entrainer une granulomatose septique chronique (syndrome d'immunodéficience héréditaire)
NOX 3 est impliquée dans des pathologies du système vestibulaire.
DUOX 1 et 2 impliquées dans des pathologies thyroïdiennes[8] (hypothyroïdie congénitale).
Notes et références
- Borel Jacques Paul, Biochimie dynamique, De Boeck Université, 1997, 2-8041-2453-3, p644
- (en) Melissa J. Grimm, R. Robert Vethanayagam, Nikolaos G. Almyroudis, David Lewandowski, Nicole Rall, Timothy S. Blackwell et Brahm H. Segal, « Role of NADPH oxidase in host defense against aspergillosis », Medicam Mycology, vol. 49, no supplément 1, , p. 144-149 (PMCID PMC5494985, DOI 10.3109/13693786.2010.487077, lire en ligne, consulté le )
- http://www.tsl.ac.uk/research/jonathan-jones/pdf/5829.pdf, consulté le 14/05/2012
- http://apsjournals.apsnet.org/doi/pdf/10.1094/MPMI-03-13-0064-R, consulté le 29/09/2013
- Laure Carrichon, Régulation de l’activité NADPH oxydase phagocytaire Mécanismes moléculaires de la super-activité oxydase du cytochrome b558 D-loopNox4-Nox2, Université Joseph Fourier, Chimie et Sciences du Vivant, année 2009, lire en ligne, consulté le 13/05/2012
- http://www.lcp.u-psud.fr/IMG/pdf/JScientifiques2008_MarieErard_NADPHoxidase-3.pdf, consulté le 13/05/2012
- http://www.springerlink.com/content/21080030k414003l/, consulté le 24/05/2012
- http://cat.inist.fr/?aModele=afficheN&cpsidt=22120081, consulté le 13/05/2012