Superoxyde dismutase
Les superoxydes dismutases (SOD) sont des métalloprotéines qui sont également des oxydoréductases catalysant la dismutation des anions superoxyde O2•– en oxygène O2 et peroxyde d'hydrogène H2O2 :
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Cette enzyme intervient dans l'explosion oxydative et est également une composante essentielle du mécanisme d'élimination des radicaux libres. Elle est présente dans presque tous les organismes aérobies. Une des rarissimes exceptions est Lactobacillus plantarum et les Lactobacillus apparentés, qui n'en possèdent pas et utilisent un mécanisme enzymatique alternatif.
Cofacteurs métalliques
Les superoxyde dismutases sont des métalloprotéines caractérisées par le métal (cuivre Cu et zinc Zn, manganèse Mn, fer Fe ou nickel Ni) contenu dans leur site actif. Les superoxyde dismutases à cuivre-zinc [1] et les superoxyde dismutases à nickel [2] constituent des classes distinctes des superoxyde dismutases à fer et à manganèse. Ces deux dernières possèdent en effet des séquences protéiques et des structures tridimensionnelles très proches[3]. Certaines protéines de cette dernière famille sont cambialistiques, c'est-à-dire qu'elles acceptent dans leur site actif du fer ou du manganèse tout en conservant leur activité enzymatique[4].
Réaction catalytique
La dismutation du superoxyde catalysée par les SOD peut être écrite à l'aide des deux demi-réactions ci-dessous :
- M(n+1)+ − SOD + O2•– ⟶ Mn+ − SOD + O2
- Mn+ − SOD + O2•– + 2H+ ⟶ M(n+1)+ − SOD + H2O2.
où M = Cu (n = 1), Mn (n = 2), Fe (n = 2).
Considérant ces équations, tout élément métallique impliqué dans un couple redox monoélectronique, dont le potentiel d'oxydo-réduction à pH physiologique est compris entre les potentiels[5] des réactions d'oxydation (-0,33V, en dioxygène) et de réduction (+0,89V en peroxyde d'hydrogène) du superoxyde peut être employé au sein d'une SOD. Bien que ces cations métalliques (excepté le fer(II)) ne possèdent pas un potentiel approprié à l'état libre, la coordination d'atomes donneurs issus de certaines chaînes latérales de la protéine (i.e. histidine, cystéine, aspartate) au centre métallique influe sur le potentiel redox de l'élément métallique, permettant ainsi la catalyse de la réaction de dismutation du superoxyde.
Dans l'enzyme à cuivre et zinc, le zinc n'a pas de rôle catalytique mais un rôle structural.
Les SOD chez les êtres vivants
La localisation chez les êtres vivants des différents types de SOD est discutée dans cette section.
Chez les procaryotes
Les bactéries photosynthétiques possèdent une Fe-SOD cytoplasmique. Les bactéries sulfato-réductrices sont généralement dotées d'une Fe-SOD périplasmique et d'une superoxyde réductase dans le cytoplasme. Les bactéries anaérobies facultatives ou aérobies possèdent des Fe-SOD ou des Mn-SOD généralement dimériques. Certaines de ces espèces peuvent posséder les deux protéines. E. coli, lorsqu'elle est cultivée en condition anaérobie exprime uniquement la Fe-SOD[6]. En revanche en présence de dioxygène, les Mn-SOD et Fe-SOD sont exprimées. Dans les bactéries Gram négatives, la Mn-SOD est inductible et est associée avec l'ADN[7]. La Fe-SOD est une protéine constitutive localisée à proximité de la paroi cellulaire. Les sites actifs de la Mn-SOD et de la Fe-SOD contiennent le même type de chaînes latérales et ont quasiment la même structure.
Une CuZn-SOD existe également chez les bactéries Gram négatives. Elle est localisée dans le périplasme sous forme monomérique ou dimérique selon les espèces. En condition standard de culture, la CuZn-SOD ne représente que 1 à 5 % de l'activité SOD totale. Elle protégerait la bactérie des effets du superoxyde exogène[8].
Chez les eucaryotes
Le cytosol de presque toutes les cellules eucaryotes contient la forme à cuivre-zinc de la SOD (CuZn-SOD)[9]. L'enzyme à Cu-Zn est un homodimère de poids moléculaire de 32 500 daltons.
Les deux sous-unités interagissent principalement par des mécanismes hydrophobes et électrostatiques. Les ligands du cuivre sont quatre chaînes latérales d'histidine. Les ligands du zinc sont constitués de trois chaînes latérales d'histidine et d'une chaine latérale d'acide aspartique. Une particularité de cet ensemble est l'existence d'une chaine latéral d'histidine liant des deux ions métalliques.
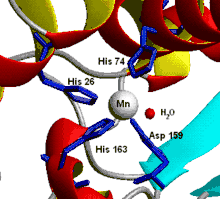
Les mitochondries des cellules eucaryotes, et beaucoup de bactéries contiennent une SOD à manganèse (Mn-SOD)[10]. Les ligands du manganèse sont trois chaines latérales d'histidine, une chaine latérale d'aspartate et une molécule d'eau ou un ion OH− suivant l'état d'oxydation du manganèse (respectivement II et III).
Chez les plantes
Les plantes sont les seuls eucaryotes à disposer des trois types de SOD. Il n'a pas été observé de SOD extracellulaire végétale, suggérant que le stress oxydant présent dans les plantes est principalement généré lors de la photosynthèse ou de la respiration. Une Mn-SOD est présente dans la matrice mitochondriale sous forme dimérique ou tétramérique suivant les espèces. Il est possible de trouver, selon les espèces, des isoformes de la Mn-SOD dans le peroxysome et le glyoxysome. Une CuZn-SOD dimérique est présente dans le cytosol. Une CuZn-SOD tétramérique est exprimée dans le chloroplaste chez la plupart des espèces bien que dans certains cas, ce soit une Fe-SOD qui y soit exprimée.
Chez l'homme
Il y a coexistence de trois formes de SOD chez l'homme. Il existe deux types de CuZn-SOD. Le premier type (SOD1) est une protéine dimérique se trouvant dans le cytoplasme et dans l'espace intermembranaire mitochondrial. Le deuxième type de CuZn-SOD (SOD3) est une protéine extracellulaire tétramèrique. Cette protéine a la capacité de se lier à la surface des membranes cellulaires ou dans le collagène de type I, elle protège les cellules du stress oxydant exogène. La Mn-SOD (SOD2) est située dans la matrice mitochondriale mais également sur la paroi interne des mitochondries les protégeant du stress oxydant généré par l'ensemble de la chaîne impliquée dans la respiration cellulaire. Les gènes correspondant aux SOD1-3 se trouvent respectivement dans les chromosomes 21, 6 et 4 (21q22.1, 6q25.3 et 4p15.3-p15.1).
Physiologie
Le radical-anion superoxyde O2•– dismute spontanément en O2 et H2O2 mais, dans les conditions physiologiques, la vitesse de cette réaction bimoléculaire est faible et le temps de vie du superoxyde est suffisamment long pour qu'il puisse soit oxyder des composants des macromolécules biologiques (acides nucléiques, protéines …), soit générer d'autres espèces réactives oxygénées bien plus toxiques que le superoxyde lui-même (telles que le peroxynitrite en réagissant avec le monoxyde d'azote ou le radical hydroxyle en réagissant avec le H2O2).
L'efficacité enzymatique des SOD est donc un point essentiel dans leur action physiologique. La CuZn-SOD a la plus grande constante catalytique connue pour une enzyme (kcat=~109 M-1 s-1). La réaction entre la CuZn-SOD et le superoxyde n'est limitée que par la diffusion du superoxyde vers le site actif de l'enzyme. Les autres SOD sont légèrement moins efficaces (kcat=~108 M-1 s-1).
Dans les conditions normales, la SOD réduit efficacement la concentration de superoxyde dans les tissus vivants, limitant la toxicité du superoxyde.
Mutations
L'importance physiologique des SOD a été mise en évidence à l'aide d'études réalisées sur des lignées de souris génétiquement modifiées dans lesquelles un des types de SOD a été inactivé.
Effets des mutations :
- Les souris dépourvues de SOD1 (CuZn-SOD cytosolique) développent une grande quantité de pathologies parmi lesquelles des cancers du foie, une accélération de la perte de masse musculaire liée a une apparition précoce de sclérose latérale amyotrophique (SLA), une incidence précoce de la cataracte et une espérance de vie réduite.
- Les souris dépourvues de SOD2 (Mn-SOD) meurent quelques jours après la naissance dans des conditions de stress oxydant massif.
- Les souris dépourvues de SOD3 ne présentent, par contre, pas d'anomalie physiologique.
Les mutations sur la CuZnSOD cytosolique sont les seules causes connues à ce jour de la sclérose latérale amyotrophique familiale (FALS) ou maladie de Charcot[11]. Cette maladie neurodégénérative se caractérise par la destruction progressive des neurones moteurs et entraîne la mort des patients cinq ans en moyenne après l'apparition des premiers symptômes.
Médecine
| orgotéïne | |
| Informations générales | |
|---|---|
| Princeps |
|
| Classe | Anti-inflammatoires et antirhumatismaux, autres anti-inflammatoires non stéroïdiens, ATC code M01AX14 |
| Administration | injection intra-articulaire, installation vésicale[12], injection intracaverneuse[13] |
| Identification | |
| No CAS | |
| No ECHA | 100.029.936 |
Induction en réponse au stress oxydant
La superoxyde dismutase est induite dans diverses pathologies associées au stress oxydant, dont l'obésité (durant la jeunesse)[14].
Pathologies caractérisées par une surexpression de l'enzyme
La SOD étant localisée sur le chromosome 21, son expression est augmentée dans la trisomie 21 aboutissant à un syndrome de Down. Contrairement à ce qui a été postulé, l'hyperactivité de la SOD chez les personnes atteintes ne semble pas causer de troubles de santé associés au syndrome de Down[15] qui implique d'autres gènes.
Sensibilité à certains champs électromagnétiques
Les utilisateurs d'appareils à soudure par points (de plus en plus remplacés par des robots-soudeurs dans l'industrie de la construction métallique, automobile et aéronautique notamment) ne voient pas leurs taux d'antioxydant sanguin diminuer[16], mais à l'intérieur de leurs globules rouges, le taux de superoxyde dismutase chute de -22% (on a aussi constaté que la glutathion peroxydase ou GPX chute elle aussi, un peu moindrement : de -12,3%[16]. Une corrélation significative est démontrée avec l'intensité du champ magnétique. Ce type de champs électromagnétique (ELF-MF) pourrait donc dégrader l'activité antioxydante des globules rouges et agir comme un stress oxydant (même aux niveaux d'exposition recommandés)[16].
Utilisation cosmétique potentielle
Une étude[17] décrit une utilisation possible de la CuZn-SOD pour réduire le stress oxydant subi par la peau, par exemple pour réduire la fibrose causée par les traitements radiologique du cancer du sein. Toutefois, cette étude n'est que préliminaire, en raison de limitations du protocole expérimental (pas de double aveugle, ni de groupe placébo).
Notes et références
- (en) I Bertini, S Mangani et MS Viezzoli, « Structure and properties of copper-zinc superoxyde dismutases. », Adv. Inorg. Chem., vol. 45, , p. 127-250.
- (en) SB Choudhury, JW Lee, G Davidson, YI Yim, K Bose, ML Sharma, SO Kang, DE Cabelli et MJ Maroney, « Examination of the nickel site structure and reaction mechanism in Streptomyces seoulensis superoxide dismutase. », Biochemistry, vol. 38, no 12, , p. 3744-3752 (PMID 10090763, DOI 10.1021/bi982537j).
- (en) WC Stallings, KA Pattridge, RK Strong et MI Ludwig, « Manganese and iron superoxide dismutases are structural homologs. », Journal of Biological Chemistry, vol. 259, no 17, , p. 10695-10699 (PMID 6381489)
- (en) B Meier, D Barra, F Bossa, L Calabrese et G Rotilio, « Synthesis of either Fe or Mn-superoxide dismutase with an apparently identical protein moity by an anaerobic bacterium dependent of the metal supplied. », Journal of Biological Chemistry, vol. 257, no 23, , p. 13977-13980 (PMID 7142189)
- potentiels à pH = 7, 25 °C, et contre l'électrode standard à hydrogène
- Fe-SOD d'E. coli: PDB 1ISA, EC 1.15.1.1.
- (en) HM Steinman, L Weinstein et M Brenowitz, « The manganese superoxide dismutase of E. coli K-12 associates with DNA. », Journal of Biological Chemistry, vol. 269, no 46, , p. 28629-28634 (PMID 7961811)
- (en) A Battistoni, F Pacello, AP Mazzetti, C Capo, JS Kroll, PR Langford, A Sansone, G Donnarumma, P Valenti et G Rotilio, « A Histidine-rich metal binding domain at the N terminus of Cu,Zn-Superoxyde Dismutases from pathogenic bacteria. A novel strategy for metal chaperoning. », Journal of Biological Chemistry, vol. 276, no 32, , p. 30315-30325 (PMID 11369756, DOI 10.1074/jbc.M010527200)
- La CuZn-SOD qui est disponible comme produit commercial est purifiée à partir des globules rouges bovins : PDB 1SXA, EC 1.15.1.1).
- La Mn-SOD mitochondriale humaine : PDB « 1N0J »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), EC 1.15.1.1.
- (en) HX Deng, A Hentati, JA Tainer, Z Iqbal, A Cayabyab, WY Hung, ED Getzoff, P Hu, B Herzfeldt, RP Roos, C Warner, C Deng, E Soriano, C Smyth, HE Parge, A Ahmed, AD Roses, RA Hallewell, MA Pericak-Vance et T Siddique, « Amyotrophic lateral sclerosis and structural defects in Cu,Zn superoxide dismutase. », Science, vol. 261, no 5124, , p. 1047-1051 (PMID 8351519, DOI 10.1126/science.8351519)
- (en) Marberger H, Huber W, Bartsch G, Schulte T, Swoboda P, « Orgotein: a new antiinflammatory metalloprotein drug evaluation of clinical efficacy and safety in inflammatory conditions of the urinary tract », Int Urol Nephrol, vol. 6, no 2, , p. 61-74. (PMID 4615073)
- (en) Gustafson H, Johansson B, Edsmyr F, « Peyronie's disease: experience of local treatment with Orgotein », Eur Urol, vol. 7, no 6, , p. 346-8. (PMID 7286003)
- (en) S Sfar, R Boussoffara, MT Sfar et A Kerkeni, « Antioxidant enzymes activities in obese Tunisian children. », Nutr J, vol. 12, no 1, , p. 18 (PMID 23360568, DOI 10.1186/1475-2891-12-18)
- (en) JF Turrens, « Increased superoxide dismutase and Down's syndrome. », Med Hypotheses, vol. 56, no 6, , p. 617-619 (PMID 11399108, DOI 10.1054/mehy.2001.1327)
- Akbar Sharifian, Marjan Gharavi, Parvin Pasalar et Omid Aminian, « Effect of extremely low frequency magnetic field on antioxidant activity in plasma and red blood cells in spot welders », International Archives of Occupational and Environmental Health, vol. 82, no 2, , p. 259–266 (ISSN 1432-1246, PMID 18504600, DOI 10.1007/s00420-008-0332-2, lire en ligne, consulté le )
- F. Campana, Topical superoxide dismutase reduces post-irradiation breast cancer fibrosis, J. Cell. Mol. Med., 2004, 8(1), 109-116. « Texte en accès libre - PDF 333kB »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
Annexes
Bibliographie
- (en) Barry Halliwell & John Gutteridge, Free Radicals in Biology and Medicine, Oxford University Press, USA, 1999.
- (en) Fridovich I (1986). Superoxide dismutases. Adv. Enzymol. Relat. Areas Mol. Biol. 58: 61-97.
Liens externes
- (en) 147450 (SOD1), (en) 147460 (SOD2), (en) 185490 (SOD3) and (en) 105400 (ALS)
- (en) The ALS Online Database
- (en) Un aperçu de la littérature scientifique concernant les SOD
- Discussion de rôle des SOD dans le vieillissement.