Électrode standard à hydrogène
L'électrode standard à hydrogène (ESH) est l'électrode de référence absolue. Elle ne peut être réalisée en pratique. La réalisation pratique de l'ESH est l'électrode normale à hydrogène ou ENH.
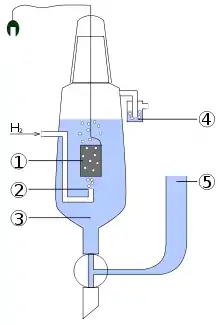
L'ESH est une électrode où a lieu la réaction d'oxydation suivante :
- H2 ⇔ 2 H+ + 2 e−
Cette réaction est réalisable mais l'ESH implique les suppositions suivantes :
- aH+ = aH2 = 1
- γH+ = γH2 = 1
Où a représente l'activité chimique des différentes espèces et γ leur coefficient d'activité.
Ces suppositions reviennent donc à considérer que, pour réaliser une ESH, la réaction d'oxydation du dihydrogène devrait avoir lieu avec :
- une pression partielle PH2 égale à 1 bar ;
- une concentration en H+ égale à 1 mol.L−1 ;
- le dihydrogène se comportant comme un gaz parfait ;
- le coefficient d'activité du proton γH+ égal à 1 ;
Les deux premiers critères peuvent être vérifiés. On obtient alors une électrode normale à hydrogène. Les deux seconds critères ne peuvent être vérifiés. C'est pourquoi l'ESH ne peut être réalisée.
Le caractère à part de l'ESH vient de la convention thermodynamique suivante. On a fixé arbitrairement le potentiel chimique standard des protons en solution comme étant nul à toute température : μH+ = 0.