Infarctus du myocarde
L'infarctus du myocarde (IDM étant une abréviation courante) est une nécrose (mort de cellules) d'une partie du muscle cardiaque secondaire due à un défaut d'apport sanguin (ischémie) dans le cadre de la maladie coronarienne. En langage courant, on l'appelle le plus souvent une « crise cardiaque » ou simplement infarctus. Il se produit quand une ou plusieurs artères coronaires se bouchent, les cellules du myocarde (le muscle constituant le cœur) irriguées par cette (ou ces) artère(s) ne sont alors plus oxygénées, ce qui provoque leur souffrance (douleur ressentie) et peut aboutir à leur mort (cicatrice de l'infarctus qui persistera habituellement). La zone « infarcie » ne se contractera plus correctement.
| Causes | Tabagisme |
|---|---|
| Symptômes | Douleur thoracique, nausée, angine de poitrine, œdème et nécrose |
| Médicament | Ténectéplase, métoprolol, bisoprolol, pindolol, anisindione (en), acébutolol, diltiazem, eptifibatide, propranolol, labetalol, Daltéparine (en), (S)-(−)-timolol, nadolol, aténolol, esmolol, tirofiban, sulfinpyrazone (en), penbutolol (en), streptokinase, anistreplase (en), préparation parmaceutique à base de nitroglycérine (en), vérapamil, carvedilol, esatenolol (d) et urokinase (d) |
|---|---|
| Spécialité | Cardiologie |
| CISP-2 | K75 |
|---|---|
| CIM-10 | I21-I22 |
| CIM-9 | 410 |
| OMIM | 608557 |
| DiseasesDB | 8664 |
| MedlinePlus | 000195 |
| eMedicine |
155919 emerg/327ped/2520 |
| MeSH | D009203 |
| Patient UK | Acute-myocardial-infarction |
![]() Mise en garde médicale
Mise en garde médicale

Historique
Les conséquences d'une ligature expérimentale d'une artère coronaire chez l'animal ont été décrites pour la première fois dans les années 1890[1]. La corrélation entre l'occlusion de la coronaire et l'infarctus chez l'être humain est évoqué dès 1892[2].
La première unité de soins intensifs de cardiologie ouvre aux États-Unis au début des années 1960, permettant de prendre en charge les infarctus et les complications rythmologiques immédiates[3].
Les fibrinolytiques ont d'abord été employés par voie endocoronarienne à la fin des années 1970[4], puis par voie intraveineuse dans les années 1980[5]. À la même époque, l'ajout d'aspirine se révèle particulièrement efficace[6]. Dans les années 1990, l'angioplastie coronaire précoce montre sa supériorité par rapport à la fibrinolyse[7].
Dans le post-infarctus, l'intérêt des inhibiteurs de l'enzyme de conversion date du début des années 1990[8].
Épidémiologie
En Angleterre, entre les années 1978 et 1980, une étude démontre que le nombre d'infarctus du myocarde décroit très sensiblement (près de 60 % en 25 ans), probablement du fait de l'amélioration de la prise en charge des facteurs de risque cardiovasculaire[9].
En Europe le nombre d'hospitalisations pour infarctus varie entre 90 et 312 par 100 000 habitants et par année suivant le pays, les infarctus « ST + » comptant pour un peu moins de la moitié[10]. Le nombre atteint 219 par 100 000 habitants en 2005 aux États-Unis, dont 77 « ST + »[11].
Une étude rétrospective pour les patients admis dans un service moderne d’accueil des urgences en Afrique subsaharienne, à Dakar, pour l'infarctus du myocarde montre que pour les 24 mois entre et , 77 % étaient des hommes. L’âge moyen des patients était de 59 ans. Les auteurs notent[12] : « les données statistiques concernant les urgences cardiovasculaires en général sont peu disponibles dans les pays en développement. Les rares études en Afrique subsaharienne montrent une prévalence de 5 à 8 % dans la population hospitalière, celle-ci restant faible malgré une légère augmentation notée ces dernières années. »
Anatomie et terminologie
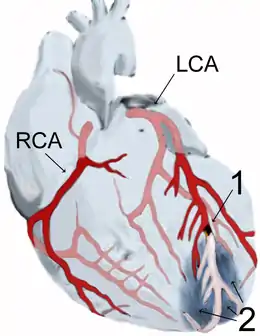
Il existe deux artères coronaires : l'artère coronaire droite et l'artère coronaire gauche. Cette dernière est à l'origine de deux grandes branches (inter-ventriculaire antérieure et circonflexe). Elles donnent d'autres branches d'importance inégale. Ces artères irriguent (apportent du sang oxygéné) chacune des différentes zones du cœur. La notion d'infarctus est ainsi variable, en fonction de (ou des) artère(s) touchée(s) et de l'importance de la souffrance du tissu musculaire cardiaque (myocarde).
Suivant la topographie
Suivant l'extension anatomique, on distinguait classiquement les infarctus « transmuraux », c'est-à-dire intéressant la totalité de l'épaisseur du muscle cardiaque (myocarde), des non trans-muraux, ces derniers étant séparés en « rudimentaire » et en « sous-endocardiques » (intéressant la partie interne du myocarde, au contact du sang des cavités). Cette distinction a été mise en correspondance avec les différents types de présentation sur l'électrocardiogramme (ECG) :
- l'infarctus transmural correspondant à la présence d'une onde Q large et profonde ;
- l'infarctus sous-endocardique correspondant à un sous décalage du segment ST ;
- l'infarctus rudimentaire correspondant à une onde T négative.
Cette correspondance anatomo-électrocardiographique, très en vogue dans les années 1970-80, s'est révélée être très souvent erronée et n'est plus utilisée dans les publications internationales.
De même, on distinguait les infarctus « antérieurs » ou « antéroseptaux », les « postérodiaphragmatiques », les « inférobasaux » sur des critères uniquement électrocardiographiques en supputant une correspondance bijective avec l'artère lésée. Cette relation est cependant loin d'être absolue et cette terminologie est également progressivement abandonnée.
Actuellement, la classification des infarctus repose uniquement sur des critères électrocardiographiques sans préjuger de l'atteinte réelle anatomique. On distingue ainsi :
- les infarctus avec élévation du segment ST (STEMI) (correspondant à peu près aux anciens « infarctus avec onde Q » ) ;
- les infarctus sans élévation du segment ST (NSTEMI) (correspondant à peu près aux anciens « infarctus sans onde Q » ).
Le territoire de l'infarctus est nommé suivant la topographie des signes électrocardiographiques : un infarctus antérieur correspond à un infarctus dont l'onde Q est visible dans les dérivations situés « en avant » (V1-V2-V3) et non pas à un infarctus intéressant la partie antérieure du myocarde (même si c'est souvent le cas).
On distingue ainsi :
- les infarctus antérieurs (en V1-V2-V3 sur l'ECG) ;
- les infarctus inférieurs (en D2, D3 et VF) ;
- les infarctus postérieurs (en V7-V8-V9) ;
- les infarctus apicaux (V4, V5 et V6) ;
- les infarctus latéraux (D1, VL).
Suivant le temps
Un infarctus « aigu » arrive à l'hôpital avant la douzième heure du début de la douleur : le problème essentiel est alors de déboucher l'artère coronaire pour sauvegarder le maximum de muscle cardiaque.
Un infarctus subaigu ou « semi-récent » arrive au-delà de la douzième heure. Le problème n'est plus la désobstruction de l'artère responsable, l'essentiel des dégâts étant déjà fait, mais d'éviter les complications.
Suivant le mécanisme ou le mode de présentation
Cette classification est essentiellement un outil de travail à visée épidémiologique. Elle a été définie en 2007 par un panel d'experts internationaux[13]. Elle classe les infarctus en cinq types :
- Infarctus sur lésion d'une ou plusieurs coronaires ;
- Infarctus sur ischémie myocardique sans lésion d'une coronaire (spasme, thrombose…) ;
- Mort subite ;
- Infarctus conséquence d'une complication d'une angioplastie (la thrombose d'un stent étant catégorisée en 4b) ;
- Infarctus conséquence d'une complication d'un pontage aorto-coronarien.
Un type particulier survient lorsqu'une prise en charge médicale rapide permet, d'une manière ou d'une autre, une désobstruction de l'artère coronaire suffisamment rapide pour qu'il n'y ait aucune séquelle, voire, aucune augmentation des enzymes myocardiques signant l'absence, de fait, de nécrose. On parle alors d'infarctus avorté[14].
Syndrome coronarien aigu
L'infarctus du myocarde à la phase aigüe fait partie des syndromes coronariens aigus, c'est-à-dire à un ensemble de symptômes nécessitant une hospitalisation en urgence pour une douleur thoracique très fortement suspecte d'être d'origine coronarienne. Ces syndromes sont classés en fonction de l'aspect électrocardiographique au départ : les « syndromes ST + » comportent un sus décalage du segment ST (« onde de Pardee (de) ») et correspondent à un infarctus avec onde Q en cours de constitution. Les « syndromes ST - » n'ont pas de sus décalage du segment ST et correspondent soit à un infarctus sans onde Q, soit à un angor instable en l'absence d'élévation significative des enzymes cardiaques. La distinction entre « syndromes ST + » et « ST - » n'est pas qu'académique car elle impose une prise en charge différente, du moins dans les premières heures.
Mécanismes de l'occlusion
L'oblitération d'une artère coronaire obéit, schématiquement, à deux mécanismes :
- la formation d'un thrombus, la formation d'un « caillot » de sang par les plaquettes qui s'agrègent, libèrent des substances thrombogènes et déclenchent des réactions en chaîne, le plus souvent au niveau de plaque(s) d'athérome préexistante(s) — l'athérome étant un dépôt qui cause l'occlusion de l'artère ;
- le spasme coronaire, réduction brutale de la lumière artérielle liée à la vasomotricité des artères, comme dans une crise d'asthme où le calibre des bronches s'auto-réduit spontanément.
Les deux mécanismes s'associent et s'auto-entretiennent, chacun renforçant l'activité de l'autre. C'est la forme la plus habituelle de l'occlusion coronaire.
Mais il existe des formes « pures », spastiques, la plus « classique » étant le Prinzmetal, sus-décalage de ST caractéristique sur l'électrocardiogramme (ECG), à condition de pouvoir enregistrer l'ECG au bon endroit, au bon moment. L'enregistrement ECG continu (Holter ECG) est ici un précieux outil, toujours à condition que le spasme se produise pendant l'examen.
À côté de cette affection anciennement décrite, existent des infarctus parfaitement authentifiés, ne s'accompagnant pas du sus-décalage bien connu. Infarctus à coronaires normales, saines en coronarographie (radiographies des artères coronaires) ou par endoscopie intracoronaire, technique moins usuelle qui consiste à monter une sorte de caméra — un appareil à ultrasons microéchographe — à l'intérieur des artères coronaires.
Ces deux formes requièrent des traitements différents (pour ne pas dire opposés).
Dans tous les cas, survient alors une occlusion de l'artère coronaire, plus ou moins complète et, surtout, plus ou moins prolongée, provoquant une ischémie (souffrance cellulaire par défaut d'apport en d'oxygène) du territoire myocardique. Au-delà d'un temps évalué à quatre heures, se produira la mort des cellules musculaires du cœur. Plus l'ischémie persiste, plus la nécrose s'étendra et plus la zone infarcie s'étendra.
Outre la prise en compte du facteur temps dans la gestion de cette urgence médicale, la nécessité absolue d'une analyse minutieuse, pointilleuse de l'examen de référence, l'électrocardiogramme (ECG) comprenant au moins 12 dérivations (12 « angles de vision » de l'activité électrique du cœur), dont l'enregistrement doit être d'excellente qualité (parfois gênée par l'angoisse, bien légitime, d'une personne souffrante), permettra d'affirmer l'ischémie myocardique, si possible avant constitution de la nécrose, et permettra d'en reconnaître le mécanisme dont dépendra l'attitude thérapeutique.
Facteurs de risque et prévention
Facteurs de risque
Les facteurs de risque essentiels aujourd'hui reconnus sont ceux de l'athérome :
- l'âge ;
- le sexe (masculin) ;
- l'hérédité (infarctus dans la famille) ;
- le tabac (ou le tabagisme passif) ;
- l'excès de cholestérol ;
- le diabète ;
- l'hypertension artérielle.
D'autres facteurs sont associés statistiquement avec le risque de faire un infarctus sans qu'il existe une démonstration forte de causalité (entre autres que la suppression du facteur entraîne une diminution du risque) :
- l'exposition à de l'air pollué (particules, HAP…) et notamment à la pollution routière[15] ;
- le stress au travail est une cause qui a été confirmée en 2012 par les conclusions d'une étude ayant porté sur près de 200 000 travailleurs européens (23 % du risque d’infarctus en cas d’exposition à un stress au travail par rapport aux personnes non exposées)[16] ;
- la sédentarité[17] ;
- l'insomnie augmenterait le risque de faire un infarctus du myocarde[18] mais il n'est pas prouvé que traiter cette insomnie soit susceptible d'en diminuer le risque.
Prévention
Le seul moyen d'inverser le cours de la maladie est d'adopter un mode de vie sain[19] :
- une alimentation à base d'aliments complets d'origine végétale ;
- une activité physique d'endurance régulière (marche rapide, vélo) pour un total de 3 heures par semaine ;
- arrêter le tabagisme le cas échéant.
Alimentation
Les fruits et légumes protègent le cœur et les vaisseaux sanguins. Grâce à leur richesse en antioxydants et en fibres alimentaires, les fruits et les légumes préviennent l'oxydation du cholestérol afin d'empêcher l'apparition de maladies cardiovasculaires, premières causes de mortalité dans de nombreux pays développés. Selon l'étude scientifique internationale Interheart publiée le , les personnes ayant une alimentation riche en fruits et en légumes « ont 30 % de risque en moins de subir une crise cardiaque que celles en consommant pas ou peu »[20].
Activité physique
Une hygiène de vie adaptée avec un régime riche en fibre et la pratique quotidienne d'une activité physique permettent de réduire le risque d'accident cardiovasculaire et notamment d'infarctus du myocarde[21].
Arrêt du tabagisme
Le tabagisme est à l’origine des principaux facteurs[22] de risque de maladie cardiovasculaire. Arrêter de fumer[23] permet de réduire les risques.
Aspirine
En prévention primaire, la prise quotidienne de très petite quantité d'aspirine, qui favoriserait la fluidité du sang par son effet antiagrégant plaquettaire (AAP), ne réduit pas la mortalité cardiovasculaire, et notamment le risque d'infarctus du myocarde, tout en majorant le risque hémorragique associé[24] - [25] - [26].
L'aspirine garde néanmoins un intérêt majeur dans les suites d'un infarctus en prévention secondaire.
Diagnostic à la phase aigüe
Symptômes
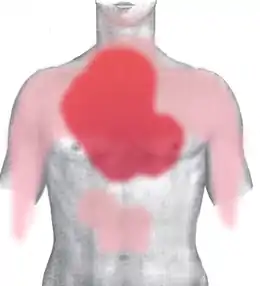

Le symptôme est la douleur thoracique. Elle concerne la région rétrosternale (en arrière du sternum). Elle est violente, habituellement intense (sensation « d'étau broyant la cage thoracique »), prolongée et non (ou peu) sensible à la trinitrine (la trinitrine soulage les douleurs d'angine de poitrine). Elle est dite pan-radiante, irradiant dans le dos, la mâchoire, les épaules, le bras gauche, la main gauche et l'épigastre (estomac). Elle est angoissante, oppressante (difficultés à respirer). Une activité physique ou un stress émotionnel sont parfois retrouvés comme facteur déclenchant[27].
Cette description correspond à la forme typique et caractérisée. En pratique, toutes les variations existent, jusqu’à l'infarctus asymptomatique (sans douleur, sans gêne respiratoire, sans angoisse, ou encore sans malaise). L'infarctus du myocarde étant découvert à l'occasion d'un électrocardiogramme « systématique », par exemple lors d'un bilan de santé.
Sur le plan symptomatique, il existe des formes dites plus trompeuses, douleurs limitées à une (ou à des) irradiation(s), des formes particulières, digestives à type de douleurs épigastriques (région de l'estomac), abdominales hautes, des formes où prédominent telle ou telle manifestation (par exemple vagale, avec sueurs, malaise, sensation de chaleur, éructations), des formes limitées à une oppression angoissante, des formes dominées par une complication ; malaises, mort subite, œdème pulmonaire (essoufflement aigu inexpliqué), choc cardiogénique (pouls et tension imprenables), tamponnade (compression du cœur par un épanchement), troubles du rythme (palpitations, malaise), des formes psychiatriques (brutale désorientation), fièvre isolée.
Devant toute manifestation dont on ne possède pas la certitude du diagnostic et/ou chez des personnes dont les facteurs de risques sont prédominants, effectuer un électrocardiogramme (ECG) permet de confirmer ou d'infirmer le diagnostic d'infarctus du myocarde.
En 1991, Bernadine Healy, une cardiologue américaine définit le syndrome de Yentl. Elle met en évidence la différence de prise en charge et de suivi des femmes. Les symptômes des femmes sont ignorés ou mal interprétés, la recherche médicale s'étant principalement intéressée aux patients de sexe masculin[28].
Signes physiques
L'examen d'un patient présentant un infarctus non compliqué est pauvre en signes cliniques. C'est l'interrogatoire qui fait l'essentiel du diagnostic, l'examen clinique ne permettant que d'éliminer certains diagnostics ou de dépister des complications.
On peut parfois percevoir, à l'auscultation cardiaque, un bruit dit de galop (trouble du remplissage du ventricule), un frottement traduisant un épanchement péricardique (tunique qui entoure le cœur). Mais ce n'est pas une péricardite habituelle (inflammation en règle virale et bénigne du péricarde, structure qui entoure le cœur et lui permet d'avoir des mouvements de contraction).
Signes de gravité
On peut les classer en plusieurs catégories :
Liés au terrain :
- l'âge ;
- le diabète (risque accru de choc cardiogénique) ;
- maladie grave associée.
Liés à la dysfonction cardiaque :
- infarctus étendu (diagnostic électrique - sur l'électrocardiogramme) ;
- insuffisance cardiaque ;
- œdème pulmonaire ;
- choc cardiogénique.
Liés à des complications mécaniques de l'infarctus :
- tamponnade (compression du cœur par un épanchement) ;
- communication interventriculaire ;
- rupture de paroi (latérale ou autre) ;
- insuffisance valvulaire aigüe (insuffisance mitrale par dysfonction ou rupture de pilier).
Liés à un trouble du rythme (tachycardie ventriculaire) ou de la conduction (blocs atrioventriculaires).
Il existe des scores tenant compte de plusieurs paramètres et qui sont corrélés avec l'évolution de la maladie. L'un des plus utilisés est le score GRACE (Global Registry for Acute Coronary Events : registre global des évènements coronariens aigus)[29]. Il prend en compte l'âge du patient, la fréquence cardiaque, la pression artérielle à l'arrivée, la fonction rénale, la présence ou non de signes d'insuffisance cardiaque (classe Killip), ainsi que certaines circonstances péjoratives (arrêt cardiaque).
Électrocardiogramme

L'interprétation d'un électrocardiogramme (ECG) n'est pas chose aisée. On s'attache à étudier l'ensemble de l'ECG et à rechercher, au sein des 12 dérivations minimales, des signes concordants d'ischémie myocardique.
Concordants veut dire : signes concernant, selon les 12 dérivations minimales - les « angles de vue » du fonctionnement électrique du cœur — un ou plusieurs territoires de la même paroi irriguée par une artère coronaire.
L'infarctus ne touche qu'exceptionnellement l'ensemble du cœur (infarctus circonférentiel, d'évolution en règle rapidement fatale).
Les douze dérivations minimales — ces « angles de vue » — explorent des zones du cœur différentes : paroi antérieure, septum interventriculaire, paroi latérale, paroi inférieure (ou inférobasale), ventricule droit. Ces douze dérivations sont regroupées, plusieurs dérivations (2 ou 3) explorant, de manière un peu différente (l'angle de vue n'est pas tout à fait le même) une paroi du cœur.
S'il y a ischémie, il doit exister une (ou des) zone(s) - topographiques - qui souffrent. L’aspect électrique de ces zones ischémiques contraste avec l'aspect des zones restées saines, non concernées par le processus, car irriguées par une autre artère ou irrigués par des branches de l'artère lésée, ces branches naissant en amont de l'occlusion coronaire. Cette souffrance est concordante, retrouvée dans une partie des douze dérivations.
Le diagnostic de l'ECG permet donc une approche topographique. Il s'agit d'authentifier la zone ischémique mais la correspondance ECG - lésion anatomique est loin d'être constante.
En pratique, il y a un « centre » (zone où l'ischémie est la plus profonde) et des « zones adjacentes d'extension », connues, selon l'anatomie des ventricules (ventricule gauche en règle, le plus important en tant que masse et du point de vue fonctionnel) et l'anatomie des artères coronaires.
Les descriptions électriques « classiques » s'attachent à l'étude :
- Des complexes QRS (correspondant à la contraction des ventricules) ;
- De la repolarisation (correspondant à la relaxation (« repos ») des Ventricules, pendant laquelle ils se remplissent « passivement ») : segment ST, onde T.
Schématiquement : Les modifications induites par l'ischémie concernent la repolarisation : « troubles de la repolarisation » :
- sus-décalage du segment ST ;
- sous-décalage du segment ST, inversion ou positivation excessive de l'onde T.
Les modifications induites par la nécrose concernent les complexes QRS avec apparition d'ondes Q (plus grande qu'un tiers d'un autre QRS et qu'1 mm). Attention, l'onde Q peut être le résultat d'un infarctus ancien ou refléter l'activité d'un Septum Inter-Ventriculaire important (ou hypertrophié).
Dosage des enzymes cardiaques
L'augmentation des enzymes cardiaques est le signe de la mort cellulaire ayant pour conséquence la nécrose et fait donc partie de la définition d'un infarctus. L'enzyme la plus spécifique et sensible est la troponine (I ou T) dont le dosage tend à supplanter celui des CPK-MB (fraction MB de la Créatine phosphokinase).
L'importance de l'élévation enzymatique est proportionnelle à l'importance de l'infarctus (on parle d'infarctus avec « pic de troponine » à 10 µg/L, par exemple). La répétition des dosages permet d'en suivre l'évolution.
D'autres enzymes s'élèvent également au cours d'un infarctus mais sont bien moins spécifiques (une augmentation peut se retrouver dans d'autres maladies, cardiaques ou non) et leur utilisation en tant que marqueur tend à être abandonné. Ce sont les SGOT, les SGPT, les LDH.
Prise en charge de l'infarctus
Premiers secours
Le diagnostic d'infarctus du myocarde est d'ordre médical. Celui-ci échappe donc en principe à la compétence du secouriste ou du témoin sauveteur, à qui il apparaîtra soit comme un malaise, soit comme un arrêt cardiaque (mort subite). Dans le cas d'un malaise, il ne faut pas se hasarder à un pseudo-diagnostic : une personne peut avoir un infarctus du myocarde sans ressentir les signes typiques (ni douleur thoracique, ni douleur dans la mâchoire rayonnant dans le bras gauche), et à l'inverse, une personne peut ressentir ces signes sans qu'elle fasse un infarctus du myocarde. Dans tous les cas, tout malaise doit être considéré comme pouvant évoluer vers une urgence vitale et nécessite une prise de contact avec un médecin, qui établira un diagnostic.
Pour un malaise :
- on met la personne au repos dans la position où elle se sent le mieux, on propose dans ce cas la position allongée ;
- on la questionne sur ce qu'elle ressent, les circonstances de survenue du malaise (notamment depuis combien de temps), les antécédents (est-ce la première fois qu'elle ressent ce malaise, prend-elle des médicaments, a-t-elle été hospitalisée) ;
- on prévient la régulation médicale : « 112 » dans l'Union européenne (remplace le « 100 » en Belgique mais ne remplace pas le « 15 ou le 18 » en France), le « 144 » en Suisse, le « 911 » au Canada, (voir Numéro d'appel d'urgence) en transmettant le maximum d'informations ;
- on revient surveiller la victime et on applique les conseils donnés par la régulation médicale ;
- dans le cadre du prompt secours : mise sous inhalation de dioxygène avec un débit de 12 L/min pour un adulte.
Pour un arrêt cardiaque :
- on protège si nécessaire ;
- on prévient immédiatement les secours (comme ci-dessus) ;
- on pratique la réanimation cardiopulmonaire en attendant les secours ;
- utilisation d'un défibrillateur automatique externe si disponible.
Traitement hospitalier et préhospitalier
Il s'agit d'une urgence médicale. L'hospitalisation doit être faite en unités spécialisées (en France : USIC ou unités de soins intensifs cardiologiques) disposant de matériels de réanimation et d'une surveillance de paramètres vitaux en continu (électrocardiogramme). L'une des complications précoces est la survenue d'un trouble du rythme ventriculaire (tachycardie ou fibrillation) imposant une prise en charge urgentissime avant la survenue d'un arrêt cardiorespiratoire prolongé.
Le patient est mis au repos strict, avec une perfusion veineuse. Un scope de surveillance électrocardiographique est mis en place. Un traitement par antiagrégants plaquettaires (clopidogrel[30], ou, de plus en plus, Ticagrelor [31] en association avec l'aspirine) est institué, en plus de la mise sous médicaments anticoagulants (héparine en continu ou en fractionné). La sédation de la douleur peut nécessiter le recours aux morphiniques. La mise sous un dérivé nitré en perfusion est habituelle.
La mise sous oxygène doit être discutée suivant les cas, une utilisation systématique de ce dernier n'ayant pas prouvé de bénéfices et pouvant même être délétère[32].
L'attitude vis-à-vis des artères coronaires dépend essentiellement du type de l'infarctus selon l'aspect électrocardiographique initial avec sus décalage du segment ST ou sans sus-décalage.
Infarctus avec sus-décalage du segment ST
Il s'agit alors d'un syndrome coronarien aigu « ST + » dont l'évolution peut se faire vers un infarctus avec onde Q. La prise en charge de ce type d'infarctus a fait l'objet de la publication de plusieurs recommandations, dont celle de l'European Society of Cardiology a été actualisée en 2012[33].
L'électrocardiogramme est, en règle, typique, et il n'est pas besoin d'attendre les résultats de la biologie (augmentation des enzymes myocardiques) pour en faire le diagnostic.
Outre la prise en charge de la douleur et d'éventuelles complications, le problème crucial est de déboucher le plus rapidement possible (au mieux dans les quatre premières heures) la (ou les) artère(s) coronaire(s) concernée(s). Plus la désobstruction de l'artère coronaire responsable est précoce, moins il y aura de séquelles. En France, toute suspicion d'infarctus (en pratique douleur thoracique prolongée) doit conduire à l'appel immédiat de la régulation médicale du SAMU via le 15 ou le 112 (voir Numéro d'appel d'urgence) pour une prise en charge la plus rapide possible.
Deux méthodes sont employées pour désobstruer une artère :
- soit par un traitement « médical », utilisant des produits qui visent à détruire (« lyser ») le thrombus (caillot de sang) obstruant l'artère ; c'est la « thrombolyse/fibrinolyse » (injection par simple voie intraveineuse) - comme lors d'une prise de sang - d'un médicament qui va dissoudre le caillot dans l'artère. Cette thrombolyse peut être faite sur le lieu même de prise en charge de l'infarctus, c'est-à-dire, bien avant l'arrivée en milieu hospitalier (thrombolyse préhospitalière). Le produit fibrinolytique le plus utilisé est les différentes formes de Tpa (Tissue plasminogen activator) ;
- soit désobstruction « instrumentale » par angioplastie, en introduisant, au cours d'une coronarographie (radiographies des artères coronaires) un microcathéter dans l'artère pour dilater la (ou les) lésion(s) responsable(s). Le geste est le plus souvent associé à la mise en place d'un stent (ressort), dans l'artère. La pratique d'une angioplastie nécessite cependant une hospitalisation dans un centre spécialisé. Le taux de réussite du geste est supérieur à celui de la fibrinolyse[34]. On parle d' angioplastie primaire ce geste fait au décours immédiat d'un infarctus. L'angioplastie peut être précédée d'une aspiration visant à évacuer le maximum du thrombus occlusif. Cette thromboaspiration a une efficacité discutée sur le pronostic[35] - [36].
Le choix entre ces deux méthodes dépend essentiellement de leur disponibilité (proximité d'un centre pratiquant l'angioplastie). Elles sont complémentaires, une angioplastie en urgence pouvant être proposée en cas d'échec de la fibrinolyse (jugée sur la persistance de la douleur et des anomalies sur l'électrocardiogramme), permettant alors une meilleure chance d'évolution favorable[37]. Par contre, le recours systématique à une angioplastie en urgence, quel que soit le résultat de la fibrinolyse, n'a pas démontré d'intérêt[38].
Une angioplastie secondaire de l'artère responsable, c'est-à-dire faite quelques jours après la survenue de l'infarctus, semble avoir un certain intérêt au niveau pronostic[39]. Par contre, si l'infarctus est vu tardivement et que l'artère est toujours occluse, une désobstruction systématique par angioplastie ne semble pas bénéficiable en l'absence d'ischémie myocardique prouvée[40].
Parfois, ces mesures peuvent s'avérer en effet partiellement voire totalement inefficaces (multiplicité des artères coronaires concernées, étendue des obstructions, obstruction complète infranchissable, siège particulier et/ou caractère anatomique des lésions). Un ou plusieurs pontages aorto-coronariens peuvent être alors proposés, idéalement un peu à distance de l'infarctus.
Infarctus sans sus-décalage du segment ST
La prise en charge de l'infarctus dit « ST- » a fait l'objet de la publication de recommandations, dont celles de l'American college of Cardiology et de l'American Heart Association ont été mises à jour en 2013[41].
Les signes électrocardiographiques sont moins typiques et le diagnostic doit être étayé par une augmentation du taux des enzymes myocardiques dans le sang. Il n'y a pas, classiquement, d'indication à une tentative de désobstruction urgente par fibrinolyse ou par angioplastie primaire.
Une angioplastie secondaire systématique semble en améliorer le pronostic[42].
Après l'hospitalisation
La prévention secondaire des syndromes coronariens aigus peut se résumer par l'acronyme BASIC : Bêta-bloquants[43], Antiagrégants plaquettaires (AAP), Statines, IEC et Contrôle des facteurs de risque.
Médicaments
La médication prescrite à la sortie du patient peut varier selon la situation clinique. Toutefois, cinq classes de médicaments apparaissent comme des standards dans le traitement post-infarctus.
Acide acétylsalicylique (Aspirine)
L'acide acétylsalicylique devrait normalement être prescrit chez tous les patients ayant subi un infarctus, sauf si une contre-indication est présente. La dose est comprise entre 75 et 160 mg, une fois par jour, et sa prescription doit être à vie. Par son effet antiagrégant plaquettaire, elle réduit le risque d'une nouvelle occlusion d'une artère coronaire. En Amérique du Nord, la dose est généralement de 80 ou 81 mg puisque le médicament est disponible à cette dose. En cas de problème (allergie, rarissime, ou intolérance), il peut être remplacé par le clopidogrel.
Bêta-bloquants
L'utilisation des bêta-bloquants a été montrée bénéfique quel que soit le type d'infarctus, son ampleur ou les caractéristiques du patient. Ils semblent toutefois encore plus bénéfiques chez les patients ayant fait un infarctus plus grave. Les bêta-bloquants vont aider à diminuer la tension artérielle, mais aussi à réduire la poussée adrénergique sur le cœur et ainsi la consommation d'O2 du myocarde. Ils réduisent ainsi le risque d'un nouvel infarctus ou l'évolution vers l'insuffisance cardiaque. Il semble peu rationnel d'utiliser un bêta-bloquant avec une activité sympathomimétique intrinsèque (ASI). Les molécules les plus étudiées et les plus utilisées sont le metoprolol (12,5 à 100 mg 2 fois par jour en forme régulière) le bisoprolol (1,25 à 10 mg 1 fois par jour) et l'aténolol. Cette médication devrait être prise à long terme.
Inhibiteurs de l'enzyme de conversion de l'angiotensine
Comme les bêta-bloqueurs, les inhibiteurs de l'enzyme de conversion vont aider au contrôle de la tension artérielle, mais ils vont également réduire le remodelage cardiaque, qui peut mener à l'insuffisance cardiaque. Également comme les bêta-bloqueurs, ils devraient être prescrits chez un patient post-infarctus, même si ce dernier a une tension artérielle normale. En cas d'intolérance, ils peuvent être remplacés par un antagoniste des récepteurs de l'angiotensine. Parmi les inhibiteurs de l'enzyme de conversion fréquemment prescrits, on peut citer le ramipril (1,25 à 20 mg 1 fois par jour) ou l'énalapril (2,5 à 40 mg 1 fois par jour). Cette médication devrait être prise à long terme.
Statines
Bien qu'étant données initialement dans le but de faire baisser un niveau de cholestérol sanguin élevé, les statines sont efficaces quelle que soit la valeur de celui-ci dans la réduction du risque de survenue d'un nouvel accident cardiaque. Celles qui ont démontré une baisse des troubles cardiovasculaires sont l'atorvastatine (40 à 80 mg 1 fois par jour au coucher), la simvastatine (40 mg) et la pravastatine (40 mg). Cette médication devrait être prise à long terme.
Clopidogrel
Le clopidogrel, un médicament antiagrégant plaquettaire va également réduire le risque de thrombose, mais par un mécanisme différent de celui de l'aspirine. Il sera combiné avec ce dernier chez les patients ayant été traités par l'implantation d'un stent. La durée du traitement est variable, mais généralement, le patient va recevoir la combinaison aspirine + clopidogrel durant au moins 1 an, l'aspirine étant laissé seul par la suite. Le prasugrel[44] ou le ticagrelor[45], médicaments plus récents, semblent donner des résultats meilleurs que le clopidogrel.
Autres
La lutte contre les facteurs de risque cardiovasculaire est indispensable : arrêt du tabagisme, prise en charge d'un diabète, d'une obésité, mise en place d'une activité physique adaptée... La réhabilitation cardiaque (ou réadaptation) semble, en particulier, diminuer significativement le risque de récidive d'infarctus et la mortalité[46].
En cas de dysfonction ventriculaire sévère, définie par une fraction d'éjection inférieure à 35 %, la pose d'un défibrillateur implantable est recommandée devant le risque important de mort subite[47].
Les oméga 3 provenant des poissons gras pourrait diminuer la mortalité[48].
Complications
La mortalité hospitalière est un peu inférieure à 10 %. L'insuffisance cardiaque survient dans un peu plus de 10 % à la phase aigüe, les chiffres tendant à diminuer actuellement, du fait d'une meilleure prise en charge initiale[49].
La mortalité est essentiellement due à une insuffisance cardiaque, soit secondaire à la taille de l'infarctus, soit, plus rarement, due à une complication mécanique : insuffisance mitrale aigüe par rupture d'un pilier, formation d'une communication entre les cavités droites et gauches cardiaques, tamponnade par fissuration ou rupture de la paroi libre d'un ventricule… À distance de l'épisode aigu, un quart des décès sont consécutifs à une mort subite, même si cette issue tend à devenir moins fréquente[50]. Le risque est d'autant plus important en cas de dysfonction ventriculaire gauche majeure et la pose d'un défibrillateur automatique implantable doit être discutée dans ces cas.
Les troubles du rythme cardiaque sont une complication fréquente.
Notes et références
- (en) Porter WT, On the results of ligation of the coronary arteries, J Physiol, 1893;15:121-121
- (en) Hektoen L. « Embolism of the left coronary artery; sudden death » Med Newsl (Lond) 1892;61:210-210
- (en) WB Fye. « Resuscitating a circulation abstract to celebrate the 50th anniversary of the coronary care unit concept » Circulation 2011;124:1886-93.
- (en) Chazov EI, Mateeva LS, Mazaev AV, Sargin KE, Sadovskaia GV, Ruda MI. « Intracoronary administration of fibrinolysin in acute myocardial infarct » Ter Arkh 1976;48:8-19.
- (en) Gruppo Italiano per lo Studio della Streptochinasi nell'Infarto Miocardico (GISSI) « Effectiveness of intravenous thrombolytic treatment in acute myocardial infarction » Lancet 1986;1:397-402
- (en) Isis-2 Collaborative Group « Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17 187 cases of suspected acute myocardial infarction: Isis-2 » Lancet 1988;2:349-360
- (en) Grines CL, Browne KF, Marco J et al. A comparison of immediate angioplasty with thrombolytic therapy for acute myocardial infarction, N Engl J Med, 1993;328:673-679
- (en) Pfeffer MA, Braunwald E, Moye LA et al. « Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction: results of the Survival and Ventricular Enlargement trial » N Engl J Med. 1992;327:669-77.
- (en) Hardoon SL, Whincup PH, Lennon LT et al. « How much of the recent decline in the incidence of myocardial infarction in british men can be explained by changes in cardiovascular risk factors? Evidence from a prospective population-based study » Circulation 2008;117:598-604.
- (en) Widimsky P, Wijns W, Fajadet J et al. « Reperfusion therapy for ST elevation acute myocardial infarction in Europe: description of the current situation in 30 countries » Eur Heart J. 2010;31:943-57.
- (en) McManus DD, Gore J, Yarzebski J, Spencer F, Lessard D, Goldberg RJ. « Recent trends in the incidence, treatment, and outcomes of patients with STEMI and NSTEMI » Am J Med. 2011;124:40-7.
- Seck M, Diouf I, Acouetey L, Wade KA, Thiam M, Diatta B, « Profil des patients admis pour infarctus du myocarde au service d'accueil des urgences de l'hôpital principal de Dakar [Profile of patients admitted for myocardial infarction at the emergency reception facility of Principal Hospital in Dakar, Senegal] », Med Trop (Mars), vol. 67, no 6, , p. 569-72. (PMID 18300517, lire en ligne [PDF])
- (en) Thygesen K, Alpert JS, White HD, Universal definition of myocardial infarction, Eur Heart J, 2007;28:2525-2538
- (en) Taher T, Fu Y, Wagner GS et al. Aborted myocardial infarction in patients with ST-segment elevation: insights from the Assessment of the Safety and Efficacy of a New Thrombolytic Regimen-3 Trial Electrocardiographic Substudy, J Am Coll Cardiol, 2004;44:38-43
- (en) Peters A, von Klot S, Heier M, Trentinaglia I, Hormann A, Wichmann HE et al. « Exposure to traffic and the onset of myocardial infarction » N Engl J Med 2004;351:1721–1730
- (en) Kivimäki M, Nyberg ST, Batty GD, Fransson EI, Theorell T et al. IPD-Work Consortium, « Job strain as a risk factor for coronary heart disease: a collaborative meta-analysis of individual participant data », Lancet, vol. 380, no 9852, , p. 1491-7. (PMID 22981903, PMCID PMC3486012, DOI 10.1016/S0140-6736(12)60994-5., lire en ligne [html])
- (en) Ford ES, Caspersen CJ, « Sedentary behaviour and cardiovascular disease: a review of prospective studies », Int J Epidemiol, vol. 41, no 5, , p. 1338-53. (PMID 22634869, DOI 10.1093/ije/dys078, lire en ligne [html])
- (en) Laugsand LE, Vatten LJ, Platou C, Janszky I, « Insomnia and the risk of acute myocardial infarction: a population study », Circulation 2011;124:2073–2081.
- Balazs I Bodai, Therese E Nakata, William T Wong et Dawn R Clark, « Lifestyle Medicine: A Brief Review of Its Dramatic Impact on Health and Survival », The Permanente Journal, vol. 22, (ISSN 1552-5767, PMID 29035175, PMCID PMC5638636, DOI 10.7812/TPP/17-025, lire en ligne, consulté le )
- Étude Interheart 20 octobre 2008 (réalisée sur 16 000 personnes), citée dans Le Monde, 23 octobre 2008, page 27.
- Scott A Lear, Weihong Hu, Sumathy Rangarajan et Danijela Gasevic, « The effect of physical activity on mortality and cardiovascular disease in 130 000 people from 17 high-income, middle-income, and low-income countries: the PURE study », The Lancet, vol. 390, no 10113, , p. 2643–2654 (ISSN 0140-6736, DOI 10.1016/s0140-6736(17)31634-3, lire en ligne, consulté le )
- « Usage du tabac | Institut de cardiologie de l'Université d'Ottawa | Centre de la prévention et du mieux-être », sur pwc.ottawaheart.ca (consulté le )
- « OMS | Maladies cardiovasculaires », sur www.who.int (consulté le )
- « Effects of Aspirin for Primary Prevention in Persons with Diabetes Mellitus », New England Journal of Medicine, vol. 379, no 16, , p. 1529–1539 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/nejmoa1804988, lire en ligne, consulté le )
- (en) John J. McNeil, Rory Wolfe, Robyn L. Woods et Andrew M. Tonkin, « Effect of Aspirin on Cardiovascular Events and Bleeding in the Healthy Elderly », New England Journal of Medicine, vol. 379, no 16, , p. 1509–1518 (ISSN 0028-4793 et 1533-4406, PMID 30221597, PMCID PMC6289056, DOI 10.1056/NEJMoa1805819, lire en ligne, consulté le )
- J Michael Gaziano, Carlos Brotons, Rosa Coppolecchia et Claudio Cricelli, « Use of aspirin to reduce risk of initial vascular events in patients at moderate risk of cardiovascular disease (ARRIVE): a randomised, double-blind, placebo-controlled trial », The Lancet, vol. 392, no 10152, , p. 1036–1046 (ISSN 0140-6736, DOI 10.1016/s0140-6736(18)31924-x, lire en ligne, consulté le )
- Smyth A, O’Donnell M, Lamelas P et al. Physical activity and anger or emotional upset as triggers of acute myocardial infarction, Circulation, 2016;134:1059-1067
- « Pour les médecins, les hommes font des crises cardiaques, les femmes des crises d'angoisse », Slate.fr, (lire en ligne, consulté le )
- (en) de Araujo Goncalves P, Ferreira J, Aguiar C, Seabra-Gomes R, TIMI, PURSUIT, and GRACE risk scores: sustained prognostic value and interaction with revascularization in NSTE-ACS, Eur Heart J 2005;26:865-872
- (en) Chen ZM, Jiang LX, Chen YP et al. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial, Lancet, 2005;366:1607-1621
- HAS, Progrès thérapeutique mineur par rapport au clopidogrel dans le syndrome coronaire aigu, décembre 2011
- (en) Cabello JB, Burls A, Emparanza JI, Bayliss S, Quinn T, Oxygen therapy for acute myocardial infarction, Cochrane Database of Systematic Reviews, 2010, Issue 6. Art. No CD007160. DOI 10.1002/14651858.CD007160.pub2
- Steg G, James SK, Atar D, guidelines: ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Eur Heart J, 2012;33:2569-2619
- (en) White HD, Chew DP « Acute myocardial infarction » Lancet 2008;372:570-584
- Kumbhani DJ, Bavry AA, Desai MY, Bangalore S, Bhatt DL, Role of aspiration and mechanical thrombectomy in patients with acute myocardial infarction undergoing primary angioplasty: an updated meta-analysis of randomized trials, J Am Coll Cardiol, 2013;62:1409–1418
- Fröbert O, Lagerqvist B, Olivecrona GK et al. Thrombus aspiration during ST-Segment elevation myocardial infarction, N Engl J Med, 2013;369:1587-1597
- (en) Wijeysundera HC, Vijayaraghavan R, Nallamothu BK et al. Rescue angioplasty or repeat fibrinolysis after failed fibrinolytic therapy for ST-segment myocardial infarction: a meta-analysis of randomized trials, J Am Coll Cardiol, 2007;49:422-430
- (en) Keeley EC, Boura JA, Grines CL, Comparison of primary and facilitated percutaneous coronary interventions for ST-elevation myocardial infarction: quantitative review of randomised trials, Lancet, 2006;367:579-588
- (en) Collet JP, Montalescot G, Le May M et al. Percutaneous coronary intervention after fibrinolysis: a multiple meta-analyses approach according to the type of strategy, J Am Coll Cardiol, 2006;48:1326-1335
- (en) Hochman JS, Lamas GA, Buller CE et al. Coronary intervention for persistent occlusion after myocardial infarction, N Engl J Med, 2006;355:2395-2407
- O'Gara PT, Kushner FG, Ascheim DD et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: A report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines, J Am Coll Cardiol, 2013;61(4):e78-e140.
- (en) Bavry AA, Kumbhani DJ, Rassi AN et al. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized clinical trials, J Am Coll Cardiol, 2006;48:1319-1325
- Sanam Safi, Naqash J. Sethi, Steven Kwasi Korang et Emil Eik Nielsen, « Beta-blockers in patients without heart failure after myocardial infarction », The Cochrane Database of Systematic Reviews, vol. 11, no 11, , p. CD012565 (ISSN 1469-493X, PMID 34739733, PMCID 8570410, DOI 10.1002/14651858.CD012565.pub2, lire en ligne, consulté le )
- Wiviott SD, Braunwald E, McCabe CH et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes, N Engl J Med, 2007;357:2001-2015
- Wallentin L, Becker RC, Budaj A et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes, N Engl J Med, 2009;361:1045-1057
- (en) Lawler PR, Filion KB, Eisenberg MJ, Efficacy of exercise-based cardiac rehabilitation post-myocardial infarction: a systematic review and meta-analysis of randomized controlled trials, Am Heart J, 2011;162:571–584 e572
- (en) Moss AJ, Zareba W, Hall WJ et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction, N Engl J Med, 2002;346:877-883
- Kamalita Pertiwi, Leanne K. Küpers, Janette de Goede et Peter L. Zock, « Dietary and Circulating Long-Chain Omega-3 Polyunsaturated Fatty Acids and Mortality Risk After Myocardial Infarction: A Long-Term Follow-Up of the Alpha Omega Cohort », Journal of the American Heart Association, vol. 10, no 23, , e022617 (ISSN 2047-9980, PMID 34845924, PMCID 9075367, DOI 10.1161/JAHA.121.022617, lire en ligne, consulté le )
- (en) Fox KA, Steg PG, Eagle KA et al. Decline in rates of death and heart failure in acute coronary syndromes, 1999–2006, JAMA, 2007;297:1892-1900
- (en) Selcuk Adabag A, Therneau TM, Gersh BJ, Weston SA, Roger VL, Sudden death after myocardial infarction, JAMA, 2008;300:2022-2029
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ICD9Data.com
- MalaCards
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (de) DocCheck Flexikon
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) ICD-10 Version:2016
- (sv) Internetmedicin
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :