Lactate déshydrogénase
Les lactates déshydrogénases (LDH) ou déshydrogénases lactiques sont des enzymes présentes dans une grande diversité d'organismes, aussi bien végétaux qu'animaux. Elles catalysent la conversion du pyruvate en lactate et vice-versa. Plusieurs types de ces enzymes existent, qui diffèrent suivant la nature du cofacteur de la réaction et le stéréoisomère du lactate formé. Le lactate possède en effet deux isomères D et L et il existe des lactates déshydrogénases capables de former soit l'un soit l'autre des produits.
_1I10.png.webp)
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Le cofacteur le plus fréquent des lactates déshydrogénases est le NADH qui est converti en NAD+. Cette conversion est la réaction de base de la fermentation lactique qui permet de régénérer le NAD+ à l'issue de la glycolyse. Elle intervient dans un grand nombre de biotransformations par des microorganismes et des bactéries lactiques. Certaines lactates déshydrogénases peuvent aussi utiliser le NADPH, voire d'autres cofacteurs comme le cytochrome c.
Chez les mammifères on trouve uniquement la lactate déshydrogénase à NADH qui produit du L-lactate[1]. Elle est également capable de catalyser l'oxydation du 2-hydroxybutyrate et est donc occasionnellement aussi appelée Hydroxybutyrate déshydrogenase (HBD).
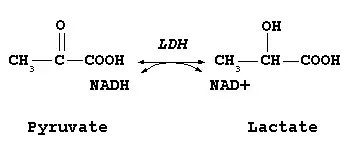
Cet article se focalise sur les lactates déshydrogénases de cette dernière famille (EC 1.1.1.27)
Iso-enzymes
La L-lactate déshydrogénase à NADH est une enzyme tétramérique. Chez les mammifères, chaque sous-unité peut être soit de type H (anglais heart = cœur) ou M (muscle) (sur la base de leur comportement électrophorétique.) Suivant le type d'assemblage formé, Il y a donc cinq isotypes de LDH :
- LDH-1 (4H) - principalement dans le cœur
- LDH-2 (3H1M) - principalement dans le système réticulo-endothélial
- LDH-3 (2H2M) - principalement dans les poumons
- LDH-4 (1H3M) - principalement dans les reins
- LDH-5 (4M) - principalement dans le foie et les muscles squelettiques
En général, la forme prédominante dans le sérum est la LDH-2. Un taux de LDH-1 plus élevé que celui de LDH-2 suggère un infarctus du myocarde (des lésions des tissus cardiaques qui libèrent la LDH cardiaque, qui est riche en LDH-1, dans la circulation sanguine). Le diagnostic, sur la base de ce phénomène, de l'infarctus a toutefois en grande mesure été supplanté par la mesure des taux de troponine I ou T.
Génétique humaine
Les sous-unités H et M sont encodées par deux gènes différents:
- La sous-unité M est encodée par LDHA, situé sur le chromosome 11p15.4 ((en) 150000 )
- La sous-unité H est encodée par LDHB, situé sur le chromosome 12p12.2-p12.1 ((en) 150100 )
Aspects médicaux
Hémolyse
En médecine, la LDH est souvent utilisée comme marqueur de dommage tissulaire. Comme la LDH est abondante dans les globules rouges, elle peut servir de marqueur de l'hémolyse. Un échantillon sanguin qui aurait été traité de façon incorrecte peut avoir des activités élevées faussement-positives de LDH à cause des dommages aux érythrocytes.
Turnover (renouvellement) des tissus
D'autres applications du dosage de l'activité de la LDH concernent la destruction des tissus en général ; cela est possible s'il n'y a pas d'autres indices d'hémolyse. On l'utilise pour le suivi des patients cancéreux (en particulier en cas de lymphome ou de cancer du testicule) : puisque les cellules cancéreuses se renouvellent rapidement, leur destruction entraîne un taux élevé de LDH.
Valeur normale
- Valeur normale de la concentration en LDH plasmatique : 190-390 UI/L
- 125-220 U/L dans bilan sanguin (test pyruvate 37 °C ABBOTT)
Notes et références
- (en) « ENZYME entry: EC 1.1.1.27 », sur enzyme.expasy.org (consulté le )