Cancer du testicule
L'expression « cancer du testicule » regroupe plusieurs types de tumeurs germinales du testicule.
| Médicament | Vinblastine, méthotrexate, actinomycine D, étoposide, bléomycine, cisplatine, (RS)-cyclophosphamide, chlorambucil, plicamycin (en), ifosfamide, phosphate d'étoposide (d), chlorhydrate de doxorubicine (en), étoposide et cisplatine |
|---|---|
| Spécialité | Oncologie |
| CIM-10 | C62 |
|---|---|
| CIM-9 | 186.9 |
| OMIM | 273300 |
| DiseasesDB | 12966 |
| MedlinePlus | 001288 |
| eMedicine |
437966 med/3232 med/863 |
| MeSH | D013736 |
![]() Mise en garde médicale
Mise en garde médicale
C'est un cancer rare (1 % environ de tous les cancers) mais est en augmentation depuis plusieurs décennies. Il est aussi le cancer le plus fréquent chez l'homme de 15 à 35 ans.
Les deux testicules sont rarement touchés simultanément (1 à 2 % des cas), et après guérison d'un cancer du testicule, le risque de développer un cancer sur l'autre testicule est de 2 à 5 % dans les 25 ans.
La chimiothérapie par les sels de platine a depuis les années 1970 considérablement modifié le pronostic de cette maladie ; près de 80 % de ces cancers sont aujourd'hui guéris (tous stades confondus). L'efficacité du traitement étant fonction du type de cancer et de la qualité de la prise en charge, il justifie d'adresser les patients à des centres spécialisés.
Types de cancer du testicule
La plupart des cancers du testicule sont des tumeurs germinales, divisées en deux grands types histopathologiques :
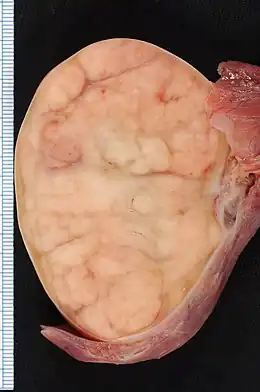
- les séminomes (50 % des cas), qui auraient pour origine une prolifération anarchique de cellules de l'épithélium germinal du tube séminifère. Ils présentent un aspect hypoéchogène et hypovascularisé à l'échographie scrotale). Ils sont radiosensibles et leur pronostic est bon dans 95 % des cas, mais ils nécessitent un suivi du patient. Un leydigome est un séminome induit par prolifération de cellules de Leydig. Le séminome spermatocytaire représente moins de 1 % des cancers du testicule et touche le sujet âgé, avec un pronostic très favorable s'il est soigné[1].
- les cancers non-séminomateux, ou tumeurs germinales non-séminomateuses (TGNS) dont le pronostic est généralement moins bon. Ils présentent un aspect "hypoéchogène" où, dans la plupart des cas, le testicule gauche se développe de 30 % à 80 % environ à partir de l'âge de puberté et se présente comme tumeur « trétragénitale » à l'âge adulte :
- les carcinomes embryonnaires ;
- les choriocarcinomes ;
- les tératomes.
Épidémiologie

Le cancer du testicule reste rare (1 % environ des cancers, 2 % chez l'enfant), mais son incidence comme celle du cancer de la prostate augmente régulièrement depuis les années 1900, et plus nettement dans les pays à peau blanche depuis les années 1950 (augmentation d'un facteur 3 à 5 des années 1950 à 2000)[4]. Les données manquent pour beaucoup de pays en voie de développement, mais ce cancer semble plus rare chez les populations noires africaines et chez les asiatiques que chez les personnes à peau blanche[5], différence qui pourrait être d'origine génétique et/ou liée à l'environnement, à l'alimentation (graisse du lait ou galactose notamment[6], le gras du lait pouvant aussi avoir solubilisé des perturbateurs endocriniens) ou à certains traits culturels.
Il est devenu la tumeur la plus fréquente de l'homme jeune, au moins dans les pays riches à population blanche dominante.
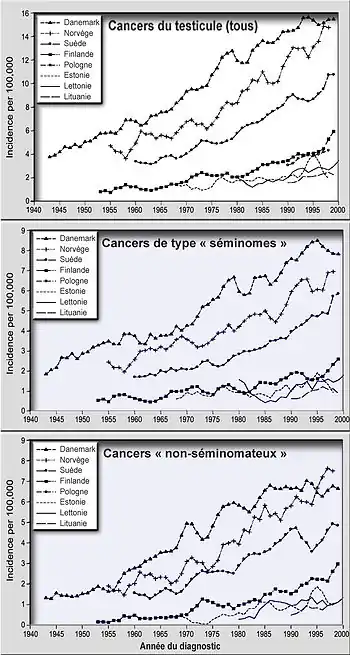
En Europe : Dans tous les pays où il est suivi par un registre[7] du cancer, hormis pour des raisons inexpliquées en Finlande, une fréquence accrue de ce cancer a été confirmée au début des années 1990 en Europe. En Europe, le Danemark semble le plus touché (4 fois plus que la proche Finlande qui compterait parmi les pays les moins touchés, et où la qualité du sperme semble la meilleure)[8].
En Europe, il présente un gradient Ouest-Est dans les régions baltes, et un gradient Nord-Sud en Europe occidentale. Le record serait norvégien (prévalence en augmentation et deux fois plus élevée qu'en Suède [9], elle-même plus touchée que la Finlande (Une étude norvégo-suédoise (en cours à ) vise à rechercher d'éventuels facteurs génétiques) [9]. Son incidence a doublé dans plusieurs pays, dont en France de 1970 à 2000, dans toutes les régions où un suivi épidémiologique existait[10]. Les urologues français B. Boillot et R. Moalic[11] estiment que le nombre des tumeurs testiculaires pré-pubertaires augmente en France depuis plusieurs décennies (comme celles de l'adulte). L'incidence de ces deux cancers (pré- et post-pubertaire) réunis augmente de 3,4 % par an depuis 30 ans (alors que l'incidence des tumeurs non séminomateuses a diminué chez l'adulte de plus de 55 ans) ;
La croissance régulière et documentée depuis les années 1950 de l'incidence du cancer du testicule (TC) dans les pays développé connaît une exception temporelle : Cette incidence semble avoir été nettement moins rapide pour les hommes nés durant la Seconde Guerre mondiale ou juste avant ou juste après, a constaté une étude norvégienne[12] publiée en 2005. Cette étude rétrospective a montré - sans vouloir tirer des conclusions définitives - qu'au vu des données disponibles, le poids moyen de la mère au moment de l'accouchement était (entre 1935 et 1955) corrélé au risque moyen de futur cancer du testicule pour les garçons nés à la même époque. Une explication pourrait être que le taux d'insuline augmente avec le poids de la mère, ce qui diminue le taux d’hormones se liant à la globuline, et par suite rend les œstrogènes plus biodisponibles pour un transfert transplacentaire. Ils ont alors chez le fœtus mâle une action de perturbateur endocrinien.
Le poids maternel pourrait donc augmenter le risque de cancer des testicules, voire de troubles hormonaux chez l'enfant mâle ainsi exposé in utero à une dose anormalement élevée d'œstrogènes lors du premier trimestre de la grossesse.
En Europe du Nord (cf. graphique ci-contre) la fréquence des séminomes et cancers non-séminomateux augmentent à la même vitesse (+ 2,6 % à + 4,9 % au cours de la période d'étude), avec de faibles différences entre les séminomes et tumeurs non séminomateuses, ce qui laisse supposer qu'ils ont au moins pour partie les mêmes causes[2] - [13] et que ces causes pourraient être en partie au moins les mêmes que celles de la délétion de la spermatogenèse[14]. Dans ces pays, les taux d'incidence (pour tous les cancers, comme pour les séminomes et tumeurs non séminomateuses, pris séparément) dépendait principalement de la cohorte de naissance plutôt que du moment où le diagnostic a été fait, mais avec d'importantes différences géographiques, ce qui laisse penser que des facteurs environnementaux sont en cause[2]. D'autres indices, nombreux, plaident donc pour des causes environnementales. 2 002 nouveaux cas ont été enregistrés en 2005 et son incidence a augmenté de 2,5 % sur la période 1980-2005 [4] - [15] et tout particulièrement pour les cancers de l'enfant, une exposition à des perturbateurs endocriniens ou à des produits cancérigènes in utero. Dans ce cas, ce cancer est un des éléments du Syndrome de dysgénésie testiculaire[14].
Incidence
Il survient le plus souvent entre 20 et 40 ans, mais il existe trois pics de fréquence du cancer du testicule ;
- dans les premières années de la vie (avant 5 ans) et à la puberté. En France, 1 à 2 % des tumeurs solides du jeune enfant sont des cancers testiculaires ; Le jeune enfant représente 5 % des cancers du testicule si on n'inclut pas l'adolescence dans la période dite de l'enfance, et 0,5 % si on inclut cette période. Ces tumeurs augmentent un peu moins vite que chez l'adulte, mais néanmoins significativement (+ 1,3 % par an), ce qui est un indice de cause commune, probablement à un ou plusieurs stades utérins de développement des testicules. À la différence des tumeurs testiculaires de l'adulte qui nécessitent une ablation chirurgicale du testicule (orchidectomie) 29 à 48 % des tumeurs testiculaires prépubertaires sont moins malignes et permettent une chirurgie conservatrice. Un facteur associé de risque est une cryptorchidie (mais ce risque est plus associé au cancer de l'adulte qu'à celui de l'enfant prépubère) ;
- après la puberté, ce sont les cas les plus fréquents (fréquence maximale entre 25 et 35 ans) ;
- après 60 ans (plus rarement).
En 2008, le taux de patients opérés, standardisé à la population mondiale en 2008 était de 6,7 pour 100 000. Une augmentation annuelle moyenne de 2,5 % du taux était observée[16].
En France
L'InVS a produit en 2011 une étude[17] sur les cancers du testicule (pour la période 1998 - 2008[16]) : depuis le milieu du XXe siècle, « l'incidence du cancer du testicule n’a cessé d’augmenter », augmentant en France de 2,5 % par an (pour 1980 - 2005). Les patients sont surtout des hommes de 20 à 64 ans, avec un âge moyen au diagnostic de 37 ans. En 2008, le nombre de cas opérés était de 6,7 pour 100 000. De fortes disparités régionales sont constatées mais non expliquées[16].
Une augmentation annuelle moyenne de 2,5 % du taux de ce cancer était observée, avec une forte disparité régionale observée (2004-2008), mais non expliquée, l'Alsace, Lorraine, Bretagne et Pays de la Loire étant les régions les plus touchées, au contraire du Languedoc-Roussillon et Île-de-France (les 2 régions les moins touchées)[16]. « L’augmentation du taux de patients opérés pour cancer du testicule observée est cohérente avec les analyses de tendances de l’incidence nationale[16]. »
L'InVS a aussi produit en 2011[18] une étude sur les malformations congénitales du petit garçon en France (pour la période 1998 - 2008). Ces malformations sont associées à une augmentation du risque de cancer du testicule. Le nombre d'interventions chirurgicales pour hypospadias (1,2 % des opérations) et cryptorchidies (1,8 % des opérations) chez le petit garçon de moins de 7 ans augmente en France métropolitaine (pour la période 1998 - 2008)[19].
L'InVS travaille aussi un bilan de la situation actuelle de la fertilité masculine et des malformations urogénitales chez l’homme en France (cryptorchidies et hypospadias) et sur les cancers du testicule opérés, qui devait être publiée en .
Facteurs de risque
Certains sont clairement identifiés (mais non expliqués). Ce sont :
- la cryptorchidie, qui multiplierait le risque de survenue d'un cancer du testicule par 3,6, à 5,2 selon les études, or les cryptorchidie et hypospadias sont nettement plus fréquentes en Europe et aux États-Unis : + 65 à 77 % au cours des dernières décennies au Royaume-Uni, pour la cryptorchidie ; et doublement des hypospadias en 10 ans (de 1970 à 1980) aux États-Unis[20] - [21].
Une étude[22] portant sur les facteurs de risques pour 131 cas de cancers des testicules (chez des hommes de moins de 40 ans) a confirmé à un risque (ici multiplié par 5) en cas de cryptorchidie à la naissance, mais elle a mis en évidence deux nouveaux facteurs de risque : six mères de patients avaient reçu un traitement hormonal durant leur grossesse (contre un seul pour les mères du groupe-témoin), et huit mères de patients contre deux mères du groupe-témoin avaient signalé des nausées excessives comme complication de la grossesse. Les auteurs pensent que ces trois facteurs traduisent le fait qu'un excès relatif de certaines hormones (œstrogène notamment) au moment de la différenciation des testicules pourrait favoriser la cancérisation future de ces cellules ;
- le cancer controlatéral ;
- le syndrome de Klinefelter, qui est caractérisé par plusieurs anomalies chromosomiques traduites une morphologie eunuchoïde, gynécomastie et petits testicules chez l'adulte ou l'adolescent ;
- l'atrophie testiculaire ou orchite ourlienne (complication rare des oreillons) ;
- des antécédents familiaux (risque 6 à 10 fois plus élevé pour un frère atteint de ce même cancer)[23] ;
- une infertilité[24] ;
- le tabagisme ;
- un poids élevé de la mère durant la grossesse[12] ;
- une exposition in utero au diéthylstilbestrol ou à d'autres perturbateurs endocriniens ou à un traitement hormonal de la mère ;
Symptômes
Le mode de découverte le plus fréquent est l'augmentation du volume d'une bourse à cause d'une masse intra-testiculaire. Le plus souvent la masse est indolore, ce qui peut en retarder le diagnostic de plusieurs mois[25].
Parfois le diagnostic est porté sur une masse abdominale ou un signe en rapport avec des métastases cérébrales (convulsions, troubles de la conscience, céphalées)[26].
La sécrétion de βHCG[26] par la lésion peut entraîner un gonflement des glandes mammaires (gynécomastie) présentes aussi chez l'homme.
Le diagnostic des cancers du testicule étant le plus souvent tardif, ce qui entraîne des traitements plus lourds, il est conseillé aux adolescents à partir de 14 ans de réaliser au moins une fois par mois, une autopalpation des testicules. Cet examen est particulièrement recommandé lorsqu'il y a un antécédent de cryptorchidie ou de cancer du testicule chez un proche (père ou frère)[27] - [28].
Examens complémentaires
En cas de découverte d'une masse testiculaire, le premier examen proposé est l'échographie des testicules qui a une sensibilité proche de 100%[29].
Le dosage des marqueurs tumoraux n'est utile que dans le bilan d'extension mais pas dans le diagnostic : l'alpha-fœtoprotéine n'est pas élevé dans les séminomes et de manière très inconstantes dans les autres tumeurs[30]. I la cure chirurgicale est complète, le taux des marqueurs (HCG totale, alpha-fœtoprotéine, lactate deshydrogenase) doit se normaliser.
Diagnostic
Le diagnostic de cancer est porté après l'ablation du testicule suspect. Cet acte chirurgical, dit « orchidectomie », est pratiqué par la voie inguinale. Il vise à empêcher la propagation de cellules cancéreuses et les métastases. Une orchidectomie unilatérale n'a pas de conséquence sur la fertilité ou sur le taux sanguin de testostérone. La mise en place d'une prothèse peut être proposée.
On distingue parmi les différents types de cancer du testicule les séminomes purs des autres tumeurs. Les séminomes sont de meilleur pronostic. La présence de métastases au diagnostic diminue les chances de guérison.
La biopsie de la masse intra-testiculaire n'est pas utilisée dans la procédure diagnostique.
Lorsque le diagnostic de cancer est confirmé, un bilan d'extension est demandé pour recherche d'éventuelles métastases ganglionnaires ou viscérales. Le bilan comportera un scanner du thorax, abdomen et pelvis et dans certains cas un scanner ou IRM cérébral. La mesure des marqueurs tumoraux comme HCG, AFP et LDH font aussi partie du bilan d'extension de la maladie.
Anatomopathologie
_nodal_metastasis.jpg.webp)
_nodal_metastasis.jpg.webp)
Lésions précancéreuses
- Néoplasie testiculaire intra épithéliale : ces lésions sont susceptibles d'entrainer l'apparition d'un cancer du testicule. Le risque est de 50 % à 5 ans.
Tumeurs germinales du testicule
95 % des cancers du testicule sont des tumeurs germinales. Parmi celles-ci ; 60 % ont un contingent cellulaire unique et 40 % sont des tumeurs mixtes. La prise en charge est nettement différente pour les séminomes purs et pour les autres tumeurs dites tumeurs germinales non-séminomateuses ou TGNS)
Les séminomes représentent 40 à 50 % des tumeurs.
Les tumeurs germinales non séminomateuses (TNGS) représentent 50 à 60 % des tumeurs. Ce sont :
- carcinome embryonnaire ;
- tumeur du sac vitellin (Yolk sac tumeur);
- tératome
- choriocarcinome.
Le risque de métastase est faible en cas de tératome, majeur en cas de choriocarcinome.
À ce groupe se rattachent toutes les tumeurs séminomateuses associées à une augmentation du taux d'alpha-fœtoprotéine (αFP) qui seront traitées également comme des tumeurs non-séminomateuses.
Les tumeurs mixtes - très fréquentes - seront aussi traitées comme des TGNS.
Parmi les tumeurs à contingent cellulaire unique, le séminome représente 30 % des cancers du testicule, le carcinome embryonnaire 3 %, le tératome 2,7 %, le choriocarcinome 0,03 % et les tumeurs du sac vitellin 2,4 %. Les tumeurs mixtes les plus fréquentes associent carcinome embryonnaire et tératome ± séminome, carcinome embryonnaire et sac vitellin ± séminome, carcinome embryonnaire et séminome, tumeur du sac vitellin et tératome ± séminome, choriocarcinome et toute autre histologie.
Tumeurs non germinales du testicule
Les autres tumeurs primitives, non germinales sont les tumeurs à stroma gonadique :
- tumeur à cellules de Leydig
- tumeur à cellules de Sertoli
- tumeurs de la granulosa.
On observe également comme dans tous les autres organes des lymphomes du testicule et des sarcomes.
Classification et pronostic
La classification pronostic des tumeurs du testicule est complexe. Elle définit le pronostic de la maladie et le choix d'une stratégie thérapeutique sur les bases suivantes :
- type histologique (« séminome purs » versus « tumeur germinale non séminomateuse » (TGNS)), sachant que l'élévation de l'aFP dans un séminome oblige à le traiter et considérer comme une TGNS ;
- tumeur limitée au testicule ou étendue au-delà.
Cela défini quatre sous groupes pour lesquels on utilisera des facteurs pronostics spécifiques :
- Les séminomes purs limités au testicule :
Ce sont les formes de meilleur pronostic, pour lesquels les seuls facteurs de risque de rechute reconnus sont la taille de la tumeur (> 4 cm) et l'atteinte du rete testis.
- Les séminomes purs étendus au-delà du testicule (ou séminomes métastatiques):
de moins bon pronostic mais curable dans la majorité des cas, ils se séparent en deux groupes de bon et de moyen pronostic (classification IGCCCG). La présence de métastases viscérales extrapulmonaire (hépatiques, encéphaliques, etc.) les font classer en pronostic intermédiaires, tous les autres sont de bon pronostic.
- Les tumeurs germinales non séminomateuses (TGNS) limitées au testicules.
Pour ces lésions la stratégie thérapeutiques dépendra de l'extension de la tumeur au sein du testicule (pT1 vs pT2T4) et l'importance de la composante carcinome embryonnaire au sein de la tumeur.
- Les tumeurs germinales non séminomateuses non limitées aux testicules.
Pour ces lésions, on utilise la classification IGCCCG, qui tient compte des localisations métastatiques et des valeurs des marqueurs tumoraux.
Classification TNM
Stadification pronostique
En fonction de la classification TNM les tumeurs du testicule sont classées en stade pronostic de stade 0 (lésion pré cancéreuse) au stade IIIc de plus mauvais pronostic.
Stade I tumeur limitée au testicule. L'atteinte des enveloppes (rete testis, albuginée) ne change pas le pronostic, mais aggrave le risque de métastase.
Stade II atteinte des ganglions para-aortiques et rétropéritonéaux
- IIa 1 ganglion atteint <2 cm de grand axe
- IIb 1 ganglion atteint > 2 cm et <5 cm ou plusieurs ganglions < 5 cm
- IIc ganglion(s) > 5 cm
Stade III atteinte supra-diaphragmatique et/ou viscérale
- Stade III « non bulky » :
- atteinte ganglionnaire limitée
- atteinte pulmonaire avec nodules < 2 cm
- Stade III « bulky » :
- atteinte rétropéritonéale extensive
- nodules pulmonaires > 2 cm
- atteinte hépatique ou cérébrale
Classification IGCCCG pour les tumeurs du testicule métastatique.
La classification de la Conférence Internationale de Consensus (IGCCCG) distingue, pour les tumeurs du testicule métastatiques (Stade II et III):
Tumeurs de bon pronostic
- TGNS (56 % des TGNS) :
- tumeur testiculaire primitive ou rétropéritonéale primitive
- et absence de métastases extra-pulmonaires
- et marqueurs (tous) : αFP < 1000 ng/ml, βHCG < 5000 UI/L (1000 ng/ml), LDH < 1,5 N
avec une survie sans progression à 5 ans de 89 % et une survie globale à 5 ans de 92 %.
- Séminomes (90 % des séminomes) :
- tout site primitif
- et absence de métastase extra-pulmonaire
- et αFP normale quel que soit βHCG et LDH dont la survie sans progression à 5 ans est de 82 % et la survie globale à 5 ans de 86 %.
Tumeurs de pronostic intermédiaire
- TGNS (28 % des TGNS)
- avec atteinte testiculaire ou rétropéritonéale
- et absence de métastase extra-pulmonaire
- et marqueurs : αFP > 1000 ng/ml et < 10000 ng/ml ou βHCG > 5000 UI/L et < 50000 UI/L ou LDH > 1,5 N et < 10 N
La survie sans progression à 5 ans est de 75 %, la survie globale de 80 %.
- Séminomes (10 % des séminomes) :
- tout site primitif
- et métastases extra-pulmonaires
- et aFP normales, quel que soit HCG et LDH
La survie sans progression à 5 ans est de 67 %, la survie globale 72 %
Tumeurs de mauvais pronostic
- TGNS (16 % des TGNS) :
- atteinte médiastinale primitive
- ou métastases extra-pulmonaires
- ou marqueurs aFP > 10000 ng/ml ou HCG > 50000 UI/L ou LDH > 10 N
La survie sans progression à 5 ans est de 41 %, la survie globale de 48 %.
- Séminomes :
- Aucune tumeur séminomateuse n'entre dans cette catégorie.
Traitement
La prise en charge du cancer du testicule a fait l'objet de la publication de recommandations. Celles, américaines, du « NCCN » (« National Comrhehensive Cancer Network ») datent de 2020[31], celles, européennes (« European Society for Medical Oncology »), datent de 2022[32]
Il repose sur la chirurgie, la chimiothérapie et la radiothérapie. Le traitement est actuellement bien codifié, avec pour objectif, une guérison avec le moins de séquelles possibles.
Si l'utilisation du cisplatine dans les années 1970 a transformé le pronostic du cancer du testicule, celui-ci reste une maladie grave justifiant une extrême rigueur dans sa prise en charge. Les meilleurs résultats quant aux guérisons sont apportés par les équipes médicales spécialisées. La stratégie thérapeutique est définie en fonction du bilan initial et de l'évolution de la maladie en cours de traitement (évolution des marqueurs tumoraux, masses résiduelles).
Le but du traitement, ses effets secondaires à court et long terme et l'importance de la surveillance doivent être bien expliqués au patient pour s'assurer de sa pleine coopération.
Chimiothérapie
Différents protocoles (c'est-à-dire la combinaison de différents médicaments donnés à des doses précises, selon une chronologie particulière) ont prouvé depuis des années leur efficacité dans le traitement de ce cancer. Des traitements aussi efficaces, mais avec des effets secondaires de plus en plus réduits sont apparus. Les protocoles sont désignés par les initiales des produits utilisés: BEP= Bléomycine, Etoposide, Cisplatine (P pour platine)
BEP (J1-J21, quelle que soit la NFS et non 28)
Bléomycine 30 mg dose totale J1 J8 J15
Etoposide 100 mg/m2 J1 à J5 / 3 semaines
Cisplatine 20 mg/m2 J1 à J5
EP = Etoposide, Cisplatine
EP (J1-J21, quelle que soit la NFS et non 28)
Etoposide 100 mg/m2 J1 à J5
Cisplatine 20 mg/m2 J1 à J5 / 3 semaines
VIP =Etoposide, Ifosfamide, Cisplatine
VeIP (rattrapage) (J1-J21, quelle que soit la NFS et non 28)
Vinblastine 0,11 mg/kg J1 J2
Ifosfamide 1 200 mg/m2 J1 à J5 / 3 semaines
Cisplatine 20 mg/m2 J1 à J5
PVB = Cisplatine, Vinblastine, Bléomycine
Les protocoles sont souvent administrés toutes les 3 semaines, avec plusieurs jours de traitement à chaque fois. On parle alors de cycles, avec donc 1 cycle toutes les 3 semaines.
Radiothérapie
L'irradiation est utilisée pour traiter des séminomes évolués, en une séance de rayons par jour durant quelques semaines. Ces rayons visent les voies lymphatiques venant de la région de l'aine et aboutissant aux ganglions situés le long de l'aorte.
Le patient devrait être suivi dans le temps car il existe un risque accru de second cancer induit par la radiothérapie. Et il semble que ce soit bien l’irradiation post-opératoire qui augmente le risque de second cancer, car les cancers non–séminomateux (habituellement non traités par irradiation) sont moins suivis d'un second cancer[33].
Ablation du testicule
L'ablation du testicule atteint (orchidectomie) est le premier temps du traitement. Elle peut être faite sous anesthésie générale, rachianesthésie ou anesthésie locorégionale (bloc iliofacial) par une incision inguinale (au pli de l'aine) et non via le scrotum. Une prothèse en silicone à but esthétique peut être posée si le patient le souhaite. Le stade du cancer est précisé par analyse anatomopathologique du testicule enlevé et par scanner thoracoabdominopelvien. Une chute des taux des marqueurs doit confirmer l'absence de toute tumeur restante. Selon le type de cancer et son stade, un traitement complémentaire peut-être proposé (radiothérapie ou chimiothérapie), soit un curage lomboaortique, soit une simple surveillance.
Curage ganglionnaire
Cela consiste - après une chimiothérapie initiale - ou dans un but de diagnostic (tumeur sans marqueurs) à enlever (par une incision médiane au niveau de l'abdomen) les ganglions lymphatiques abdominaux situés le long de l'aorte, dans lesquels arrivent la lymphe provenant des testicules.
Ablation des masses résiduelles
Si des métastases ganglionnaires ou viscérales sont détectées au diagnostic, le patient est souvent traité par trois ou quatre cures de chimiothérapie puis un nouveau scanner est réalisé quatre semaines à l'issue de la dernière cure. Si ce scanner retrouve des masses résiduelles, l'ablation de ces masses résiduelles est généralement pratiquée par un chirurgien.
Stratégie thérapeutique
Pour tous
- Conservation de sperme (au moins 2 prélèvements, dont 1 avant orchidectomie) (Niveau II)
- Orchidectomie par voie inguinale (Niveau II)
Autres situations:
- si tumeur sur testicule unique, chirurgie partielle envisageable (Niveau II-2)
- si néoplasie intra-tubulaire en périphérie : radiothérapie scrotale (Niveau II-2)
Séminomes Pur
- Stade I
- orchidectomie par voie inguinale
- radiothérapie : 25 Gy lomboaortique (+ éventuellement branche iliaque homolatérale) (Niveau I-2)
- Options :
- orchidectomie puis surveillance (taux de rechute attendu : 15 %, rattrapé par chimiothérapie ou radiothérapie).
- une injection unique de carboplatine (AUC 7) offre les mêmes résultats à quatre ans quant à la survie sans rechute et de survie globale. Les résultats à 5 ans sont attendus en 2005.
- Stade II ou III de bon pronostic selon IGCCCG
- orchidectomie par voie inguinale
- radiothérapie : 25 Gy lomboaortique avec branche iliaque homolatérale avec surdosage 5 à 10 Gy sur les aires ganglionnaires suspectes (Niveau II-2)
- pas d'irradiation médiastinale
- Stade II ou III de pronostic intermédiaire selon IGCCCG
- chimiothérapie (3 BEP ou 4 EP) (Niveau I-1)
- pas de radiothérapie
Bilan de réévaluation : TDM TAP à 4 semaines.
- - masse résiduelle < 3 cm : surveillance
- - masse résiduelle > 3 cm : TDM TAP tous les 3 mois tant que la lésion régresse (existence de réponses différée) (Niveau III)
- taille finale < 3 cm : surveillance
- taille finale > 3 cm : PET scan ± chirurgie (Niveau II-2)
Tumeurs germinales non séminomateuses (TGNS)
La stratégie thérapeutique des TGNS sépare les tumeurs limitées au testicule des tumeurs étendues au-delà du testicule.
Pour les tumeurs limitées au testicule et à marqueurs normalisés après la chirurgie, on définit trois niveaux de risque (SFU) en fonction du type histologie (carcinome embryonnaire) et de l'extension de la tumeur primitive (d'envahissement lymphatique ou vasculaire, d'atteinte de la vaginale).
Pour les tumeurs étendues au-delà du testicule ou à marqueurs non normalisés, la stratégie est fonction du groupe pronostique IGCCCG.
- TGNS Stade I à marqueurs normalisés
- La stratégie thérapeutique est fonction du risque, défini par la classification suivante :
- bas risque : stade pT1 sans carcinome embryonnaire majoritaire
- risque intermédiaire : stade > pT2 ou carcinome embryonnaire majoritaire
- haut risque : stade > pT2 et carcinome embryonnaire majoritaire
- La stratégie thérapeutique est fonction du risque, défini par la classification suivante :
Les trois stades de prise en charge sont, en fonction du risque :
- surveillance
- curage
- chimiothérapie
- curage et chimiothérapie
La survie globale avoisine 98 à 100 % à long terme, quelle que soit la stratégie choisie. La décision doit être individualisée selon le profil de risque du patient ainsi que sa préférence après une discussion des avantages et inconvénients de chaque option. La présence de tératome dans la tumeur primitive doit faire préférer un curage à la chimiothérapie compte tenu de la faible chimio sensibilité de ce type de lésion.
- TGNS a marqueurs non normalisés ou stade II ou III
la stratégie est alors fonction du groupe pronostique IGCCCG :
- Bon pronostic : 3 BEP tous les 21 jours ;
- Pronostic intermédiaire ou mauvais pronostic : 4 BEP tous les 21 jours
- quatre semaines après le dernier cycle in nouveau bilan est réalisé comportant un scanner thoracoabdopelvien et un dosage des marqueurs tumoraux. La suite du traitement dépendra des résultats de ce bilan :
- marqueurs non normalisés : 4 VeIP
- marqueurs normalisés ET masse résiduelle visible en TDM : curage rétropéritonéal et ablation de toutes les lésions visibles (Niveau II-1)
- marqueurs normalisés ET masse < 1 cm ET absence de tératome : surveillance possible
- si tissu actif dans les masses résiduelles : 2 cures de VeIP.
Suivi des patients
Un bilan initial est fait trois mois après le traitement.
- si la réponse au traitement est complète (cas le plus fréquent), la surveillance doit être poursuivie au moins 5 ans ;
- si la réponse n'est que partielle, avec des masses ganglionnaires résiduelles, une intervention chirurgicale est nécessaire si la taille résiduelle est de plus de 3 cm. Si du tissu tumoral est présent à l’examen histologique, une chimiothérapie est faite, avec des protocoles de rattrapage.
Une surveillance à long terme est indispensable, 5 à 10 ans après le traitement, tous les 6 mois pendant deux ans, puis tous les ans pendant au moins 5 ans. À chaque consultation le patient a un examen clinique, un dosage des marqueurs, un scanner abdominal et thoracique, et une radiographie pulmonaire. Les rechutes surviennent surtout dans les deux premières années.
Notes et références
- Fiche Inist/CNRS DECAUSSIN Myriam e al. Annales de pathologie ISSN 0242-6498, 2004
- Richiardi L, Bellocco R, Adami HO, Torrång A, Barlow L, Hakulinen T, Rahu M, Stengrevics A, Storm H, Tretli S, Kurtinaitis J, Tyczynski JE, Akre O. « Testicular cancer incidence in eight northern European countries: secular and recent trends » Cancer Epidemiol Biomarkers Prev. 2004 Dec;13(12):2157-66. (résumé)])
- Henrik Møller et Skakkebæk Niels, Risk of testicular cancer in subfertile men: case-control study ; BMJ 1999; 318 doi: 10.1136/bmj.318.7183.559 (Published 27 February 1999) ; Cite this as: BMJ 1999;318:559 (Summary & paper)
- page de l'ARTAC (avec statistiques, graphes, etc.)
- matsuda Tomohiro, Huygue Eric, Thonneau Patrick ; Incidence du cancer du testicule au niveau mondial, Andrologie, 2002, vol. 12, no2, p. 149-155, Éditeur : Méd, Paris, FRANCE (1991) (Revue)Fiche INIST CNRS
- (en) Andreas Stang et al. « Adolescent Milk Fat and Galactose Consumption and Testicular Germ Cell Cancer » Cancer Epidemiol. Biomarkers Prev. (2006) 15(11): 2189-2195 (résumé)
- Exemple : registre de l'Américan academy of pediatrics (Section urologie)
- Brève
- Testikkelkreft og arv I dette norsk-svenske samarbeidsprosjektet skal gener som kan ha betydning for utvikling av testikkelkreft undersøkes. (Consulté 2010 03 13)
- Giwercman A, Skakkebaek NE. The human testis -- an organ at risk?, Int J Androl 1992;15:373-375, via Medline]
- Cancer du testicule de l'enfant prépubère, Ed : Springer Paris ; 30 mars 2006 ; DOI:10.1007/2-287-31232-3, (ISBN 978-2-287-21243-7) (imprimé) ; (ISBN 978-2-287-31232-8) (Online)
- Elin L. Aschim, Tom Grotmol, Steinar Tretli, Trine B. Haugen ; Is there an association between maternal weight and the risk of testicular cancer? An epidemiologic study of Norwegian data with emphasis on World War II ; International Journal of Cancer ; Volume 116 Issue 2, Pages 327 – 330 ; Online: 30 mars 2005 DOI: 10.1002/ijc.21044
- (en) Freddie Bray et al. « Do testicular seminoma and nonseminoma share the same etiology? Evidence from an age-period-cohort analysis of incidence trends in eight European countries » Cancer Epidemiol. Biomarkers Prev. (2006) 15(4): 652-658 (résumé)
- (en) Møller H, Skakkebaek NE (1999), Risk of testicular cancer in subfertile men: case-control study. BMJ 1999; 318 doi:10.1136/bmj.318.7183.559 publié 27 February 1 BMJ 1999;318:559–62.
- Cancer, approche méthodologique du lien avec l'environnement, Ed. INSERM, expertise collective 2005, 92 p. (Communiqué, consulté 2008 10 04)
- [PDF] Kudjawu Y, Uhry Z, Danzon A, Bloch J. Cancer du testicule : évolution nationale et variations régionales du taux de patients opérés, 1998-2008 - Données hospitalières. Saint-Maurice: Institut de veille sanitaire; 2011. 35 p. [www.invs.sante.fr InVS]
- Kudjawu Y, Uhry Z, Danzon A, Bloch J. Cancer du testicule : évolution nationale et variations régionales du taux de patients opérés, 1998-2008 - Données hospitalières. Saint-Maurice : Institut de veille sanitaire ; 2011. 31 p. ; (ISSN 1956-6964) ; (ISBN 978-2-11-128444-9) (résumé)
- 26 mai 2011
- Paty AC, Gomes do Espirito Santo E, Suzan F. Étude des cryptorchidies et hypospadias opérés en France de 1998 à 2008 chez le petit garçon de moins de 7 ans à partir des données du Programme de médicalisation des systèmes d'information (PMSI). Saint-Maurice : Institut de veille sanitaire (ISSN 1956-6964) (ISBN 9 78-2-11-128243-8) dépôt légal : avril 2011, 63 pages
- Environnement, Risques & Santé. Mai - juin 2002. Volume 1, Number 2, Claudine Goldgewicht.
- (en) Irvine DS. « Changing male reproductive health: a review of the clinical evidence? » Hum Ecol Risk Assess 2001 ; 7 : 1003-16. Éditeur
- (en) Henderson BE, Benton B, Jin J, Yu MC, Pike MC. « Risk factors for cancer of the testis in young men » Int J Cancer 1979;23: 598–602. (Résumé)
- Dictionnaire médical, article « Cancer du testicule »
- (en) Walsh TJ, Croughan MS, Schembri M, Chan JM, Turek PJ, « Increased risk of testicular germ cell cancer among infertile men » Arch Intern Med. 2009;169:351-356
- Huyghe E, Muller A, Mieusset R, Bujan L, Bachaud JM, Chevreau C et al. Impact of diagnostic delay in testis cancer: results of a large population-based study, Eur Urol, 2007;52:1710-6
- (en) Schmoll HJ, Jordan K, Huddart R, Pes MP, Horwich A, Fizazi K, Kataja V. et al. ESMO Guidelines Working Group et al., « Testicular seminoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up », Ann Oncol, vol. 21, no Suppl 5, , v140-6. (PMID 20555065, DOI 10.1093/annonc/mdq176, lire en ligne [html])
- https://www.fondation-arc.org/cancer/cancer-testicule/symptomes-diagnostic-cancer
- https://www.europe1.fr/sante/palpations-des-testicules-comment-faire-2903114
- Horwich A, Nicol D, Huddart R, Testicular germ cell tumours, BMJ; 2013;347:f5526
- Gilligan TD, Seidenfeld J, Basch EM et al. American Society of Clinical Oncology Clinical Practice guideline on uses of serum tumor markers in adult males with germ cell tumors, J Clin Oncol, 2010;28:3388-494
- Gilligan T, Lin DW, Aggarwal R et al, Testicular cancer, version 2.2020, NCCN clinical practice guidelines in oncology, J Natl Compr Canc Netw, 2019;17:1529-54. doi:10.6004/jnccn.2019.0058
- Oldenburg J, Berney DM, Bokemeyer C et al. Testicular seminoma and non-seminoma: ESMO-EURACAN Clinical Practice Guideline for diagnosis, treatment and follow-up, Ann Oncol, 2022;33:362-75
- À propos du risque de 2d cancer (poster scientifique intitué Séminome testiculaire et risque de 2e cancer dans le département du Doubs (Consulté 2008 11 29)
Lien externe
- Société française d'urologie, recommandations en cancérologie, régulièrement mises à jour.