Streptokinase
La streptokinase (SK) est une protéine de 414 résidus d'acides aminés synthétisée par plusieurs espèces de streptocoques qui a la propriété de se lier au plasminogène humain. On l'utilise comme médicament thrombolytique efficace et bon marché dans certains cas d'infarctus du myocarde[3] (crises cardiaques) et d'embolie pulmonaire[4]. Elle fait partie d'une classe de médicaments appelée fibrinolytiques, et les complexes de streptokinases avec le plasminogène humain peuvent activer d'autres plasminogènes non liés par protéolyse pour donner de la plasmine.
| Streptokinase | |
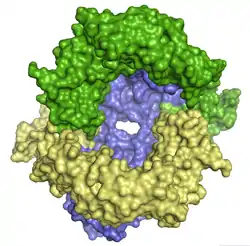 Trois domaines d'une streptokinase C humaine cristallisée (PDB 1BML[1]) |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.667 |
| No CE | 232-647-1 |
| No RTECS | OB8880000 |
| Code ATC | B01 B06 |
| DrugBank | DB00086 |
| Propriétés chimiques | |
| Formule | C2100H3278N566O669S4 |
| Masse molaire[2] | 47 286,148 ± 2,243 g/mol C 53,34 %, H 6,99 %, N 16,77 %, O 22,64 %, S 0,27 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
La streptokinase est organisée en trois domaines, notés α (résidus 1 à 150), β (résidus 151 à 287) et γ (résidus 288 à 414), qui se lient chacun au plasminogène mais ne peuvent activer le plasminogène séparément[5].
Mode d'action
La plasmine est libérée dans le sang pour dégrader la fibrine, principal constituant des caillots sanguins, ce qui permet de les dissoudre une fois qu'ils ont rempli leur mission d'arrêter le saignement. La plasmine produite sous l'effet de la streptokinase permet de dissoudre également les caillots non désirés, par exemple dans les poumons dans le cas d'une embolie pulmonaire. L'activation normale du plasminogène en plasmine s'effectue par protéolyse de la liaison peptidique unissant les résidus Arg561 et Val562.
Le groupe amine de la Val562 forme alors un pont salin avec l'Asp740, ce qui provoque un changement conformationnel conduisant à la plasmine active. La liaison de la streptokinase au plasminogène convertit ce dernier en plasmine. Les résidus 1 à 59 de la streptokinase régulent sa capacité à faire apparaître un site actif en se liant au plasminogène par un mécanisme non protéolytique et pour convertir le plasminogène en plasmine de façon indépendante de la fibrine. Ce complexe subit alors un réarrangement intramoléculaire vers sa forme active tout en laissant intacte la liaison peptidique Arg561–Val562.
Un autre résidu doit alors se substituer à l'amine du résidu Val562 afin de fournir un contre-ion au résidu Asp740[6]. Deux candidats pour ce contre-ion ont été proposés : le résidu Ile1 de la streptokinase et le résidu Lys698 du plasminogène. La délétion du premier inhibe la capacité de la streptokinase de former un site actif en se liant au plasminogène[7], tandis que les mutations du second divisent d'un facteur 15 à 50 la constante de dissociation du complexe formé par la streptokinase et le plasminogène[1].
Précautions d'emploi
La streptokinase est utilisée pour l'élimination des caillots de sang non désirés, qu'il s'agisse du nettoyage du matériel chirurgical maculé de sang (cathéters et endoscopes par exemple), du nettoyage des plaies (élimination des escarres) ou de la prise en charge d'un infarctus du myocarde ou d'une embolie pulmonaire. Dans ce dernier cas, la streptokinase est administrée par perfusion intraveineuse. Elle agit rapidement en dissolvant les caillots indésirables dans le cœur ou les poumons. Cependant, cette protéine est d'origine bactérienne, et possède par conséquent une nature antigénique susceptible de conduire à un choc anaphylactique. L'administration de streptokinase après une infection à streptocoques doit être considérée avec prudence. L'urokinase, qui est une protéine humaine, peut être un traitement alternatif.
Il existe par ailleurs un certain nombre de contre-indications à l'utilisation de streptokinase.
Divers
La streptokinase fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[8].
Notes et références
- (en) Xiaoqiang Wang, Xinli Lin, Jeffrey A. Loy, Jordan Tang et Xuejun C. Zhang, « Crystal Structure of the Catalytic Domain of Human Plasmin Complexed with Streptokinase », Science, vol. 281, no 5383, , p. 1662-1665 (PMID 9733510, DOI 10.1126/science.281.5383.1662, lire en ligne)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Nikhil Sikri et Amit Bardia, « A History of Streptokinase Use in Acute Myocardial Infarction », Texas Heart Institute Journal, vol. 34, no 3, , p. 318-327 (PMID 17948083, PMCID 1995058, lire en ligne)
- (en) N. Meneveau, F. Schiele, A. Vuillemenot, B. Valette, G. Grollier, Y. Bernard et J.-P. Bassand, « Streptokinase vs alteplase in massive pulmonary embolism. A randomized trial assessing right heart haemodynamics and pulmonary vascular obstruction », European Heart Journal, vol. 18, no 7, , p. 1141-1148 (PMID 9243149, DOI 10.1093/oxfordjournals.eurheartj.a015410, lire en ligne)
- (en) Lakshmi V. Mundada, Mary Prorok, Melanie E. DeFord, Mariana Figuera, Francis J. Castellino et William P. Fay, « Structure-Function Analysis of the Streptokinase Amino Terminus (Residues 1–59) », Journal of Biological Chemistry, vol. 278, no 27, , p. 24421-24427 (PMID 12704199, DOI 10.1074/jbc.M301825200, lire en ligne)
- (en) Jeffrey A. Loy, Xinli Lin, Monica Schenone, Francis J. Castellino, Xuejun C. Zhang et Jordan Tang, « Domain Interactions between Streptokinase and Human Plasminogen », Biochemistry, vol. 40, no 48, , p. 14686-14695 (PMID 11724583, DOI 10.1021/bi011309d, lire en ligne)
- (en) Shunguang Wang, Guy L. Reed et Lizbeth Hedstrom, « Deletion of Ile1 Changes the Mechanism of Streptokinase: Evidence for the Molecular Sexuality Hypothesis », Biochemistry, vol. 38, no 16, , p. 5232-5240 (PMID 10213631, DOI 10.1021/bi981915h, lire en ligne)
- WHO Model List of Essential Medicines, 18th list, avril 2013