Tyrosine
La tyrosine (abréviations IUPAC-IUBMB : Tyr et Y) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, codé sur les ARN messagers par les codons UAU et UAC. Sa chaîne latérale comporte un groupe phénol dont l'hydroxyle est légèrement acide (pKa = 9,76[7]). Cet acide aminé n'est pas essentiel chez les mammifères mais peut néanmoins être produit en quantité insuffisante par l'organisme dans certains cas particuliers, nécessitant alors un apport alimentaire.
| Tyrosine | |
 L ou S(–)-tyrosine  D ou R(+)-tyrosine |
|
| Identification | |
|---|---|
| Nom UICPA | acide (S)-2-amino-3-(4-hydroxyphényl)propanoïque |
| Synonymes |
Y, Tyr |
| No CAS | (racémique) (L) ou S(–) (D) ou R |
| No ECHA | 100.000.419 |
| No CE | 200-460-4 |
| DrugBank | DB00135 |
| PubChem | 6057 |
| ChEBI | 18186 |
| FEMA | 3736 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C9H11NO3 [Isomères] |
| Masse molaire[1] | 181,188 5 ± 0,009 1 g/mol C 59,66 %, H 6,12 %, N 7,73 %, O 26,49 %, |
| pKa | 2,2 pour l'acide ; 9,11 pour la base et 10,07 pour le groupement phénol [2] |
| Propriétés physiques | |
| T° fusion | 343 °C (décomposition) [2] |
| Solubilité | 479 mg·l-1 (eau,25 °C) [2] |
| Thermochimie | |
| S0solide | 214,01 J·mol-1·K-1 [3] |
| ΔfH0solide | −685,6 kJ·mol-1 [3] |
| Cp | 216,44 J·mol-1·K-1 (solide,25 °C)[3] |
| Propriétés biochimiques | |
| Codons | UAU, UAC |
| pH isoélectrique | 5,66[4] |
| Acide aminé essentiel | selon les cas |
| Occurrence chez les vertébrés | 3,3 %[5] |
| Précautions | |
| SIMDUT[6] | |
Produit non contrôlé |
|
| Écotoxicologie | |
| LogP | -2.26 [2] |
| Unités du SI et CNTP, sauf indication contraire. | |
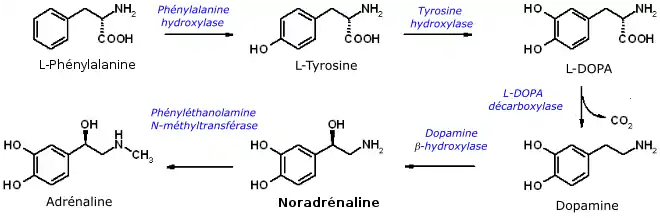
La tyrosine participe à la synthèse des catécholamines : l'adrénaline, la noradrénaline, la dopamine et la DOPA. Elle est aussi précurseur de la mélanine (pigment qui colore la peau, les poils, l'iris) et des hormones thyroïdiennes (formation de thyronine à partir de deux tyrosines).
Étymologie
Cet acide aminé est isolé pour la première fois en 1846 par Justus von Liebig à partir de la caséine du fromage. Le chimiste allemand lui donne le nom de « tyrosine », du grec tyrós signifiant fromage. Cette racine grecque se retrouve dans les termes tyrophile, « amoureux de fromages », et tyrosémiophile, collectioneur des étiquettes de fromage[8].
Biosynthèse
Chez les mammifères, elle est synthétisée par hydroxylation de la phénylalanine, catalysée par la phénylalanine hydroxylase, sauf dans un cas, plus ou moins marqué de phénylcétonurie (maladie résultant d'une accumulation de phénylalanine dans le sang, due à une réduction de l'activité hydroxylase).
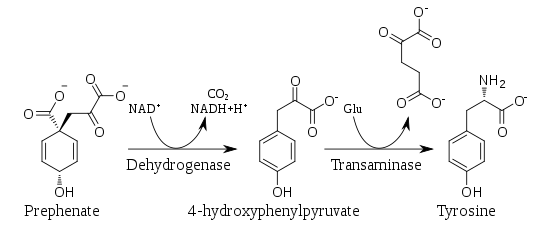
Chez les plantes et la plupart des microorganismes, la tyrosine est produite à partir du préphénate, un métabolite intermédiaire de la voie du shikimate. Le préphénate subit une décarboxylation oxydative pour donner du p-hydroxyphénylpyruvate, qui est ensuite soumis à une transamination pour donner de la tyrosine et du 2-cétoglutarate.
Modifications biochimiques
Le noyau aromatique de la tyrosine (ou parahydroxy phénylalanine) comprend un groupement hydroxyle qui rend sa chaine latérale moins hydrophobe que celle de la phénylalanine (mais la tyrosine est un acide aminé nettement moins soluble dans l'eau que la phénylalanine). Le groupement phénol (benzène+hydroxyle) lui confère une absorption dans l'UV à 275 nm[9]. Sa fonction hydroxyle lui permet d'être phosphorylée par des enzymes appelés kinases. La phosphorylation d'un acide aminé a très souvent un rôle de régulation de l'activité de l'enzyme elle-même. La thréonine et la sérine sont deux autres acides aminés pouvant subir la même phosphorylation. La tyrosine peut également subir une sulfatation ou une hydroxylation.
La tyrosine peut également être modifiée en (3-)nitrotyrosine. Cette réaction de nitration peut affecter la tyrosine en tant qu'acide aminé libre ou que résidu d'acide aminé intégré dans une chaîne polypeptidique. In vivo, cette réaction est majoritairement due à l'action de l'acide péroxynitreux (ou peroxynitrite, ONOO(-)), mais d'autres voies réactionnelles peuvent également aboutir à la formation de nitrotyrosine. In vitro, le tétranitrométhane (TNM) a aussi été utilisé dans ce but. La nitration de tyrosines est généralement vue comme un phénomène pathologique (e.g. l'augmentation de la concentration plasmatique de nitrotyrosine est considérée comme un biomarqueur de phénomènes inflammatoires), bien que la possibilité que cette réaction soit également un phénomène physiologique ait récemment été suggérée.
Les tyrosines engagées dans des liaisons peptidiques au sein des protéines peuvent forment des ponts tyrosine-tyrosine (dityrosine), tyrosine-tyrosine-tyrosine (trityrosine), tyrosine-tyrosine-tyrosine-tyrosine (tétratyrosine)[10].
Applications thérapeutiques
Henri Laborit fut un des premiers chercheurs à l'employer et à obtenir les brevets mondiaux d'application thérapeutique, dans le traitement des états de choc, des dépressions, de l'hypertension artérielle et de la maladie de Parkinson. Il dut abandonner car il ne trouva personne à l'époque pour les exploiter.
Aliments sources de tyrosine
Comme tous les acides aminés, la tyrosine est présente là où il y a des protéines.
Cependant, la quantité de tyrosine ingérée ne dépendra pas seulement de ses concentrations dans un aliment donné, mais aussi de la quantité totale consommée. Par exemple, il est plus rare que l'on consomme autant de protéines en mangeant des graines de sésame ou de citrouille que l'on en consomme de fèves. On trouve notamment de la tyrosine dans les aliments suivants :
- viande de boeuf, poulet, porc
- amande ;
- avocat ;
- banane ;
- fève de Lima ;
- graine de citrouille ;
- graine de sésame ;
- fromages à pâte dure : parmesan, 2 328 mg ; comté, emmental, 1 693 mg ;
- soja, graines, rôties, sans sel, 1 332 mg ;
- jambon cru ;
- Graines, farine de graines de coton, faible en gras, 1 796 mg, etc.[11].
On peut observer de petites étoiles blanches visibles sur la tranche de section de certains fromages à pâte dure comme le parmesan et le comté[12]. Ce sont des cristaux de tyrosine, qui attestent de la protéolyse qui a eu lieu lors de la maturation du fromage. Cette tyrosine peu soluble dans l'eau se rassemble en fines cristallisations.
Action dans le corps humain
La tyrosine intervient dans la synthèse de la mélanine, le pigment naturel de la peau et des cheveux, et dans celle de la thyroxine, l'hormone thyroïdienne.
Elle a une action sur la dépression ou l’anxiété et intervient dans la formation du neurotransmetteur épinéphrine dans la médullosurrénale[13].
Un athlète ou un culturiste qui s'entraîne intensivement peut tirer profit d'un complément de L Tyrosine qui, en affectant directement les niveaux de dopamine, peut aider à combattre la fatigue et le stress associés à des séances d'entraînement lourdes et intensives. Certaines études semblent aussi indiquer que la L Tyrosine pourrait être utile dans la perte de poids.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Tyrosine », sur ChemIDplus, consulté le 8 juillet 2009
- (en) « Tyrosine », sur NIST/WebBook, consulté le 8 juillet 2009
- (en) Francis A. Carey, « Table of pKa and pI values », sur Département de chimie de l'université de Calgary, (consulté le )
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le )
- « Tyrosine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Gerald Platzer, Mark Okon et Lawrence P. McIntosh, « pH-dependent random coil 1H, 13C, and 15N chemical shifts of the ionizable amino acids: a guide for protein pK a measurements », Journal of Biomolecular NMR, vol. 60, nos 2-3, , p. 109–129 (ISSN 0925-2738 et 1573-5001, DOI 10.1007/s10858-014-9862-y, lire en ligne, consulté le )
- (en) Catherine Donnelly, The Oxford Companion to Cheese, Oxford University Press, , p. 255.
- (en) J.B.A. Ross, W.R. Laws, K.W. Rousslang et H.R. Wyssbrod, « Tyrosine Fluorescence and Phosphorescence from Proteins and Polypeptides », dans J.R. Lakowicz, Topics in Fluorescence Spectroscopy, vol. 3 : Biochemical applications, New-York, Springer (ISBN 978-0-306-47059-2, DOI 10.1007/b112909, lire en ligne)
- (en) Svend Olav Andersen, « The cross-links in resilin identified as dityrosine and trityrosine », Biochimica et Biophysica Acta, vol. 93, no 1, , p. 213-215 (DOI 10.1016/0304-4165(64)90289-2)
- Voir divers tableaux de chiffres des teneurs (variables) en tyrosine /
- « Question (pas) bête : c'est quoi, ces cristaux de sel dans mon fromage ? », sur Les produits laitiers, (consulté le ).
- (en) McLean A, Rubinsztein JS, Robbins TW, Sahakian BJ., « The effects of tyrosine depletion in normal healthy volunteers: implications for unipolar depression. », Psychopharmacology, vol. 171, no 3, , p. 286-97. (PMID 12955284, lire en ligne)
