Dopamine
La dopamine (DA) est un neurotransmetteur, une molécule biochimique qui permet la communication au sein du système nerveux, et l'une de celles qui influent directement sur le comportement. La dopamine renforce les actions habituellement bénéfiques telles que manger un aliment sain en provoquant la sensation de plaisir ce qui active ainsi le système de récompense/renforcement. Elle est donc indispensable à la survie de l'individu. Plus généralement, elle joue un rôle dans la motivation et la prise de risque chez les mammifères, donc chez l'humain aussi. Cette molécule est également impliquée dans certains plaisirs abstraits comme écouter de la musique[2].
| Dopamine | |
  Molécule de dopamine |
|
| Identification | |
|---|---|
| Nom UICPA | 4-(2-aminoéthyl)benzène-1,2-diol |
| Synonymes |
oxytyramine |
| No CAS | |
| No ECHA | 100.000.101 |
| No CE | 200-110-0 |
| Code ATC | C01 |
| DrugBank | DB00988 |
| PubChem | 681 |
| ChEBI | 18243 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche à odeur distinctive |
| Propriétés chimiques | |
| Formule | C8H11NO2 [Isomères] |
| Masse molaire[1] | 153,178 4 ± 0,008 g/mol C 62,73 %, H 7,24 %, N 9,14 %, O 20,89 %, |
| Précautions | |
| Directive 67/548/EEC | |
 Xi |
|
| Unités du SI et CNTP, sauf indication contraire. | |
La dopamine affecte aussi l'appétence des insectes, notamment des drosophiles[3] et des abeilles domestiques[4].
Cette molécule appartient au groupe des catécholamines, et est issue de deux acides aminés tyrosine ou phénylalanine. Dans le système nerveux central, elle active les récepteurs dopaminergiques postsynaptiques et présynaptiques (autorécepteur D2). Elle est principalement produite dans la substance noire et dans l'aire tegmentale ventrale[5], situées dans le mésencéphale (partie supérieure du tronc cérébral). Bien que la dopamine, avec la noradrénaline et la sérotonine, soient très minoritaires dans le cerveau, puisque ensemble elles concernent moins de 1 % des neurones[6], elles jouent un rôle modulateur final essentiel des sorties motrices et psychiques.
C'est aussi une neurohormone produite par l'hypothalamus. Sa principale fonction hormonale est d'inhiber la libération de prolactine par le lobe antérieur de l'hypophyse.
La dopamine est le précurseur de l'adrénaline et de la noradrénaline. Les personnes ayant un fort taux de dopamine auraient davantage tendance à poursuivre des conduites dites « à risque » ou à rechercher ces situations (dont l'usage de stupéfiants, les jeux de hasard ou les paris). En effet, des résultats scientifiques ayant mesuré le taux de dopamine ont montré que les sujets qui avaient le plus fort désir de vivre de nouvelles expériences excitantes avaient à la fois plus de dopamine dans le cerveau et plus de régions du cerveau où la dopamine était active[7].
Sémantique
Elle est nommée « dopamine » car c'est une monoamine dont le précurseur direct est le 3,4-dihydroxyphénylalanine (dit L-DOPA).
Historique
Sa fonction de neurotransmetteur a été découverte en 1958 par Arvid Carlsson et Nils-Åke Hillarp au Laboratoire de pharmacologie du Conseil national cardiologique de Suède. Arvid Carlsson a reçu en 2000 le prix Nobel de physiologie ou médecine pour avoir démontré que la dopamine n'est pas seulement un précurseur de la norépinéphrine (noradrénaline) et de l'épinéphrine (adrénaline), mais également un neurotransmetteur.
La dopamine a été synthétisée pour la première fois en 1910 par George Barger et James Ewens (au Wellcome Laboratories, à Londres)[8] - [9]
Métabolisme de la dopamine


La dopamine est synthétisée dans les neurones à partir de la tyrosine d'origine circulante. La réaction est assurée par deux enzymes : la tyrosine hydroxylase (TH), une enzyme limitante contrôlant la production de L-DOPA, puis par la DOPA-décarboxylase (DDC)[10] assurant la décarboxylation de cette dernière pour donner la dopamine.
Après avoir été produite dans le cytoplasme des terminaisons axonales, la dopamine est chargée dans des vésicules synaptiques par un transporteur VMAT-2. À l'arrivée d'un potentiel d'action, les vésicules libèrent leur contenu dans le milieu extracellulaire par exocytose.
La dopamine libérée dans le milieu extracellulaire se lie en partie aux récepteurs dopaminergiques métabotropes se trouvant sur la cellule postsynaptique et transmet ainsi le signal neuronal par transduction. Environ 80 % de la dopamine libérée est recapturée par les neurones dopaminergiques via le transporteur membranaire sélectif de la dopamine (dopamine transporter ou DAT). Cependant, au niveau du cortex préfrontal, où l'expression des DAT est très faible, la dopamine est recapturée par les neurones noradrénergiques via le transporteur NET[11].
La dégradation de la dopamine s'opère soit dans le milieu extracellulaire par une ectoenzyme, la catécholamine-O-méthyltransférase (COMT), soit à l'intérieur du neurone par des enzymes mitochondriales, les monoamine-oxydases A et B (MAO). La première voie produit de l'acide homovanillique (HVA) et la seconde, de l'acide dihydroxyphénylacétique (DOPAC). La mesure du taux de ces deux métabolites dans le liquide céphalorachidien peut donner un index indirect de l'activité des neurones dopaminergiques centraux.
Récepteurs dopaminergiques
À la puberté, les récepteurs de la dopamine augmentent plus rapidement chez les garçons que chez les filles. On connaît actuellement cinq types de récepteurs de la dopamine, encodés par cinq gènes différents. Ce sont tous des récepteurs métabotropes, également appelés récepteurs couplés aux protéines G (RCPG), formés par des protéines comportant sept hélices transmembranaires. Ils sont classés en deux familles suivant la nature de la protéine G à laquelle ils sont couplés :
- la famille des récepteurs de type D1, comprenant les sous-types D1 et D5, couplés à la protéine Gs qui augmente l'activité de l'adénylate cyclase ;
- la famille des récepteurs de type D2, comprenant les sous-types D2, D3, D4, couplés à la protéine Gi qui diminue l'activité de l'adénylate cyclase.
Contrairement aux récepteurs ionotropes, qui sont rapides, les récepteurs couplés aux protéines G réagissent lentement et le plus souvent ne produisent pas de courants postsynaptiques mesurables (du moins in vitro). Ils sont là pour moduler l'activité des neurones postsynaptiques en modifiant leur excitabilité et donc leur mode de traitement de l'information[12].
| Localisation des récepteurs dopaminergiques (d'après Landry et Gies[10] 2009) | |||||
| Famille de type D1 | Famille de type D2 | ||||
| D1 | D5 | D2 | D3 | D4 | |
| Protéine G | Gs | Gs | Gi | Gi | Gi |
| Localisation centrale | striatum, noyau accumbens, tubercules olfactifs, cortex | hippocampe, hypothalamus | striatum, substance noire, noyau accumbens, tubercules olfactifs, cortex | tubercules olfactifs, noyau accumbens | amygdale, cortex, hippocampe |
| Localisation périphérique | artères, rein, tractus digestif | artères, rein, tractus digestif | terminaisons synaptiques, système nerveux entérique, area postrema, hypophyse | rein, area postrema | rein, cœur |
Quand les récepteurs de sous-types D1 et D5 de la première famille sont activés par la liaison d'un agoniste, ils induisent la formation d'AMP cyclique par activation de l'adénylate cyclase par l'intermédiaire de la protéine Gs. La cascade de réactions qui s'ensuit mène souvent à une augmentation de l'excitabilité cellulaire.
Ces récepteurs ont une localisation somato-dendritique dans le système nerveux central. Ils sont fortement exprimés par le striatum, le noyau accumbens, les tubercules olfactifs, le cortex cérébral, l'hypothalamus, le thalamus, et la pars reticulata de la substance noire. Le récepteur D5, dont l'affinité pour la dopamine est 10 fois supérieure à celle du récepteur D1, se trouve essentiellement dans l'hippocampe et l'hypothalamus.
Au niveau périphérique, l'activation des récepteurs de la famille D1, présents dans les cellules musculaires lisses vasculaires, entraînent une vasodilatation.
Les récepteurs dopaminergiques de type D2 comportent les sous-types D2, D3, D4 et leurs isoformes. Ils réagissent différemment à la liaison de la dopamine puisque la protéine Gi à laquelle ils sont couplés induit une diminution du taux d'AMP cyclique et donc de l'activité PKA. Cette voie de signalisation mène souvent à une activation de canaux potassiques à rectification entrante, à une hyperpolarisation au niveau postsynaptique, à une baisse de l'excitabilité cellulaire et à une diminution de la libération de neuromédiateur (par inhibition de l'exocytose) au niveau présynaptique.
Au niveau central, ces récepteurs sont principalement localisés dans le striatum, la pars compacta de la substance noire, l'aire tegmentaire ventrale, le noyau accumbens, les tubercules olfactifs et le cortex cérébral.
Voies de projections dopaminergiques
Dans le système nerveux central, la dopamine joue un rôle complexe et intervient dans diverses fonctions importantes telles que le comportement, la cognition, les fonctions motrices, la motivation, les récompenses, le sommeil ou la mémorisation. La dopamine est principalement synthétisée et libérée par des populations de neurones très restreintes situées dans la substance noire (SN) et dans l'aire tegmentaire ventrale qui ont pour cible majeure diverses structures cérébrales appartenant au système des noyaux de la base. Les noyaux de la base sont des structures sous-corticales comprenant différents noyaux (striatum, globus pallidus, noyau sous-thalamique). Le striatum qui représente le premier relais du système et la cible principale des projections dopaminergiques se divise en deux composantes : ventrale et dorsale.
De nombreuses études[13] ont mis en évidence trois grandes voies de projection ascendantes du mésencéphale : la voie nigro-striée, la voie mésolimbique et la voie mésocorticale.
Voie nigro-striatale ou nigrostriée

Les neurones dopaminergiques de la pars compacta de la substance noire projettent majoritairement dans la partie supérieure du striatum, constituée du noyau caudé et du putamen. La voie nigrostriée représente 80 % des neurones dopaminergiques centraux[10]. Ce réseau constitue un système modulateur des aires corticales motrices et intervient dans le phénomène de contrôle des fonctions motrices[14]. La maladie de Parkinson est une maladie dont la cause est la dégénérescence du groupe de neurones produisant la dopamine dans la substance noire. L'administration du précurseur L-DOPA qui, contrairement à la dopamine, peut traverser la barrière hémato-encéphalique, ralentit la progression de la maladie, car le cerveau transforme cette substance en dopamine.
Voie mésolimbique (mésencéphale → système limbique)
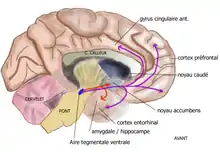
Les projections dopaminergiques qui trouvent leur origine dans l'aire tegmentaire ventrale (ATV) (également appelée aire tegmentale ventrale) du mésencéphale ont pour cible la région ventrale du striatum, appelée également noyau accumbens ou nucleus accumbens, la stria terminalis, les tubercules olfactifs, le septum, l'amygdale, l'hippocampe. Ce réseau neuronal, qui représente le système de récompense / renforcement participe au contrôle des processus motivationnels et de récompense et est impliqué dans les phénomènes de dépendance et d'addiction[15]. Par exemple, la cocaïne provoque une augmentation de dopamine dans les fentes synaptiques au niveau du noyau accumbens en inversant le fonctionnement du système de recapture de la dopamine. La nicotine provoque aussi une augmentation de la transmission dopaminergique. Toutes les substances psychoactives (cocaïne, amphétamine, alcool, opiacés) provoquent une augmentation des taux extracellulaires de dopamine dans le noyau accumbens (Di Chiara et al[16] 1988). D'une manière générale, son dysfonctionnement est lié aux comportements d'addiction : c'est parce que l'individu a, en fonction de plusieurs facteurs, associé une substance, nocive ou non, ou bien des actions (écoute musicale...) à un phénomène de plaisir que la dopamine sera sécrétée par la suite. La dopamine est aussi impliquée dans la zone cérébrale non incluse dans la barrière hémato-encéphalique responsable du réflexe de vomissement, ce qui explique l'effet antiémétique des neuroleptiques (antagonistes dopaminergiques).
Voie mésocorticale
Cette voie est formée de neurones dopaminergiques de l'aire tegmentale ventrale (ATV) dont les axones projettent sur le cortex frontal et ventral, en particulier sur le gyrus cingulaire antérieur, l'aire entorhinale et le cortex préfrontal. Elle joue un rôle dans la concentration et des fonctions exécutives comme la mémoire de travail[17].
Dans le système nerveux périphérique, elle joue le rôle d'analeptique circulatoire (stimulant des fonctions assurant la circulation sanguine).
Voie tubéro-infundibulaire
La dopamine joue aussi un rôle de neuro-hormone au niveau de l'axe hypothalamo-hypophysaire. Cette voie a son origine dans l'hypothalamus et projette sur l'éminence médiane où la dopamine est relâchée dans la veine porte antéhypophysaire. Elle inhibe la libération de prolactine par l'hypophyse antérieure.
La pratique régulière d'un sport permet d'augmenter la sécrétion naturelle de dopamine[18].
La dopamine serait significativement impliquée dans le trouble déficitaire de l'attention avec ou sans hyperactivité (TDAH) , elle serait produite de manière irrégulière et provoquerait les symptômes du trouble. L'efficacité des psychostimulant serait alors basé sur leur effet dans le système dopaminérgetique[19] - [20]
Agonistes et antagonistes
La dopamine ne passant pas la barrière hémato-encéphalique, elle n'exerce que des effets périphériques lorsqu'elle est administrée par voie générale.
L'apomorphine, un dérivé alcaloïdique de la morphine, sans action narcotique, est un puissant agoniste (activateur) des récepteurs dopaminergiques de type D1 et D2, qui a l'avantage de passer la barrière hémato-encéphalique. Elle est indiquée :
- dans le traitement de la maladie de Parkinson, par voie sous-cutanée. Apokinon, par perfusion sous-cutanée continue, exerce une action antiparkinsonnienne en activant les récepteurs de type D2 striataux ;
- dans le traitement des dysfonctions érectiles, par voie sublinguale ;
- dans le traitement de certaines intoxications, comme émétique, par voie sous-cutanée (Apokinon).
| Agonistes et antagonistes des récepteurs dopaminergiques (d'après Dunlop et al.[11]) | |||||
| Famille de type D1 | Famille de type D2 | ||||
| D1 | D5 | D2 | D3 | D4 | |
| Agoniste | apomorphine, SKF38893,fénoldopan | apomorphine, chloro-PB | apomorphine, bromocriptine, pergolide, ropinirole, rotigotine | apomorphine, cabergoline, pergolide, pramipexole | apomorphine, PD 168077, quinpirole |
| Antagoniste | SCH 23390 | SCH 23390 | chlorpromazine, sulpiride | chlorpromazine | clozapine |
L'antagoniste SCH 23390 a permis de distinguer expérimentalement l'activation des récepteurs de type D1 de ceux de type D2. La chlorpromazine, à l'inverse, est plus affine pour les récepteurs de type D2.
La chlorpromazine (4560 RP , Largactil) fut utilisée en 1951 par Henri Laborit dans le choc post-opératoire, qui en décela le potentiel psychotrope [21]et alerta les psychiatres Jean Delay et Pierre Deniker (1952). Premier antipsychotique, son action a été analysée et détaillée par ces derniers en 1954, créant ainsi la classe des neuroleptiques[22].
Utilisation médicale
Comme médicament
En perfusion continue, c'est un tonique qui accélère le rythme cardiaque. Elle permet de maintenir la pression artérielle et le débit cardiaque chez les patients dans certains cas comme des états de choc. À dose modérée, elle entraîne une vasoconstriction veineuse aidant au maintien de la pression artérielle. Elle entraîne également une vasodilatation des artères rénales permettant de conserver une diurèse mais sans protection rénale démontrée[23]. À plus forte dose, les effets sur la contraction cardiaque sont contrebalancés par la survenue d'une tachycardie, voire de troubles du rythme cardiaque. Un dérivé, la dobutamine, présentant de manière atténuée ces effets secondaires, est alors préférentiellement utilisé. Dans les états de chocs, son emploi tend à être supplanté par la noradrénaline, cette dernière ayant des résultats meilleurs en termes de mortalité, tant dans les chocs cardiogéniques[24] que septiques[25].
À dose contrôlée, l'apport d'un agoniste de la dopamine améliore plusieurs maladies dont la maladie de Parkinson, le syndrome des jambes sans repos et les acouphènes[26].
Elle fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[27].
Sous forme de polydopamine
Des travaux dérivés de l'étude des protéines adhésives utilisées par les moules pour se fixer solidement et sous l'eau sur divers supports ont mené à découvrir en 2007 qu'une grande quantité de matériaux, s'ils sont placés dans une solution de dopamine au pH légèrement basique, se couvrent d'une fine couche de dopamine polymérisée (dite polydopamine [28] - [29]). Cette couche peut se former sur des objets de grande taille comme sur des objets de taille nanométrique et elle possède des propriétés chimiques potentiellement extrêmement utiles qui ont motivé de nombreux travaux de recherche. Elles peuvent notamment être utilisées pour encapsuler des médicaments et les protéger de la lumière ou de sucs digestifs, ou encore pour qu'ils soient lentement et durablement relargués dans l'organisme. On envisage aussi d'utiliser ses propriétés adhésives pour "coller" des biocapteurs ou d'autres macromolécules biologiquement actives sur ou dans les organismes[30].
Traitements
Pour traiter des maladies à déficit dopaminergique, on a recours à plusieurs types de traitements, dont les neurostéroïdes comme le sulfate de déhydroépiandrostérone (SDHEA) à effet correcteur des altérations du système à dopamine dans le cas de l’encéphalopathie hépatique chronique à titre expérimental chez le rat[31]. Le cannabis peut être utilisé pour traiter certaines maladies à déficit dopaminergique : en effet, « l’élévation de la concentration de dopamine dans le noyau d’accumbens après une administration de THC [...] met en évidence l’action du THC de stimulation de la transmission dopaminergique »[32].
Molécules agissant sur le phénomène de recapture de la dopamine
On classe dans ce groupe les tricycliques, qui inhibent les transporteurs d'amines de la membrane pré-synaptique. Les tricycliques ne sont pas spécifiques du transporteur de dopamine (DAT), ils inhibent aussi les transporteurs de la sérotonine, la noradrénaline, etc.
Les molécules agissant sur le phénomène de dégradation synaptique de la dopamine
On classe dans ce groupe les IMAO, inhibiteurs de la monoamine oxydase (MAO).
L'étude des mésanges charbonnières vient confirmer les études de Bart Kempenaers, qui évoquait le fait qu'une augmentation de concentration en récepteur D4 de la dopamine dans le cerveau allait de pair avec un accroissement de curiosité chez l'animal[33].
Relation entre dopamine et effet placébo
Une relation dose-effet a été confirmée entre dopamine et effet placébo[34] en 2012 par une étude qui a conclu à une différence individuelle de réponse aux placébos, en partie en raison de facteurs génétiques, lesquels pourraient donner lieu à la création d’un marqueur génétique relatif à cette « sensibilité », qui devrait à l’avenir être mieux pris en compte dans les stratégies thérapeutiques, la distribution des soins et la conception des essais cliniques[34].
Les essais cliniques impliquent en effet des tests en double aveugle pour les nouvelles molécules candidates à être de nouveaux médicaments, contre des placebos. Les résultats seront plus clairs et statistiquement plus significatifs avec des patients insensibles à l’effet placébo[34].
Le gène en cause est le gène COMT (catéchol-O-méthyltransférase). Il avait déjà été repéré dans le traitement de la douleur et de nombreuses affections (maladie de Parkinson) ainsi que dans le « comportement de confirmation de nouvelles informations selon nos croyances »[34] ;
L’activation de ce gène modifie la production de dopamine. La dopamine participe aux voies neuronales impliquées dans l’anticipation (qui est en jeu dans l’effet placebo[34]).
Ce gène COMT conditionne ainsi l'ampleur de la réponse au placebo pour chaque individu. Il existe un allèle Met et un allèle Val pour ce gène, caractérisés selon que le codon 158 de leur séquence code une méthionine ou une valine. Le cortex préfrontal des personnes disposant de deux allèles Met semble produire 3 à 4 fois plus de dopamine que chez les porteurs de deux allèles Val. Or, le cortex préfrontal est la zone du cerveau associée à la cognition, à l'expression de la personnalité, à la prise de décision et au comportement social[34]. Cette découverte renforce l’importance du rôle de la dopamine dans le cerveau. Elle confirme aussi l’influence de l'environnement médical et clinique (incluant la relation médecin-patient) dans les soins pour les patients sensibles à l’effet placebo[34].
Chez des patients atteints du syndrome du côlon irritable, expérimentalement soumis à des médicaments habituels ou à un placebo, ce dernier était d’autant plus efficace (fonction linéaire « effet-dose ») que la disponibilité de dopamine était élevée chez les patients, en lien avec leur profil génétique. « En particulier, les patients « à double Met » (Met/Met) montrent une amélioration de leurs symptômes avec placebo par rapport aux patients « à double Val » (Val/Val) » [34].
Origine naturelle
Outre son rôle de neurotransmetteur, la dopamine (dérivée d'un pyrocatéchol) est une molécule naturelle que l'on retrouve dans certaines des protéines sécrétées par les moules marines. Ces dernières s'avèrent être très riches en motifs catéchols, dont la dopamine, et permet ainsi aux moules de posséder des propriétés adhésives exceptionnelles.
Utilisation
La dopamine fait partie de la famille des catéchols au même titre que la DOPA (3,4-dihydroxy-L-phénylalanine), qui est une forme hydroxylée de l’acide aminé L-phénylalanine et de l’acide 3-(3,4-dihydroxyphényl) propionique. Il s'agit d'une molécule biocompatible, commerciale qui possède une fonction amine primaire libre susceptible de subir une modification chimique. Ainsi, cette molécule a connu depuis quelques années un véritable succès dans la modification de surface [35] - [36], notamment grâce à ses fortes propriétés adhésives (motif catéchol) et grâce à la présence d'une fonction chimique capable de réagir avec une molécule d'intérêt, par exemple.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Anatomically distinct dopamine release during anticipation and experience of peak emotion to music
- (en) Thomas Riemensperger, Guillaume Isabel, Hélène Coulom, Kirsa Neuser, Laurent Seugnet et al., « Behavioral consequences of dopamine deficiency in the Drosophila central nervous system », PNAS, vol. 108, no 2, , p. 834-839 (DOI 10.1073/pnas.1010930108).
- (en) Jingnan Huang, Zhaonan Zhang, Wangjiang Feng, Yuanhong Zhao, Anna Aldanondo et al., « Food wanting is mediated by transient activation of dopaminergic signaling in the honey bee brain », Science, vol. 376, no 6592, , p. 508-512 (DOI 10.1126/science.abn9920).
- Fallon J.H. and Moore R.Y. (1978), Catecholamine innervation of the basal forebrain. IV. Topography of the dopamine projection to the basal forebrain and neostriatum, J. Comp. Neurol., Volume 180, Issue 3, p. 545-80
- Abrous, Nora et als, « Tabac : comprendre la dépendance pour agir
chap 5 : Effets de la nicotine sur la neurotransmission cérébrale », INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE, (lire en ligne) - New Brain Research: Hunger for Stimulation Driven by Dopamine in the Brain, Science Daily, 1er février 2010, étude publiée dans les Proceedings of the National Academy of Sciences
- « L-DOPA et Dopamine - Société Chimique de France », sur www.societechimiquedefrance.fr (consulté le )
- (en) Stanley Fahn, « The history of dopamine and levodopa in the treatment of Parkinson's disease: Dopamine and Levodopa in the Treatment of PD », Movement Disorders, vol. 23, no S3, , S497–S508 (DOI 10.1002/mds.22028, lire en ligne, consulté le )
- (en) Yves Landry et Jean-Pierre Gies, Pharmacologie : des cibles vers l'indication thérapeutique : cours et exercices corrigés, Paris, Dunod, coll. « Sciences sup : cours et exercices corrigés », , 531 p. (ISBN 978-2-10-052888-2, OCLC 470560328, BNF 42000273)
- Dunlop BW, Nemeroff CB., « The role of dopamine in the pathophysiology of depression. », Arch Gen Psychiatry., vol. 64, no 3, , p. 327-37 (lire en ligne)
- Missale C, Nash SR, Robinson SW, Jaber M, Caron MG., « Dopamine receptors: from structure to function. », Physiol Rev., vol. 78, no 1, , p. 189-225
- (en) Bertha Madras, C. Colvis, J.D. Pollock, JL Rutter, D. Shurtleff, M. von Zastrow et al., The cell biology of addiction, Cold Spring Harbor, N.Y, Cold Spring Harbor Laboratory Press, , 465 p. (ISBN 978-0-87969-753-2, OCLC 61115489, lire en ligne)
- Houk J.C. and Wise S.P. (1995), Distributed modular architectures linking basal ganglia, cerebellum, and cerebral cortex: their role in planning and controlling action, Cereb. Cortex. 5, 95-110.
- Nestler E.J. (2001), Molecular basis of long-term plasticity underlying addiction, Nat. Rev. Neurosci. 2, 119-128.
- DICHIARA G, IMPERATO A., « Drugs abused by humans preferentially increase synaptic dopamine concentrations in the mesolimbic system of freely moving rats », Proc Natl Acad Sci USA, vol. 85, .
- Charles B. Nemeroff, « The role of dopamine in pathophysiology of depression », Arch Gen Psychiatry, vol. 64,
- Santé Magazine : Vous êtes fatigué ? Bougez !
- « Déficit de l’attention: une question de génétique et non d’éducation! », sur sante.lefigaro.fr, (consulté le )
- Pierre Laporte, « Les données neurochimiques », sur HyperSupers - TDAH France (consulté le )
- Laborit, « Un nouveau stabilisateur végétatif, le 4560RP. », Presse Médicale n° 60, , p. 206
- Delay et Deniker, « Utilisation en thérapeutique psychiatrique d'une phénothiazine d'action centrale élective (4560RP). », Annales de Médecine et de Psychologie., , p. 110 - 112
- Bellomo R, Chapman M, Finfer S, Hickling K, Myburgh J, Low-dose dopamine in patients with early renal dysfunction: a placebo-controlled randomised trial, Lancet, 2000;356:2139-2143
- De Backer D, Biston P, Devriendt J et al. Comparison of dopamine and norepinephrine in the treatment of shock, N Engl J Med, 2010;362:779-789
- De Backer D, Aldecoa C, Njimi H, Vincent JL, Dopamine versus norepinephrine in the treatment of septic shock: a meta-analysis, Crit Care Med, 2012;40:725-730
- (en) István Sziklai, Judit Szilvássy et Zoltán Szilvássy, « Tinnitus control by dopamine agonist pramipexole in presbycusis patients: A randomized, placebo‐controlled, double‐blind study † », Laryngoscope, , p. 888-893 (lire en ligne)
- WHO Model List of Essential Medicines, 18th list, avril 2013
- Mussel-Inspired Surface Chemistry for Multifunctional Coatings Haeshin Lee, Shara M. Dellatore, William M. Miller, Phillip B. Messersmith Science 19 October 2007: Vol. 318 no. 5849 pp. 426–430 DOI 10.1126/science.1147241
- Perspectives on poly(dopamine) Daniel R. Dreyer, Daniel J. Miller, Benny D. Freeman, Donald R. Paul and Christopher W. Bielawski Chem" Sci 2013, Advance Article DOI 10.1039/C3SC51501J
- Lynge ME, van der Westen R, Postma A, Städler B, « Polydopamine—a nature-inspired polymer coating for biomedical science », Nanoscale, vol. 3, no 12, , p. 4916–28 (PMID 22024699, DOI 10.1039/c1nr10969c, lire en ligne)
- (en) Omar El Hiba, Halima Gamrani Hicham Chatoui, Samir Ahboucha « Loss of tyrosine hydroxylase expression within the nigro-striato-cortical pathways in the cirrhotic rat: The possible restorative effect of the neurosteroid dehydroepiandrosterone sulfate » Acta Histochemica Available online 27 February 2013 DOI 10.1016/j.acthis.2013.01.006
- Xavier Laqueille, Amine Benyamina, Mustapha Kanit, Alain Dervaux, « Aspects psychiatriques de la consommation de cannabis », L'Information Psychiatrique, vol. 79, no 3, , p.207-13 (lire en ligne)
- (en) « Drd4 gene polymorphisms are associated with personality variation in a passerine bird » Proc Biol Sci. 2007;274(1619):1685–91.
- Kathryn T. Hall, Anthony J. Lembo, Irving Kirsch, Dimitrios C. Ziogas, Jeffrey Douaiher, Karin B. Jensen, Lisa A. Conboy, John M. Kelley, Efi Kokkotou, Ted J. Kaptchuk (2012), Catechol-O-Methyltransferase val158met Polymorphism Predicts Placebo Effect in Irritable Bowel Syndrome ; > PLoS ONE doi:10.1371/journal.pone.0048135 2012-10-23
- Lee, H.; Lee, B. P.; Messersmith, P. B. A reversible wet/dry adhesive inspired by mussels and geckos. Nature 2007, 448, 338-341.
- Lee, H.; Dellatore, S. M.; Miller, W. M.; Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science 2007, 318, 426-430.
Voir aussi
Bibliographie
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- FMA
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en) National Drug File
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :