Hypothalamus
L'hypothalamus (du grec : ὑπό, hypo = dessous et θάλαμος, thálamos = chambre, cavité) est une structure du système nerveux central, située sur la face ventrale de l'encéphale. Cette partie du cerveau est constituée de plusieurs sous-structures, appelées noyaux. Ces noyaux sont des ensembles anatomiquement indépendants de neurones qui assurent diverses fonctions. L'une des fonctions les plus importantes de l'hypothalamus est de réaliser la liaison entre le système nerveux et le système endocrinien par le biais d'une glande endocrine : l'hypophyse.
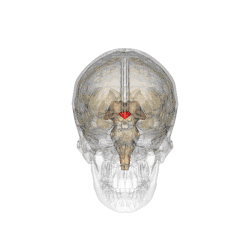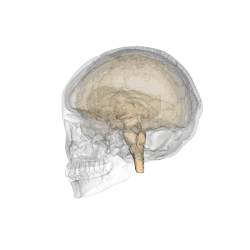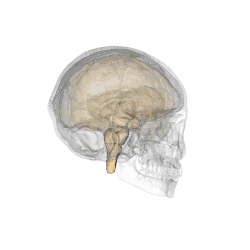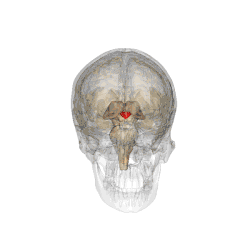
Comme son nom l'indique, cet organe est situé en dessous du thalamus, juste au-dessus du tronc cérébral et forme la partie ventrale du diencéphale. Tous les vertébrés possèdent un hypothalamus. Chez l'humain, il est à peu près de la taille d'une amande.
Grâce à ses connexions avec l'hypophyse, l'hypothalamus est responsable de plusieurs processus métaboliques et d'autres activités du système nerveux autonome. Il permet la synthèse et la sécrétion de neurohormones hypothalamiques dans la tige hypophysaire (ou tige pituitaire), qui à leur tour stimulent ou inhibent la sécrétion d'hormones hypophysaires. Il intervient ainsi dans la régulation du système nerveux autonome et des fonctions endocrines. Il intervient également dans le contrôle d'une large gamme de fonctions corporelles comportementales, incluant la reproduction, la thermorégulation, le contrôle du rythme circadien ou encore la faim.
Anatomie
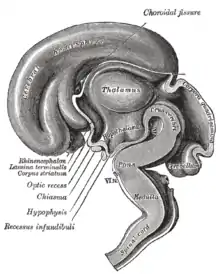
L'hypothalamus fait partie de la portion inférieure du diencéphale. Il forme les parois inféro-latérales et le plancher du 3e ventricule, situé sous le thalamus (d'où son nom), dont il est séparé par le sillon hypothalamique (de Monro). Il est en rapport, par ailleurs, avec la région sous-thalamique, en dehors via le champ tegmental de Forel, en avant par la lame terminale, et en arrière par le tegmentum mésencéphalique.
L'hypothalamus se compose de trois régions parasagittales adjacentes (périventriculaire, médiale et latérale) lesquelles se subdivisent selon un axe antéro-postérieur en des régions pré-optique, antérieure, tubérale et mamillaire. Se distinguent ainsi les noyaux pairs suivant :
- Aire préoptique (ventrolatéral et médial) ;
- Noyau suprachiasmatique (périventriculaire) ;
- Noyaux paraventriculaires (périventriculaire et médial) ;
- Noyau antérieur (médial) ;
- Noyau infundibulaire ou noyau arqué (périventriculaire) ;
- Noyau ventro-médial ;
- Noyau dorso-médial ;
- Noyau hypothalamique postérieur ;
- Noyaux prémamillaires dorsal et ventral ;
- Noyaux mamillaires latéral et médial ;
- Noyaux tubéro-mamillaires médial et latéral ;
- Noyau hypothalamique latéral.
Les principaux faisceaux centrés sur l'hypothalamus comprennent[1] :
- Le faisceau hypothalamo-hypophysaire issu des noyaux supra-optique et paraventriculaire et se terminant via la tige pituitaire dans la neuro-hypophyse (libérant de la vasopressine et de l'ocytocine) ;
- Le faisceau médial du télencéphale ;
- Le faisceau longitudinal médial ;
- Le fornix ;
- Les faisceaux mamillothalamique et mamillotegmental.
Fonctions
L’hypothalamus est à la fois un capteur et un centre intégrateur du corps : il intègre des stimuli périphériques (hormonaux, humoraux et nerveux), et y répond par la modulation de la sécrétion des hormones hypothalamiques.
L'hypothalamus répond ainsi à divers facteurs comme :
- la lumière : la durée du jour et la photopériode régulent les rythmes circadiens et saisonniers et chez les mammifères c'est dans la partie antérieure de l'hypothalamus qu'est situé le principal stimulateur circadien (dans le noyau suprachiasmatique[2]) ;
- les stimuli olfactifs, notamment les phéromones ;
- les informations nerveuses provenant du cœur, de l'estomac et des organes reproducteurs ;
- les influx du système nerveux autonome ;
- les paramètres du sang comme les taux de leptine, ghréline, angiotensine, insuline, des hormones pituitaires et des cytokines, ainsi que la glycémie et l'osmolarité, etc.
- les stéroïdes (corticostéroïdes), indicateur du stress ;
- les signaux d'invasions microbiennes, auxquelles il répond par une élévation de la température générale du corps (élévation du « thermostat »).
C'est notamment grâce à la vasopressine, qui est libérée par l'hypophyse « alerté » par l'hypothalamus quand l'intensité lumineuse baisse le soir, que le corps se met à stocker l'eau (au lieu de remplir la vessie à partir des reins), de manière à conserver un niveau d'hydratation idéal du corps et de ses cellules durant le sommeil. En effet, l'organisme ne recevant pas d'apport d'eau pendant le sommeil, il doit en minimiser les pertes pour rester suffisamment hydraté. Quand l'eau commence à manquer, des neurones osmosensibles activent d'autres neurones qui libèrent davantage de vasopressine dans le sang. Ce système est en partie régulé par l'horloge circadienne de l'organisme[3].
Le complexe hypothalamo-hypophysaire
Sécrétion de la GnRH
Une neurohormone, la GnRH (Gonadotropin releasing hormone), est synthétisée par ces neurones puis libérée de manière pulsatile dans le sang : l'hypothalamus envoie des trains de potentiels d'actions à travers le neurone. Par la suite, la GnRH agit sur les cellules de l'hypophyse. La liaison GnRH aux cellules hypophysaires entraîne la libération d'hormone folliculo-stimulante (FSH en anglais) et d'hormone lutéinisante (LH), qui sont de nature glycoprotéique.
Dimorphisme sexuel
Plusieurs noyaux hypothalamiques sont sexuellement dimorphes ; c'est-à-dire qu'ils présentent une nette différence de structure et de fonction selon que le cerveau soit celui d'un mâle ou d'une femelle (homme ou femme au sein de l'espèce humaine)[4]. Certaines différences sont visibles macroscopiquement en neuroanatomie, dont le noyau de la zone préoptique[4], où des changements subtils de connectivité et de sensibilité chimique existent selon le sexe pour certains groupes de neurones. L'attirance du mâle pour l'odeur et l'apparence du sexe opposé observée chez la plupart des espèces y serait liée (si le noyau sexuellement dimorphique est lésé, cette préférence pour les femelles par les mâles diminue). En outre, le modèle de sécrétion de l'hormone de croissance est aussi sexuellement dimorphe[5], ce pourquoi chez de nombreuses espèces, les mâles adultes se distinguent visiblement des femelles.
Rôle chez la femme
La FSH (Follicle Stimulating Hormone) et la LH (Luteinizing Hormone), deux hormones hypophysaires stimulent la production d'œstrogènes et de progestérone par les ovaires. On les appelle les gonadonostimulines (ou gonadotropin). La FSH intervient dans la maturation des follicules. Une brusque élévation de la concentration du taux de LH (pic de LH) en fin de phase folliculaire déclenche l'ovulation et provoque la transformation du follicule rompu en corps jaune.
Les sécrétions hypophysaires sont elles-mêmes sous le contrôle de l'hypothalamus qui sécrète une substance neurohormone (GnRH). Les hormones ovariennes (œstrogène et progestérones) exercent un rétrocontrôle sur le complexe hypothalamo-hypophysaire : elles inhibent la sécrétion de LH et de FSH pendant la majeure partie du cycle. Inversement, les œstrogènes stimulent la sécrétion de LH et de FSH dès qu'ils franchissent une concentration seuil dans le plasma sanguin (environ 200 pg/mL de plasma), ce qui est le cas juste avant l'ovulation (rétrocontrôle positif).
Ce sont ces sécrétions cycliques des hormones qui induisent les modifications cycliques de l'appareil reproducteur des femmes. Des stimuli externes provenant de l'environnement peuvent par l'intermédiaire du système nerveux central influencer le complexe hypothalamo-hypophysaire et donc les cycles sexuels. Le complexe hypothalamo-hypophysaire prend en compte les variations des hormones ovariennes et les facteurs de l'environnement. Il réalise donc une intégration de multiples messages nerveux et hormonaux afin de contrôler les cycles sexuels, ce qui peut être à l'origine d'un décalage du cycle ovarien normal chez la femme (fortes émotions par exemple).
Rôle chez le mâle
Chez le mâle, la LH agit sur les cellules de Leydig (cellules interstitielles du testicule) et stimule la sécrétion de la testostérone. La FSH agit quant à elle sur une autre partie du testicule, les cellules de Sertoli, rendant ces cellules réceptives aux effets stimulateurs de la testostérone, cellules qui sont, elles, responsables du bon déroulement de la spermatogénèse.
La testostérone ainsi sécrétée verra son taux constamment analysé par le complexe hypothalamo-hypophysaire. L'augmentation trop importante des concentrations de testostérone et d'inhibine exerce un rétrocontrôle négatif sur l'hypothalamus et l'hypophyse, afin de baisser les sécrétions pulsatiles de GnRH, de FSH et de LH, et permettre un retour à la normale de la testostéronémie.
Régulation de l’appétit
C'est au sein de l'hypothalamus que s'effectue l'intégration de différents types de signaux permettant la régulation de l’appétit. Celle-ci se fait notamment en cohérence avec les besoins énergétiques et la quantité de masse graisseuse du corps. Les signaux — les inputs — sont à la fois des neurotransmetteurs classiques et des neuropeptides. L'effet sur l’appétit — l'output — passe ensuite par différentes voies de signalisation. Cette réponse de l'hypothalamus va agir sur de nombreuses structures cérébrales impliquées dans la mémoire, la motivation, la planification, la prise de décision, l'apprentissage, l'action et le contrôle moteur, qui sont l'ensemble des fonctions requises pour l'alimentation[6].
La partie latérale extrême du noyau ventromédial de l'hypothalamus est responsable du contrôle de la prise alimentaire. Stimuler cette région augmente la prise de nourriture. Une lésion bilatérale de cette aire induit un arrêt complet de la prise de nourriture. De plus, la partie médiane de ce noyau contrôle l'activité de la partie latérale. Ainsi, une lésion bilatérale à la partie médiane provoque une hyperphagie et une obésité chez l'animal. Si chez le même animal la partie latérale est ensuite lésée, il cesse de se nourrir. Ce qui montre que l'aire latérale est le centre de la prise de nourriture et qu'il est régulé négativement par l'aire médiane du noyau qui est le « centre de la satiété » pour éviter une continuelle sustentation.
Différentes hypothèses concernent le mécanisme de cette régulation de la prise alimentaire[7] :
- Hypothèse lipostatique : cette hypothèse suppose que le tissu adipeux produit un signal humoral qui est proportionnel à la quantité de graisse et agit sur l'hypothalamus pour diminuer la prise alimentaire et augmenter la dépense énergétique. Il a d'ailleurs été montré qu'une hormone, la leptine, agit sur l'hypothalamus pour provoquer cet effet dont le but est de diminuer la masse graisseuse du corps ;
- Hypothèse du peptide gastro-intestinal : certaines hormones du système digestif, comme le Grp, le glucagon ou la cholecystokinine (CCK), semblent inhiber la prise alimentaire. Ce serait l'entrée d'aliment dans le tube digestif qui provoquerait la libération de ces hormones pour induire la sensation de satiété au niveau du cerveau. Celui-ci présente notamment des récepteurs à la CCK-A et la CCK-B ;
- Hypothèse glucostatique : l'activité du centre de la satiété situé dans le noyau ventromédial serait probablement gouvernée par l'utilisation du glucose par les neurones. Il a été postulé que lorsque cette utilisation du glucose est faible — lorsque les taux de glucose entre les artères (à l'entrée) et les veines (à la sortie) sont très peu différent ;
- Hypothèse thermostatique.
Gestion de la peur
La partie médiane de l'hypothalamus fait partie du circuit cérébral qui contrôle les comportements motivés, comme les comportements de défense[8]. Des analyses du marqueur d'activité neuronale c-Fos ont montré l'importance d'une série de noyaux hypothalamiques médians — appartenant à une sorte de « colonne du contrôle du comportement » — dans la régulation des réactions de défense innées ou conditionnées face à un prédateur[9].
Mécanisme de défense face à un prédateur
Chez le rongeur, la présence d'un prédateur (comme le chat) déclenche des comportements défensifs, même si l'animal n'a jamais croisé de prédateur[10]. Au niveau de l'hypothalamus, cette exposition à un prédateur augmente le nombre de cellules activant c-Fos dans le noyau antérieur, la partie dorsomédiane du noyau ventromédian et le noyau dorsal premammillaire[11]. Ce dernier semble avoir un rôle important dans la régulation des comportements défensifs face à un prédateur, car une lésion de ce noyau abolit ces comportements défensifs, comme l'immobilisation ou la fuite[12] - [11]. Le noyau prémamillaire semble réguler uniquement les mécanismes de défense momentanés, face au prédateur, puisque son ablation ne modifie pas, par exemple, les scores d'immobilisation défensives une fois le prédateur retiré[12]. De plus, ce noyau est étroitement connecté à la substance grise périaqueducale, une structure importante de l'expression de la peur[13] - [14].
D'autre part, l'animal montre des comportements de crainte et d'évaluation des risques lorsqu'il est replacé dans un environnement associé à la présence d'un chat. Les marquages c-Fos montre que le noyau premamillaire dorsal est le plus activé au sein de l'hypothalamus lors de ce paradigme. L'inactivation au muscimole, avant l'exposition à ce contexte, abolit ces mécanismes défensifs[11].
Embryologie
Lors du développement, la totalité du système nerveux central se développe à partir d'une structure appelée le tube neural situé dans la partie dorsale de l'embryon. Ce tube se divise ensuite en 4 parties distinctes selon l'axe antéro-postérieur :
- la moelle spinale (structure la plus caudale) ;
- le rhombencéphale ;
- le mésencéphale ;
- le prosencéphale :
- de cette dernière structure naît le diencéphale (qui donnera naissance notamment au thalamus),
- et le prosencéphale secondaire qui se divise lui aussi en :
- hypothalamus,
- aire préoptique et pédonculaire,
- télencéphale (qui donnera notamment naissance au cortex).
Hormones hypothalamiques
- Corticolibérine (CRH)
- Dopamine
- Somatolibérine
- Somatostatine
- TRH
- GnRH
- Vasopressine
- Ocytocine
- Endorphine
Ces hormones se dirigent vers l'hypophyse grâce au système porte hypothalamo-hypophysaire.
Pathologie de l'hypothalamus
il serait le siège d'une grande activité lors de crises d'AVF (Algies Vasculaires de la Face) et ce qui expliquerait que les crises soient à fréquences régulières (même heures aux mêmes moments de la journée).
Cerveau, hypothalamus et pilule contraceptive
On sait que les hormones gonadiques influencent l'organisation neuronale et la plasticité cérébrale, et notamment celle de l'hypothalamus[15]. En 2021, on ignore encore si chez la femme, la suppression hormonale ovarienne à moyen ou long terme (en cas de prise de pilule) a des conséquences morphologiques et fonctionnelles sur la fonction cérébrale[16], mais selon Taylor et al. (2021), « les nouvelles preuves issues d'une poignée d'études humaines à petite échelle en soulèvent la possibilité »[16]. Des études transversales ont montré que la pilule modifie la taille de certaines régions corticales (plus grandes ou plus petites selon les cas) et induit divers changements d'humeur chez leurs utilisatrices (par rapport aux femmes naturellement cyclées)[15]. L'hypothalamus joue un rôle dans la gestion de l'ocytocine et on a montré en 1993 que l'Estradiol modifiait la plasticité des synapses de l'hypothalamus[17].
Selon le centre de recherche Gruss Magnetic Resonance de l'Université de médecine Albert Einstein de New-York (États-Unis)[18], chez 50 femmes en bonne santé, dont 21 prenant la pilule, présentés au Congrès annuel de la Radiological Society of North America (RSNA), celles prenant la pilule avaient un hypothalamus plus petit, caractéristique semblant associée à un risque accru de colères et/ou dépression[19] - [20].
Une autre étude récente (2020) a montré qu'utiliser la pilule durant la puberté/adolescence se traduit par une réponse au stress émoussée (et une altération de l'activation du cerveau lors du traitement de la mémoire de travail)[21]. Le test de stress social de Trier, l'imagerie par résonance magnétique (IRM) structurelle et fonctionnelle montrent de effets sur la structure et la fonction du cerveau[21].
L'hypothalamus n'est pas seul en cause : une étude plus récente encore (2021), croisée randomisée en double aveugle, contrôlée par placebo, basée sur l'IRM montre des différences dans la structure/épaisseur cérébrale corticale préfrontale (connue pour aussi réguler l'humeur) : l'épaisseur corticale diminue des deux côtés dans la pars triangularis et dans la pars opercularis ainsi que dans le pôle frontal de l'hémisphère droit chez les femmes exposées à des hormones contraceptives (0,15 mg de lévonorgestrel + 0,30 μg d'éthinylestradiol, par rapport au placebo), en lien avec certains symptômes somatiques[15]. Selon Sharma et al. (2020) De manière générale, utiliser la pilule à la puberté augmente la connectivité dans le réseau limbique SN, CEN, RN et sous-cortical avec des effets sur le traitement des émotions et des récompenses, ce qui pourrait alors augmenter la vulnérabilité à certains problèmes de santé mentale[22].
Notes et références
- Nieuwenhuys et al., 2008.
- A. Kalsbeek, M.-L. Garidou, I.F. Palm et al., « Melatonin sees the light: blocking GABA-ergic transmission in the paraventricular nucleus induces daytime secretion of melatonin », European Journal of Neuroscience, vol. 12, no 9, , p. 3146–3154 (DOI 10.1046/j.1460-9568.2000.00202.x, résumé) ;
- Andrew Bennett Hellman, « Why the body isn't thirsty at night », Nature, (lire en ligne).
- (en)Hofman MA, Swaab DF (juin 1989) "The sexually dimorphic nucleus of the preoptic area in the human brain: a comparative morphometric study". Journal of Anatomy (en), n° 164, pp. 55–72. PMC 1256598.
- (en)Quinnies KM, Bonthuis PJ, Harris EP, Shetty SR, Rissman EF (2015) "Neural growth hormone: regional regulation by estradiol and/or sex chromosome complement in male and female mice". Biology of Sex Differences, vol. 6, art. 8, doi:10.1186/s13293-015-0026-x. PMC 4434521.
- Parker JA and Bloom SR. Hypothalamic neuropeptides and the regulation of appetite. Neuropharmacology, 2012. .
- (en) Theologides A, « Anorexia-producing intermediary metabolites », Am J Clin Nutr, vol. 29, no 5, , p. 552–8 (PMID 178168).
- (en) Swanson, L.W., « Cerebral Hemisphere Regulation of Motivated Behavior », Brain Research, vol. 886, , p. 113-164 (DOI 10.1016/S0006-8993(00)02905-X).
- (en) Canteras, N.S., « The medial hypothalamic defensive system:Hodological organization and functional implications », Pharmacology, Biochemistry & Behavior, vol. 71, , p. 481-491 (DOI 10.1016/S0091-3057(01)00685-2).
- (en) Ribeiro-Barbosa,E.R.; et al, « An alternative experimental procedure for studying predator-related defensive responses. », Neuroscience & Biobehavioral Reviews, vol. 29, no 8, , p. 1255-1263 (DOI 10.1016/j.neubiorev.2005.04.006).
- (en) Cezário, A.F., « Hypothalamic sites responding to predator threats--the role of the dorsal premammillary nucleus in unconditioned and conditioned antipredatory defensive behavior. », European Journal of Neuroscience, vol. 28, no 5, , p. 1003-1015 (DOI 10.1111/j.1460-9568.2008.06392.x).
- (en) Blanchard, D.C., « Dorsal premammillary nucleus differentially modulates defensive behaviors induced by different threat stimuli in rats », Neuroscience Letters, vol. 345, no 3, , p. 145-148 (DOI 10.1016/S0304-3940(03)00415-4)
- (en) Canteras, N.S.; Swanson, L.W., « The dorsal premammillary nucleus: an unusual component of the mammillary body. », PNAS, vol. 89, no 21, , p. 10089-10093 (lire en ligne).
- (en) Behbehani, M.M., « Functional characteristics of the midbrain periaqueductal gray. », Progress in Neurobiology, vol. 46, no 6, , p. 575-605 (DOI 10.1016/0301-0082(95)00009-K).
- (en) Nicole Petersen, Nicholas W. Kearley, Dara G. Ghahremani et Jean-Baptiste Pochon, « Effects of oral contraceptive pills on mood and magnetic resonance imaging measures of prefrontal cortical thickness », Molecular Psychiatry, vol. 26, no 3, 2021-03-xx, p. 917–926 (ISSN 1359-4184 et 1476-5578, PMID 33420480, PMCID PMC7914152, DOI 10.1038/s41380-020-00990-2, lire en ligne, consulté le )
- (en) Caitlin M. Taylor, Laura Pritschet et Emily G. Jacobs, « The scientific body of knowledge – Whose body does it serve? A spotlight on oral contraceptives and women’s health factors in neuroimaging », Frontiers in Neuroendocrinology, vol. 60, 2021-01-xx, p. 100874 (PMID 33002517, PMCID PMC7882021, DOI 10.1016/j.yfrne.2020.100874, lire en ligne, consulté le )
- (en) A. Párducz, J. Perez et L.M. Garcia-Segura, « Estradiol induces plasticity of gabaergic synapses in the hypothalamus », Neuroscience, vol. 53, no 2, 1993-03-xx, p. 395–401 (DOI 10.1016/0306-4522(93)90203-R, lire en ligne, consulté le )
- RSNA (2019) Communiqué intitulé Study Finds Key Brain Region Smaller in Birth Control Pill Users, 04 décembre
- France Info (2019) Brève intitulée : Les femmes sous pilule présentent "une différence spectaculaire" dans leur cerveau, 09/12/2019
- « Study Finds Key Brain Region Smaller in Birth Control Pill Users - ProQuest », sur search.proquest.com (consulté le )
- (en) « Use of the birth control pill affects stress reactivity and brain structure and function », Hormones and Behavior, vol. 124, , p. 104783 (ISSN 0018-506X, DOI 10.1016/j.yhbeh.2020.104783, lire en ligne, consulté le )
- (en) Rupali Sharma, Zhuo Fang, Andra Smith et Nafissa Ismail, « Oral contraceptive use, especially during puberty, alters resting state functional connectivity », Hormones and Behavior, vol. 126, 2020-11-xx, p. 104849 (DOI 10.1016/j.yhbeh.2020.104849, lire en ligne, consulté le )
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- BRENDA Tissue Ontology
- FMA
- TA2
- Uberon
- Xenopus Anatomy Ontology
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (la + en) TA98
- (cs + sk) WikiSkripta
- Vidéo diaporamique de l'hypothalamus, par le Dr Dominique Hasboun (cours sous vidéo nécessitant le décodeur vidéo gratuit Distens)
- Le complexe hypothalamo-hypophysaire